La tromboendarterectomía pulmonar es el tratamiento de elección y potencialmente curativo de la hipertensión pulmonar tromboembólica crónica; el tratamiento médico quedaría limitado a los pacientes considerados inoperables. Este estudio evalúa los resultados a largo plazo con ambos tratamientos en una Unidad de Referencia Nacional.
MétodosDesde febrero de 1996 hasta diciembre del 2015 se ha valorado a 292 pacientes, intervenido 142 (grupo 1) y considerado inoperables 116 (grupo 2). El seguimiento finalizó en diciembre del 2016.
ResultadosLa supervivencia a los 3 años fue del 92% en el grupo 1 y del 86% en el grupo 2, a los 5 años el 91 y el 78%, respectivamente (p = 0,001). En el análisis multivariante la supervivencia en ambos grupos estuvo relacionada con la tromboendarterectomía (HR 0,37; IC del 95% 0,19-0,72; p = 0,003), el antecedente de embolia aguda de pulmón (HR 0,50; IC del 95% 0,27-0,92; p = 0,026), el test de la marcha de 6 min (HR 0,79; IC del 95% 0,73-0,85; p = 0,001), la historia de cáncer (HR 2,57; IC del 95% 1,22-5,43; p = 0,013) y las resistencias vasculares pulmonares (HR 1,19; IC del 95% 1,02-1,39; p = 0,024). En el grupo 1 la supervivencia se relacionó con el test de 6 min (HR 0,84; IC del 95% 0,79-0,96; p = 0,009) y el gasto cardiaco (HR 0,61; IC del 95% 0,39-0,96; p = 0,033); en el grupo 2 únicamente con el test de 6 min (HR 0,81; IC del 95% 0,71-0,92; p = 0,001).
ConclusionesLos pacientes con hipertensión pulmonar tromboembólica crónica intervenidos con tromboendarterectomía tienen una supervivencia excelente y significativamente superior a la de los pacientes tratados médicamente. En la presente serie la tromboendarterectomía es el factor predictor de supervivencia más importante.
Although medical treatment can clinically improve inoperable patients, pulmonary endarterectomy surgery is the treatment of choice for patients with chronic thromboembolic pulmonary hypertension, and is potentially curative. An evaluation was made of the long-term outcomes in medical and surgical populations at a national Unit of Reference.
MethodsA total of 292 patients were evaluated from February 1996 until December 2015, of whom 142 were had surgery (group 1) and 116 were considered inoperable (group 2). The follow-up ended in December 2016.
ResultsSurvival rate after 3 3years was 92% in group 1 and 86% in group 2, and after 5 5years it was 91% and 78%, respectively (P=.001). The multivariate analysis results showed that survival in patients with chronic thromboembolic pulmonary hypertension was related to surgery (HR 0.37; 95% CI; 0.19-0.72; P=.003), history of acute pulmonary embolism (HR 0.50; 95% CI; 0.27-0.92; P=.026), distance walked in the six-minute walk test (HR 0.79; 95% CI; 0.73-0.85; P=.001), history of cancer (HR 2.57; 95% CI; 1.22-5.43; P=.013), and pulmonary vascular resistance (HR 1.19; 95% CI; 1.02-1.39; P=.024). In group 1, the variables associated with survival were the six-minute walk test (HR 0.84; 95% CI; 0.79-0.96; P=.009), and the cardiac output (HR 0.61; 95% CI; 0.39-0.96; P=.033), and in group 2, the variable associated was the six-minute walk test (HR 0.81; 95% CI; 0.71-0.92; P=.001).
ConclusionPatients with chronic thromboembolic pulmonary hypertension who received pulmonary endarterectomy surgery have an excellent survival rate, and significantly superior to that of patients treated medically. In the present series, pulmonary endarterectomy surgery was the most important predictive survival factor.
La hipertensión pulmonar (HP) tromboembólica crónica (HPTEC) es una complicación de la embolia pulmonar aguda, cuya prevalencia oscila entre el 0,57 y el 9,1%. Los episodios de embolias pulmonares que preceden a la HPTEC pueden cursar muchas veces de forma asintomática1. La cirugía de tromboendarterectomía pulmonar (TEA) es el tratamiento de elección de la HPTEC2,3. La mortalidad hospitalaria, en los centros con mayor experiencia, es inferior al 4%4. Tras la TEA, las cifras de presión arterial pulmonar prácticamente se normalizan en un alto porcentaje de pacientes y la gran mayoría mejora funcionalmente. La cirugía cambia el pronóstico de la enfermedad con una supervivencia a los 5 años entre el 74% y el 89%4-7.
La HPTEC es una enfermedad poco frecuente. Según datos del Registro Español de Hipertensión Pulmonar (REHAP) del año 2013, se estima una prevalencia de 8,4 casos/millón de habitantes y una incidencia de 1,26 casos/millón de habitantes/año8. Aunque las guías clínicas recomiendan la creación de centros de referencia en esta patología2,3, solo la serie del Registro Internacional contempla la experiencia del equipo como un factor que influye en la supervivencia de los pacientes intervenidos quirúrgicamente9.
Aunque se ha comunicado la supervivencia de los pacientes operados en distintas series, unicéntricas y multicéntricas, a lo largo de los últimos 15 años4,9-12 no disponemos de información suficiente en la evolución hemodinámica y clínica a largo plazo. No hay una definición universalmente aceptada de qué se considera HP residual tras la TEA y el impacto de esta en la supervivencia es en gran medida desconocido11,13-16. En cuanto a los pacientes sin indicación de cirugía, se conoce poco en cuanto a cuál es su evolución a largo plazo. Únicamente existe información obtenida de registros voluntarios de pacientes con HPTEC9,10 y de la experiencia inglesa, con una estructura centralizada para el manejo de pacientes con HPTEC6,12.
La Unidad de Hipertensión Pulmonar de nuestro hospital es Unidad de Referencia Nacional en la asistencia al enfermo con HP. Dentro de ella se atiende a la población de enfermos con HPTEC más amplia de nuestro país y los resultados de la TEA han sido publicados recientemente17,18. El objetivo principal de este trabajo es analizar el manejo terapéutico de los pacientes con HPTEC atendidos en la Unidad estudiando las características al diagnóstico de la enfermedad y determinando los factores predictores de supervivencia a largo plazo.
Material y métodosExiste un registro de todos los pacientes atendidos en la Unidad donde, de manera prospectiva, se recogen variables demográficas, clínicas, analíticas, hemodinámicas, de tratamiento y supervivencia. La recogida se realiza en el momento de llegada del paciente a la Unidad y durante su seguimiento con el consentimiento informado y por escrito del mismo.
El protocolo de diagnóstico de HPTEC cumple las guías de práctica clínica2,3. El estudio de trombofilia incluye presencia de anticoagulante lúpico o antifosfolípidos, déficit de proteína C, proteína S y antitrombina iii, presencia del factor v de Leiden y mutaciones del gen de la protrombina.
Todos los pacientes con diagnóstico de HPTEC se presentan en la sesión de la Unidad Multidisciplinar. Las indicaciones para la cirugía fueron2,3: a) clase funcional ii-iv de la Organización Mundial de la Salud; b) resistencias vasculares pulmonares (RVP) superiores a 300 dinas.s.cm−5, y c) trombos o lesiones típicas, accesibles quirúrgicamente en las ramas pulmonares principales, lobares o segmentarias proximales. Fueron criterios de exclusión la no accesibilidad quirúrgica y la presencia de enfermedad grave asociada, como enfermedad pulmonar severa, neoplasia activa, etc. (12% de los excluidos). La detección de valores muy elevados de RVP y la insuficiencia cardiaca derecha avanzada no fueron criterios de exclusión17,18. A partir de mayo del 2013 los pacientes sin indicación quirúrgica y con mala evolución clínica se revalúan para considerar la angioplastia pulmonar.
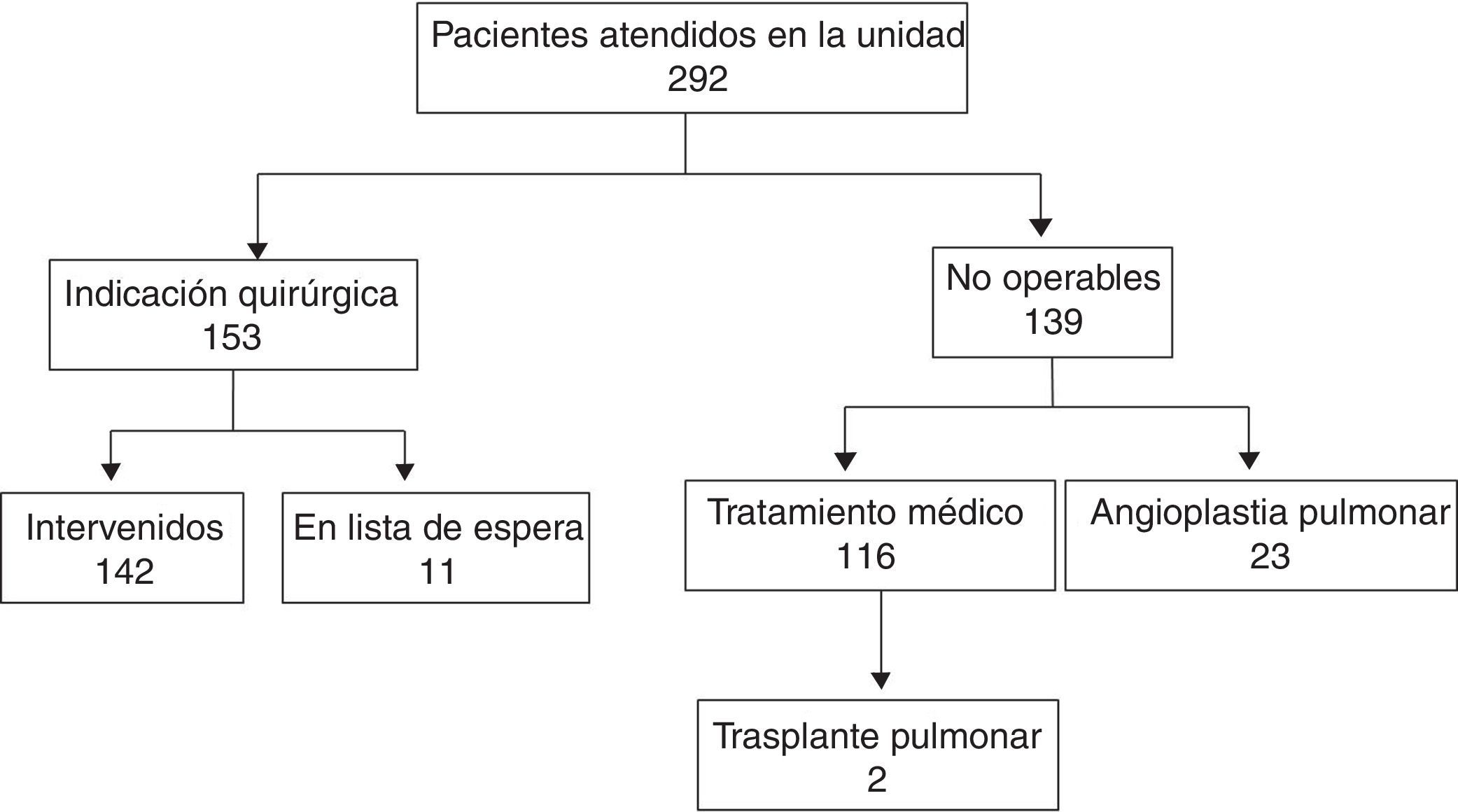
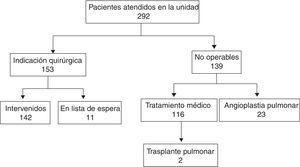
Desde febrero de 1996 hasta diciembre del 2015 se ha valorado a 292 pacientes (fig. 1). Los grupos a comparar son: grupo 1, los 142 pacientes intervenidos a 31 de diciembre del 2015; grupo 2, los 116 pacientes que se han derivado a tratamiento médico hasta esa fecha, excluyendo a los 23 pacientes en los que se ha considerado angioplastia pulmonar.
La curva de aprendizaje para la TEA se situó en los primeros 46 casos realizados entre 1996 y 2010, cuando se realizaban menos de 10 TEA al año9,13. En el grupo de tratamiento médico se situó en los 41 pacientes atendidos en el mismo periodo.
En los enfermos intervenidos se realizó cateterismo cardiaco derecho a los 6meses de la TEA; el diagnóstico de HP residual se estableció con RVP superiores a 400 dinas.s.cm−516,19.
Análisis estadísticoPara el análisis estadístico se utilizó el programa Stata versión 13 (Stata Corp, College Station, TX, EE. UU.). Las variables continuas se presentan como media ± desviación estándar o mediana y rango intercuartil (RIC) y las categóricas como frecuencias. El nivel de significación fue p < 0,05. La normalidad de la distribución de cada variable fue evaluada con la prueba de Kolmogorov-Smirnov.
Se compararon variables demográficas, clínicas, hemodinámicas y ecocardiográficas entre el grupo 1 y el 2. Se realizó el mismo análisis entre pacientes incluidos o no en la curva de aprendizaje en cada grupo. Para la comparación se utilizó el test estadístico t de Student en las variables continuas y la prueba de la χ2 o el test de Fisher en las variables categóricas.
El periodo de observación abarca desde el momento de diagnóstico de HPTEC hasta la muerte, el trasplante pulmonar o el cierre del análisis a 31 de diciembre del 2016, fecha en la que toda la población tenía, al menos, un año de seguimiento. El momento de diagnóstico es la fecha del primer cateterismo derecho en el que se objetiva una presión media en arteria pulmonar (PAPm) mayor de 25mmHg. Las curvas de supervivencia desde el diagnóstico se calcularon mediante el método de Kaplan-Meier y la comparación entre las curvas con la prueba de rangos logarítmicos. Se consideró estadísticamente significativo un valor de p < 0,05.
Se realizó modelo de regresión de Cox univariante para determinar los factores de riesgo de mortalidad en el seguimiento. Por último, aquellas variables que en el análisis univariante mostraron un nivel de significación de p < 0,05 fueron incluidas en el modelo de regresión de Cox multivariante. El valor del NT-proBNP se obtuvo a partir del año 2009, por esta razón, hay más de un 30% de los casos en los que no está recogido y no se ha incluido en el análisis multivariante.
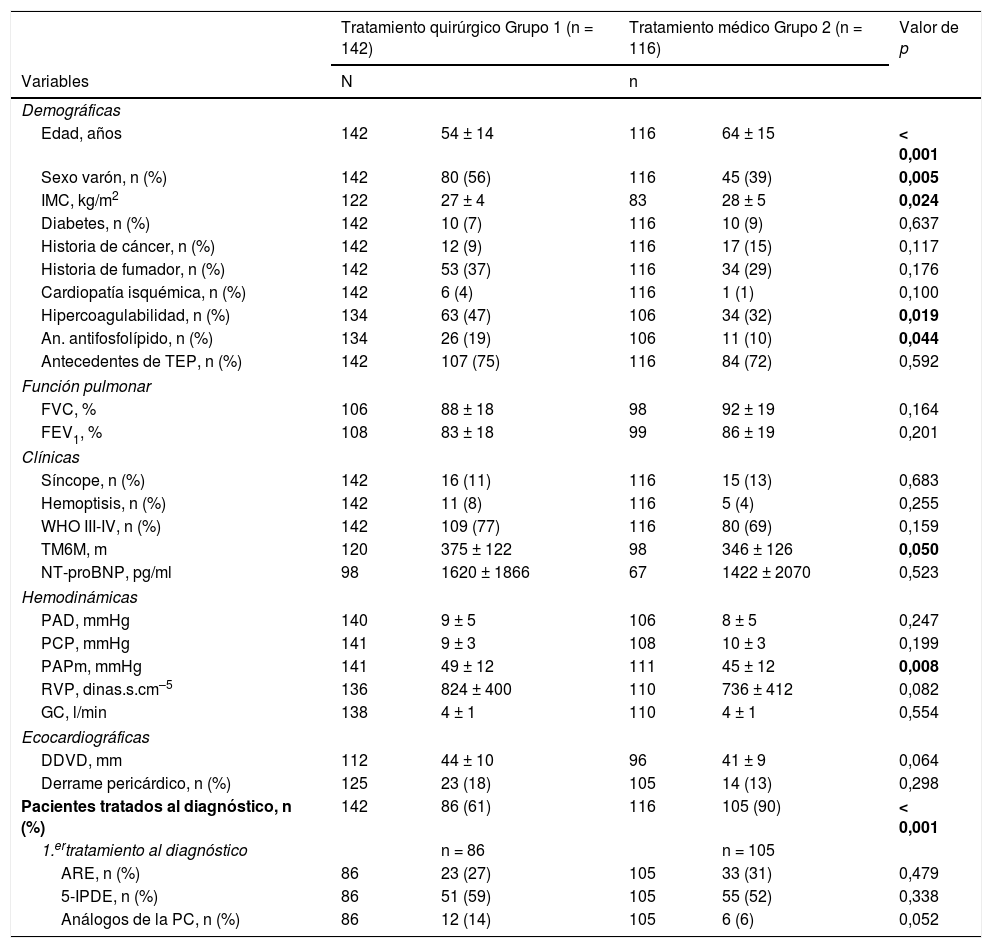
ResultadosPacientes operados vs. no operadosLas variables analizadas al diagnóstico figuran en la tabla 1.
Características de ambos grupos
| Tratamiento quirúrgico Grupo 1 (n = 142) | Tratamiento médico Grupo 2 (n = 116) | Valor de p | |||
|---|---|---|---|---|---|
| Variables | N | n | |||
| Demográficas | |||||
| Edad, años | 142 | 54 ± 14 | 116 | 64 ± 15 | < 0,001 |
| Sexo varón, n (%) | 142 | 80 (56) | 116 | 45 (39) | 0,005 |
| IMC, kg/m2 | 122 | 27 ± 4 | 83 | 28 ± 5 | 0,024 |
| Diabetes, n (%) | 142 | 10 (7) | 116 | 10 (9) | 0,637 |
| Historia de cáncer, n (%) | 142 | 12 (9) | 116 | 17 (15) | 0,117 |
| Historia de fumador, n (%) | 142 | 53 (37) | 116 | 34 (29) | 0,176 |
| Cardiopatía isquémica, n (%) | 142 | 6 (4) | 116 | 1 (1) | 0,100 |
| Hipercoagulabilidad, n (%) | 134 | 63 (47) | 106 | 34 (32) | 0,019 |
| An. antifosfolípido, n (%) | 134 | 26 (19) | 106 | 11 (10) | 0,044 |
| Antecedentes de TEP, n (%) | 142 | 107 (75) | 116 | 84 (72) | 0,592 |
| Función pulmonar | |||||
| FVC, % | 106 | 88 ± 18 | 98 | 92 ± 19 | 0,164 |
| FEV1, % | 108 | 83 ± 18 | 99 | 86 ± 19 | 0,201 |
| Clínicas | |||||
| Síncope, n (%) | 142 | 16 (11) | 116 | 15 (13) | 0,683 |
| Hemoptisis, n (%) | 142 | 11 (8) | 116 | 5 (4) | 0,255 |
| WHO III-IV, n (%) | 142 | 109 (77) | 116 | 80 (69) | 0,159 |
| TM6M, m | 120 | 375 ± 122 | 98 | 346 ± 126 | 0,050 |
| NT-proBNP, pg/ml | 98 | 1620 ± 1866 | 67 | 1422 ± 2070 | 0,523 |
| Hemodinámicas | |||||
| PAD, mmHg | 140 | 9 ± 5 | 106 | 8 ± 5 | 0,247 |
| PCP, mmHg | 141 | 9 ± 3 | 108 | 10 ± 3 | 0,199 |
| PAPm, mmHg | 141 | 49 ± 12 | 111 | 45 ± 12 | 0,008 |
| RVP, dinas.s.cm–5 | 136 | 824 ± 400 | 110 | 736 ± 412 | 0,082 |
| GC, l/min | 138 | 4 ± 1 | 110 | 4 ± 1 | 0,554 |
| Ecocardiográficas | |||||
| DDVD, mm | 112 | 44 ± 10 | 96 | 41 ± 9 | 0,064 |
| Derrame pericárdico, n (%) | 125 | 23 (18) | 105 | 14 (13) | 0,298 |
| Pacientes tratados al diagnóstico, n (%) | 142 | 86 (61) | 116 | 105 (90) | < 0,001 |
| 1.ertratamiento al diagnóstico | n = 86 | n = 105 | |||
| ARE, n (%) | 86 | 23 (27) | 105 | 33 (31) | 0,479 |
| 5-IPDE, n (%) | 86 | 51 (59) | 105 | 55 (52) | 0,338 |
| Análogos de la PC, n (%) | 86 | 12 (14) | 105 | 6 (6) | 0,052 |
ARE: antagonistas de la endotelina; DDVD: diámetro diastólico del ventrículo derecho; DE: desviación estándar; FVC: capacidad pulmonar vital forzada; FVE1: volumen espiratorio forzado en el primer segundo, GC: gasto cardiaco; IMC: índice de masa corporal; NT-proBNP: propéptido natriurético cerebral N-terminal; PAD: presión en aurícula derecha; PAPm: presión media en arteria pulmonar; PC: prostaciclinas; PCP: presión capilar pulmonar; RVP: resistencias vasculares pulmonares; TEP: tromboembolia pulmonar aguda; TM6M: test de la marcha de 6 min; 5-IPDE: inhibidores de la 5-fosfodiesterasa; WHO: World Heart Association.
En negrita se resaltan los valores de p<0,05. La variables cuantitativas se expresan como media ± DE.
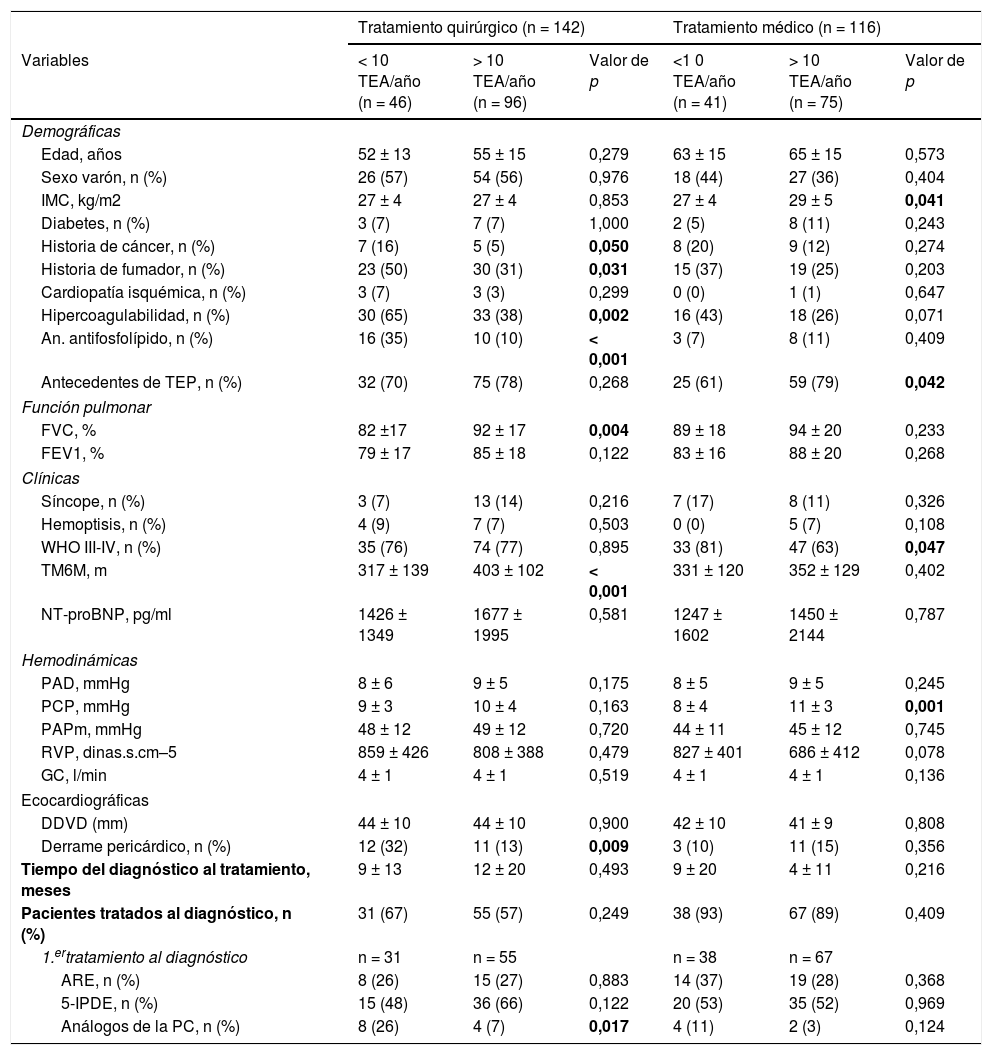
No se modificó el tiempo entre el diagnóstico y el inicio del tratamiento específico en los pacientes en curva de aprendizaje vs. no curva de aprendizaje.
En el grupo 1 los pacientes de la curva de aprendizaje presentaron más morbilidad y una distancia recorrida en el test de la marcha de 6 min (TM6M) menor. El estudio hemodinámico fue muy similar (tabla 2).
Características de ambos grupos antes y después de la curva de aprendizaje
| Tratamiento quirúrgico (n = 142) | Tratamiento médico (n = 116) | |||||
|---|---|---|---|---|---|---|
| Variables | < 10 TEA/año (n = 46) | > 10 TEA/año (n = 96) | Valor de p | <1 0 TEA/año (n = 41) | > 10 TEA/año (n = 75) | Valor de p |
| Demográficas | ||||||
| Edad, años | 52 ± 13 | 55 ± 15 | 0,279 | 63 ± 15 | 65 ± 15 | 0,573 |
| Sexo varón, n (%) | 26 (57) | 54 (56) | 0,976 | 18 (44) | 27 (36) | 0,404 |
| IMC, kg/m2 | 27 ± 4 | 27 ± 4 | 0,853 | 27 ± 4 | 29 ± 5 | 0,041 |
| Diabetes, n (%) | 3 (7) | 7 (7) | 1,000 | 2 (5) | 8 (11) | 0,243 |
| Historia de cáncer, n (%) | 7 (16) | 5 (5) | 0,050 | 8 (20) | 9 (12) | 0,274 |
| Historia de fumador, n (%) | 23 (50) | 30 (31) | 0,031 | 15 (37) | 19 (25) | 0,203 |
| Cardiopatía isquémica, n (%) | 3 (7) | 3 (3) | 0,299 | 0 (0) | 1 (1) | 0,647 |
| Hipercoagulabilidad, n (%) | 30 (65) | 33 (38) | 0,002 | 16 (43) | 18 (26) | 0,071 |
| An. antifosfolípido, n (%) | 16 (35) | 10 (10) | < 0,001 | 3 (7) | 8 (11) | 0,409 |
| Antecedentes de TEP, n (%) | 32 (70) | 75 (78) | 0,268 | 25 (61) | 59 (79) | 0,042 |
| Función pulmonar | ||||||
| FVC, % | 82 ±17 | 92 ± 17 | 0,004 | 89 ± 18 | 94 ± 20 | 0,233 |
| FEV1, % | 79 ± 17 | 85 ± 18 | 0,122 | 83 ± 16 | 88 ± 20 | 0,268 |
| Clínicas | ||||||
| Síncope, n (%) | 3 (7) | 13 (14) | 0,216 | 7 (17) | 8 (11) | 0,326 |
| Hemoptisis, n (%) | 4 (9) | 7 (7) | 0,503 | 0 (0) | 5 (7) | 0,108 |
| WHO III-IV, n (%) | 35 (76) | 74 (77) | 0,895 | 33 (81) | 47 (63) | 0,047 |
| TM6M, m | 317 ± 139 | 403 ± 102 | < 0,001 | 331 ± 120 | 352 ± 129 | 0,402 |
| NT-proBNP, pg/ml | 1426 ± 1349 | 1677 ± 1995 | 0,581 | 1247 ± 1602 | 1450 ± 2144 | 0,787 |
| Hemodinámicas | ||||||
| PAD, mmHg | 8 ± 6 | 9 ± 5 | 0,175 | 8 ± 5 | 9 ± 5 | 0,245 |
| PCP, mmHg | 9 ± 3 | 10 ± 4 | 0,163 | 8 ± 4 | 11 ± 3 | 0,001 |
| PAPm, mmHg | 48 ± 12 | 49 ± 12 | 0,720 | 44 ± 11 | 45 ± 12 | 0,745 |
| RVP, dinas.s.cm–5 | 859 ± 426 | 808 ± 388 | 0,479 | 827 ± 401 | 686 ± 412 | 0,078 |
| GC, l/min | 4 ± 1 | 4 ± 1 | 0,519 | 4 ± 1 | 4 ± 1 | 0,136 |
| Ecocardiográficas | ||||||
| DDVD (mm) | 44 ± 10 | 44 ± 10 | 0,900 | 42 ± 10 | 41 ± 9 | 0,808 |
| Derrame pericárdico, n (%) | 12 (32) | 11 (13) | 0,009 | 3 (10) | 11 (15) | 0,356 |
| Tiempo del diagnóstico al tratamiento, meses | 9 ± 13 | 12 ± 20 | 0,493 | 9 ± 20 | 4 ± 11 | 0,216 |
| Pacientes tratados al diagnóstico, n (%) | 31 (67) | 55 (57) | 0,249 | 38 (93) | 67 (89) | 0,409 |
| 1.ertratamiento al diagnóstico | n = 31 | n = 55 | n = 38 | n = 67 | ||
| ARE, n (%) | 8 (26) | 15 (27) | 0,883 | 14 (37) | 19 (28) | 0,368 |
| 5-IPDE, n (%) | 15 (48) | 36 (66) | 0,122 | 20 (53) | 35 (52) | 0,969 |
| Análogos de la PC, n (%) | 8 (26) | 4 (7) | 0,017 | 4 (11) | 2 (3) | 0,124 |
ARE: antagonistas de la endotelina; DDVD: diámetro diastólico del ventrículo derecho; FVC: capacidad pulmonar vital forzada; FVE1: volumen espiratorio forzado en el primer segundo, GC: gasto cardiaco; IMC: índice de masa corporal; NT-proBNP: propéptido natriurético cerebral N-terminal; PAD: presión en aurícula derecha; PAPm: presión media en arteria pulmonar; PC: prostaciclinas; PCP: presión capilar pulmonar; RVP: resistencias vasculares pulmonares; TEA: tromboendarterectomía pulmonar; TEP: tromboembolia pulmonar aguda; TM6M: test de la marcha de 6 min; 5-IPDE: inhibidores de la 5-fosfodiesterasa; WHO: World Heart Association.
En negrita se resaltan los valores de p<0,05. La variables cuantitativas se expresan como media ± DE.
En las 143 TEA, realizadas en 142 pacientes, la mortalidad hospitalaria fue del 5,6% (8/143). Las causas fueron: insuficiencia respiratoria (5 pacientes), hemorragia pulmonar (2) y shock cardiogénico (1). La morbilidad específica consistió en: edema pulmonar de reperfusión (19%), insuficiencia cardiaca (8%), hemorragia pulmonar (6%), necesidad de extracorporeal membrane oxigenation (ECMO) (4%) y daño neurológico transitorio (3%).
Se realizó cateterismo cardiaco a los 6meses en 112 pacientes: el porcentaje de HP residual fue 21% (23/112).
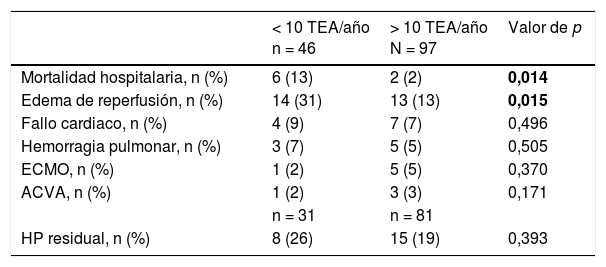
Durante la curva de aprendizaje se indicó TEA en el 44% de los pacientes diagnosticados, posteriormente en el 58%. En la tabla 3 se observa el cambio en los resultados quirúrgicos comparando ambos periodos.
Resultados quirúrgicos en función de la experiencia del grupo
| < 10 TEA/año n = 46 | > 10 TEA/año N = 97 | Valor de p | |
|---|---|---|---|
| Mortalidad hospitalaria, n (%) | 6 (13) | 2 (2) | 0,014 |
| Edema de reperfusión, n (%) | 14 (31) | 13 (13) | 0,015 |
| Fallo cardiaco, n (%) | 4 (9) | 7 (7) | 0,496 |
| Hemorragia pulmonar, n (%) | 3 (7) | 5 (5) | 0,505 |
| ECMO, n (%) | 1 (2) | 5 (5) | 0,370 |
| ACVA, n (%) | 1 (2) | 3 (3) | 0,171 |
| n = 31 | n = 81 | ||
| HP residual, n (%) | 8 (26) | 15 (19) | 0,393 |
ACVA: accidente cerebrovascular; ECMO: extracorporeal membrane oxigenation; HP: hipertensión pulmonar; TEA: tromboendarterectomía pulmonar.
En negrita se resaltan los valores de p<0,05.
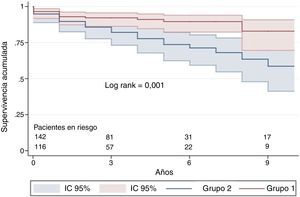
La mediana del tiempo de seguimiento fue 55 meses (RIC 44) en el grupo 1 y 47 (RIC 52) en el grupo 2 (p = 0,095). Al final del seguimiento, la mortalidad fue del 11% (15/142) en el grupo 1 y del 27% (31/116) en el grupo 2 (p = 0,001). Dentro del grupo 1, además de la mortalidad hospitalaria, hubo 7 fallecimientos en el seguimiento, 5 (71%) relacionados con la enfermedad. En el grupo 2, 2 pacientes necesitaron trasplante pulmonar y 29 fallecieron; de ellos, 25 (86%) por causas relacionadas con la enfermedad.
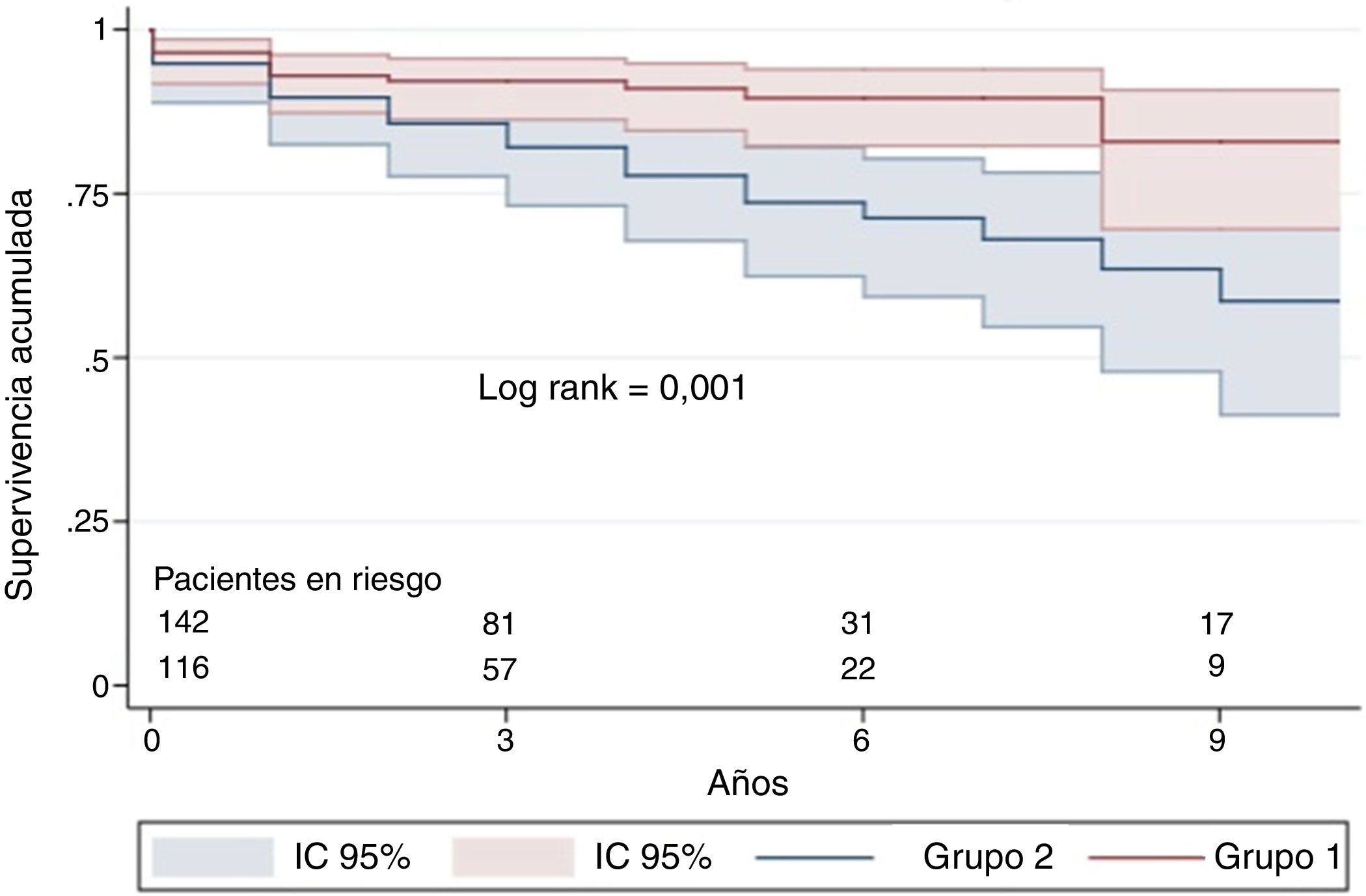
La supervivencia de toda la población con HPTEC fue del 89% a los 3 años, el 85% a los 5 años y el 72% a los 10 años. Analizada por grupos, la supervivencia a los 3 años fue del 92% en el grupo 1 y del 86% en el grupo 2; a los 5 años, el 91 y el 78%, respectivamente (p = 0,001) (fig. 2).
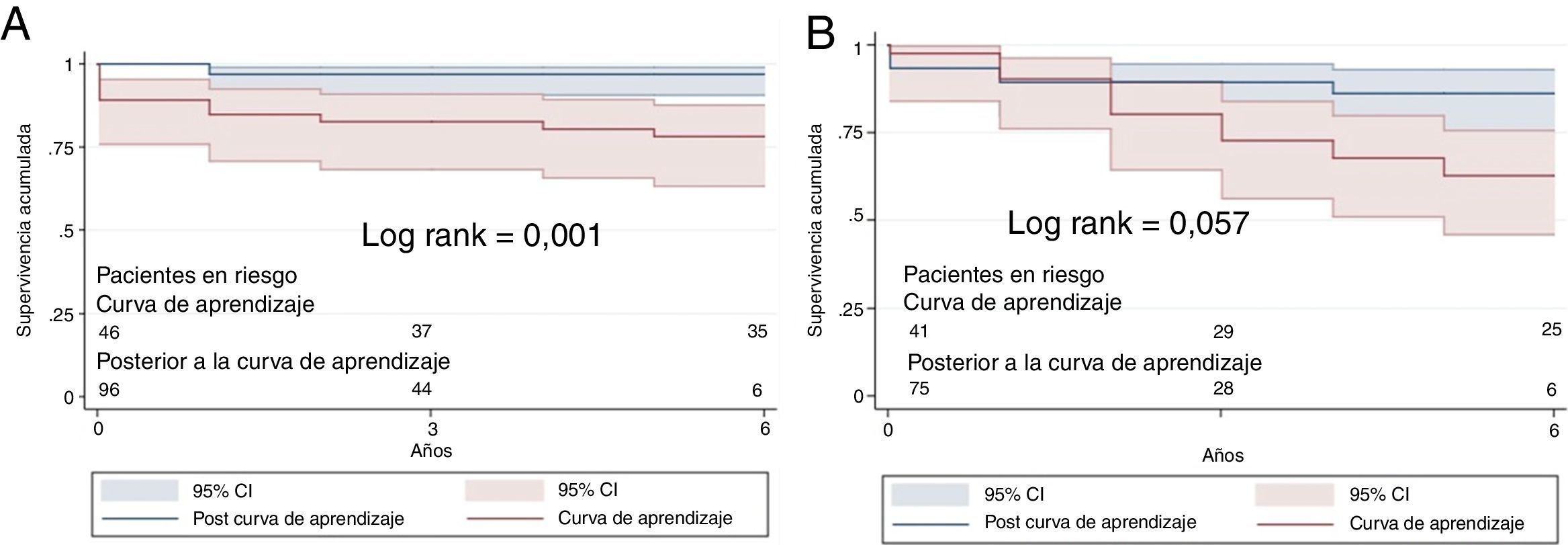
En el grupo 1, la supervivencia a los 3 años fue del 83% en los pacientes en la curva de aprendizaje y del 97% en el resto; a los 5 años, el 78 y el 97%, respectivamente (p = 0,001). En el grupo 2 la supervivencia a los 3 años fue 80% vs. 89%; a los 5 años, 68% vs. 86% (p = 0,057) (fig. 3).
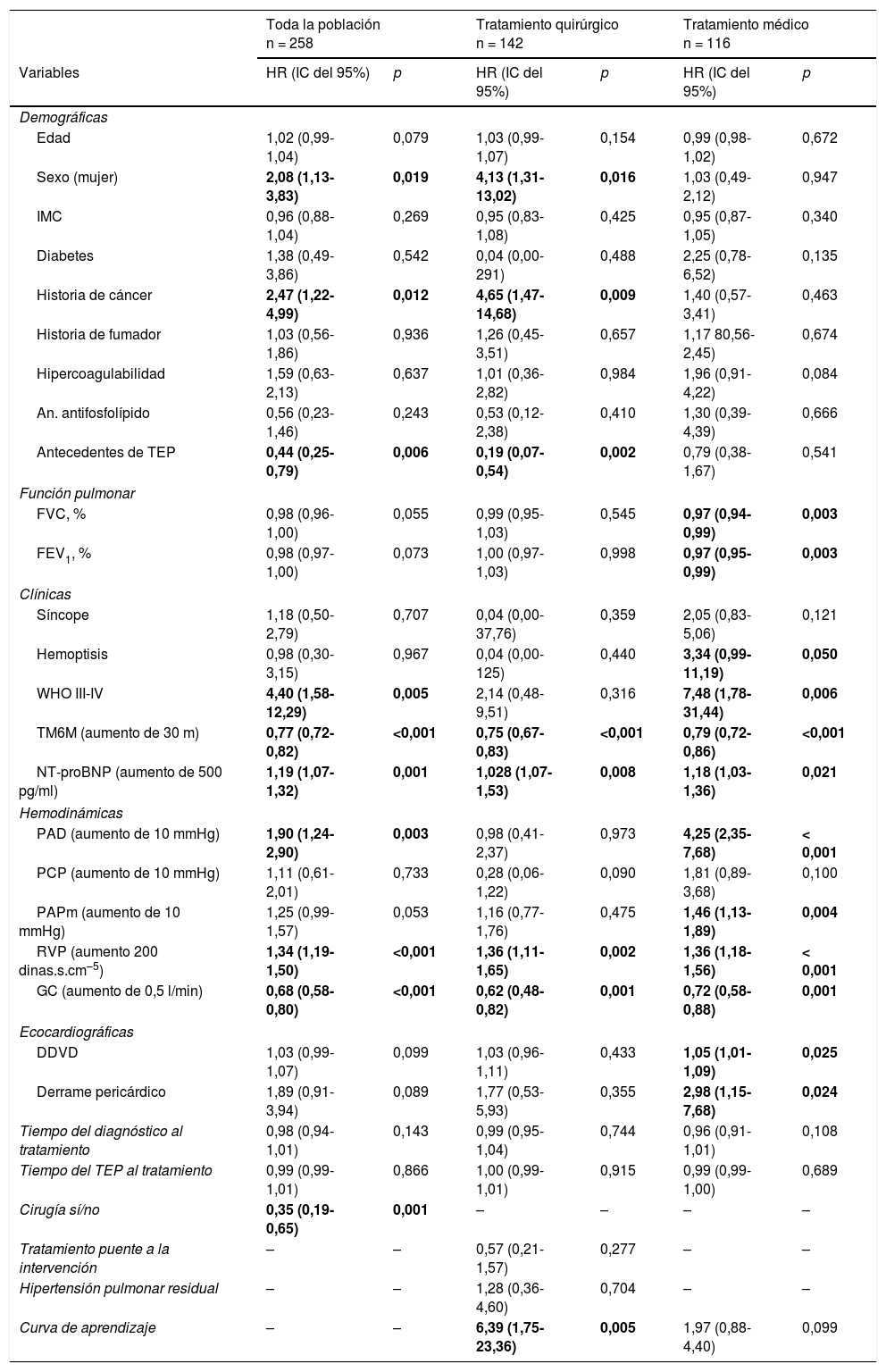
Supervivientes vs. no supervivientesEn la tabla 4 figuran las variables asociadas con la supervivencia en el análisis univariante para toda la población y por grupos.
Análisis univariante de supervivencia
| Toda la población n = 258 | Tratamiento quirúrgico n = 142 | Tratamiento médico n = 116 | ||||
|---|---|---|---|---|---|---|
| Variables | HR (IC del 95%) | p | HR (IC del 95%) | p | HR (IC del 95%) | p |
| Demográficas | ||||||
| Edad | 1,02 (0,99-1,04) | 0,079 | 1,03 (0,99-1,07) | 0,154 | 0,99 (0,98-1,02) | 0,672 |
| Sexo (mujer) | 2,08 (1,13-3,83) | 0,019 | 4,13 (1,31-13,02) | 0,016 | 1,03 (0,49-2,12) | 0,947 |
| IMC | 0,96 (0,88-1,04) | 0,269 | 0,95 (0,83-1,08) | 0,425 | 0,95 (0,87-1,05) | 0,340 |
| Diabetes | 1,38 (0,49-3,86) | 0,542 | 0,04 (0,00-291) | 0,488 | 2,25 (0,78-6,52) | 0,135 |
| Historia de cáncer | 2,47 (1,22-4,99) | 0,012 | 4,65 (1,47-14,68) | 0,009 | 1,40 (0,57-3,41) | 0,463 |
| Historia de fumador | 1,03 (0,56-1,86) | 0,936 | 1,26 (0,45-3,51) | 0,657 | 1,17 80,56-2,45) | 0,674 |
| Hipercoagulabilidad | 1,59 (0,63-2,13) | 0,637 | 1,01 (0,36-2,82) | 0,984 | 1,96 (0,91-4,22) | 0,084 |
| An. antifosfolípido | 0,56 (0,23-1,46) | 0,243 | 0,53 (0,12-2,38) | 0,410 | 1,30 (0,39-4,39) | 0,666 |
| Antecedentes de TEP | 0,44 (0,25-0,79) | 0,006 | 0,19 (0,07-0,54) | 0,002 | 0,79 (0,38-1,67) | 0,541 |
| Función pulmonar | ||||||
| FVC, % | 0,98 (0,96-1,00) | 0,055 | 0,99 (0,95-1,03) | 0,545 | 0,97 (0,94-0,99) | 0,003 |
| FEV1, % | 0,98 (0,97-1,00) | 0,073 | 1,00 (0,97-1,03) | 0,998 | 0,97 (0,95-0,99) | 0,003 |
| Clínicas | ||||||
| Síncope | 1,18 (0,50-2,79) | 0,707 | 0,04 (0,00-37,76) | 0,359 | 2,05 (0,83-5,06) | 0,121 |
| Hemoptisis | 0,98 (0,30-3,15) | 0,967 | 0,04 (0,00-125) | 0,440 | 3,34 (0,99-11,19) | 0,050 |
| WHO III-IV | 4,40 (1,58-12,29) | 0,005 | 2,14 (0,48-9,51) | 0,316 | 7,48 (1,78-31,44) | 0,006 |
| TM6M (aumento de 30 m) | 0,77 (0,72-0,82) | <0,001 | 0,75 (0,67-0,83) | <0,001 | 0,79 (0,72-0,86) | <0,001 |
| NT-proBNP (aumento de 500 pg/ml) | 1,19 (1,07-1,32) | 0,001 | 1,028 (1,07-1,53) | 0,008 | 1,18 (1,03-1,36) | 0,021 |
| Hemodinámicas | ||||||
| PAD (aumento de 10 mmHg) | 1,90 (1,24-2,90) | 0,003 | 0,98 (0,41-2,37) | 0,973 | 4,25 (2,35-7,68) | < 0,001 |
| PCP (aumento de 10 mmHg) | 1,11 (0,61-2,01) | 0,733 | 0,28 (0,06-1,22) | 0,090 | 1,81 (0,89-3,68) | 0,100 |
| PAPm (aumento de 10 mmHg) | 1,25 (0,99-1,57) | 0,053 | 1,16 (0,77-1,76) | 0,475 | 1,46 (1,13-1,89) | 0,004 |
| RVP (aumento 200 dinas.s.cm–5) | 1,34 (1,19-1,50) | <0,001 | 1,36 (1,11-1,65) | 0,002 | 1,36 (1,18-1,56) | < 0,001 |
| GC (aumento de 0,5 l/min) | 0,68 (0,58-0,80) | <0,001 | 0,62 (0,48-0,82) | 0,001 | 0,72 (0,58-0,88) | 0,001 |
| Ecocardiográficas | ||||||
| DDVD | 1,03 (0,99-1,07) | 0,099 | 1,03 (0,96-1,11) | 0,433 | 1,05 (1,01-1,09) | 0,025 |
| Derrame pericárdico | 1,89 (0,91-3,94) | 0,089 | 1,77 (0,53-5,93) | 0,355 | 2,98 (1,15-7,68) | 0,024 |
| Tiempo del diagnóstico al tratamiento | 0,98 (0,94-1,01) | 0,143 | 0,99 (0,95-1,04) | 0,744 | 0,96 (0,91-1,01) | 0,108 |
| Tiempo del TEP al tratamiento | 0,99 (0,99-1,01) | 0,866 | 1,00 (0,99-1,01) | 0,915 | 0,99 (0,99-1,00) | 0,689 |
| Cirugía sí/no | 0,35 (0,19-0,65) | 0,001 | – | – | – | – |
| Tratamiento puente a la intervención | – | – | 0,57 (0,21-1,57) | 0,277 | – | – |
| Hipertensión pulmonar residual | – | – | 1,28 (0,36-4,60) | 0,704 | – | – |
| Curva de aprendizaje | – | – | 6,39 (1,75-23,36) | 0,005 | 1,97 (0,88-4,40) | 0,099 |
DDVD: diámetro diastólico del ventrículo derecho; FVC: capacidad pulmonar vital forzada; FVE1: volumen espiratorio forzado en el primer segundo, GC: gasto cardiaco; HR: hazard ratio; IC: intervalo de confianza; IMC: índice de masa corporal; NT-proBNP: propéptido natriurético cerebral N-terminal; PAD: presión en aurícula derecha; PAPm: presión media en arteria pulmonar; PCP: presión capilar pulmonar; RVP: resistencias vasculares pulmonares; TEP: tromboembolia pulmonar aguda; TM6M: test de la marcha de 6 min; WHO: World Heart Association.
En negrita se resaltan los valores de hazard ratio con significación estadística.
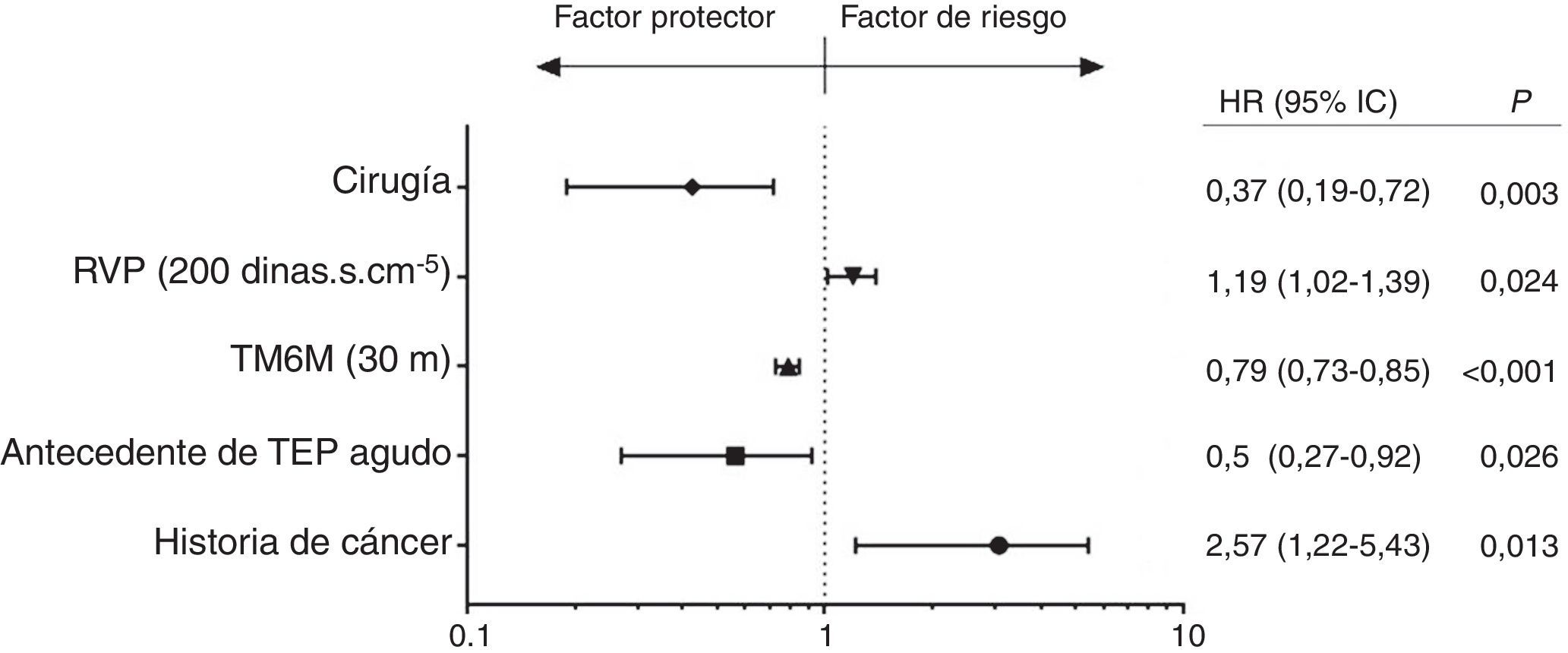
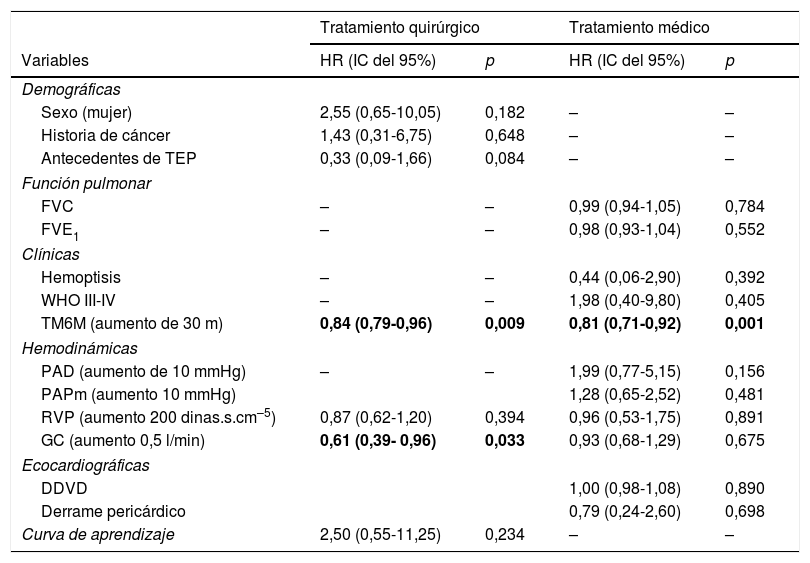
En el análisis multivariante para todos los pacientes con HPTEC, fueron variables asociadas a la supervivencia: la TEA (HR 0,37; IC del 95% 0,19-0,72; p = 0,003), el antecedente de embolia pulmonar (HR 0,5; IC del 95% 0,27-0,92; p = 0,026) y el aumento en la distancia recorrida en el TM6M (HR 0,79; IC del 95% 0,73-0,85; p < 0,001; por cada 30 m), y con la mortalidad la historia previa de cáncer (HR 2,57; IC del 95% 1,22-5,43; p = 0,013) y el aumento en las RVP preoperatorios (HR 1,19; IC del 95% 1,02-1,39; p = 0,024; por cada 200 dinas.s.cm–5) (fig. 4). En la tabla 5 aparece el análisis multivariante por grupos.
Características asociadas con la mortalidad en el análisis multivariante en cada grupo
| Tratamiento quirúrgico | Tratamiento médico | |||
|---|---|---|---|---|
| Variables | HR (IC del 95%) | p | HR (IC del 95%) | p |
| Demográficas | ||||
| Sexo (mujer) | 2,55 (0,65-10,05) | 0,182 | – | – |
| Historia de cáncer | 1,43 (0,31-6,75) | 0,648 | – | – |
| Antecedentes de TEP | 0,33 (0,09-1,66) | 0,084 | – | – |
| Función pulmonar | ||||
| FVC | – | – | 0,99 (0,94-1,05) | 0,784 |
| FVE1 | – | – | 0,98 (0,93-1,04) | 0,552 |
| Clínicas | ||||
| Hemoptisis | – | – | 0,44 (0,06-2,90) | 0,392 |
| WHO III-IV | – | – | 1,98 (0,40-9,80) | 0,405 |
| TM6M (aumento de 30 m) | 0,84 (0,79-0,96) | 0,009 | 0,81 (0,71-0,92) | 0,001 |
| Hemodinámicas | ||||
| PAD (aumento de 10 mmHg) | – | – | 1,99 (0,77-5,15) | 0,156 |
| PAPm (aumento 10 mmHg) | 1,28 (0,65-2,52) | 0,481 | ||
| RVP (aumento 200 dinas.s.cm–5) | 0,87 (0,62-1,20) | 0,394 | 0,96 (0,53-1,75) | 0,891 |
| GC (aumento 0,5 l/min) | 0,61 (0,39- 0,96) | 0,033 | 0,93 (0,68-1,29) | 0,675 |
| Ecocardiográficas | ||||
| DDVD | 1,00 (0,98-1,08) | 0,890 | ||
| Derrame pericárdico | 0,79 (0,24-2,60) | 0,698 | ||
| Curva de aprendizaje | 2,50 (0,55-11,25) | 0,234 | – | – |
GC: gasto cardiaco; HR: hazard ratio; IC: intervalo de confianza; PAD: presión en aurícula derecha; PCP: presión capilar pulmonar; RVP: resistencias vasculares pulmonares; TEP: tromboembolia pulmonar aguda; TM6M: test de la marcha de 6 min; WHO: World Heart Association.
En negrita se resaltan los valores de hazard ratio con significación estadística.
El presente estudio recoge la población más amplia con HPTEC atendida en una Unidad de Referencia en HP en España. La Unidad presta una asistencia integral a estos pacientes2,3, incluyendo la realización de TEA, angioplastia pulmonar en casos seleccionados no susceptibles de cirugía, tratamiento médico específico para HP y trasplante pulmonar. Dispone de una organización mutidisciplinar que se ha ido consolidando a lo largo de 20 años y que ha conseguido, superada la curva de aprendizaje, incrementar el porcentaje de pacientes operados hasta el 58%, disminuir la mortalidad hospitalaria de la TEA al 2% y lograr una supervivencia excelente a largo plazo en los pacientes intervenidos.
En la presente serie, recibir tratamiento quirúrgico es el factor más decisivo en la supervivencia a largo plazo del paciente con HPTEC.
Análisis de toda la poblaciónLa supervivencia en los pacientes con HPTEC fue del 89% a los 3 años, del 85% a los 5 años y del 72% a los 10 años. La cirugía pudo indicarse a un 52% de ellos. Los pacientes operados fueron más jóvenes, con mayor frecuencia varones y con índice de masa corporal más bajo; el perfil hemodinámico fue superponible en ambos grupos. El principal criterio para indicar la TEA fue la accesibilidad de las lesiones; solo en un 12% de los pacientes no considerados quirúrgicos la razón fue la comorbilidad asociada.
En el análisis multivariante, la cirugía de TEA es el factor independiente predictor de supervivencia más importante en los pacientes con HPTEC. Este resultado concuerda con lo expuesto en el Registro Internacional9 y el REHAP10, y tiene que ver con el hecho de que los pacientes candidatos a TEA tienen un componente obstructivo predominante, mientras que en los no susceptibles de cirugía puede ser más relevante la vasculopatía pulmonar, indistinguible de la vasculopatía de la HP idiopática20,21. A día de hoy, la cirugía es un excelente recurso para el tratamiento de la obstrucción trombótica; sin embargo, las opciones terapéuticas para la vasculopatía pulmonar son menores. En otros estudios, en los pacientes no operados la presencia de trombos centrales triplica el riesgo de fallecimiento10, lo que refuerza de nuevo el papel de la TEA cuando existen lesiones accesibles.
La experiencia del equipo quirúrgico es un factor fundamental para mejorar los resultados de la TEA e incrementar el porcentaje de pacientes en el que se indica. En nuestra serie, con la experiencia creciente, la indicación asciende al 58%. En otros grupos, como el de la Universidad de California, San Diego, que posee la serie quirúrgica más amplia de la literatura, el porcentaje de indicación de TEA llega a ser del 75%. En este centro, se ha incrementado la indicación quirúrgica a obstrucciones situadas en ramas segmentarias y subsegmentarias consiguiendo así aumentar el número de pacientes que pueden beneficiarse de la cirugía sin empeorar los resultados4,22. En el Registro Internacional (2007-2009), la TEA se indicó en el 63% de los pacientes13.
El TM6M ha sido identificado como factor independiente predictor de morbimortalidad en pacientes con HP23 y ha sido la base para estudiar la eficacia de distintos fármacos en HPTEC24,25. En el presente estudio, al igual que en el REHAP10, el aumento en la distancia recorrida en el TM6M es predictor independiente de supervivencia en la HPTEC.
El antecedente de embolia aguda de pulmón está presente en aproximadamente un 75% de los pacientes con HPTEC, de forma similar a otras series de la literatura26,27. En el presente estudio, el antecedente de embolia pulmonar aguda fue un factor independiente predictor de supervivencia en los pacientes con HPTEC. Los pacientes con embolia pulmonar previa podrían tener más contenido trombótico obstructivo y menos vasculopatía de pequeño vaso. Adicionalmente, en el Registro Internacional9 y en nuestra serie, en el análisis univariante, el antecedente de embolia pulmonar fue un predictor de supervivencia en los pacientes tratados mediante cirugía.
El antecedente de cáncer en la historia clínica es factor predictor de mortalidad a largo plazo en nuestra serie, igual ocurre en el Registro Internacional9. El cáncer es una de las condiciones médicas que se asocian al desarrollo de la HPTEC28,29 y adicionalmente reduce la supervivencia.
El pronóstico en la HPTEC está directamente relacionado con la gravedad hemodinámica de la HP30,31. En el conjunto de nuestros pacientes, la mortalidad se incrementa un 19% por cada 200 dinas.s.cm–5 que aumenten las RVP en el diagnóstico de la enfermedad.
Análisis de los pacientes intervenidosLa mortalidad hospitalaria en las 143 TEA fue del 5,6% y se redujo al 2% tras la curva de aprendizaje. Un hecho destacable de nuestra serie fue que la cirugía es igualmente segura y eficaz en los pacientes con mayor gravedad hemodinámica y, teóricamente, con un peor pronóstico. En la serie publicada recientemente por nuestro grupo con 160 TEA, pasada la curva de aprendizaje, la mortalidad fue del 3,8% en los pacientes con RVP ≥ 1.090 dinas.s.cm–518 y no hubo diferencias estadísticamente significativas en la supervivencia a largo plazo entre estos pacientes y los que tenían RVP < 1.090 dinas.s.cm–5. Estos resultados son superponibles a los grupos quirúrgicos principales4,11,13 y subrayan que el programa de TEA cumple los estándares exigidos en las guías de práctica clínica3.
La HP residual tras la TEA no está bien definida4,13-16,29. Su relevancia está en el hecho de haberse asociado repetidamente con la mortalidad en el seguimiento de los pacientes operados13-15,29. La reciente publicación del grupo del Hospital de Papworth, con 880 pacientes operados y seguidos con cateterismo a los 3, 6 y 12 meses, ha clarificado algunos aspectos de la HP residual11. En este trabajo, las RVP ≥ 425 dinas.s.cm–5 en el seguimiento se asocian significativamente a la mortalidad relacionada con la HPTEC. En nuestro caso, no encontramos relación entre la HP residual y la mortalidad a largo plazo; esto puede deberse al número reducido de pacientes con HP residual (23 pacientes).
El significado pronóstico del TM6M en los pacientes intervenidos ha sido poco estudiado, casi siempre en relación con la mortalidad hospitalaria y pocas veces en el seguimiento9,10,12,32. En nuestra serie, el TM6M al diagnóstico de la enfermedad fue un factor predictivo independiente de supervivencia a largo plazo, al igual que en la experiencia inglesa11. Estos datos subrayan la utilidad del TM6M para estratificar la gravedad del paciente y priorizar la realización de la cirugía.
Análisis de los pacientes no intervenidosEn este trabajo, la supervivencia en el grupo de pacientes no intervenidos es significativamente inferior a la de los tratados con TEA9,10,12. Por otro lado, aunque no de forma significativa, la supervivencia de estos pacientes ha mejorado a lo largo de los 20 años de experiencia de la Unidad. Solo otro estudio ha comunicado unos resultados similares; se trata del registro de Reino Unido publicado en 2008, en el que la atención a los pacientes con HPTEC está centralizada en unidades de referencia en HP.
En nuestra serie, en el registro internacional de HPTEC9 y en la mayoría de los registros de HP33 la gravedad hemodinámica de la HP, la clase funcional avanzada, la obstrucción en las pruebas de función respiratoria, la dilatación del ventrículo derecho, la presencia de derrame pericárdico y los valores de NT-proBNP fueron factores pronósticos de mortalidad. Sin embargo, la edad y el sexo, al contrario que en los registros de HP, no modifican significativamente el pronóstico en los pacientes inoperables con HPTEC.
El TM6M al diagnóstico fue predictor independiente de supervivencia a largo plazo10,12,31. La importancia de la estratificación pronóstico de los metros recorridos en el TM6M ha sido ya descrita y ha constituido el objetivo primario en los ensayos clínicos farmacológicos realizados en estos pacientes24,25.
El tratamiento específico utilizado en esta serie fueron los antagonistas de la endotelina, los inhibidores de la 5-fosfodiesterasa y las prostaciclinas. El riociguat no estaba en uso en el momento del diagnóstico de los pacientes, en la actualidad se está administrando según recomendación3,25.
Las guías clínicas consideran el tratamiento con angioplastia pulmonar para pacientes sin indicación quirúrgica y dentro de una unidad experta3,34,35. En nuestro centro, desde al año 2013, los pacientes no candidatos a cirugía de TEA y con mala evolución clínica se han revaluado para ofrecerles la posibilidad de angioplastia pulmonar36,37.
LimitacionesLos tratamientos médico y quirúrgico no pueden ser comparados de forma estricta puesto que se indican en poblaciones de HPTEC distintas, pacientes con lesiones accesibles a la cirugía y pacientes inoperables.
Se trata de un estudio retrospectivo realizado solo en un centro; sin embargo, todos los datos se recogieron de forma prospectiva y a lo largo de 20 años.
Los pacientes que recibieron angioplastia han sido excluidos del análisis; se trata de los pacientes con peor evolución clínica del grupo no quirúrgico.
ConclusionesEsta es la población con HPTEC más extensa atendida en un solo centro de nuestro país y seguida durante 20 años. Los pacientes operados tienen una supervivencia mayor que los no intervenidos, con un 63% menos de riesgo de morir en el seguimiento.
La experiencia acumulada a lo largo de 20 años ha mejorado significativamente la supervivencia a largo plazo en los pacientes intervenidos, aumentado el porcentaje de pacientes con indicación de cirugía y beneficiando a los pacientes que reciben tratamiento médico.
AutoríaLópez Gude MJ: colaboración en los procedimientos quirúrgicos, recogida de datos, análisis estadístico, interpretación de resultados y elaboración del manuscrito.
Santos-Lozano A: análisis estadístico.
Pérez de la Sota E, Centeno Rodríguez J: colaboración
en los procedimientos quirúrgicos.
Pérez Vela JL, Velázquez MT, Delgado Jiménez J, Morales R: diagnóstico y manejo clínico de los pacientes.
Aguado García JM: elaboración del manuscrito.
Escribano Subías P: diagnóstico y manejo clínico de los pacientes, interpretación de resultados y elaboración del manuscrito.
Cortina Romero JM: realización de los procedimientos quirúrgicos, recogida de datos, análisis estadístico, interpretación de resultados y elaboración del manuscrito.
Los dos últimos autores han colaborado por igual en la elaboración del manuscrito.
FinanciaciónEste trabajo fue parcialmente financiado por el Instituto de Salud Carlos III y los Fondos Europeos de Desarrollo Regional (FEDER).