Un porcentaje de pacientes intervenidos de cirugía cardiaca presentan fracaso cardiorrespiratorio refractario a medidas convencionales, y precisan soporte circulatorio y respiratorio con membrana de oxigenación extracorpórea (ECMO) en el postoperatorio.
MétodosEn los últimos 20 años, 119 pacientes pediátricos precisaron ECMO en nuestro centro.
El 46% de los pacientes fueron neonatos, con una edad media de 15,4 meses y un peso de 6,9kg.
La principal indicación (60%) fue incapacidad de destete de la circulación extracorpórea.
ResultadosDe los 119 pacientes intervenidos se consiguió un éxito de destete en el 63%, con un porcentaje de supervivencia del 50%. A partir del año 2009, se consigue el destete en el 78% de los pacientes, con supervivencia del 66%.
Los factores de riesgo asociados con mortalidad en el análisis univariante fueron: sexo masculino, periodo neonatal, la primera etapa (antes de 2009), cardioplejía St. Thomas, tiempo de circulación extracorpórea, no drenaje de cavidades izquierdas, duración de la ECMO menos de 2 días o más de 5, y el uso de dispositivo diferente de la centrífuga de segunda generación.
El 47% de los pacientes necesitaron algún tipo de reintervención.
ConclusionesSe trata de una serie amplia de ECMO poscardiotomía en la edad pediátrica, con buenos resultados de destete y supervivencia, especialmente en la última década (66% de supervivencia).
La mitad de los pacientes necesitaron algún tipo de reintervención, por lo que es muy importante la búsqueda de lesiones residuales postoperatorias.
A percentage of patients undergoing cardiac surgery present with cardiorespiratory failure refractory to maximal conventional therapy during the post-operative period, and require circulatory and respiratory support with extracorporeal membrane oxygenation (ECMO).
MethodsA total of 119 paediatric patients required ECMO after cardiotomy in our institution.
Just under half (46%) of the patients were neonates, with a mean age of 15.4 months and mean weight of 6.9kg.
The main indication (60%) was the impossibility to wean the patient off extracorporeal circulation.
ResultsOf the 119 patients, weaning off ECMO was achieved in 63%, with a survival rate of 50%. As of 2009, weaning rate was 78%, with 66% survival.
The risk factors associated with mortality in the univariate analysis were: male gender, neonatal period, and the first era (before 2009), as well as St. Thomas Cardioplegia, extracorporeal circulation time, no left cavities drainage, ECMO duration of less than two days or more than 5, and the use of a device different from the second generation centrifuge pump.
Just under half (47%) of the patients needed some type of re-intervention.
ConclusionsThis is a wide series of post-cardiotomy ECMO in patients of paediatric age, with good weaning and survival results, especially in the last decade (66% survival).
Some type of re-intervention was required by 47% of the patients, making it very important to look actively for residual post-operative residual lesions.
Un porcentaje de pacientes intervenidos de cirugía cardiaca presentan fracaso cardiorrespiratorio refractario a medidas convencionales, y precisan soporte circulatorio y respiratorio con membrana de oxigenación extracorpórea (ECMO) por imposibilidad de destete de la circulación extracorpórea (CEC) o durante las primeras horas del postoperatorio. Este porcentaje varía según las diferentes series entre el 1 y el 4%1-6.
A pesar de los avances en los últimos años en los campos de la cirugía, técnicas de CEC, de protección miocárdica y cuidados postoperatorios, este porcentaje permanece constante (especialmente en lo referente a la cirugía neonatal), e incluso va en aumento debido a la mayor complejidad de los procedimientos en la mayoría de los centros, incluida una mayor tendencia a la reparación completa de los defectos en periodo neonatal.
La supervivencia media oscila entre el 35 y el 60%7 en diferentes series, incluido el registro de la ELSO (Extracorporeal Life Support Organization), en el que según el último reporte de julio de 2018 sobreviven al alta el 42% de los neonatos y el 52% de los pacientes pediátricos (con porcentajes de destete del 64% en neonatos y del 68% en pacientes pediátricos).
En este artículo analizamos los resultados en nuestro centro en los últimos 20 años. Además, realizamos una revisión del manejo general y en determinadas circunstancias de especial interés, tales como los diferentes estadios de la vía univentricular.
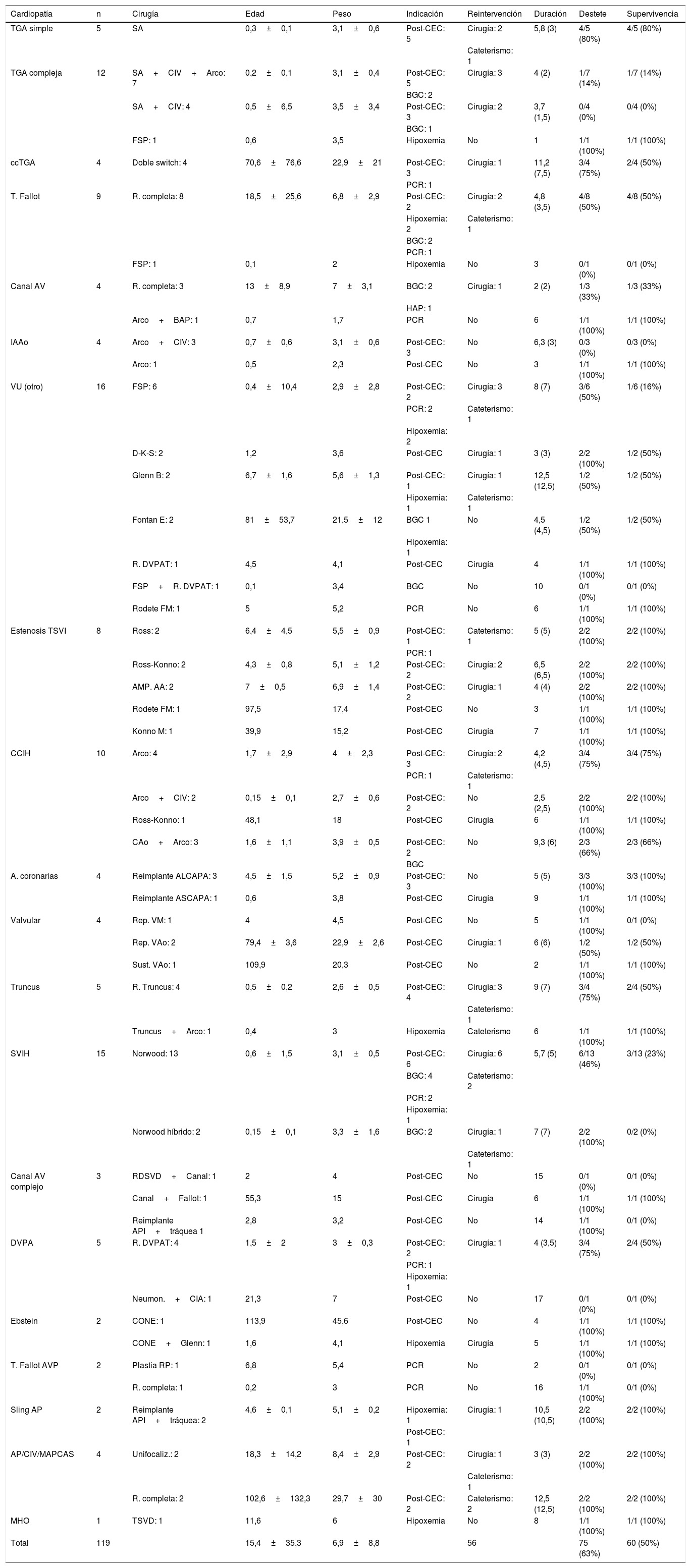
MétodosEntre 1998 y 2018, 119 pacientes pediátricos precisaron ECMO en el postoperatorio de reparación o paliación de cardiopatías congénitas. El comité ético del Hospital Universitario 12 de Octubre autorizó la recogida de datos y la publicación del presente estudio. La tabla 1 resume las características de los pacientes por diagnóstico, procedimiento, peso, edad, indicación y necesidad de reintervención durante la asistencia con ECMO, duración de la asistencia, porcentajes de destete y supervivencia.
Características de los paciente según cardiopatía, cirugía, edad en meses, peso en kg, indicación, reintervención, duración media de la asistencia en días (mediana entre paréntesis), destete y supervivencia. Se reflejan los porcentajes de destete y supervivencia según la cardiopatía y el procedimiento
| Cardiopatía | n | Cirugía | Edad | Peso | Indicación | Reintervención | Duración | Destete | Supervivencia |
|---|---|---|---|---|---|---|---|---|---|
| TGA simple | 5 | SA | 0,3±0,1 | 3,1±0,6 | Post-CEC: 5 | Cirugía: 2 | 5,8 (3) | 4/5 (80%) | 4/5 (80%) |
| Cateterismo: 1 | |||||||||
| TGA compleja | 12 | SA+CIV+Arco: 7 | 0,2±0,1 | 3,1±0,4 | Post-CEC: 5 | Cirugía: 3 | 4 (2) | 1/7 (14%) | 1/7 (14%) |
| BGC: 2 | |||||||||
| SA+CIV: 4 | 0,5±6,5 | 3,5±3,4 | Post-CEC: 3 | Cirugía: 2 | 3,7 (1,5) | 0/4 (0%) | 0/4 (0%) | ||
| BGC: 1 | |||||||||
| FSP: 1 | 0,6 | 3,5 | Hipoxemia | No | 1 | 1/1 (100%) | 1/1 (100%) | ||
| ccTGA | 4 | Doble switch: 4 | 70,6±76,6 | 22,9±21 | Post-CEC: 3 | Cirugía: 1 | 11,2 (7,5) | 3/4 (75%) | 2/4 (50%) |
| PCR: 1 | |||||||||
| T. Fallot | 9 | R. completa: 8 | 18,5±25,6 | 6,8±2,9 | Post-CEC: 2 | Cirugía: 2 | 4,8 (3,5) | 4/8 (50%) | 4/8 (50%) |
| Hipoxemia: 2 | Cateterismo: 1 | ||||||||
| BGC: 2 | |||||||||
| PCR: 1 | |||||||||
| FSP: 1 | 0,1 | 2 | Hipoxemia | No | 3 | 0/1 (0%) | 0/1 (0%) | ||
| Canal AV | 4 | R. completa: 3 | 13±8,9 | 7±3,1 | BGC: 2 | Cirugía: 1 | 2 (2) | 1/3 (33%) | 1/3 (33%) |
| HAP: 1 | |||||||||
| Arco+BAP: 1 | 0,7 | 1,7 | PCR | No | 6 | 1/1 (100%) | 1/1 (100%) | ||
| IAAo | 4 | Arco+CIV: 3 | 0,7±0,6 | 3,1±0,6 | Post-CEC: 3 | No | 6,3 (3) | 0/3 (0%) | 0/3 (0%) |
| Arco: 1 | 0,5 | 2,3 | Post-CEC | No | 3 | 1/1 (100%) | 1/1 (100%) | ||
| VU (otro) | 16 | FSP: 6 | 0,4±10,4 | 2,9±2,8 | Post-CEC: 2 | Cirugía: 3 | 8 (7) | 3/6 (50%) | 1/6 (16%) |
| PCR: 2 | Cateterismo: 1 | ||||||||
| Hipoxemia: 2 | |||||||||
| D-K-S: 2 | 1,2 | 3,6 | Post-CEC | Cirugía: 1 | 3 (3) | 2/2 (100%) | 1/2 (50%) | ||
| Glenn B: 2 | 6,7±1,6 | 5,6±1,3 | Post-CEC: 1 | Cirugía: 1 | 12,5 (12,5) | 1/2 (50%) | 1/2 (50%) | ||
| Hipoxemia: 1 | Cateterismo: 1 | ||||||||
| Fontan E: 2 | 81±53,7 | 21,5±12 | BGC 1 | No | 4,5 (4,5) | 1/2 (50%) | 1/2 (50%) | ||
| Hipoxemia: 1 | |||||||||
| R. DVPAT: 1 | 4,5 | 4,1 | Post-CEC | Cirugía | 4 | 1/1 (100%) | 1/1 (100%) | ||
| FSP+R. DVPAT: 1 | 0,1 | 3,4 | BGC | No | 10 | 0/1 (0%) | 0/1 (0%) | ||
| Rodete FM: 1 | 5 | 5,2 | PCR | No | 6 | 1/1 (100%) | 1/1 (100%) | ||
| Estenosis TSVI | 8 | Ross: 2 | 6,4±4,5 | 5,5±0,9 | Post-CEC: 1 | Cateterismo: 1 | 5 (5) | 2/2 (100%) | 2/2 (100%) |
| PCR: 1 | |||||||||
| Ross-Konno: 2 | 4,3±0,8 | 5,1±1,2 | Post-CEC: 2 | Cirugía: 2 | 6,5 (6,5) | 2/2 (100%) | 2/2 (100%) | ||
| AMP. AA: 2 | 7±0,5 | 6,9±1,4 | Post-CEC: 2 | Cirugía: 1 | 4 (4) | 2/2 (100%) | 2/2 (100%) | ||
| Rodete FM: 1 | 97,5 | 17,4 | Post-CEC | No | 3 | 1/1 (100%) | 1/1 (100%) | ||
| Konno M: 1 | 39,9 | 15,2 | Post-CEC | Cirugía | 7 | 1/1 (100%) | 1/1 (100%) | ||
| CCIH | 10 | Arco: 4 | 1,7±2,9 | 4±2,3 | Post-CEC: 3 | Cirugía: 2 | 4,2 (4,5) | 3/4 (75%) | 3/4 (75%) |
| PCR: 1 | Cateterismo: 1 | ||||||||
| Arco+CIV: 2 | 0,15±0,1 | 2,7±0,6 | Post-CEC: 2 | No | 2,5 (2,5) | 2/2 (100%) | 2/2 (100%) | ||
| Ross-Konno: 1 | 48,1 | 18 | Post-CEC | Cirugía | 6 | 1/1 (100%) | 1/1 (100%) | ||
| CAo+Arco: 3 | 1,6±1,1 | 3,9±0,5 | Post-CEC: 2 | No | 9,3 (6) | 2/3 (66%) | 2/3 (66%) | ||
| BGC | |||||||||
| A. coronarias | 4 | Reimplante ALCAPA: 3 | 4,5±1,5 | 5,2±0,9 | Post-CEC: 3 | No | 5 (5) | 3/3 (100%) | 3/3 (100%) |
| Reimplante ASCAPA: 1 | 0,6 | 3,8 | Post-CEC | Cirugía | 9 | 1/1 (100%) | 1/1 (100%) | ||
| Valvular | 4 | Rep. VM: 1 | 4 | 4,5 | Post-CEC | No | 5 | 1/1 (100%) | 0/1 (0%) |
| Rep. VAo: 2 | 79,4±3,6 | 22,9±2,6 | Post-CEC | Cirugía: 1 | 6 (6) | 1/2 (50%) | 1/2 (50%) | ||
| Sust. VAo: 1 | 109,9 | 20,3 | Post-CEC | No | 2 | 1/1 (100%) | 1/1 (100%) | ||
| Truncus | 5 | R. Truncus: 4 | 0,5±0,2 | 2,6±0,5 | Post-CEC: 4 | Cirugía: 3 | 9 (7) | 3/4 (75%) | 2/4 (50%) |
| Cateterismo: 1 | |||||||||
| Truncus+Arco: 1 | 0,4 | 3 | Hipoxemia | Cateterismo | 6 | 1/1 (100%) | 1/1 (100%) | ||
| SVIH | 15 | Norwood: 13 | 0,6±1,5 | 3,1±0,5 | Post-CEC: 6 | Cirugía: 6 | 5,7 (5) | 6/13 (46%) | 3/13 (23%) |
| BGC: 4 | Cateterismo: 2 | ||||||||
| PCR: 2 | |||||||||
| Hipoxemia: 1 | |||||||||
| Norwood híbrido: 2 | 0,15±0,1 | 3,3±1,6 | BGC: 2 | Cirugía: 1 | 7 (7) | 2/2 (100%) | 0/2 (0%) | ||
| Cateterismo: 1 | |||||||||
| Canal AV complejo | 3 | RDSVD+Canal: 1 | 2 | 4 | Post-CEC | No | 15 | 0/1 (0%) | 0/1 (0%) |
| Canal+Fallot: 1 | 55,3 | 15 | Post-CEC | Cirugía | 6 | 1/1 (100%) | 1/1 (100%) | ||
| Reimplante API+tráquea 1 | 2,8 | 3,2 | Post-CEC | No | 14 | 1/1 (100%) | 0/1 (0%) | ||
| DVPA | 5 | R. DVPAT: 4 | 1,5±2 | 3±0,3 | Post-CEC: 2 | Cirugía: 1 | 4 (3,5) | 3/4 (75%) | 2/4 (50%) |
| PCR: 1 | |||||||||
| Hipoxemia: 1 | |||||||||
| Neumon.+CIA: 1 | 21,3 | 7 | Post-CEC | No | 17 | 0/1 (0%) | 0/1 (0%) | ||
| Ebstein | 2 | CONE: 1 | 113,9 | 45,6 | Post-CEC | No | 4 | 1/1 (100%) | 1/1 (100%) |
| CONE+Glenn: 1 | 1,6 | 4,1 | Hipoxemia | Cirugía | 5 | 1/1 (100%) | 1/1 (100%) | ||
| T. Fallot AVP | 2 | Plastia RP: 1 | 6,8 | 5,4 | PCR | No | 2 | 0/1 (0%) | 0/1 (0%) |
| R. completa: 1 | 0,2 | 3 | PCR | No | 16 | 1/1 (100%) | 0/1 (0%) | ||
| Sling AP | 2 | Reimplante API+tráquea: 2 | 4,6±0,1 | 5,1±0,2 | Hipoxemia: 1 | Cirugía: 1 | 10,5 (10,5) | 2/2 (100%) | 2/2 (100%) |
| Post-CEC: 1 | |||||||||
| AP/CIV/MAPCAS | 4 | Unifocaliz.: 2 | 18,3±14,2 | 8,4±2,9 | Post-CEC: 2 | Cirugía: 1 | 3 (3) | 2/2 (100%) | 2/2 (100%) |
| Cateterismo: 1 | |||||||||
| R. completa: 2 | 102,6±132,3 | 29,7±30 | Post-CEC: 2 | Cateterismo: 2 | 12,5 (12,5) | 2/2 (100%) | 2/2 (100%) | ||
| MHO | 1 | TSVD: 1 | 11,6 | 6 | Hipoxemia | No | 8 | 1/1 (100%) | 1/1 (100%) |
| Total | 119 | 15,4±35,3 | 6,9±8,8 | 56 | 75 (63%) | 60 (50%) |
ALCAPA: anomalous left coronary artery from pulmonary artery; AMP. AA: ampliación de aorta ascendente; API: arteria pulmonar izquierda; ASCAPA: anomalous single coronary artery from pulmonary artery; BAP: banding arteria pulmonar; BGC: bajo gasto cardiaco; Canal AV: canal auriculoventricular; CAo: comisurotomía aórtica; CCIH: complejo de cavidades izquierdas hipoplásicas; ccTGA: trasposición de grandes arterias congénitamente corregida; CIA: comunicación interauricular; CIV: comunicación interventricular; CONE: cone reconstruction; D-K-S: procedimiento de Damus-Kaye-Stansel; DVPAT: drenaje venoso pulmonar anómalo total. FSP: fístula sistémico-pulmonar; HAP: hipertensión pulmonar; IAAo: interrupción de arco aórtico; Konno M: Konno modificado; MAPCAS: colaterales aortopulmonares; MHO: miocardiopatía hipertrófica obstructiva; Neumon.: neumonectomía; PCR: parada cardiorrespiratoria; Post-CEC: incapacidad de destete de circulación extracorpórea; RDSVD: reparación de doble salida de ventrículo derecho; Rep. VAo: reparación valvular aórtica; Rep. VM: reparación valvular mitral; Rodete FM: rodete fibromuscular; RP: ramas pulmonares; SA: swicth arterial; Sling AP: sling de arteria pulmonar; Sust. VAo: sustitución valvular aórtica; SVIH: síndrome de ventrículo izquierdo hipoplásico; T. Fallot AVP: Fallot con agenesia de válvula pulmonar; TGA: trasposición de grandes arterias. TSVD: tracto de salida de ventrículo derecho; TSVI: tracto de salida de ventrículo izquierdo; Unifocaliz: unifocalización; VU (otro): cualquier otra cardiopatía paliada con la vía univentricular diferente del ventrículo izquierdo hipoplásico.
El 46% de los pacientes (n=55) fueron neonatos, con una edad media de 15,4±35,3 meses y un peso de 6,9±8,8kg. El porcentaje de supervivencia en este subgrupo de pacientes fue del 40%.
El diagnóstico más frecuente en reparación biventricular (n=87) fue el de trasposición de grandes vasos, incluyendo formas simples (n=5) y complejas (n=12). El porcentaje de supervivencia en este subgrupo de pacientes es de casi el 58%. En paliación univentricular (n=32) el diagnóstico más frecuente el de síndrome de ventrículo izquierdo hipoplásico en su primer estadio, cirugía de Norwood (n=13) o Norwood híbrido (n=2). El porcentaje de supervivencia en este subgrupo de pacientes fue del 31%.
La principal indicación, en más del 60% de los pacientes (n=75), fue incapacidad de destete de la CEC.
En la práctica totalidad de los pacientes se empleó asistencia con ECMO en modalidad venoarterial. Únicamente en 2 pacientes se empleó una asistencia ventricular izquierda, en los que la función del ventrículo derecho y la pulmonar estaban conservadas. En 3 pacientes se utilizó asistencia veno-venosa con cánula única a través de la vena yugular derecha, en los que la indicación de la asistencia fue por hipoxemia (poscardiotomía) en la unidad de cuidados intensivos.
En el 20% (n=24) fue necesario emplear una cánula para el drenaje de cavidades izquierdas en casos de disfunción ventricular izquierda postoperatoria o cuando se objetivó distensión ventricular izquierda sin apertura de la válvula aórtica con/sin ecogenicidad/trombos intracavitarios.
Hasta el año 2005 el dispositivo de asistencia empleado fue una bomba centrífuga de primera generación con un oxigenador de membrana de silicona sin intercambiador de calor incorporado. Desde el año 2005 hasta el año 2009 se utilizó un sistema cerrado con una bomba de rodillo y un oxigenador de membrana de polimetilpenteno con intercambiador de calor incorporado, descritos para larga duración y de bajo cebado. A partir del año 2009 comenzamos a emplear bombas centrífugas de segunda generación con oxigenadores de polimetilpenteno como los descritos a partir de 2005. Este ha sido el dispositivo más frecuentemente empleado en nuestra serie (65% de los pacientes, n=77).
Análisis estadísticoSe ha utilizado el paquete de datos estadísticos SPSS, considerando significativo un valor de p<0,05.
Se ha realizado un análisis descriptivo de las variables cuantitativas mediante media, desviación estándar y mediana según la distribución de la variable. Para variables cualitativas, un análisis de frecuencia y porcentajes. Se realizó un análisis univariante de los factores de riesgo asociados a mortalidad, mediante una prueba T para las variables numéricas y una prueba de Chi-cuadrado o Fisher para variables categóricas. Se realizó un análisis univariante de las complicaciones asociadas a mortalidad mediante la prueba de Chi-cuadrado o de Fisher.
Además realizamos un análisis multivariante mediante regresión logística de los factores de riesgo de mortalidad.
Técnica de canulaciónEn prácticamente todos los pacientes se realizó canulación central, habitualmente con una cánula venosa en aurícula derecha y arterial en aorta ascendente.
En 24 pacientes (20%), en los que se evidenció disfunción ventricular izquierda y en los que el ventrículo izquierdo no se drenaba adecuadamente a través de la cánula de la aurícula derecha (no existía comunicación interauricular o era restrictiva), se utilizó una segunda cánula venosa situada en la aurícula izquierda, a nivel de las venas pulmonares derechas y conectadas en Y a la línea venosa de la ECMO. En nuestra experiencia las cánulas que mejor drenaje aportan son las acodadas metálicas, tanto en la aurícula derecha como en la izquierda.
En el 47% de los pacientes en los que la indicación fue la incapacidad de destete de CEC, la canulación se realizó en quirófano reutilizando las mismas cánulas empleadas en la CEC, cambiando únicamente el circuito de la CEC por el de la ECMO. En el resto de pacientes la canulación se realizó en cuidados intensivos.
Únicamente en 3 pacientes en los que la indicación fue la hipoxemia en el periodo postoperatorio recibieron una asistencia veno-venosa, mediante un abordaje cervical y canulación yugular con cánula de doble luz.
Manejo del paciente asistido con oxigenación por membrana extracorpóreaEl flujo de bomba se inicia habitualmente con el objetivo de suplir el gasto cardiaco (unos 100-120ml/kg/min en neonatos y lactantes, 80ml/kg/min en niños y 60ml/kg/min en adolescentes), aumentando dicho objetivo en el caso de la fisiología de ventrículo único o la existencia de cortocircuitos significativos.
La asistencia se ajusta para conseguir una adecuada perfusión periférica, con incremento y normalización de la saturación venosa mixta, adecuada función de órganos y normalización de los controles gasométricos, con aclaramiento del láctico.
Los inotropos se disminuyen inicialmente hasta suspender, con excepción del levosimendán si está indicado, pudiéndose reiniciar algún inotropo tras un periodo de reposo inicial para mejorar la pulsatilidad.
Se emplean fármacos para modificar las resistencias vasculares sistémicas según necesidad individual, habitualmente noradrenalina como vasopresor y urapidilo como vasodilatador.
En el caso de hipertensión pulmonar se indican vasodilatadores pulmonares (óxido nítrico y/o sildenafilo y bosentán, habitualmente).
La ventilación mecánica se disminuye a parámetros de reposo pulmonar evitando el colapso buscando PEEP óptima (alrededor de 10cmH2O), presiones pico bajas (alrededor de 20cmH2O), volúmenes corriente <6-7ml/kg, frecuencias de 10-20rpm y FiO2<0,5, habitualmente entre 0,3-0,4, aunque ajustada e individualizada según las necesidades de cada paciente y la patología añadida.
El flujo de gas y la concentración de oxígeno de la ECMO se modifican según las gasometrías arteriales.
La anticoagulación se realiza con heparina para mantener tiempos de coagulación activados entre 180-200 segundos, monitorizando la coagulación según protocolo y modificando dicho objetivo en situaciones individuales de sangrado y coagulación.
El hematocrito se mantiene >30%, aunque se trasfunde de manera ajustada a las necesidades y la situación de cada paciente. Se evita la trombocitopenia <100.000 plaquetas y el fibrinógeno <100mg/dl con transfusiones. En la presencia de sangrados significativos, se trasfunden otros hemoderivados según protocolo y situación clínica, empleando en ocasiones agentes antifibrinolíticos como el ácido tranexámico.
Se utiliza profilaxis quirúrgica durante el acto quirúrgico, haciendo posteriormente un seguimiento clínico y analítico exhaustivo para detectar y tratar precozmente las infecciones.
La nutrición se inicia de manera precoz tras la estabilización, y según la situación, como nutrición parenteral o enteral, empleando la nutrición enteral a débito continuo por sonda transpilórica de forma preferente.
Se emplean diuréticos si la diuresis es escasa o el balance positivo, añadiendo la depuración extrarrenal con hemofiltración conectada al circuito de forma precoz en lesión renal aguda, síndrome de respuesta inflamatoria sistémica o balances positivos excesivos.
El seguimiento cardiológico es continuo para descartar y evaluar el estado clínico, la adecuación de la asistencia en ECMO a las necesidades y la existencia de lesiones residuales, realizándose ecocardiografías seriadas y diagnóstico o tratamiento por cateterismo o cirugía, si el paciente lo precisa.
El seguimiento neurológico comprende la exploración clínica, así como ecografías doppler cerebrales seriadas y TC en caso de sospecha de lesión.
El destete se ajusta y diseña individualmente siguiendo en todos los casos el protocolo de desconexión de la unidad y ajustando la ventilación mecánica y el apoyo inotrópico según cada situación, disminuyendo en caso de buena tolerancia los flujos de la ECMO con ajustes en la anticoagulación hasta hacer una prueba pinzando las líneas arterial y venosa y recirculando la sangre en su circuito tras haber insertado un by-pass, para comprobar la indicación al destete de forma clínica, analítica y ecocardiográfica. Una vez comprobada, se procede a la decanulación, dejando las bolsas de tabaco, los torniquetes y el tórax abierto 24h, por si fuera preciso la reentrada en ECMO. En caso de canulación cervical, se reconstruyen los vasos del cuello, si es posible.
Manejo en la vía univentricularEl manejo del primer estadio de la vía univentricular del paciente paliado con una fístula sistémico-pulmonar, es controvertido y difiere según el centro al que nos refiramos. Existen diferentes estrategias posibles de manejo2,4,8:
- 1.
Mantener la permeabilidad de la fístula sistémico-pulmonar que conlleva sobrecirculación en el circuito pulmonar. Es necesario aumentar el flujo de la asistencia para mantener adecuados flujos en ambos circuitos, pulmonar y sistémico.
- 2.
Oclusión temporal completa de la fístula.
- 3.
Realizar un cerclaje de la fístula hasta mantener SO2 de alrededor del 80% con FiO2 del 60%.
- 4.
Realizar un Glenn bidireccional y desmontar la fístula.
En el caso del ventrículo izquierdo hipoplásico, en nuestro centro realizamos fístula sistémico-pulmonar cuando la aorta ascendente es mayor de 3mm y hay flujo anterógrado. En el resto de los casos realizamos Norwood-Sano.
En los pacientes paliados con fístula nuestra política es ocluirla temporalmente, para garantizar una adecuada perfusión periférica y evitar el hiperaflujo pulmonar.
Los pacientes que precisan asistencia con ECMO tras la cirugía de Glenn bidireccional y Fontan son un grupo de malos resultados y de un manejo complejo debido a las múltiples cánulas que, en ocasiones, son necesarias para un adecuado drenaje del circuito venoso y del corazón.
En caso de precisar ECMO tras una parada cardiorrespiratoria, este grupo presenta especial morbilidad neurológica. El incremento de la presión intratorácica por el masaje cardiaco produce una disminución del retorno venoso, y por tanto del flujo pulmonar y cerebral, aumentando el riesgo de daño neurológico7.
ResultadosDe los 119 pacientes intervenidos se consiguió un éxito de destete en el 63% de los pacientes (n=75), con un porcentaje de supervivencia del 50% (n=60). Si analizamos los datos desde el uso de la bomba centrífuga de segunda generación a partir del año 2009 (n=80), se consigue el destete en el 78% de los pacientes, con una supervivencia del 66%.
La supervivencia en el grupo de neonatos fue del 40% de forma global, siendo después de 2009 del 48,5%.
En el 47% de los casos (n=56) se precisó reintervención durante la asistencia con ECMO, en 39 pacientes mediante cirugía y en 17 mediante cateterismo.
El tiempo medio de asistencia fue mayor en el grupo de los paciente fallecidos que en el de los supervivientes (6,7 vs. 5,5 días, respectivamente).
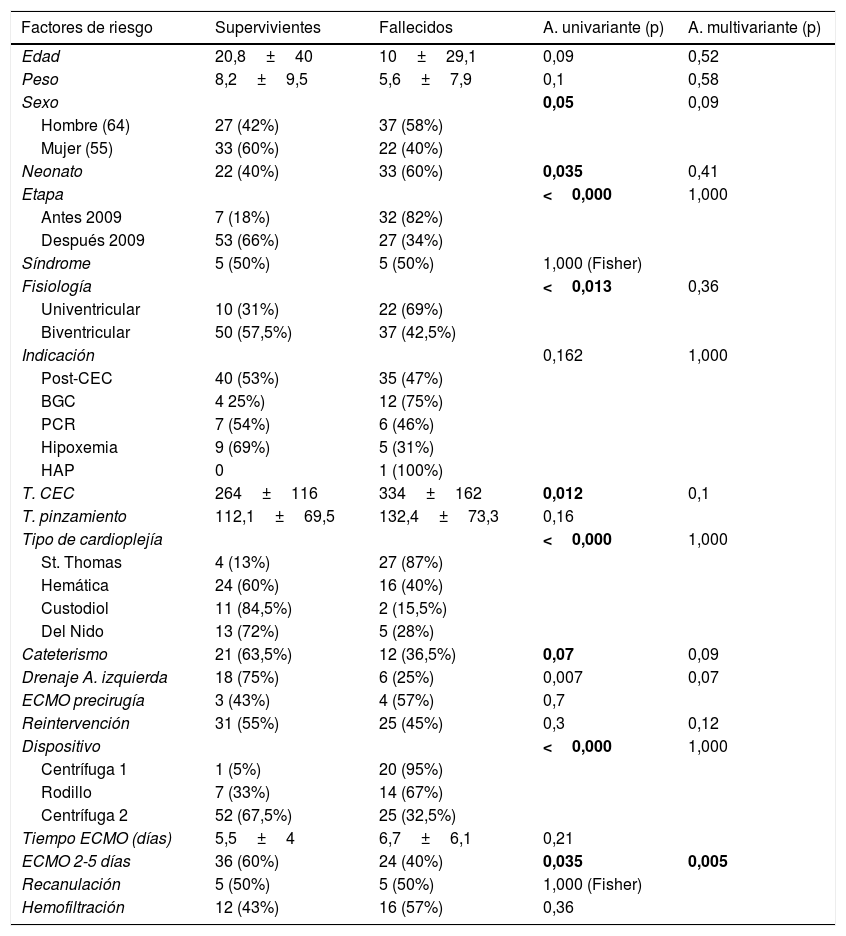
Factores de riesgoLos factores de riesgo de mortalidad según el análisis univariante quedan reflejados en la tabla 2.
Factores de riesgo de mortalidad
| Factores de riesgo | Supervivientes | Fallecidos | A. univariante (p) | A. multivariante (p) |
|---|---|---|---|---|
| Edad | 20,8±40 | 10±29,1 | 0,09 | 0,52 |
| Peso | 8,2±9,5 | 5,6±7,9 | 0,1 | 0,58 |
| Sexo | 0,05 | 0,09 | ||
| Hombre (64) | 27 (42%) | 37 (58%) | ||
| Mujer (55) | 33 (60%) | 22 (40%) | ||
| Neonato | 22 (40%) | 33 (60%) | 0,035 | 0,41 |
| Etapa | <0,000 | 1,000 | ||
| Antes 2009 | 7 (18%) | 32 (82%) | ||
| Después 2009 | 53 (66%) | 27 (34%) | ||
| Síndrome | 5 (50%) | 5 (50%) | 1,000 (Fisher) | |
| Fisiología | <0,013 | 0,36 | ||
| Univentricular | 10 (31%) | 22 (69%) | ||
| Biventricular | 50 (57,5%) | 37 (42,5%) | ||
| Indicación | 0,162 | 1,000 | ||
| Post-CEC | 40 (53%) | 35 (47%) | ||
| BGC | 4 25%) | 12 (75%) | ||
| PCR | 7 (54%) | 6 (46%) | ||
| Hipoxemia | 9 (69%) | 5 (31%) | ||
| HAP | 0 | 1 (100%) | ||
| T. CEC | 264±116 | 334±162 | 0,012 | 0,1 |
| T. pinzamiento | 112,1±69,5 | 132,4±73,3 | 0,16 | |
| Tipo de cardioplejía | <0,000 | 1,000 | ||
| St. Thomas | 4 (13%) | 27 (87%) | ||
| Hemática | 24 (60%) | 16 (40%) | ||
| Custodiol | 11 (84,5%) | 2 (15,5%) | ||
| Del Nido | 13 (72%) | 5 (28%) | ||
| Cateterismo | 21 (63,5%) | 12 (36,5%) | 0,07 | 0,09 |
| Drenaje A. izquierda | 18 (75%) | 6 (25%) | 0,007 | 0,07 |
| ECMO precirugía | 3 (43%) | 4 (57%) | 0,7 | |
| Reintervención | 31 (55%) | 25 (45%) | 0,3 | 0,12 |
| Dispositivo | <0,000 | 1,000 | ||
| Centrífuga 1 | 1 (5%) | 20 (95%) | ||
| Rodillo | 7 (33%) | 14 (67%) | ||
| Centrífuga 2 | 52 (67,5%) | 25 (32,5%) | ||
| Tiempo ECMO (días) | 5,5±4 | 6,7±6,1 | 0,21 | |
| ECMO 2-5 días | 36 (60%) | 24 (40%) | 0,035 | 0,005 |
| Recanulación | 5 (50%) | 5 (50%) | 1,000 (Fisher) | |
| Hemofiltración | 12 (43%) | 16 (57%) | 0,36 |
BGC: bajo gasto cardiaco; ECMO: membrana de oxigenación extracorpórea; HAP: hipertensión pulmonar; PCR: parada cardiorrespiratoria; Post-CEC: incapacidad de destete de circulación extracorpórea; T. CEC: tiempo de circulación extracorpórea.
En negrita se resaltan los factores de riesgo de mortalidad que resultaron estadísticamente significativos, tanto en el análisis uni como multivariante.
Los factores de riesgo asociados con mortalidad en el análisis univariante fueron: sexo masculino, intervención en periodo neonatal, intervención en la primera etapa (antes de 2009), cardioplejía St. Thomas, tiempo de CEC, no drenaje de cavidades izquierdas, duración de la ECMO menos de 2 días o más de 5, y el uso de dispositivo diferente de la centrífuga de segunda generación.
En el análisis multivariante el único factor de riesgo asociado a mortalidad fue una duración de la ECMO menos de 2 días o más de 5.
ComplicacionesLa tabla 3 muestra las complicaciones de la serie, siendo la más prevalente la infección, seguida de la reintervención por sangrado; la única complicación en la que se encontraron diferencias estadísticamente significativas fue la de infecciones.
Complicaciones
| Complicación | Mortalidad (n=59) | No mortalidad (n=60) | Análisis univariante (p) |
|---|---|---|---|
| R. sangrado | 16 | 16 | 0,95 |
| Infecciosas | 13 | 27 | 0,008 |
| Trombóticas | 3 | 4 | 1,000 (Fisher) |
| CID | 2 | 3 | 1,000 (Fisher) |
| Renales | 7 | 4 | 0,32 |
| Neurológicas | 10 | 5 | 0,15 |
| Pulmonares | 5 | 3 | 0,49 (Fisher) |
| Intestinales | 3 | 1 | 0,36 (Fisher) |
| Escape capilar | 2 | 1 | 0,61 (Fisher) |
CID: coagulación intravascular diseminada; R. sangrado: reintervención por sangrado.
En negrita se resaltan las complicaciones en ambos grupos de pacientes (mortalidad y no mortalidad) con diferencias estadísticamente significativas en el análisis univariante.
La mayor prevalencia de infección en el grupo de supervivientes puede estar explicada por el hecho de que el análisis no tiene en cuenta la variable tiempo, es decir, no se trata de infecciones durante la asistencia, sino de todo el ingreso.
Las complicaciones trombóticas hacen referencia a la presencia de trombosis en el circuito que obligasen a recambio del mismo o a trombos intracavitarios documentados por ecocardiografía.
En lo referente a la coagulación intravascular diseminada, quedan registrados los casos que implicaron necrosis distal de los miembros superiores o inferiores. De estos, 2 pacientes en el grupo de los supervivientes precisaron amputación de los miembros inferiores (infra- y supracondílea).
En cuanto a las complicaciones neurológicas, son aquellas lesiones trombóticas y/o hemorrágicas documentadas mediante ecografías cerebrales seriadas según el protocolo de la unidad de cuidados intensivos. En 9 de los 10 pacientes que presentaron lesiones neurológicas en el grupo de pacientes fallecidos, la causa de mortalidad fue limitación del esfuerzo terapéutico debido al daño neurológico.
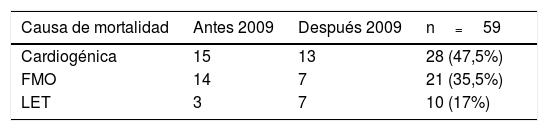
Causas de mortalidadLa tabla 4 muestra las causas de mortalidad de la serie antes y después del año 2009. No hubo diferencias estadísticamente significativas en las causas de mortalidad según la etapa. La principal causa de mortalidad fue la de origen cardiogénico, en el 47% de los casos.
DiscusiónEl presente estudio analiza una serie amplia de ECMO poscardiotomía. Como se ha comentado anteriormente, este porcentaje oscila entre el 1 y el 4% de los pacientes intervenidos de cardiopatías congénitas según el centro. Los porcentajes de éxito en el destete y supervivencia varían según el centro y el rango etario de los pacientes. En el último registro de la ELSO de julio de 2018 sobreviven al alta el 42% de los neonatos y el 52% de los pacientes pediátricos.
Nuestros resultados en 119 pacientes en los últimos 20 años concuerdan con los reportados por la ELSO, con una supervivencia del 50% y un porcentaje de destete del 60%. Además, si tenemos en cuenta la última década, los resultados mejoran sensiblemente los reportados por la ELSO, con un porcentaje de destete del 78% y una supervivencia del 66% en un grupo de 80 pacientes.
Los peores resultados de la primera década pueden ser explicados por diferentes razones: comienzo del programa no solo de ECMO, sino también de cirugía cardiaca infantil, el uso de sistemas de ECMO con bombas centrífugas de primera generación y de rodillo con mayor hemólisis que las empleadas actualmente, el uso de oxigenadores de membrana de silicona no aptos para larga duración, la posterior mejoría en las técnicas y el aparataje de la CEC, de protección miocárdica, la mejoría en las técnicas de hemofiltración, etc.
Otro aspecto a comentar es que el porcentaje de ECMO anual en nuestra serie se encuentra dentro de lo reportado anteriormente, siendo el 4,2% de los pacientes intervenidos con CEC, y teniendo en cuenta la alta complejidad de nuestro case mix, con un Aristóteles score promedio de 7,5 en la última década.
Los factores de riesgo de mortalidad identificados en nuestro estudio fueron: sexo masculino, intervención en periodo neonatal, intervención en la primera etapa (antes de 2009), el uso de cardioplejía St. Thomas, tiempo de CEC, fisiología univentricular, no drenaje de cavidades izquierdas, duración de la ECMO menos de 2 días o más de 5, y el uso de dispositivo diferente de centrífuga de segunda generación.
Estos resultados concuerdan con los reportados en otras series, como la de Sasaki et al.4, donde la supervivencia fue mayor en pacientes con circulación biventricular y en paciente mayores, y menor en pacientes con niveles de lactato más elevados en el momento de iniciar la asistencia. También encontraron mayores tasas de destete en los pacientes asistidos con dispositivo de asistencia ventricular (DAV) en el grupo de fisiología univentricular. Este grupo utiliza DAV siempre que los pulmones del paciente permitan una oxigenación suficiente, lo cual aporta determinadas ventajas, como disminuir la necesidad de anticoagulación, la hemólisis y la respuesta inflamatoria sistémica.
Nuestro grupo no tiene experiencia en el uso de asistencia ventricular en la vía univentricular; cuando es necesario se utiliza ECMO de forma rutinaria, aunque es cierto que el adecuado balance de los flujos pulmonar y sistémico, especialmente en el primer estadio, es de difícil manejo.
En nuestra serie únicamente se ha empleado asistencia sin oxigenador en 2 pacientes que presentaban disfunción ventricular izquierda aislada.
Según Delmo Walter et al.9, la duración de la CEC no fue asociada con mayor mortalidad, sin embargo, sí lo fue la duración de la asistencia en ECMO así como los niveles de lactato al comienzo de la asistencia8,9.
Otro factor que se encuentra asociado a mortalidad es el desarrollo de fallo renal8,10,11. En nuestro grupo no encontramos diferencias estadísticamente significativas en el desarrollo de fallo renal o necesidad de hemofiltración entre los supervivientes y los no supervivientes.
Algunos autores han identificado el inicio de la asistencia en quirófano como un factor de riesgo de mortalidad10,12. En nuestra serie la principal indicación de asistencia fue la incapacidad de destete de la CEC, aunque no se identifica ninguna indicación como factor de riesgo de mortalidad. Estos resultados son concordantes con otras series como la Jaggers et al.2, Aharon et al.5 o Alsoufi et al.8.
En cuanto a los ECMO precirugía, se refiere al subgrupo de pacientes que precisaron ECMO antes de la cirugía y que tras la intervención quirúrgica no se consiguieron destetar de CEC. Se trata de 7 pacientes con un grupo diagnóstico heterogéneo, y la indicación en todos los casos fue la hipoxemia. Tres pacientes sobrevivieron y 4 fallecieron. Bautista-Hernandez et al.13 reportan la serie más amplia del subgrupo de pacientes que precisan ECMO precirugía. La indicación más común de canulación fue la hipoxemia (17/26), seguida de parada cardiorrespiratoria y de shock cardiogénico. La principal cardiopatía fue la trasposición de grandes arterias con septo íntegro. La supervivencia en este grupo fue del 62%. Los pacientes que no se consiguieron destetar tras la cirugía presentaron mayor mortalidad, así como aquellos que precisaron una asistencia de mayor duración tras la cirugía. El único grupo de pacientes que refieren ser malos candidatos a ECMO precirugía son los de drenaje venoso pulmonar anómalo total obstructivo, que necesitan reparación quirúrgica lo antes posibles porque las presiones venosas pulmonares permanecen elevadas a pesar de la asistencia.
En el subgrupo de pacientes que precisan volver a canularse tras un destete de ECMO, Shuhaiber et al.7 reportan una supervivencia del 25%, que baja al 0% en los pacientes que necesitan entrada en ECMO 3 o más veces. En el grupo de pacientes de la ELSO no hay diferencias entre los paciente soportados con ECMO en una o 2 ocasiones. En nuestra serie 10 pacientes precisaron volver a canularse, 5 de ellos sobrevivieron y 5 no. Tan solo un paciente precisó una tercera entrada en ECMO, con diagnóstico de atresia pulmonar, comunicación interventricular (CIV) y colaterales aortopulmonares (MAPCAS) por sobreinfecciones respiratorias, y finalmente sobrevivió al alta.
En cuanto al porcentaje de reintervención, solo el 15% de la serie de Chaturvedi et al.10 precisa reintervención, pero solamente hace referencia a las quirúrgicas. Sasaki et al. en su serie4 solo hacen referencia a reintervenciones en corazones univentriculares, donde el 52% de los pacientes (10/19) precisaron reintervención. En nuestra serie el 47% de los pacientes (n=56) precisaron algún tipo de reintervención, siendo la mayoría por cirugía (39 pacientes) y el resto por cateterismo (17 pacientes).
La principal complicación en la mayoría de las series8,9,14 es la hemorragia y reintervención por sangrado, llegando en algunas series al 50% de los pacientes. En nuestra serie las infecciones fueron la complicación más frecuente pero no lo sería, probablemente, si se tuviese en cuenta las complicaciones mientras el paciente se mantuviese asistido. En cuanto a la trombosis del circuito en nuestra serie tuvo baja incidencia (6%), mientras que existen series con un porcentaje de hasta el 23%10,14.
ConclusionesSe trata de una serie amplia de ECMO poscardiotomía en la edad pediátrica, con buenos resultados de destete y supervivencia, especialmente en la última década (66% de supervivencia). El porcentaje de pacientes operados en CEC que precisaron asistencia (4,2%) se encuentra en los límites de lo reportado en la literatura.
El único factor de riesgo de mortalidad con el que se encontró asociación estadística en el análisis multivariante fue la duración de la ECMO menor de 2 o mayor de 5 días, aunque esto tiene que ser la expresión estadística de otros factores que no hemos podido identificar.
El 47% de los pacientes necesitaron algún tipo de reintervención, por lo que es muy importante la búsqueda de lesiones residuales mediante la evaluación ecocardiográfica seriada y el cateterismo cardiaco, cuando se quiera confirmar y/o intervenir sobre alguna lesión residual.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.