Se presenta un caso clínico de ALCAPA neonatal con disfunción ventricular izquierda grave e insuficiencia mitral moderada. El paciente tuvo una buena evolución postoperatoria. A pesar de necesitar soporte en oxigenación por membrana extracorpórea los primeros días del postoperatorio, el paciente recuperó la función ventricular con persistencia de insuficiencia mitral leve al décimo mes postoperatorio. A propósito del caso, se realiza una revisión del síndrome centrándonos en su tratamiento quirúrgico. El síndrome consiste en el nacimiento de la arteria coronaria izquierda desde el tronco de la arteria pulmonar. Una vez que la presión pulmonar del recién nacido comienza a descender de forma fisiológica, se producen fenómenos de isquemia por robo desde el tronco de la arteria pulmonar. Dependiendo del grado de circulación colateral desarrollado desde la coronaria derecha, el paciente presentará isquemia e insuficiencia cardiaca en la infancia o puede pasar desapercibido hasta la edad adulta. Hoy día el tratamiento de elección, especialmente en su presentación infantil, es el reimplante en la aorta. En la gran mayoría de los pacientes se produce la recuperación de la función ventricular izquierda y mejoría o resolución de la insuficiencia mitral preoperatoria en el primer año tras la cirugía.
The case is presented of neonatal ALCAPA with severe left ventricular dysfunction and moderate mitral regurgitation. The patient had good postoperative course. Despite needing extracorporeal membrane oxigenation support in the first postoperative days, the patient recovered ventricular function with persistence of mild mitral regurgitation 10months after the surgery. Along with this case, a review is carried out on the syndrome, mainly focusing on the surgical treatment. The syndrome consists of the origin of the left coronary artery from the pulmonary trunk. Once the physiological pulmonary pressure of the newborn falls, ischemia phenomena occur due to steal from the pulmonary trunk. Depending on the level of collateral circulation developed from the right coronary artery, the patient will present with ischaemia and heart failure in childhood, or can go unnoticed until adulthood. The treatment of choice, especially in infantile form, is currently aortic reimplantation. In the vast majority of patients, recovery of left ventricular function and improvement or resolution of preoperative mitral regurgitation occur in the first year after surgery.
Paciente recién nacido a término de 3 semanas de vida y 3,4kg de peso que consulta en urgencias por taquipnea persistente, fatiga con las tomas e hipersudoración progresivas en los últimos 2-3 días. En la radiografía de tórax se objetiva una cardiomegalia significativa, por lo que se decide valoración urgente por parte de cardiología pediátrica. En el ecocardiograma se evidencia una dilatación grave del ventrículo izquierdo (VI) con disfunción sistólica severa e insuficiencia mitral (IM) moderada. Se diagnostica de arteria coronaria izquierda con origen en arteria pulmonar (ALCAPA).
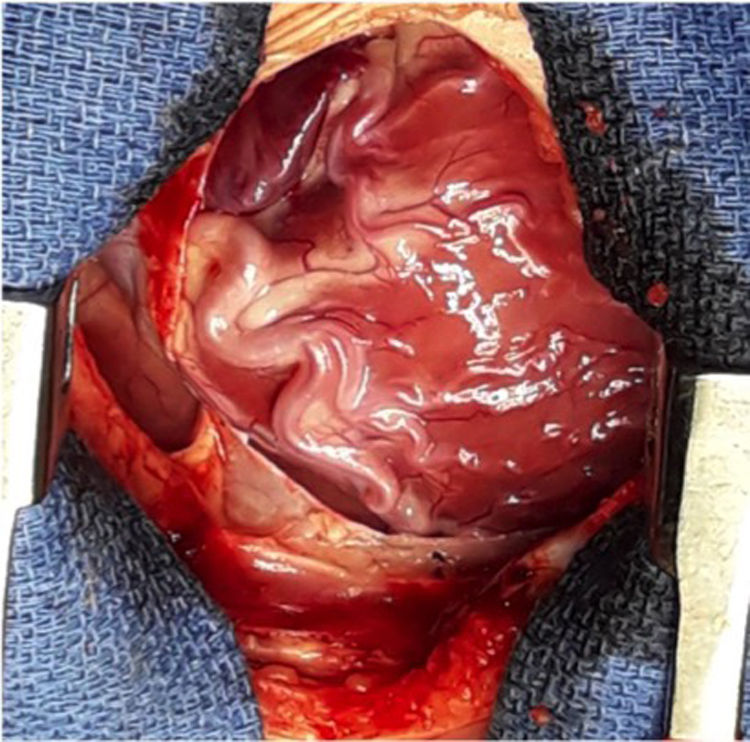
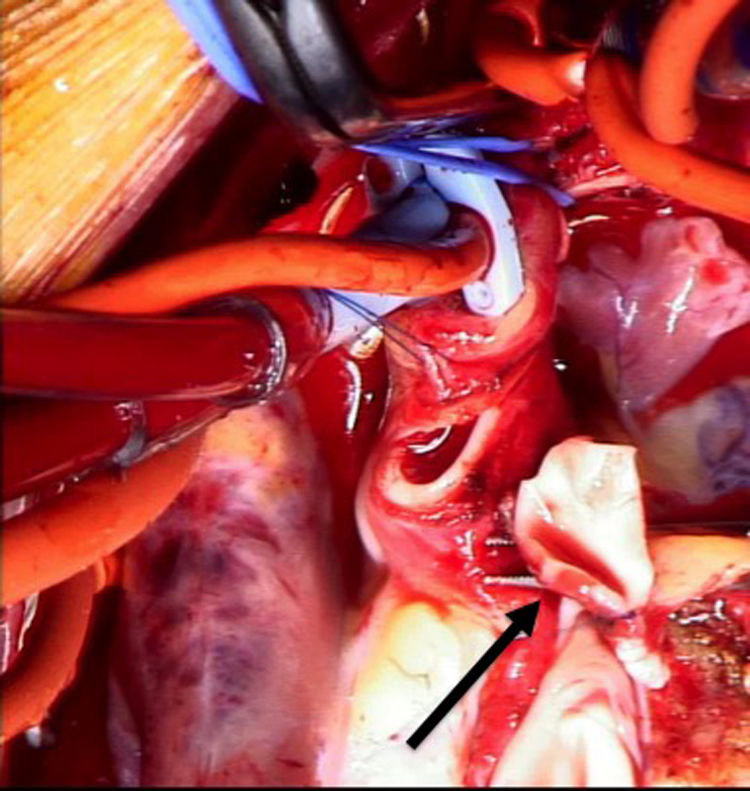
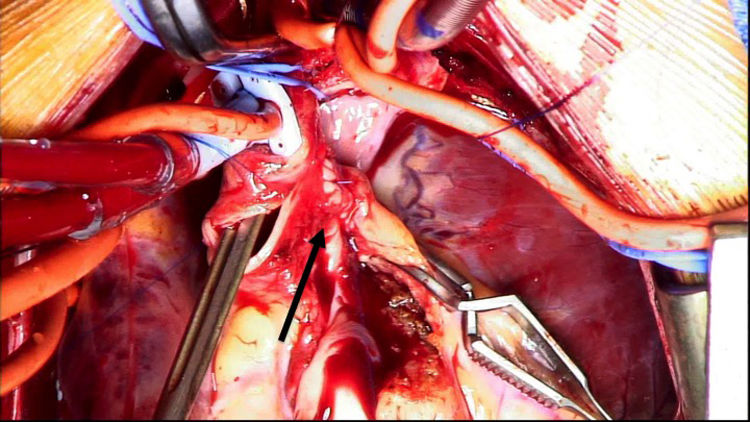
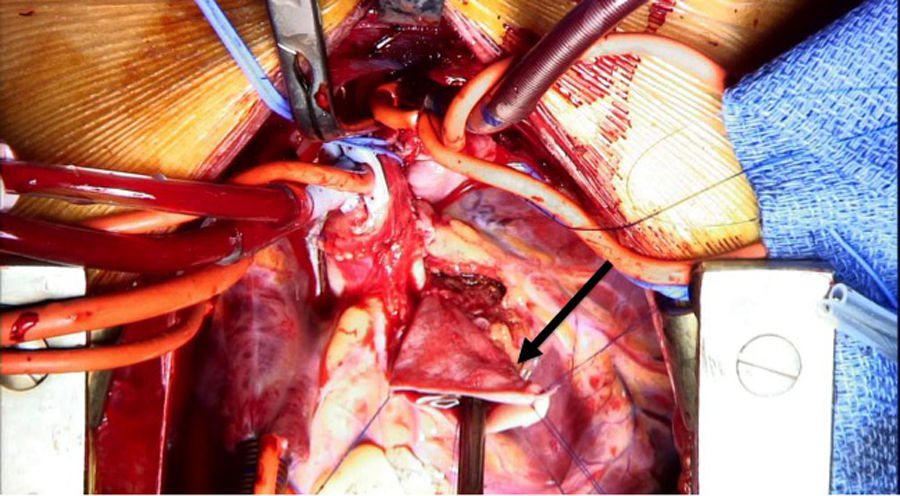
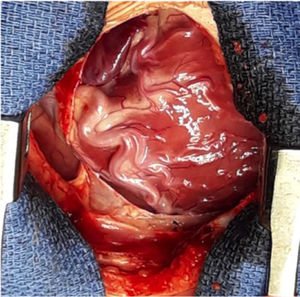
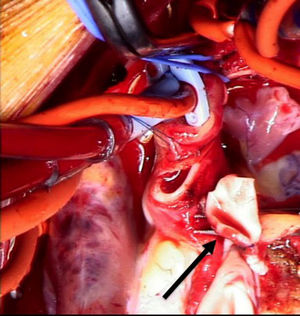
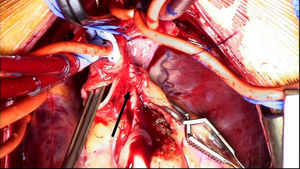
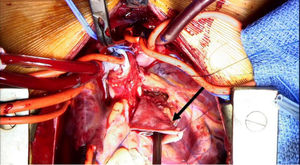
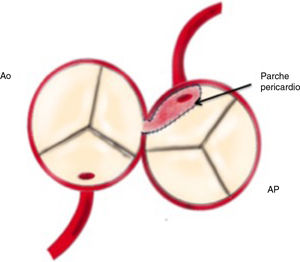
Se decide ingreso en unidad de cuidados intensivos pediátricos y cirugía urgente, donde se evidencia la arteria coronaria derecha dilatada y se procede al reimplante de la arteria coronaria izquierda que nace del tronco de la arteria pulmonar (TAP) en el seno lateral o izquierdo. Para ello se establece circulación extracorpórea a 28°C con canulación venosa bicava y arterial en aorta ascendente. Se pinza la aorta y se administra cardioplejía fría cristaloide a través de la raíz aórtica y la pulmonar (previo cerclaje temporal de ambas ramas pulmonares). Se realiza sección transversa del tronco pulmonar por encima de la unión sinotubular y se extrae el botón de la arteria coronaria izquierda. Se libera extensamente la coronaria y se realiza reinserción mediante contraapertura en la raíz aórtica en posición postero-lateral con técnica de trap-door. Se reconstruye la arteria pulmonar con el parche de pericardio autógeno y se reanastomosa el TAP a la confluencia de ambas ramas.
A la salida de circulación extracorpórea persiste con disfunción ventricular izquierda severa e IM moderada-severa, por lo que se decide salida en oxigenación por membrana extracorpórea (ECMO) electiva con canulación venosa en aurícula derecha e izquierda y arterial en aorta ascendente.
Permanece asistido en ECMO durante 5 días, tras lo que se realiza salida de ECMO con FEVI por Simpson biplano del 35%. Cierre de tórax diferido un día después del destete de la ECMO.
Es extubado a los 9 días de la decanulación y en su estancia en la unidad de cuidados intensivos presenta un episodio de sepsis por Serratia marcenses e infección del tracto urinario por Proteus mirabilis.
A los 30 y 42 días de la cirugía es dado de alta a planta y domicilio, respectivamente, con ciclos semanales de levosimendán. Recibe el último ciclo de levosimendán a los 2meses y medio de la cirugía.
Cuatro meses después de la cirugía se evidencia mejoría de la función ventricular izquierda con FEVI por Simpson biplano del 45% y persistencia de IM moderada.
El paciente presenta normalización de la función ventricular izquierda e IM leve desde la revisión de los 10 meses tras la cirugía, con el siguiente ecocardiograma-Doppler: no signos de congestión sistémica; aurículas normales; tabique interauricular íntegro; no insuficiencia tricúspide; IM leve excéntrica con jet leve de dirección posterolateral; ventrículo derecho no dilatado, con función sistólica conservada (TAPSE 13mm); VI no dilatado (DTd: 33mm, volumen telediastólico 28 ml=40ml/m2), con función sistólica recuperada (fracción de eyección por Simpson biplano 55%, 4C 59%, 2C 54%, PEL 60%). Asincronía del septo sin evidenciar alteraciones claras de la contractilidad segmentaria. Función diastólica preservada (E>A 1,3, E/E, hoy 10, TeiVI 0,5). Hiperrefringencia de músculos papilares y segmento basal de la cara lateral y posterior. Tractos de salida libres. IP leve. TAP sin aceleración patológica de flujo a su través. No insuficiencia aórtica. Arco aórtico normal, sin datos de coartación. Se observa coronaria izquierda reimplantada y con flujo a su través.
DiscusiónEl síndrome de ALCAPA también se conoce como síndrome de Bland-White-Garland y consiste en el nacimiento de la coronaria izquierda en el TAP. Presenta una incidencia de 1 de cada 300.000 recién nacidos vivos.
El paciente está asintomático durante el periodo neonatal, pero, debido a que el TAP contiene sangre desaturada, el miocardio se perfunde con sangre desaturada a baja presión. A medida que va disminuyendo la presión pulmonar, tras el periodo neonatal, empieza una isquemia miocárdica por fenómenos de robo coronario (cortocircuito izquierda-derecha) que provoca insuficiencia cardiaca y mitral secundaria, bien por anillo mitral dilatado o por infarto del músculo papilar anterior mitral. Pueden ir apareciendo colaterales de la coronaria derecha a la izquierda, debido a los fenómenos de robo coronario. Del desarrollo de colaterales desde la arteria coronaria derecha dependerá si el paciente sobrevive al primer año de vida. Se trata de un cortocircuito pequeño respecto al gasto cardiaco, pero elevado a nivel del flujo coronario.
Por lo tanto, suelen iniciar al final o tras el periodo neonatal, una vez que las resistencias pulmonares elevadas fisiológicas del recién nacido comienzan a descender, en la mayoría de las ocasiones con disfunción ventricular izquierda e IM asociadas.
Esta cardiopatía puede presentarse aislada o estar asociada a otras cardiopatías congénitas como ductus, comunicación interventricular, tetralogía de Fallot o coartación de aorta. La asociación con otras cardiopatías puede provocar el retraso de la clínica y el diagnóstico debido a que el descenso de la presión pulmonar se produce de forma más progresiva, lo que disminuye los fenómenos de robo coronario.
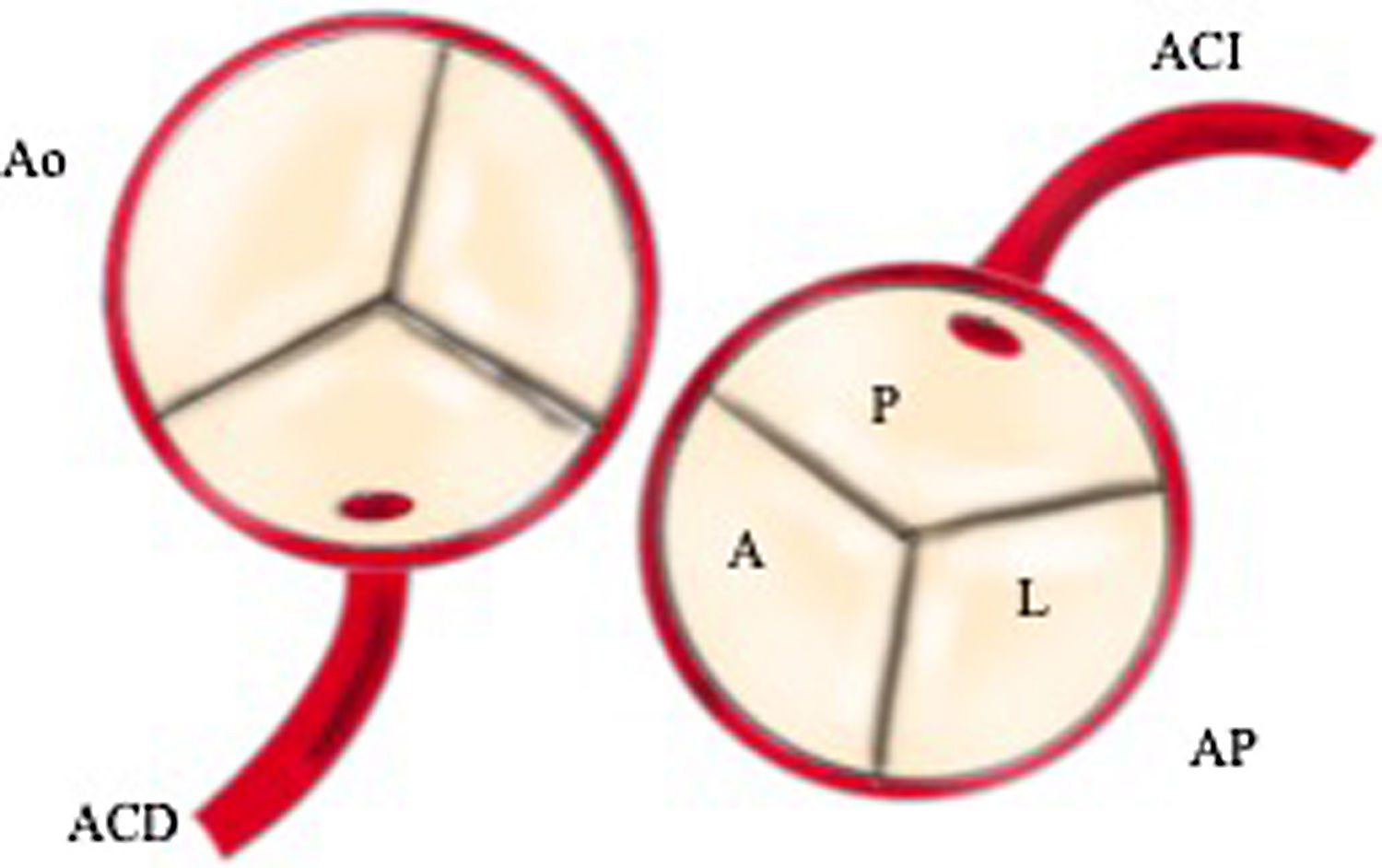
La coronaria izquierda suele estar localizada, en la mayoría de las ocasiones, antes de la bifurcación de las ramas pulmonares, en el seno pulmonar izquierdo o lateral. La coronaria derecha suele estar dilatada. Si existe hipertensión pulmonar, la perfusión del VI puede estar mantenida y prevenir la isquemia. Sin embargo, la mayoría de las veces provoca isquemia y fibroelastosis endomiocárdica difusa del VI.
También se han descrito anomalías en la implantación de la descendente anterior o la circunfleja que nacen de la arteria pulmonar, pero son variantes muy excepcionales1-3.
El diagnóstico es indicación de cirugía ya que hasta el 90% de los pacientes fallece en el primer año de vida. El objetivo del tratamiento quirúrgico es mantener los 2sistemas coronarios principales (coronaria derecha y coronaria izquierda) pero perfundidas con presión sistémica.
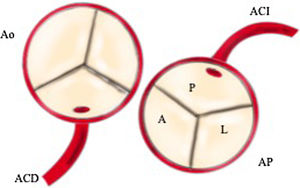
Se distinguen 2formas de presentación, la infantil, que es la más habitual y en la que se presentan signos y síntomas de insuficiencia cardiaca debido a que no se desarrollan colaterales desde la arteria coronaria derecha, y la forma del adulto, en la que se desarrollan colaterales y el paciente presenta función ventricular normal o disfunción ventricular ligera. Estos pacientes presentan riesgo de muerte súbita por desarrollo de arritmias ventriculares (fig. 1).
El primero en realizar un tratamiento quirúrgico fue Potts, en 1953, que realizó una fístula sistémico-pulmonar para aumentar la presión pulmonar y la presión de perfusión de la coronaria izquierda. El primer tratamiento quirúrgico con éxito fue realizado por Sabiston, que realizó la ligadura del tronco coronario izquierdo.
Existen diferentes técnicas para la reparación:
- 1.
Ligadura del origen de la coronaria anómala: su uso se realiza casi únicamente en pacientes adultos y en casi todas las ocasiones como procedimiento previo a la revascularización en pacientes inestables. Puede realizarse por abordaje miniinvasivo, aunque puede requerirse esternotomía media y circulación extracorpórea si la localización es posterior. La ligadura aislada no se recomienda hoy día debido a la alta mortalidad a corto y largo plazo que presenta.
- 2.
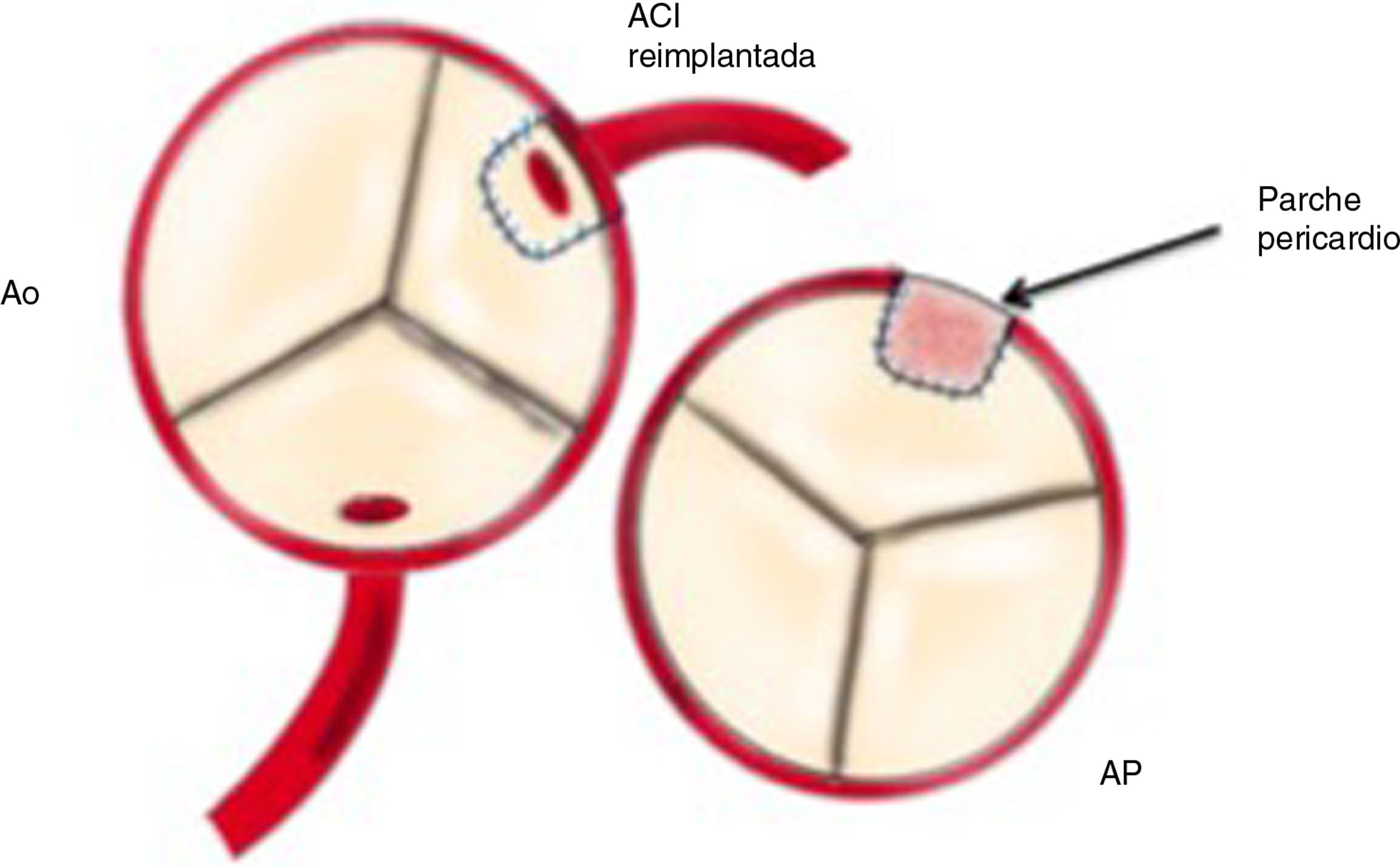
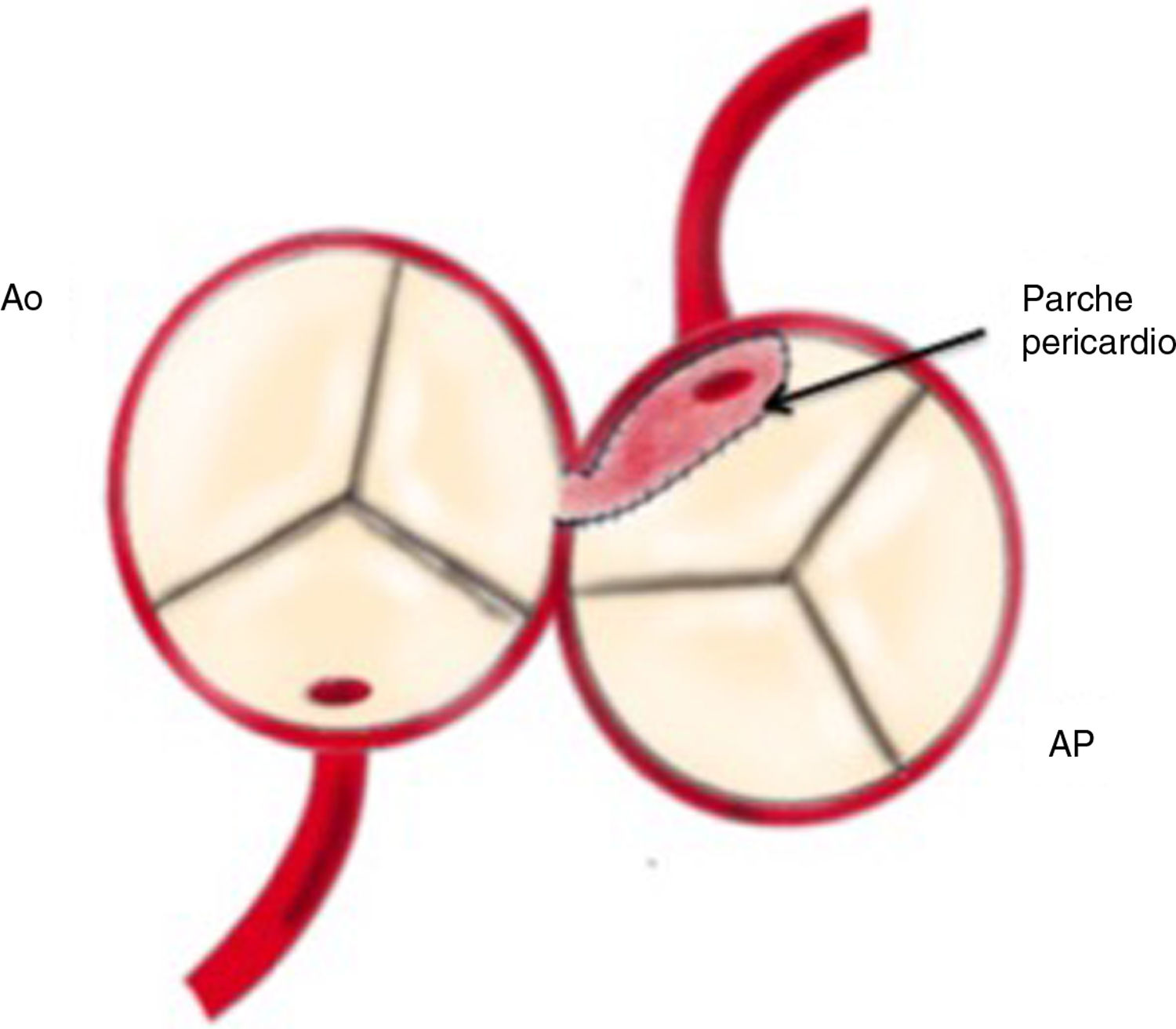
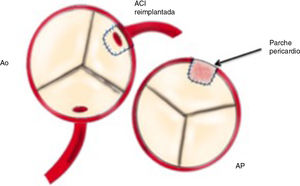
Reimplante en la aorta: se considera la técnica de elección debido a las potenciales complicaciones de la técnica de Takeuchi, fundamentalmente estenosis supravalvular pulmonar. Esta técnica puede ser empleada incluso cuando la arteria coronaria izquierda se encuentre saliendo del seno izquierdo (el más alejado de la aorta). Existen diferentes modificaciones de la técnica para que la anastomosis quede libre de tensión, que consiste en alargar el botón coronario con tejido de la arteria pulmonar, como la descrita por Turley et al.4,5, o pericardio autógeno. El defecto que queda en la arteria pulmonar al extraer el botón coronario es reparado con un parche de pericardio autógeno. Un aspecto importante en aquellas cirugías que requieran el pinzamiento aórtico es la protección miocárdica de forma anterógrada en la raíz aórtica y en el tronco de arteria pulmonar, con las ramas pulmonares cercladas. Esto garantiza una adecuada protección del territorio de la coronaria izquierda (figs. 2-6).
- 3.
Técnica de Takeuchi6: consiste en anastomosar lado a lado las arterias aorta y pulmonar para posteriormente tunelizar con un parche de pericardio autólogo, heterólogo o de material sintético la arteria coronaria izquierda hacia la aorta. Suele ser necesario ampliar la arteria pulmonar con otro parche para disminuir el riesgo de estenosis supravalvular. Hoy en día, alternativa, debido a sus potenciales complicaciones, especialmente la estenosis supravalvular pulmonar Puede tener indicación cuando la arteria coronaria afectada nace del seno más alejado (lateral o izquierdo), especialmente si se trata de una arteria coronaria única con un trayecto anterior de la coronaria derecha (fig. 7).
- 4.
Bypass coronario: con arteria mamaria interna izquierda. Considerada por algunos autores técnica de elección en adultos donde los tejidos son más friables y existe mayor dificultad para movilizar el botón coronario.
- 5.
Anastomosis de la arteria subclavia al tronco coronario izquierdo6: alternativa a reimplante y Takeuchi. Habitualmente, se realiza anastomosis término-terminal. En ocasiones, se puede realizar término-lateral con ligadura del origen en el TAP, con la ventaja de que puede realizarse la cirugía a corazón latiendo o incluso sin circulación extracorpórea. Es importante evitar tensiones o acodamiento en la anastomosis y en la arteria subclavia izquierda.
En cuanto a los resultados tras la cirugía, los resultados hoy día suelen ser excelentes con supervivencias mayores del 95% e incluso existen series como la de Backer et al.7, sin mortalidad operatoria ni necesidad de soporte mecánico circulatorio postoperatorio.
En cuanto a la función ventricular izquierda y al grado de IMl, normalmente comienzan a recuperarse en torno a los 4meses tras la cirugía y se suelen normalizar al año de la cirugía. En ocasiones, puede persistir cierto grado de IM, en la mayoría de las ocasiones leve, por lo que se recomienda no realizar ningún procedimiento asociado de reparación valvular mitral, especialmente en lactantes o neonatos8.
ConclusionesEn pacientes neonatos con disfunción ventricular izquierda hay que descartar la presencia de ALCAPA. Su diagnóstico es indicación de cirugía urgente debido al elevado riesgo de mortalidad que presenta, especialmente en el primer año de vida. En la gran mayoría de los casos se puede realizar el reimplante de la arteria coronaria en la aorta, existiendo diferentes técnicas para alargar el botón coronario si es necesario. La disfunción ventricular izquierda suele mejorar, en la mayoría de los casos, hasta su normalización en el primer año tras la cirugía. Del mismo modo, el grado de IM preoperatorio suele mejorar en el primer año tras la cirugía, en muchos casos hasta su desaparición. Por lo tanto, la gran mayoría de los grupos quirúrgicos no realizan ningún acto quirúrgico inicial sobre la válvula mitral, especialmente en los pacientes intervenidos en el primer año de vida.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.