Presentamos el caso de un neonato de 7 días de vida con diagnóstico prenatal de estenosis aórtica crítica y doble lesión valvular mitral grave, a quien realizamos una reparación biventricular neonatal completa, que consistió en procedimiento de Ross-Konno, resección extensa de fibroelastosis endocárdica y sustitución valvular mitral con una prótesis Melody®. Como antecedente se destaca la realización exitosa de valvuloplastia aórtica percutánea intraútero.
We report a case of a 7 days neonate with critical aortic stenosis and severe mitral stenosis and regurgitation, who underwent a complete biventricular repair in the neonatal period. The surgery consisted in a Ross-Konno procedure, extensive endocardial fibroelastosis resection and mitral valve replacement with the Melody™ valve. Previously a successfully fetal percutaneus aortic valvuloplasty had been performed.
La estenosis aórtica grave del recién nacido se inicia precozmente intraútero. El aumento de la presión intraventricular secundaria a la obstrucción aórtica genera un engrosamiento de la pared del ventrículo izquierdo (VI) y cierto grado de hipoplasia de la cavidad del mismo. Como consecuencia de un flujo transvalvular aórtico reducido y escape del retorno venoso pulmonar hacia la aurícula derecha (a través del foramen oval) en respuesta al aumento de la presión telediastólica del VI durante el desarrollo fetal, el anillo mitral, el aórtico y la aorta ascendente son habitualmente más pequeños de lo normal.
El grado de hipertrofia del VI es directamente proporcional a la severidad de la estenosis aórtica. Al tener una mayor masa muscular, y además sometida a una mayor tensión por el aumento de la presión intraventricular, aumenta el consumo miocárdico de oxígeno. Esto, aunado al hecho de que la hipertrofia muscular se desarrolla en ausencia de neovascularización, determina una reserva de flujo coronario disminuida. El más afectado es el músculo subendocárdico, donde además se han identificado estrechamientos de los vasos intramiocárdicos, comprometiendo aún más la perfusión miocárdica. Esta disminución del flujo coronario, sumada al aumento de la presión sistólica del VI de forma crónica intraútero, predispone a la aparición de isquemia y la consecuente fibroelastosis endocárdica.
Históricamente los grados más graves de hipoplasia del VI se han tratado, con relativo éxito, mediante procedimientos que determinan la vía univentricular (procedimiento de Norwood, Norwood híbrido); sin embargo, esta vía suele distar mucho (en términos de morbimortalidad y calidad de vida) de la biventricular.
El diagnóstico prenatal precoz, la realización con éxito de una valvuloplastia aórtica con balón intraútero y la cirugía cardiaca neonatal correctora (Ross-Konno o Yasui en caso de comunicación interventricular) han permitido cambiar el curso de esta fatídica cardiopatía1-3.
Caso clínicoSe trata de un paciente masculino con diagnóstico prenatal (22 semanas de gestación) de estenosis aórtica crítica (orificio efectivo de 1mm), estenosis e insuficiencia mitral graves y flujo reverso en arco aórtico. A las 23 semanas de gestación se le realiza valvuloplastia aórtica con balón percutánea, lográndose apertura aórtica eficaz (orificio efectivo de 3mm) y aumento del flujo transvalvular aórtico. Durante el embarazo el feto se desarrolla sin otras enfermedades. Se induce parto vaginal y se usan espátulas para abreviar el expulsivo.
La ecocardiografía posnatal muestra estenosis aórtica crítica, válvula mitral en paracaídas con doble lesión (ambas graves), fibroelastosis endocárdica difusa y flujo sistémico dependiente del ductus. Se inician prostaglandinas intravenosas y se presenta en sesión médico-quirúrgica. Se decide llevar a cabo una reparación biventricular precoz en un estadio.
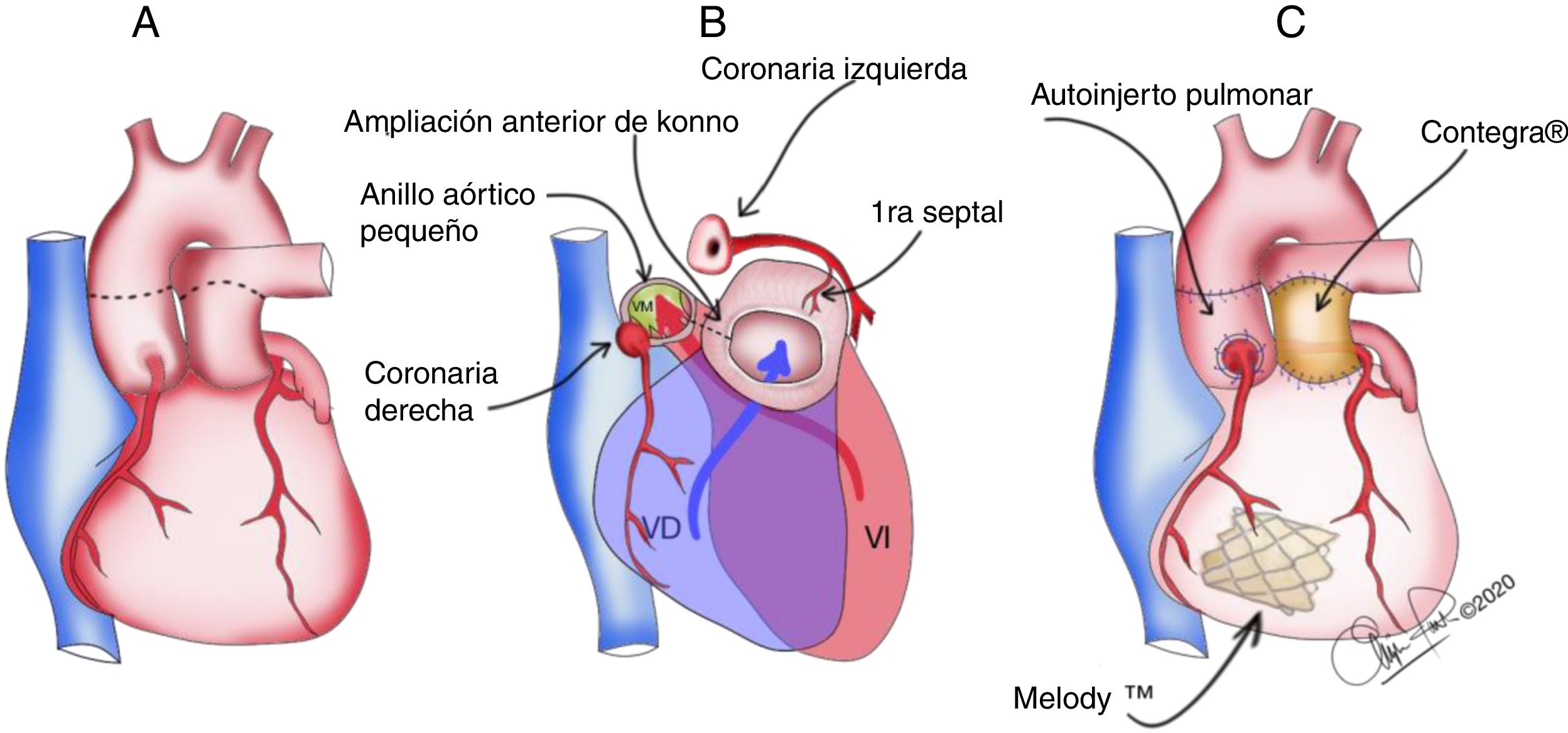
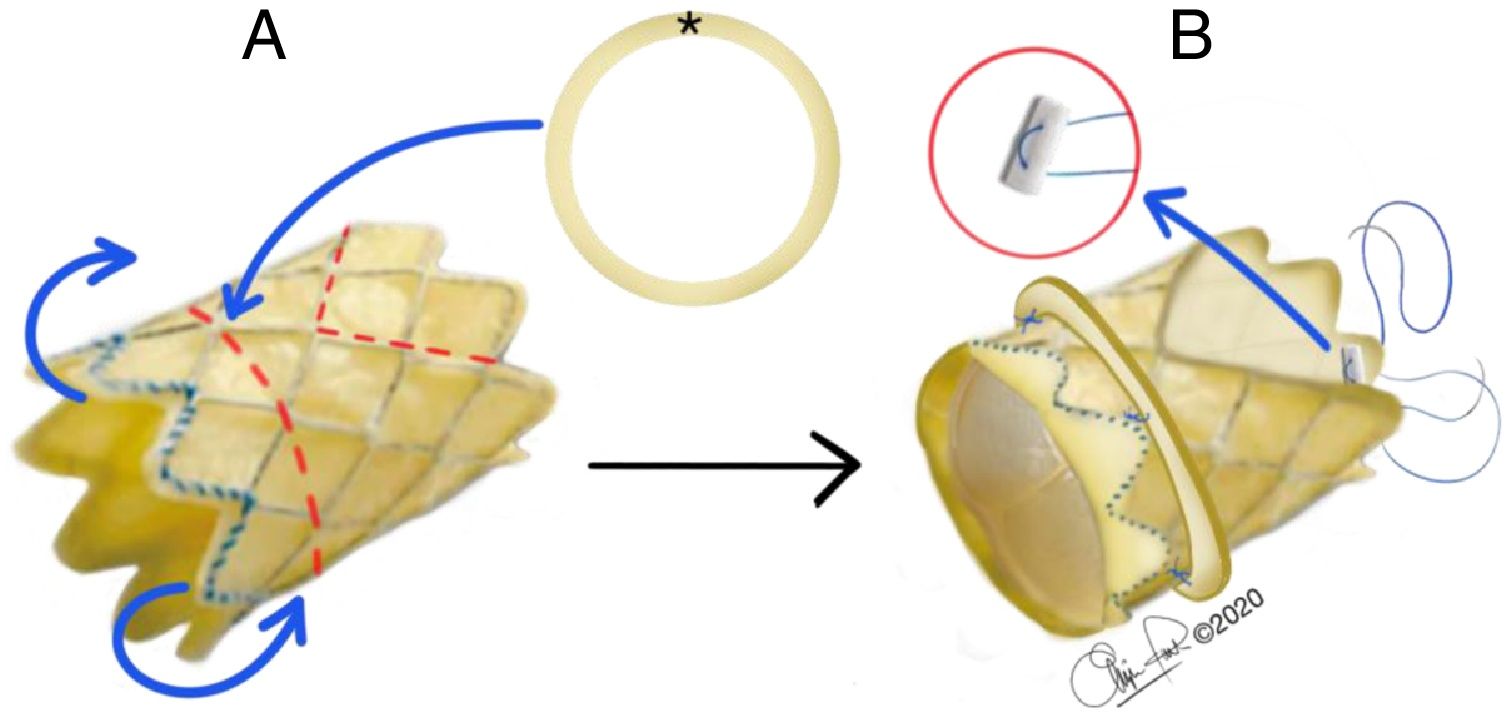
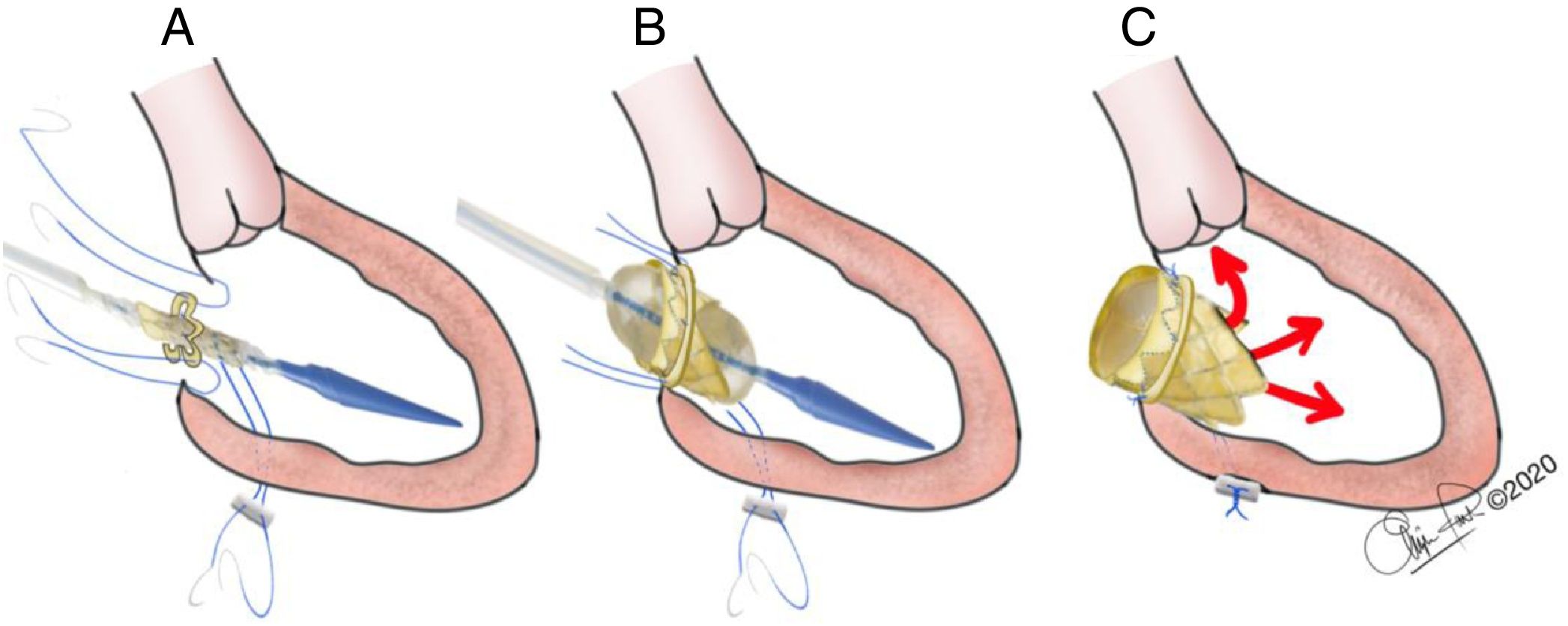
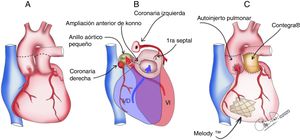
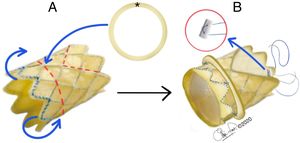
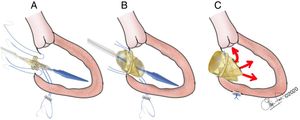
CirugíaCon 7 días y 2,8kg de peso, bajo anestesia general e intubación nasotraqueal, se realiza esternotomía media longitudinal. Se establece circulación extracorpórea a 28oC con canulación arterial en aorta ascendente y venosa bicava. Mediante parada cardiopléjica fría hemática (cardioplejia de Del Nido), y previa visualización de la adecuada anatomía de la válvula pulmonar, se explanta la válvula aórtica nativa y se extraen los botones coronarios. A través del tracto de salida del VI (TSVI) y una vez hecha la incisión del Konno, se realiza resección de la fibroelastosis endocárdica hasta la punta del VI. Se completa el procedimiento de Ross-Konno con anastomosis del autoinjerto pulmonar al TSVI, reimplante de ostia coronaria con técnica de «punch» y reconstrucción del tracto de salida del ventrículo derecho (VD) con conducto valvulado de vena yugular bovina Contegra® (Medtronic, Minneapolis, MN, EE. UU.) de 12mm en posición ortotópica (fig. 1). Posteriormente, mediante abordaje transeptal y transmitral, se completa la resección de la fibroelastosis basal y medio ventricular. Se reseca el aparato valvular y subvalvular mitral y se implanta una válvula Melody® (Medtronic, Minneapolis, MN, EE. UU.) TVP 20. Se prepara la válvula para disminuir su longitud y evitar la obstrucción del TSVI (fig. 2). La válvula se fija en su porción media con 4 puntos a un anillo de pericardio bovino y luego de este al anillo mitral. Distalmente se pasa otro punto con teflón a través de la válvula y luego perforando completamente la cara diafragmática del VI (fig. 3), para ser anudado desde fuera una vez esté desplegada la válvula. Seguidamente se expande la válvula con un balón Valver® de 12×20mm (Balton®, Warsaw, Polonia), inflado hasta 4atm, lo que supone un diámetro teórico de 12,5mm. Se deja una comunicación interauricular con parche fenestrado de 4mm, que servirá como escape y permitirá futuras dilataciones percutáneas de la Melody®.
Esquema del procedimiento del reemplazo aórtico (Ross-Konno) y del mitral (Melody®). A. Las líneas negras discontinuas muestran el sitio de las arteriotomías aórtica y pulmonar. B. Las líneas negras discontinuas indican el sitio de la incisión del Konno y los tractos de salida del VD/VI. C. Vista final del procedimiento.
A. Válvula Melody®. Las líneas curvas azules indican el pliegue externo del extremo proximal del stent. La línea roja discontinua circular indica el sitio de fijación del anillo de pericardio bovino (☆). Las líneas rojas discontinuas rectas indican el sitio de recorte distal del stent. B. Vista final de la válvula con el anillo de pericardio fijado, extremo proximal del stent plegado y extremo distal del stent recortado. Dentro del círculo rojo, punto de PTFE apoyado en teflón.
A. Válvula Melody® montada en el balón de despliegue, colocada en posición mitral; se muestran los puntos (cardinales) de fijación al anillo mitral nativo. B. Inflado del balón y despliegue de la Melody®. C. Anudado de los 4 puntos de fijación de la válvula Melody® al anillo mitral y del punto de fijación externa, comprobando que el TSVI quede libre de obstrucción.
Como complicación inmediata presenta bloqueo AV completo, que precisa estimulación con marcapasos epicárdico. El tiempo de circulación extracorpórea fue de 317min y de 180min el de pinzamiento aórtico. En la ecocardiografía epicárdica intraoperatoria se objetiva: buena función sistólica global, TSVI libre con flujo laminar en la aorta, tracto de salida del VD sin obstrucción, flujo laminar en tronco y ramas pulmonares. No se detectan insuficiencias ni estenosis aórtica, mitral o pulmonar.
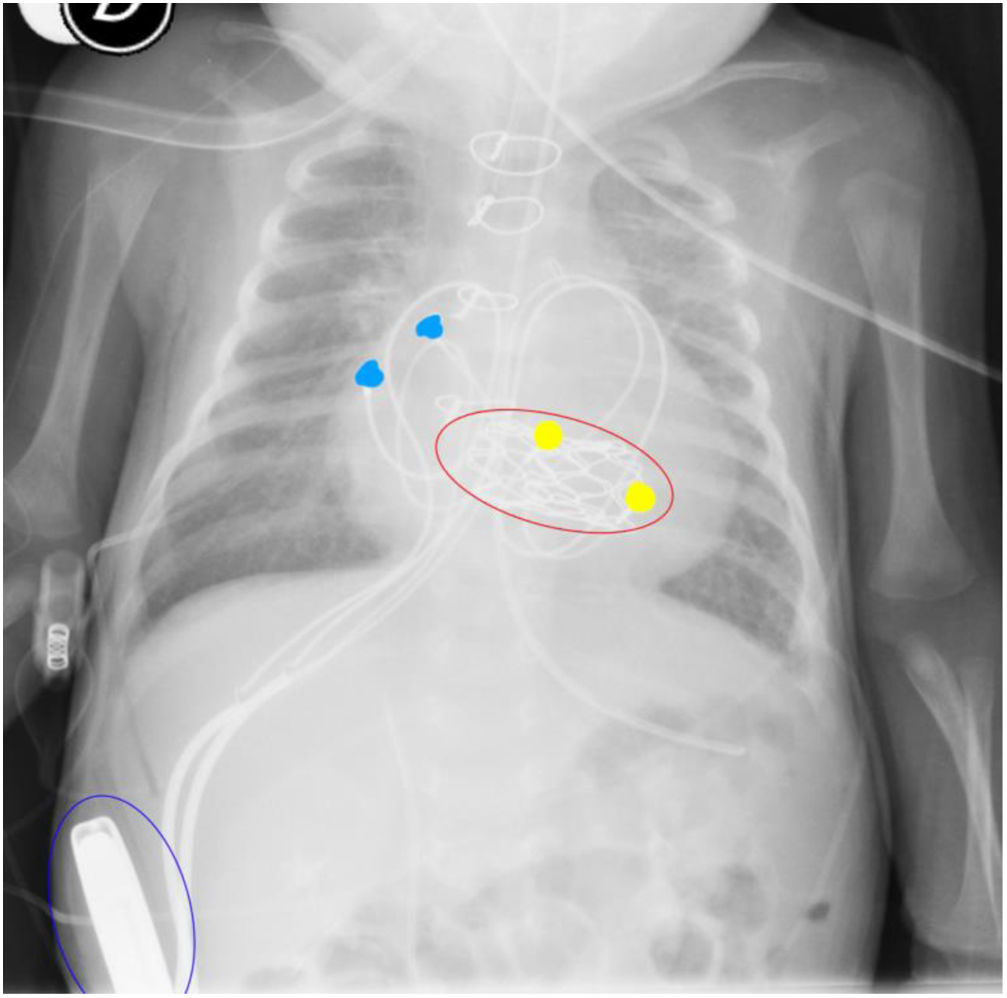
Se deja el tórax abierto electivo y se traslada al paciente a la UCI pediátrica. Al tercer día del postoperatorio en situación hemodinámica estable se implanta sistema de estimulación epicárdico bicameral definitivo (Endurity MRI™, St. Jude Medical, Saint Paul, Minnesota, EE. UU.) a través de lumbotomía derecha y en posición retromuscular (con electrodos en aurícula derecha y VD), y se cierra el esternón (fig. 4).
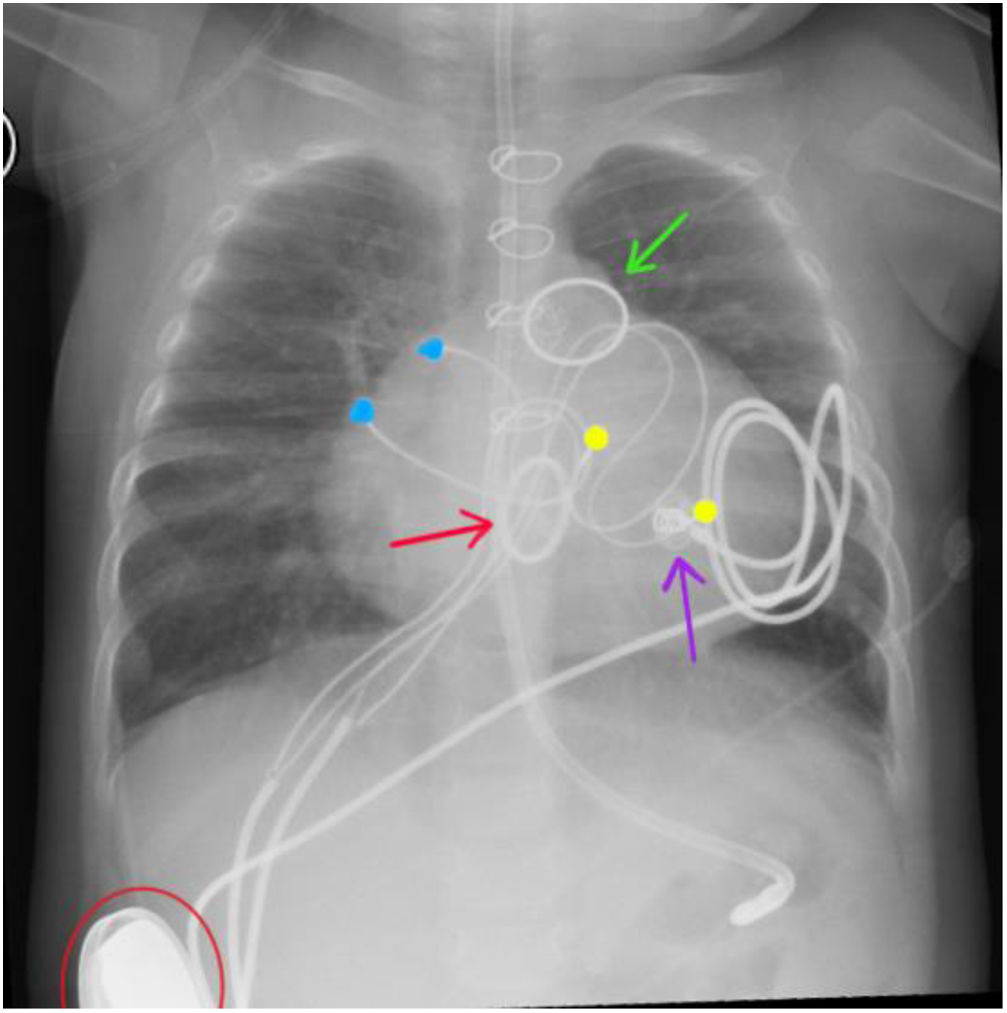
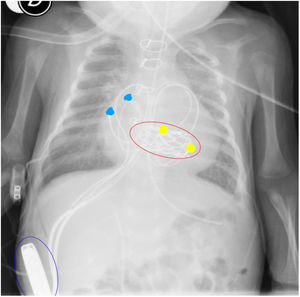
Radiografía toracoabdominal donde se observa la válvula Melody® en posición mitral (óvalo rojo), electrodos epicárdicos de contacto en aurícula derecha (puntos azules), electrodos epicárdicos de contacto en VD (puntos amarillos) y generador de marcapasos bicameral en bolsillo paralumbar derecho retromuscular (óvalo azul).
El postoperatorio en la UCI se caracteriza por disfunción diastólica del VI, que condiciona 2 intentos fallidos de retirada de la ventilación mecánica. Se extuba a los 24 días de la cirugía y es dado de alta a domicilio el día +37 del postoperatorio. En el seguimiento cardiológico a los 5 meses de edad desarrolla estenosis grave de la rama pulmonar derecha (RPD) e insuficiencia pulmonar libre por calcificación del Contegra®. Se realiza cateterismo cardiaco con implantación de stent en la RPD, que resulta exitoso.
A los 6 meses de edad ingresa en la UCI pediátrica en situación de insuficiencia cardiaca y congestión pulmonar secundaria a asincronía por estimulación de marcapasos epicárdico y aumento del gradiente transmitral (17mmHg).
Dada la situación clínica del paciente, se decide en sesión médico-quirúrgica iniciar terapia de resincronización mediante la implantación de un electrodo epicárdico de fijación activa en el VI a través de toracotomía posterolateral izquierda y dilatación percutánea de la válvula Melody®. A los 2 días de iniciada con éxito la resincronización con generador tricameral y en situación hemodinámica estable, se realiza cateterismo cardiaco con dilatación transeptal con balón del stent de la Melody® hasta 17mm. La ecocardiografía transesofágica periprocedimiento objetiva insuficiencia valvular mitral grave. Ante esta complicación y la imposibilidad de extubación de la ventilación mecánica, se decide reesternotomía con recambio valvular mitral con prótesis mecánica ATS AP® (Medtronic, Minneapolis, MN, EE. UU.) n.o 16 en posición supramitral y recambio del conducto VD-AP por uno nuevo Hancock® (Medtronic, Minneapolis, MN, EE. UU.) de 14mm. Durante el mismo procedimiento se dilata el stent de la RPD hasta llevarlo a 13mm de diámetro. Se inician ciclos semanales de levosimendán, recuperando la función sistólica del VI, y se extuba a los 10 días del postoperatorio (fig. 5).
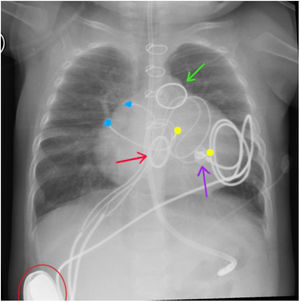
Radiografía toracoabdominal donde se observan: anillo de la válvula mecánica mitral (flecha roja), anillo del conducto VD-AP (flecha verde), electrodo epicárdico de fijación activa (flecha violeta), electrodos epicárdicos de contacto en aurícula derecha (puntos azules), electrodos epicárdicos de contacto en VD (puntos amarillos) y generador de marcapasos tricameral en bolsillo paralumbar derecho retromuscular (semicírculo rojo).
Actualmente el paciente tiene un año y 9 meses de edad, se encuentra en situación cardiológica estable, con buena ganancia de peso y adecuado desarrollo psicomotor. Se sigue en la consulta de cardiología infantil y en la última ecocardiografía de control se objetiva prótesis valvular mitral normofuncionante con gradiente transvalvular medio de 4mmHg y buena contractilidad del VI, con una FE del 60%; disfunción diastólica leve-moderada del VI con presiones de VD al 50% de las sistémicas; insuficiencia pulmonar leve con gradiente máximo en el tercio medio del conducto de 15mmHg y de 21mmHg en la rama pulmonar derecha; insuficiencia aórtica trivial con flujo laminar en la aorta.
DiscusiónCuando comparamos la vía univentricular con la biventricular para tratar a neonatos con estenosis aórtica crítica y enfermedad mitral asociada, los resultados a medio/largo plazo siguen generando discusión y mucha controversia, aunque parece existir una mayor tendencia en los últimos años hacia las reparaciones biventriculares.
Tanto la vía univentricular como la biventricular se pueden realizar directamente (Norwood vs. Ross-Konno) o pasando por un procedimiento intermedio (Norwood híbrido). En este paciente apostamos fuertemente por la vía biventricular; por un lado, basándonos en la experiencia previa de pacientes similares donde la vía univentricular había fracasado y también apoyando la preferencia de los padres (que aun conociendo la alta incidencia de mortalidad fetal secundaria a intervencionismo aórtico intraútero, habían apostado por este intervencionismo con vistas a una posible futura reparación biventricular). Además, consideramos que tanto la fibroelastosis endocárdica como las lesiones valvulares asociadas hacían de nuestro paciente un candidato subóptimo para la vía univentricular.
Una vez considerada la vía biventricular como mejor opción para este niño, pensamos que la vía híbrida clásica (banding bilateral de ramas pulmonares, stent ductal y ampliación de la CIA) no habría funcionado sin un reemplazo valvular mitral asociado (recordando que esta válvula tenía una doble lesión grave y no era reparable). Valoramos que una cirugía híbrida más reemplazo mitral (o sea, una paliación) hubiera expuesto a nuestro paciente a un riesgo demasiado alto (un postoperatorio de una cirugía compleja neonatal sin reparación completa de las lesiones). Así, considerando los buenos resultados de nuestro centro en Ross-Konno neonatal, decidimos la reparación completa de la cardiopatía en un solo estadio.
Por supuesto, también consideramos que un procedimiento de Ross-Konno con reemplazo valvular mitral concomitante pone 3 válvulas (autoinjerto aórtico, conducto pulmonar y válvula mitral) en riesgo de complicaciones postoperatorias y mayor necesidad de reoperación a largo plazo, además del riesgo vital y de complicaciones graves tras una cirugía de esta complejidad.
Concluyendo, consideramos que se necesita mayor evidencia científica que nos ayude en la toma de decisiones para seleccionar la mejor estrategia quirúrgica en este complicado grupo de pacientes. Aun así, se trata de cirugías altamente demandantes desde el punto de vista técnico-quirúrgico y de manejo perioperatorio. Por eso, destacamos la importancia de contar con experiencia de grupo tanto quirúrgica (reemplazo aórtico y mitral neonatal)4-6 como del manejo anestésico, cardiológico y postoperatorio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.