Las prótesis híbridas combinan una prótesis vascular convencional con un stent graft de nitinol, facilitando el abordaje simultáneo de la aorta ascendente, cayado y descendente proximal. Presentamos nuestra experiencia en el tratamiento de la patología compleja de la aorta torácica.
MétodosUn total de 27 pacientes intervenidos con prótesis híbridas E-vita (n=27) o Thoraflex (n=1) desde octubre de 2013. Se realiza descripción de la serie y análisis de los resultados.
ResultadosEdad media: 64,1 años (DE: 14,5). Varones: n=21 (75%); 17 aneurismas (60,7%), 5 disecciones agudas (17,9%), 5 crónicas, una aortitis. EuroSCORE logístico medio: 20,2 (DE: 11,5). Cirugía previa: n=5 (17,9%). Tiempos de circulación extracorpórea, isquemia, parada circulatoria y perfusión cerebral anterógrada: 184,7min (DE: 52,6), 109,4min (DE: 46,3), 50,6min (DE: 19,6), y 75,7min (DE: 32). Perfusión cerebral bilateral: n=19 (67,9%). Temperatura media: 22,6°C (DE: 3,5). Zona anastomosis distal: Z1 (n=3; 10,7%), Z2 (n=18; 64,3%) y Z3 (n=7; 25%). Implante troncos supraaórticos: pastilla (n=8; 28,6%), pastilla+bypass (n=13; 46,3%) e injerto trifurcado (n=7; 25%). Segundo tiempo programado en aorta distal: n=12 (10 endovascular, una cirugía abierta y una combinada). Mortalidad hospitalaria: n=3 (10,7%). Ictus permanente: n=2 (7,1%). Reoperación por hemorragia: n=2 (7,1%). Seguimiento medio: 16,6 meses (DE: 18). Supervivencia al año: 89,3%. Mortalidad en el seguimiento: n=3 (2 de causa cardiovascular).
ConclusionesLas prótesis híbridas simplifican el tratamiento de la patología compleja de la aorta torácica, permitiendo con frecuencia resolverla en un solo tiempo o bien facilitando el segundo, sea quirúrgico o endovascular.
The hybrid prostheses combine a conventional vascular prosthesis with a nitinol stented portion to facilitate the simultaneous approach of the ascending aorta, aortic arch, and proximal descending aorta. Experience in the treatment of this complex thoracic aorta pathology is presented.
MethodsA total of 28 patients underwent surgery using the E-vita prosthesis (n=27) or Thoraflex prosthesis (n=1) from October 2013. The experience and the medium-term results are presented.
ResultsThe patient variables included: mean age: 64.1 years (SD: 14.5). Men: n=21 (75%). 17 aneurysms (60.7%), 5 acute aortic dissections (17.9%), 5 chronic dissections, 1 aortitis. Mean EuroSCORE logistic 20.2 (SD: 11.5). Prior cardiac surgery: n=5 (17.9%). Mean cardiopulmonary bypass time, aortic cross clamp time, circulatory arrest time and selective antegrade cerebral perfusion: 184.7min (SD: 52.6), 109.4min (SD: 46.3), 50.6min (SD: 19.6), and 75.7min (SD: 32). Bilateral antegrade selective cerebral perfusion: n=19 (67.9%). Temperature: 22.6°C (SD: 3.5). Distal anastomosis zone: Z1 (n=3, 10.7%), Z2 (n=18, 64.3%), and Z3 (n=7, 25%). Supra-aortic vessels re-implantation: En bloc (n=8, 28.6%), En bloc+bypass (n=13, 46.3%), and trifurcated graft (n=7, 25%). Second-stage distal aortic intervention: n=12 (10 endovascular, 1 open surgery, 1 combined). In-hospital mortality: n=3 (10.7%). Permanent stroke: n=2 (7.1%). Re-exploration due to bleeding: n=2 (7.1%). Mean follow-up: 16.6 months (SD: 18). 1-year survival: 89.3%. Mortality during follow-up: n=3 (2 cardiovascular).
ConclusionsHybrid prostheses simplify the treatment of complex pathology of the thoracic aorta, often being able to resolve it in a single stage, or facilitating an open or endovascular second stage.
El tratamiento de la patología de la aorta torácica que involucra al arco aórtico y a la aorta descendente continúa siendo un reto para los cirujanos, no solo por la complejidad técnica sino también por su propia anatomía, que determina un mayor riesgo de complicaciones, principalmente neurológicas1.
La primera cirugía exitosa de sustitución de arco aórtico se llevó a cabo en 19572. Desde entonces, a lo largo de las últimas décadas, se han ido desarrollando técnicas y tecnologías que han permitido un abordaje más seguro de este tipo de patología. Dos hitos importantes han sido el empleo de la hipotermia profunda y parada circulatoria, y la perfusión cerebral anterógrada (PCA). Se ha ido avanzando en un proceso dinámico y cambiante, desde la descripción de la técnica de trompa de elefante realizada por Borst et al. en 19833, el desarrollo de endoprótesis para el tratamiento de la aorta descendente4,5 hasta el nacimiento de las prótesis híbridas y la técnica de la trompa de elefante congelada6. Estas prótesis combinan un injerto vascular convencional con un stent graft de nitinol, facilitando el abordaje simultáneo de la aorta ascendente, cayado y aorta descendente proximal.
La medicina actual tiende al abordaje mínimamente invasivo, y la patología de la aorta no ha sido ajena a ello. El abordaje endovascular constituye el tratamiento de primera elección en determinadas patologías de la aorta torácica descendente, aunque tanto en la patología aislada del cayado como en la patología extensa de la aorta torácica todavía presenta serias limitaciones7,8. Ello, asociado al elevado riesgo de la cirugía abierta en alguno de estos pacientes, hace que el abordaje combinado sea el más apropiado para tratar dicha patología, al aprovechar las ventajas de cada abordaje y compensar sus limitaciones.
En Europa, tienen el marcado CE dos tipos de prótesis híbridas: la E-vita Open con su posterior modificación E-vita Open Plus (Jotec GmbH, Hechingen, Alemania)9,10 y la Thoraflex (Vascutek Terumo, Inchinnan, Reino Unido)11. La principal diferencia entra ambas es que la segunda incorpora 4 ramas para la perfusión arterial y para el reimplante individual de los troncos supraaórticos (TSA).
Presentamos nuestra experiencia en el tratamiento de la patología compleja de la aorta torácica con el uso de prótesis híbridas.
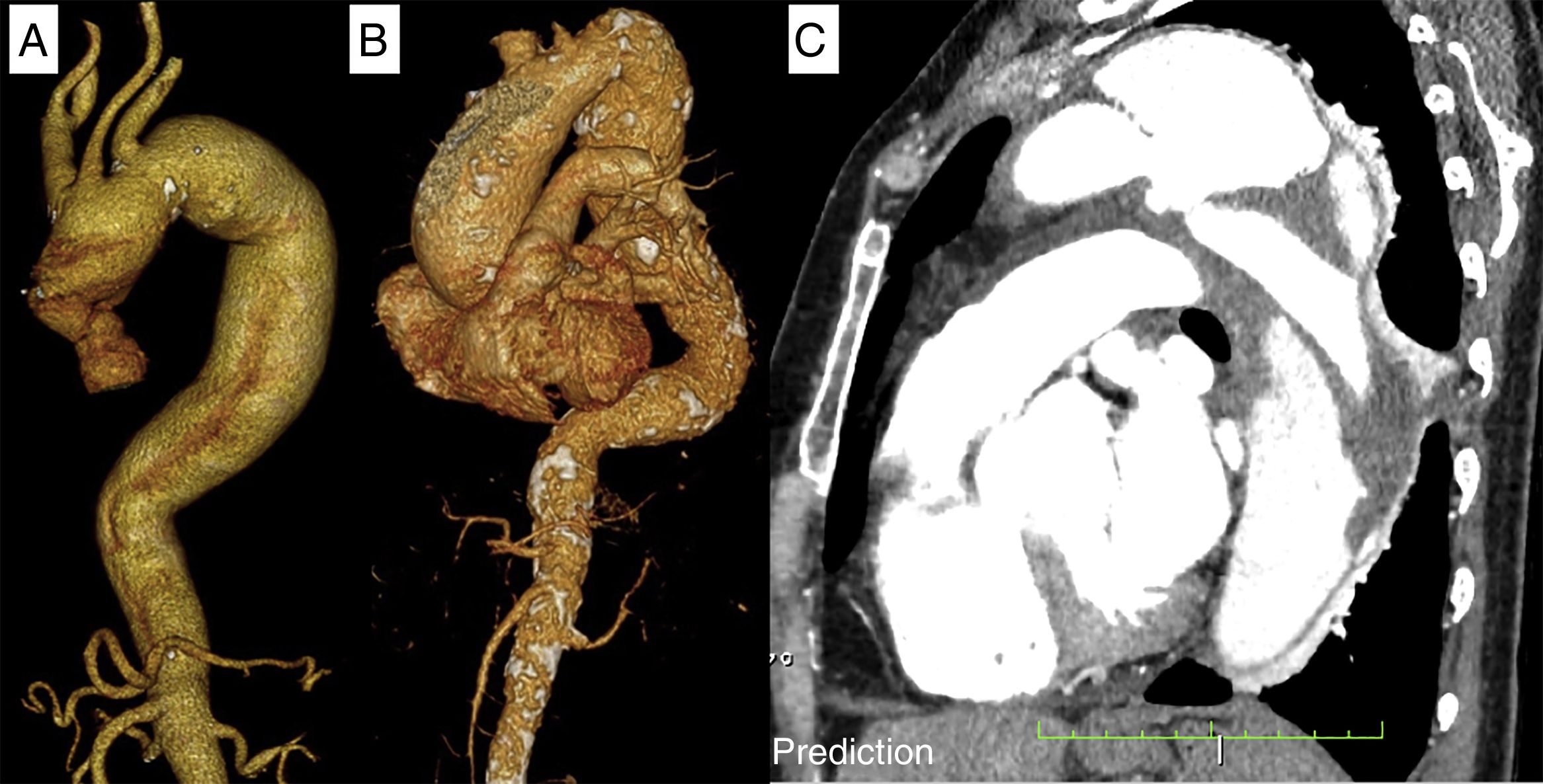
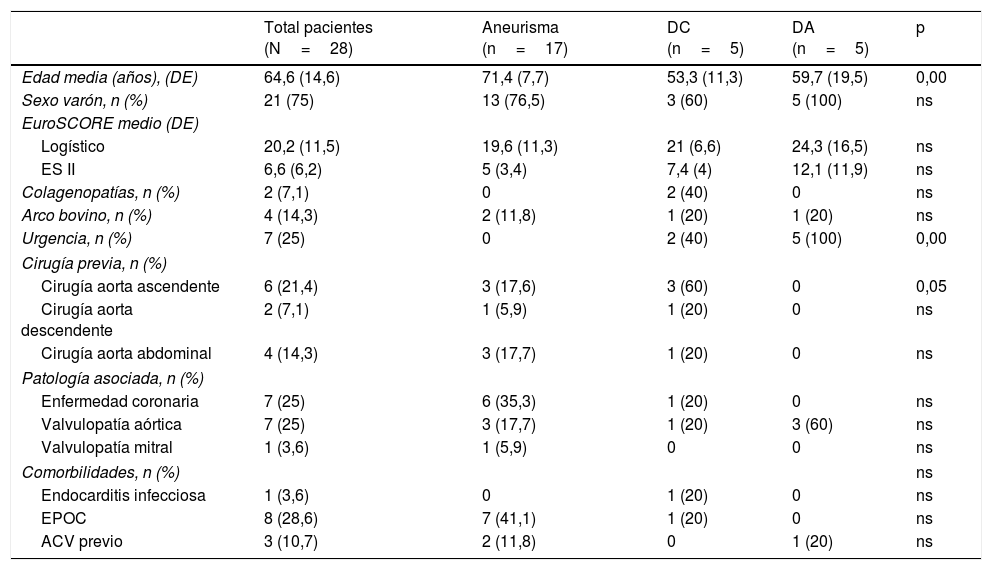
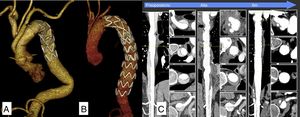
Material y métodosPacientesSe trata de un estudio observacional descriptivo de pacientes con patología compleja de la aorta torácica tratados con prótesis híbridas desde octubre de 2013 hasta febrero de 2018. En todos los pacientes se realizó un estudio prequirúrgico completo incluyendo tomografía computarizada (TC) de alta resolución de la aorta completa con reconstrucciones vasculares bi y tridimensionales (fig. 1).
Se recogieron de manera prospectiva datos clínicos y de imagen, postoperatorios y de seguimiento.
Técnica quirúrgicaTodos los pacientes se intervienen bajo anestesia general, por esternotomía media y con monitorización consistente en vía venosa central, arteria radial bilateral, actividad eléctrica cerebral (BISTM), oximetría cerebral no invasiva (INVOSTM), temperatura nasofaríngea y vesical, sondaje vesical convencional y ecocardiografía transesofágica.
Las estrategias de canulación varían en función de la etiología y extensión de la patología. Para la canulación arterial utilizamos la arteria axilar, el tronco braquiocefálico o la arteria carótida, de forma directa o mediante la interposición de un tubo de Dacron de 8mm. La canulación venosa se realiza de forma central con una cánula cavoauricular. En los últimos casos hemos procedido a la ligadura electiva de la vena innominada para facilitar el acceso al cayado y TSA.
La protección miocárdica se realiza con cardioplejía hemática (DeBraun®) o cristaloide (Custodiol®, Koehler Chemie, Alsbach-Haenlein, Alemania) vía anterógrada, retrógrada o combinada. La protección cerebral se hace mediante PCA unilateral o bilateral, con un flujo de 10-15ml/kg/min y una presión media de entre 40-60mmHg. La protección medular y de las vísceras abdominales durante la parada circulatoria se realiza con hipotermia moderada o profunda (18-28°C), reperfusión precoz anterógrada o retrógrada de la aorta toracoabdominal y perfusión de la arteria subclavia izquierda, siempre que sea técnicamente posible.
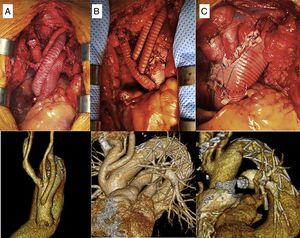
Las prótesis híbridas utilizadas han sido la E-vita Open, su posterior modificación a la E-vita Open Plus y la Thoraflex. Una vez alcanzada la temperatura objetivo, se procede a pinzar la aorta ascendente y administrar la cardioplejía. Si es necesario realizar algún procedimiento cardiaco asociado, este se lleva a cabo durante el enfriamiento. Tras ello se libera el pinzamiento y se inicia la parada circulatoria y la perfusión cerebral. Una vez resecada la aorta ascendente y el cayado se libera la prótesis híbrida, utilizando una guía introducida previamente desde la arteria femoral. La anastomosis distal se realiza con sutura continua de polipropileno de 3/0 apoyada en teflonTM o pericardio bovino. Se reinicia entonces la perfusión de la aorta toracoabdominal, a través de la rama lateral en el caso de la prótesis Thoraflex y a través de la arteria femoral en el caso de la prótesis E-vita, ocluyendo la endoprótesis con un catéter-balón introducido de manera anterógrada. La afectación y extensión de la patología aórtica y la zona donde se realiza la anastomosis distal (Z0-Z3) condicionan la técnica de implante de los TSA. En la prótesis E-vita utilizamos tres técnicas: en pastilla única, mediante injerto trifurcado construido con 3 segmentos de Dacron o mediante pastilla con el tronco braquicefálico y carótida izquierda y bypass con tubo de 8mm a la arteria subclavia izquierda. Tanto en el bypass a la subclavia izquierda como en el injerto trifurcado, las anastomosis distales las realizamos durante el enfriamiento antes de la parada circulatoria. En el caso de la prótesis Thoraflex y en el reimplante en pastilla de los TSA, estos se anastomosan a la prótesis una vez hecha la anastomosis distal.
En aquellos pacientes en los que es necesario un segundo tiempo quirúrgico, endovascular o combinado, para completar el tratamiento de su patología, este se programa durante el mismo ingreso o de manera electiva unas semanas después del alta, en función de la patología de base y de su situación clínica.
SeguimientoTodos los pacientes son vistos en nuestra consulta al mes, a los 3 meses, a los 6 meses y posteriormente anualmente. Se realiza ecocardiograma y TC al alta, a los 3 meses y posteriormente cada año.
Análisis estadísticoLos datos fueron analizados de forma retrospectiva a partir de nuestra base de datos informatizada prospectiva. La normalidad de la distribución de las variables se analizó con el test Shapiro-Wilk. Las variables categóricas se expresan en porcentajes y las continuas con media y su desviación estándar (DE) o mediana con rango intercuartílico (RIQ) si no siguen una distribución normal. La supervivencia global se presenta con la curva de Kaplan-Meier. Todos los análisis estadísticos se realizaron con el paquete estadístico de STATA (Stata v.13.1, StataCorp, College Station, TX, EE.UU.) y SPSS (20.0.0 software, IBM Corp, Armonk, NY, EE.UU.).
ResultadosPoblaciónUn total de 28 pacientes fueron tratados desde octubre de 2013, 7 de los cuales (25%) fueron intervenidos de urgencia. La etiología más común fue el aneurisma degenerativo (n=17; 60,7%, 4 de ellos saculares), seguida de la disección crónica (n=5; 17,9%), la disección aórtica aguda tipo A (n=5; 17,9%) y de la aortitis (n=1; 3,6%). La edad media fue 64,1 años (DE: 14,5), siendo mayor en los portadores de aneurismas degenerativos (71,4 años; DE: 7,7); 21 pacientes eran varones (75%); 6 pacientes eran reoperados (21,4%) con cirugía previa sobre la raíz y/o la aorta ascendente. El EuroSCORE logístico medio fue de 20,2 (DE: 11,5). Dos casos presentaron colagenopatías: un síndrome de Marfan portador de un Bentall previo y un síndrome de Loeys-Dietz con cirugía toracoabdominal abierta previa. Cuatro pacientes (14,3%) presentaban patología aislada del cayado aórtico y otros 4, patología aislada de la aorta torácica descendente. El resto de los pacientes (n=20, 71,4%) presentaban afectación de al menos 2 segmentos de la aorta torácica y en 10 de ellos la patología se extendía además a la aorta abdominal (tabla 1).
Características demográficas
| Total pacientes (N=28) | Aneurisma (n=17) | DC (n=5) | DA (n=5) | p | |
|---|---|---|---|---|---|
| Edad media (años), (DE) | 64,6 (14,6) | 71,4 (7,7) | 53,3 (11,3) | 59,7 (19,5) | 0,00 |
| Sexo varón, n (%) | 21 (75) | 13 (76,5) | 3 (60) | 5 (100) | ns |
| EuroSCORE medio (DE) | |||||
| Logístico | 20,2 (11,5) | 19,6 (11,3) | 21 (6,6) | 24,3 (16,5) | ns |
| ES II | 6,6 (6,2) | 5 (3,4) | 7,4 (4) | 12,1 (11,9) | ns |
| Colagenopatías, n (%) | 2 (7,1) | 0 | 2 (40) | 0 | ns |
| Arco bovino, n (%) | 4 (14,3) | 2 (11,8) | 1 (20) | 1 (20) | ns |
| Urgencia, n (%) | 7 (25) | 0 | 2 (40) | 5 (100) | 0,00 |
| Cirugía previa, n (%) | |||||
| Cirugía aorta ascendente | 6 (21,4) | 3 (17,6) | 3 (60) | 0 | 0,05 |
| Cirugía aorta descendente | 2 (7,1) | 1 (5,9) | 1 (20) | 0 | ns |
| Cirugía aorta abdominal | 4 (14,3) | 3 (17,7) | 1 (20) | 0 | ns |
| Patología asociada, n (%) | |||||
| Enfermedad coronaria | 7 (25) | 6 (35,3) | 1 (20) | 0 | ns |
| Valvulopatía aórtica | 7 (25) | 3 (17,7) | 1 (20) | 3 (60) | ns |
| Valvulopatía mitral | 1 (3,6) | 1 (5,9) | 0 | 0 | ns |
| Comorbilidades, n (%) | ns | ||||
| Endocarditis infecciosa | 1 (3,6) | 0 | 1 (20) | 0 | ns |
| EPOC | 8 (28,6) | 7 (41,1) | 1 (20) | 0 | ns |
| ACV previo | 3 (10,7) | 2 (11,8) | 0 | 1 (20) | ns |
ACV: accidente cerebrovascular; DA: disección aguda; DC: disección crónica; DE: desviación estándar; EPOC: enfermedad pulmonar obstructiva crónica; ns: no significativo.
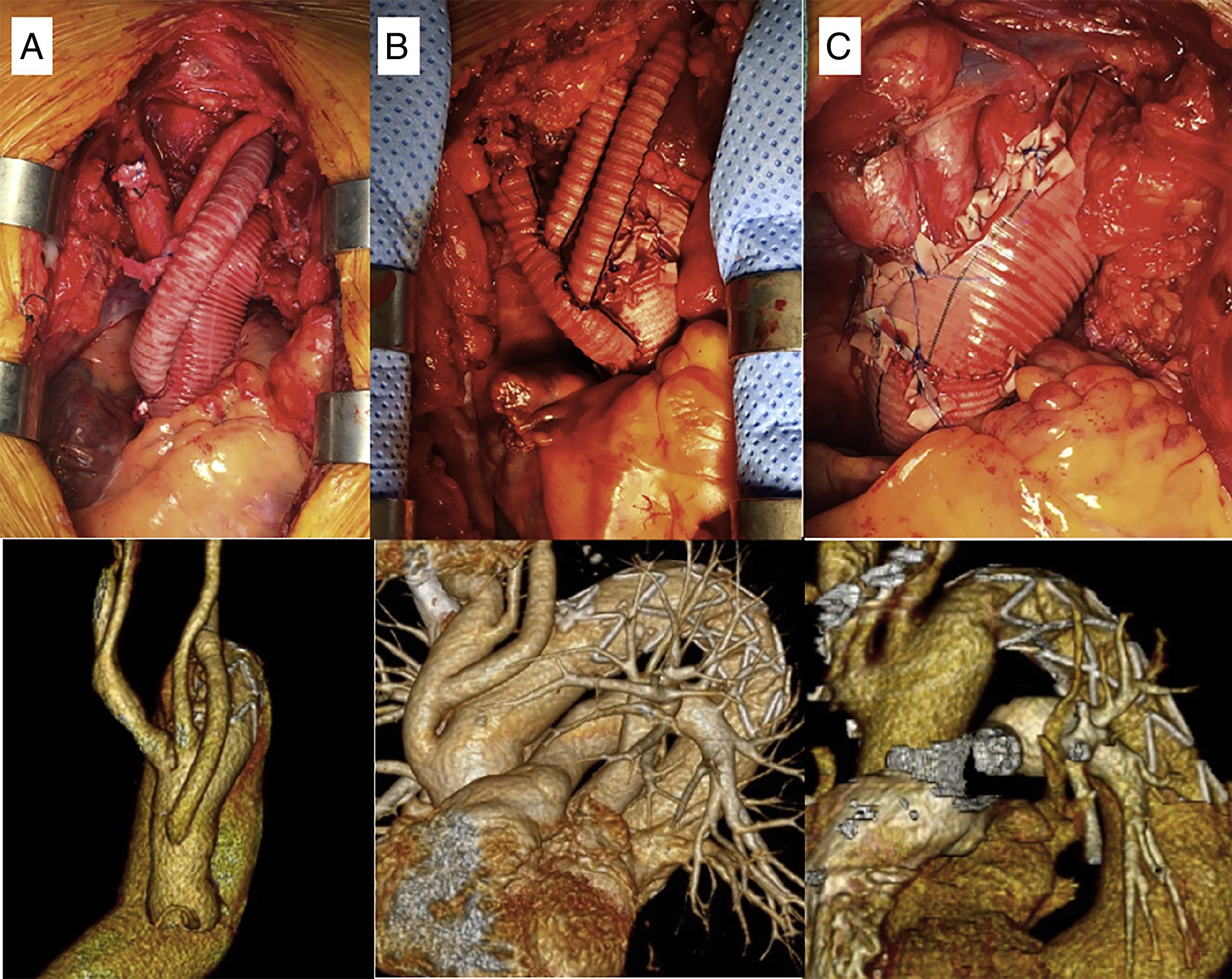
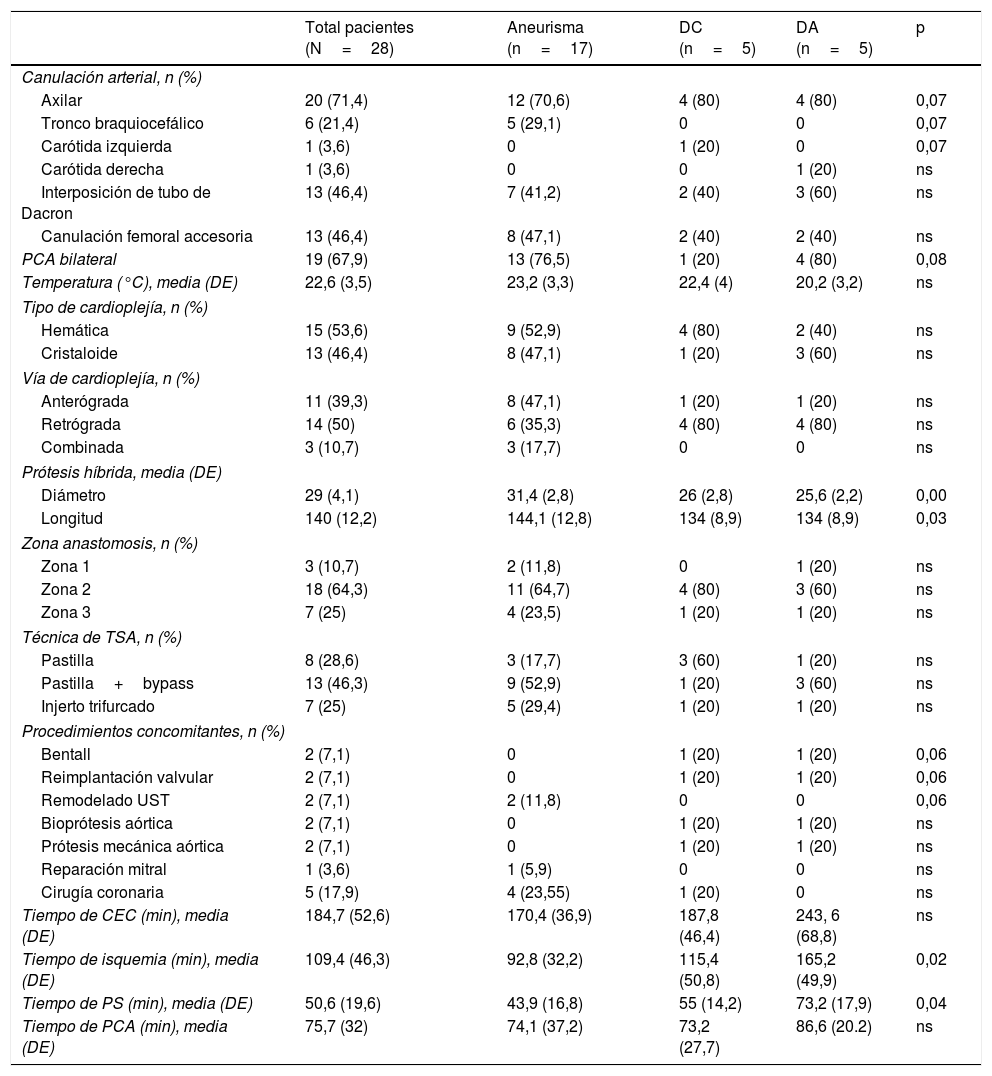
Los resultados intraoperatorios y las estrategias llevadas a cabo se muestran en la tabla 2. La canulación arterial se realizó a través de la arteria axilar en 20 pacientes (71,4%), del tronco braquiocefálico en 6 pacientes (21,4%) y de la carótida en 2 pacientes (7,2%). En un paciente se canuló la carótida izquierda debido a una endocarditis sobre Bentall previo y disección crónica del tronco braquiocefálico, y en otro paciente se canuló la carótida derecha por disección aguda tipo A con afectación del tronco braquiocefálico, axilar derecha y carótida izquierda. En 13 pacientes (46,4%) se canuló la arteria femoral para la reperfusión precoz de la aorta toracoabdominal. Se utilizó PCA en el 100% de los pacientes, siendo bilateral en el 67,9% (n=19). En 27 pacientes se utilizó la prótesis E-vita Open y en un paciente la Thoraflex. El diámetro medio fue de 29mm (DE: 4,1) y la longitud media de 140mm (DE: 12,2). En los pacientes con aneurismas degenerativos se implantaron prótesis de mayor diámetro (31,4mm, DE: 2,8; p=0,001) y longitud (144,1mm, DE: 12,8; p=0,03). La temperatura media fue de 22,6°C (DE: 3,5). La anastomosis distal de la prótesis se realizó en la zona 2 en 18 casos (64,3%), en la zona 3 en 7 casos (25%) y en la zona 1 en 3 casos (10,7%). El reimplante de los TSA se realizó mediante la pastilla con bypass a la arteria subclavia izquierda en 13 pacientes (46,3%), pastilla única en 8 (28,6%) e injerto trifurcado en 7 (25%) (fig. 2). Los tiempos medios de circulación extracorpórea, isquemia miocárdica, parada circulatoria sistémica y PCA fueron de 184,7min (DE: 52,6), 109,4min (DE: 46,3), 50,6min (DE: 19,6) y 75,7min (DE: 32), respectivamente, siendo significativamente más largos los tiempos de isquemia (165,2min; DE: 49,9; p=0,02) y de parada circulatoria (73,2min; DE: 17,9; p=0,04) en la disección aórtica aguda. La parada circulatoria fue significativamente más corta en los casos en los que se utilizó la canulación femoral accesoria (38min, DE: 17,7 vs. 61min, DE: 38,6; p=0,001).
Resultados intraoperatorios
| Total pacientes (N=28) | Aneurisma (n=17) | DC (n=5) | DA (n=5) | p | |
|---|---|---|---|---|---|
| Canulación arterial, n (%) | |||||
| Axilar | 20 (71,4) | 12 (70,6) | 4 (80) | 4 (80) | 0,07 |
| Tronco braquiocefálico | 6 (21,4) | 5 (29,1) | 0 | 0 | 0,07 |
| Carótida izquierda | 1 (3,6) | 0 | 1 (20) | 0 | 0,07 |
| Carótida derecha | 1 (3,6) | 0 | 0 | 1 (20) | ns |
| Interposición de tubo de Dacron | 13 (46,4) | 7 (41,2) | 2 (40) | 3 (60) | ns |
| Canulación femoral accesoria | 13 (46,4) | 8 (47,1) | 2 (40) | 2 (40) | ns |
| PCA bilateral | 19 (67,9) | 13 (76,5) | 1 (20) | 4 (80) | 0,08 |
| Temperatura (°C), media (DE) | 22,6 (3,5) | 23,2 (3,3) | 22,4 (4) | 20,2 (3,2) | ns |
| Tipo de cardioplejía, n (%) | |||||
| Hemática | 15 (53,6) | 9 (52,9) | 4 (80) | 2 (40) | ns |
| Cristaloide | 13 (46,4) | 8 (47,1) | 1 (20) | 3 (60) | ns |
| Vía de cardioplejía, n (%) | |||||
| Anterógrada | 11 (39,3) | 8 (47,1) | 1 (20) | 1 (20) | ns |
| Retrógrada | 14 (50) | 6 (35,3) | 4 (80) | 4 (80) | ns |
| Combinada | 3 (10,7) | 3 (17,7) | 0 | 0 | ns |
| Prótesis híbrida, media (DE) | |||||
| Diámetro | 29 (4,1) | 31,4 (2,8) | 26 (2,8) | 25,6 (2,2) | 0,00 |
| Longitud | 140 (12,2) | 144,1 (12,8) | 134 (8,9) | 134 (8,9) | 0,03 |
| Zona anastomosis, n (%) | |||||
| Zona 1 | 3 (10,7) | 2 (11,8) | 0 | 1 (20) | ns |
| Zona 2 | 18 (64,3) | 11 (64,7) | 4 (80) | 3 (60) | ns |
| Zona 3 | 7 (25) | 4 (23,5) | 1 (20) | 1 (20) | ns |
| Técnica de TSA, n (%) | |||||
| Pastilla | 8 (28,6) | 3 (17,7) | 3 (60) | 1 (20) | ns |
| Pastilla+bypass | 13 (46,3) | 9 (52,9) | 1 (20) | 3 (60) | ns |
| Injerto trifurcado | 7 (25) | 5 (29,4) | 1 (20) | 1 (20) | ns |
| Procedimientos concomitantes, n (%) | |||||
| Bentall | 2 (7,1) | 0 | 1 (20) | 1 (20) | 0,06 |
| Reimplantación valvular | 2 (7,1) | 0 | 1 (20) | 1 (20) | 0,06 |
| Remodelado UST | 2 (7,1) | 2 (11,8) | 0 | 0 | 0,06 |
| Bioprótesis aórtica | 2 (7,1) | 0 | 1 (20) | 1 (20) | ns |
| Prótesis mecánica aórtica | 2 (7,1) | 0 | 1 (20) | 1 (20) | ns |
| Reparación mitral | 1 (3,6) | 1 (5,9) | 0 | 0 | ns |
| Cirugía coronaria | 5 (17,9) | 4 (23,55) | 1 (20) | 0 | ns |
| Tiempo de CEC (min), media (DE) | 184,7 (52,6) | 170,4 (36,9) | 187,8 (46,4) | 243, 6 (68,8) | ns |
| Tiempo de isquemia (min), media (DE) | 109,4 (46,3) | 92,8 (32,2) | 115,4 (50,8) | 165,2 (49,9) | 0,02 |
| Tiempo de PS (min), media (DE) | 50,6 (19,6) | 43,9 (16,8) | 55 (14,2) | 73,2 (17,9) | 0,04 |
| Tiempo de PCA (min), media (DE) | 75,7 (32) | 74,1 (37,2) | 73,2 (27,7) | 86,6 (20.2) | ns |
CEC: circulación extracorpórea; DA: disección aguda; DC: disección crónica; DE: desviación estándar; ns: no significativo; PCA: perfusión cerebral anterógrada; PS: parada sistémica; TSA: troncos supraaórticos; UST: unión sinotubular; VI: vena innominada.
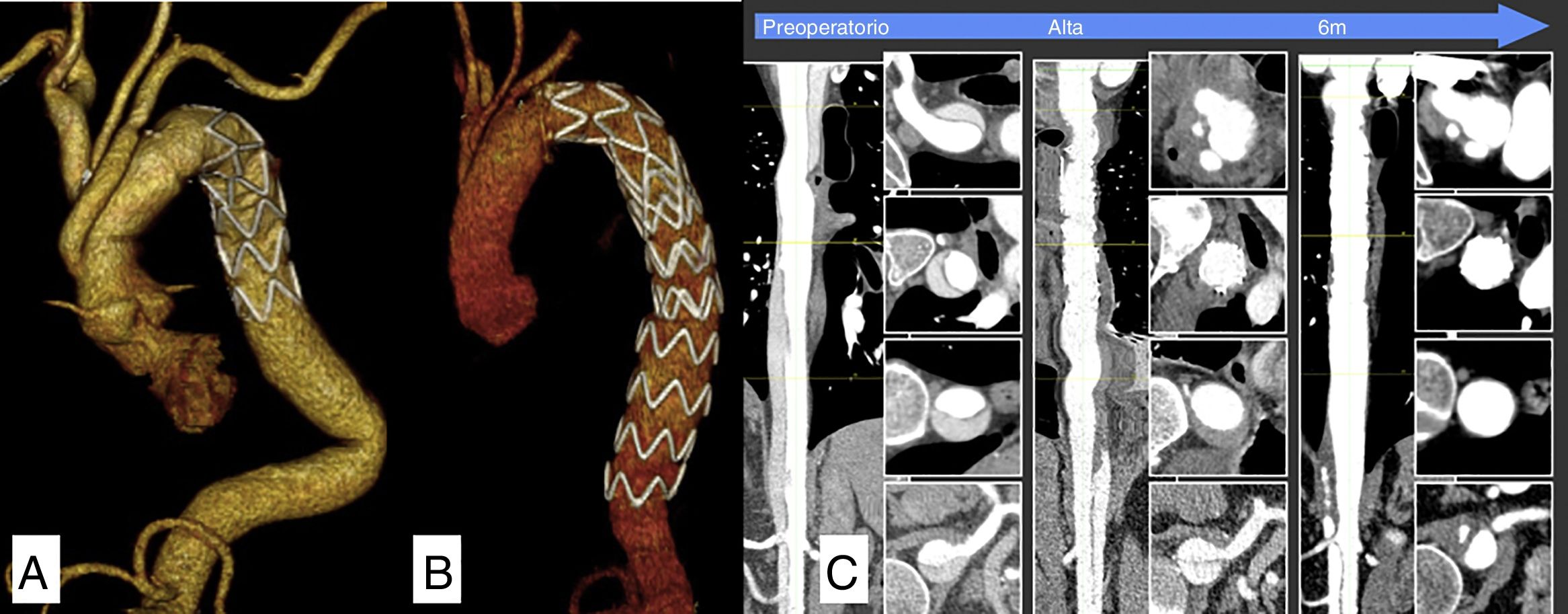
En 11 pacientes se realizó de manera programada un segundo tiempo (fig. 3) para completar el tratamiento (10 reparaciones endovasculares de la aorta torácica [TEVAR] y una cirugía abierta sobre un aneurisma toracoabdominal) y en un paciente se realizó el tratamiento de su patología en 3 tiempos: trompa de elefante congelada (frozen elephant trunk [FET]), extensión mediante endoprótesis torácica de la FET y cirugía abierta para sustituir el resto de la aorta toracoabdominal.
PostoperatorioLa mortalidad hospitalaria fue del 10,7% (n=3), 20% en disección aguda y 11,8% en el resto (p=ns). Un paciente falleció en el quirófano por sangrado incoercible tras una disección aórtica aguda tipo A, otro de causa neurológica y otro por shock séptico. Dos pacientes (7,1%) fueron reintervenidos por hemorragia y un paciente (3,6%) requirió hemofiltración por fracaso renal agudo. Hubo un accidente cerebrovascular (ACV) transitorio (3,6%) y 2 ACV permanentes (7,1%). La mediana de estancia hospitalaria fue de 14 días (RIQ: 10-37,5) (tabla 3).
Resultados postoperatorios
| Variables postoperatorias | Total pacientes (N=28) | Aneurisma (n=17) | DC (n=5) | DA (n=5) | p |
|---|---|---|---|---|---|
| Mortalidad hospitalaria, n (%) | 3 (10,71) | 2 (11,8) | 0 | 1 (20) | ns |
| Estancia en UCI (días), n (RIQ) | 3 (2-10) | 3 (2-5) | 4 (4-9) | 4 (2-41) | ns |
| Reintervención por hemorragia, n (%) | 2 (7,1) | 1 (5,9) | 0 | 1 (20) | ns |
| Ventilación >72h, n (%) | 7 (25) | 5 (29,4) | 0 | 2 (40) | ns |
| FRA con hemofiltración, n (%) | 1 (3,6) | 0 | 0 | 1 (20) | ns |
| Complicaciones neurológicas, n (%) | |||||
| ACV transitorio | 1 (3,6) | 1 (5,9) | 0 | 0 | ns |
| ACV permanente | 2 (7,1) | 2 (11,8) | 0 | 0 | ns |
| Estancia hospitalaria (días), n (RIQ) | 14 (10-37,5) | 12 (10-15) | 31 (19-44) | 9 (7-52) | ns |
ACV: accidente cerebrovascular; DA: disección aguda; DC: disección crónica; FRA: fracaso renal agudo; ns: no significativo; RIQ: rango intercuartílico; UCI: unidad de cuidados intensivos.
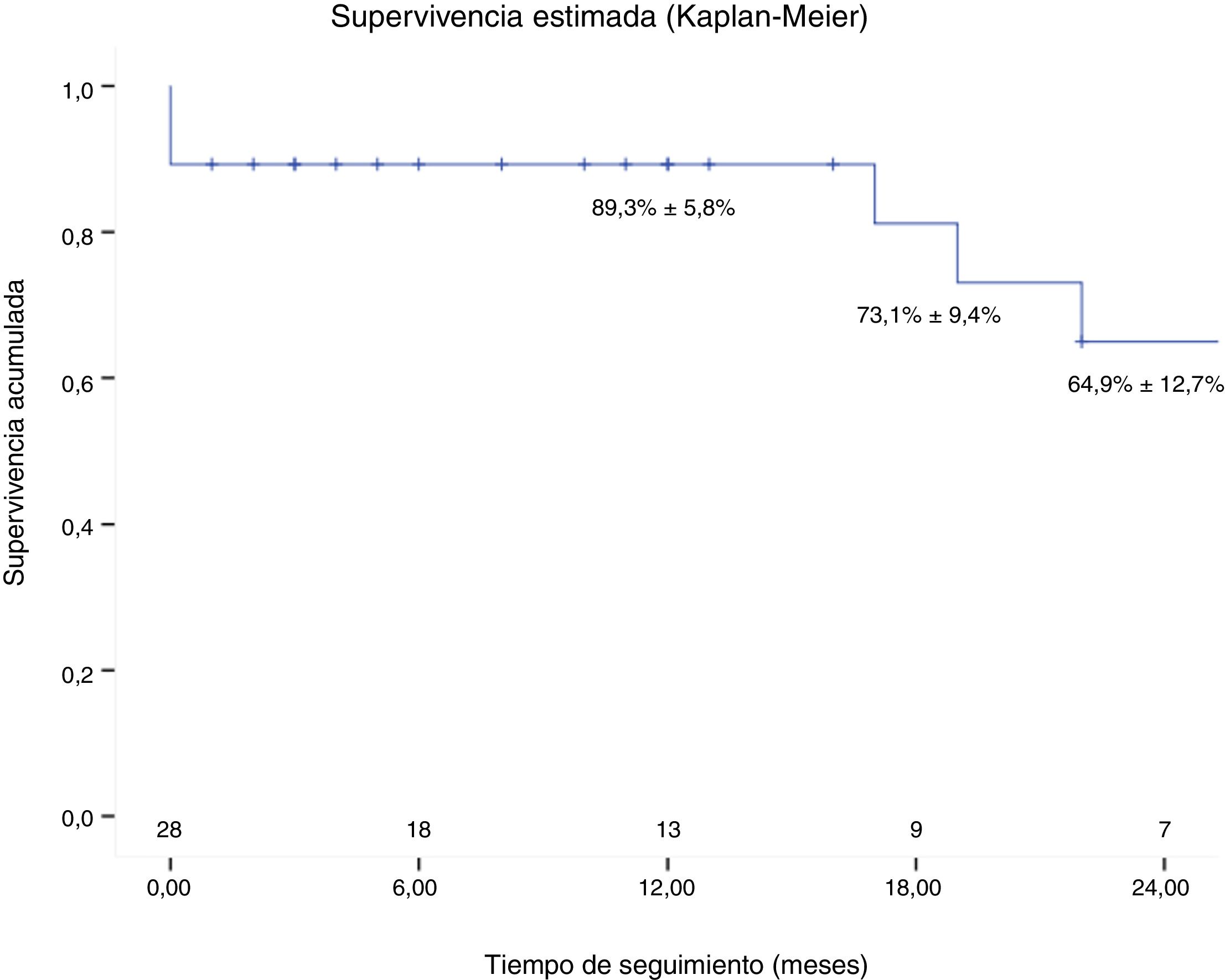
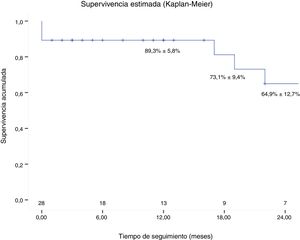
El seguimiento fue completo en el 100% de los pacientes. El tiempo medio de seguimiento fue de 17 meses (DE: 18). La supervivencia al año fue del 89,3% (fig. 4). Dos pacientes (7,1%) fueron reintervenidos durante el seguimiento: uno por progresión de la patología aórtica residual y otro por un seudoaneurisma en la anastomosis de la pastilla de los TSA. Tres pacientes fallecieron al cabo de 17, 19 y 22 meses, 2 de ellos por causa cardiovascular.
DiscusiónLas prótesis híbridas permiten tratar de manera simultánea la patología del cayado aórtico y de la aorta torácica descendente proximal12. No obstante, cuando la patología aórtica se extiende más allá de esta última, pueden ser necesarios uno o varios procedimientos adicionales, ya sean tanto abiertos como endovasculares, que se ven facilitados por las prótesis híbridas, pues hacen la anastomosis proximal más sencilla y constituyen una zona de anclaje excelente para las endoprótesis13,14. De esta manera, podemos realizar un tratamiento individualizado para cada paciente, y en función de la anatomía, etiología, comorbilidad y edad llevar a cabo un procedimiento abierto, endovascular o híbrido, en uno o varios tiempos.
El grupo de Essen tiene la serie más larga publicada hasta la fecha con el uso de prótesis E-vita Open15. En un periodo de 10 años intervinieron a 178 pacientes, presentando una mortalidad a los 30 días del 10% y a los 7 años del 67%. Tuvieron un 7% de ACV permanentes y un 5% de paraplejía. Las reintervenciones en la aorta distal se realizaron en un 12% en un intervalo de tiempo de 0,5-6,5 años, de forma planificada en 2 pacientes y por progresión de la enfermedad en 17 pacientes. El grupo de Hannover ha publicado recientemente una serie con 257 pacientes. Para el análisis de los resultados estableció 2 grupos: uno con pacientes intervenidos en una etapa más temprana (años 2001-2011) y otro en una etapa más contemporánea (año 2012-actualidad). En estos últimos utilizó la prótesis Thoraflex en el 100% de los casos (n=119)16. La mortalidad hospitalaria fue del 8%, la incidencia de ACV del 14% y de lesión medular del 3%. No se han objetivado diferencias significativas en los resultados entre ambas prótesis12.
Nuestra experiencia es fundamentalmente con la prótesis E-vita Open Plus. Nos parece que tiene mayor versatilidad al no obligar al debranching de los 3 TSA, permitiendo individualizar en cada paciente. Nuestros resultados son similares a los de la bibliografía, con una mortalidad hospitalaria del 10,7% y una incidencia de ACV permanente del 7,1%. A pesar de que la serie es corta, la técnica quirúrgica ha ido evolucionando. En la actualidad la arteria se canula siempre mediante la interposición de un injerto de Dacron. La PCA es bilateral con monitorización de la presión en ambas arterias radiales y de la perfusión cerebral con espectroscopia por infrarrojo cercano (NIRS). Hemos ido desplazando la anastomosis distal hacia una zona más proximal, habiéndose abandonado la zona 3. De esta manera la anastomosis es más sencilla, si sangra es más fácil de reparar, es menos frecuente abrir la pleura izquierda y desaparece el riesgo de lesionar el nervio recurrente laríngeo izquierdo. Hemos abandonado también el reimplante en pastilla de los 3 TSA, utilizándose un injerto trifurcado construido sobre la marcha o bien reimplantando una pastilla con el tronco braquiocefálico y la carótida y un bypass a la subclavia izquierda. Con el objeto de proteger las vísceras abdominales y la médula espinal, intentamos acortar el periodo de parada circulatoria al máximo, limitándolo el tiempo de la anastomosis distal. Así, siempre que es posible, se canula la arteria femoral para reiniciar la perfusión del hemicuerpo inferior una vez terminada la anastomosis distal, a la vez que se perfunde la arteria subclavia izquierda durante la parada circulatoria.
La lesión medular está descrita como complicación en esta técnica con una incidencia que varía entre el 0-24%17. Algunos estudios han revelado como factores de riesgo independiente de lesión medular la posición de la endoprótesis más allá de T9 y el tiempo de parada circulatoria17. En nuestra serie no hemos tenido ningún caso, y creemos que esto es debido fundamentalmente a nuestra estrategia de perfusión para la protección medular. Aunque el drenaje del líquido cefalorraquídeo es otra herramienta a considerar para la disminución de su incidencia17,18, en nuestro centro no se realiza de rutina.
A pesar de ser una serie corta en número y seguimiento, la tasa de reintervención es baja (2 pacientes), pudiendo verse influida por el abordaje híbrido que se realiza en la patología extensa. Siempre que es posible, en estos pacientes se programa el segundo tiempo, generalmente endovascular, antes del alta o durante el primer mes.
LimitacionesSe trata de un estudio unicéntrico, descriptivo, con un tamaño muestral pequeño y un seguimiento corto.
ConclusionesLas prótesis híbridas simplifican el tratamiento de la patología compleja de la aorta torácica, permitiendo con frecuencia resolverla en un solo tiempo o bien facilitando el segundo, sea quirúrgico o endovascular.
Conflicto de interesesNinguno.
Este manuscrito corresponde a un trabajo aceptado para el congreso nacional de la SECVTCV 2018 como comunicación oral para optar a premio. Presentado por un residente.