La introducción de las nuevas prótesis aórticas sin sutura ha supuesto una alternativa para el tratamiento quirúrgico de la estenosis aórtica severa.
Presentamos la experiencia de nuestro grupo tras el inicio de un programa con prótesis Perceval S (Livanova, Saluggia, Italia).
Pacientes y métodosEntre marzo de 2012 y octubre de 2016 se implantó la prótesis Perceval S en 262 pacientes (edad media: 77,97±6,12 años; 56,49% de mujeres). En 176 casos (67,18%) se realizó sustitución valvular aórtica aislada, con miniesternotomía en un 36,9%. El seguimiento clínico y ecocardiográfico se realizó al alta, a los 6 meses y anualmente.
ResultadosLa mortalidad esperada fue del 14,19±1,31% (Euroscore log I) y del 7,47±1,11% (Euroscore log II). La mortalidad observada fue del 4,23%. Hubo complicaciones neurológicas en 2 pacientes (0,94%), y fuga periprotésica moderada al alta en 2 pacientes.
El seguimiento medio fue de 26±6,2 meses. La mortalidad en el seguimiento fue del 1,9% (4 pacientes); estabilidad de las fugas grado II en el seguimiento; gradiente medio de 10,2mmHg. El 95% de los pacientes se encontraban en grado funcional I-II.
ConclusionesEl inicio de un programa de implante de prótesis sin sutura Perceval S ha permitido intervenir a pacientes de alto riesgo con buenos resultados y baja morbilidad. La prótesis ha demostrado ser muy versátil, tener un excelente comportamiento hemodinámico y favorecer la cirugía de mínimo acceso.
Sutureless aortic valve replacement has emerged as an innovative alternative for treatment of severe aortic stenosis.
Patients and methodsBetween March 2012 and October 2016 Perceval S (Livanova, Saluggia, Italia) prosthesis was implanted in 262 patients (mean age: 77.97±6.12 years; 56.22% women). In 176 cases (67.18%) isolated aortic valve replacement was performed, 36.9% was minimally invasive approach. Clinical and echocardiographic follow-up was performed at discharge, 6 months and yearly after surgery.
ResultsThe expected risk of mortality was 14.19±1.31% (Euroscore log I) and 7.47±1.11% (Euroscore log II). Observed hospital mortality was 4.23%. Neurological complications in 2 patients (0.94%), one transient, and moderate paravalvular leak 2 patients.
Mean follow-up of 26±6.2 months. Follow-up mortality 1.9% (4 patients); leaks grade II in 2 patients. Mean transprosthetic gradient of 10.2mmHg; 95% of patients in functional class I-II.
ConclusionsThe use of the sutureless Perceval S (Livanova, Saluggia, Italia) prosthesis for surgical treatment of severe aortic stenosis has shown to be feasible, safe and effective. This valve is a very useful tool in high risk aortic patients, with low mortality and low complications rates, and highly versatile has allowed us to solve very complex cases.
La afectación de la válvula aórtica es muy común en la población de edad avanzada. En los mayores de 75 años de edad, la prevalencia de estenosis aórtica es del 3% y uno de cada 8 pacientes tiene una afectación moderada o severa de la válvula1.
La actuación sobre la válvula aórtica aislada representa el 78% de la actividad quirúrgica sobre la válvula aislada, según el registro español de nuestra sociedad2.
La historia natural sin tratamiento de la estenosis aórtica severa sintomática es de mal pronóstico vital en 1-2 años3. En los últimos 50 años, la cirugía de sustitución valvular aórtica con prótesis mecánicas y biológicas ha sido el gold standard en el tratamiento de esta enfermedad, con excelentes resultados a corto, medio y largo plazo.
Debido al envejecimiento progresivo de la población, al aumento de las comorbilidades de los pacientes y a los problemas asociados a la anticoagulación crónica, alrededor del 80% de las prótesis aórticas implantadas actualmente en los países desarrollados son biológicas.
Aunque la cirugía convencional de sustitución valvular aórtica por esternotomía completa ha tenido buenos resultados incluso en pacientes de edad avanzada y alto riesgo, un porcentaje significativo de estos pacientes (30-40%) nunca fueron referidos para cirugía. Eran pacientes considerados inoperables o de un riesgo inasumible3,4.
Las nuevas válvulas aórticas implantadas transcatéter por vía percutánea (TAVI, de «transcatheter aortic valve implantation») han demostrado mejor resultado que el tratamiento médico en pacientes inoperables5 y no inferioridad respecto a la cirugía en pacientes de alto riesgo6. Las válvulas percutáneas han tenido en los últimos años una gran expansión, e intentan expandir su implante en pacientes de moderado riesgo (PARTNER II trial y SURTAVI trial).
A pesar de la mejora técnica en los últimos años, los procedimientos TAVI se asocian a una incidencia, no despreciable, de accidentes cerebrovasculares7,8 (2,5-3,5%), fugas perivalvulares residuales9,10, complicaciones vasculares y necesidad de marcapasos (MCP) definitivo. Tampoco tenemos aún datos de durabilidad a largo plazo.
Recientemente, han aparecido las nuevas válvulas aórticas sin sutura que permiten ofrecer una alternativa quirúrgica a pacientes de mayor riesgo y complejidad, facilitando las técnicas de mínima invasión y con menor morbimortalidad11,12.
Presentamos nuestra experiencia con la prótesis Perceval S, en términos de mortalidad y morbilidad a 30 días y en el seguimiento, durante el cual evaluamos el comportamiento hemodinámico de la prótesis y el impacto en la clase funcional de los pacientes.
Material y métodosEntre marzo de 2012 y octubre de 2016 la prótesis Perceval S (Livanova, Saluggia, Italia) fue implantada en 262 pacientes que fueron remitidos a nuestro servicio con el diagnóstico de estenosis aórtica severa sintomática.
Se excluyeron los pacientes en los cuales no se recomienda el implante de esta prótesis: aorta ascendente dilatada con diámetro de la unión sino-tubular ≥1,3 respecto del diámetro del anillo aórtico, y pacientes bicúspides puros (solo 2 senos coronarios).
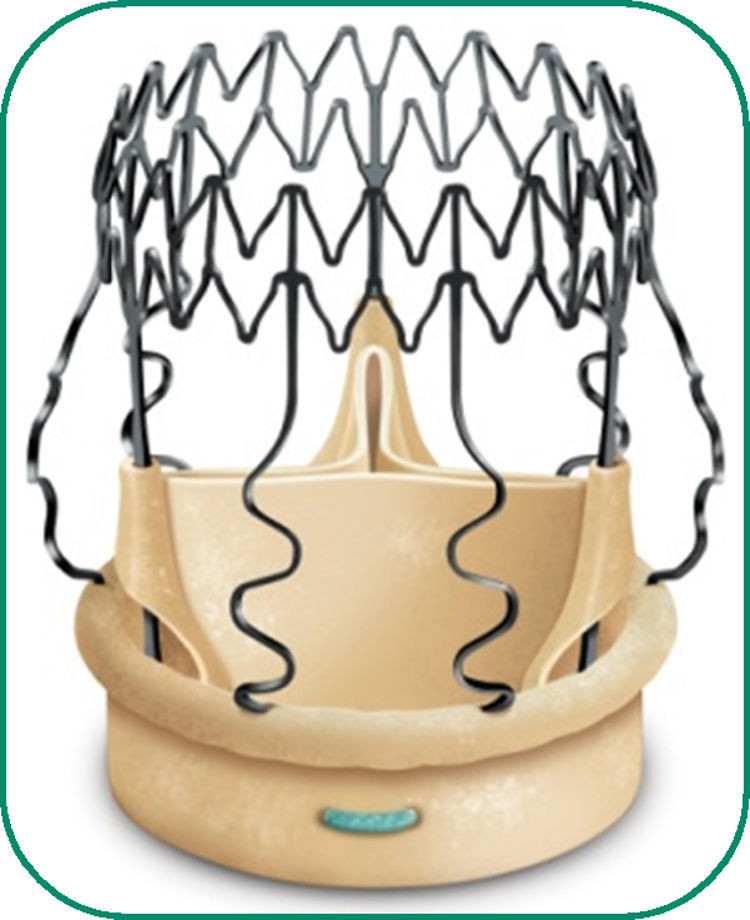
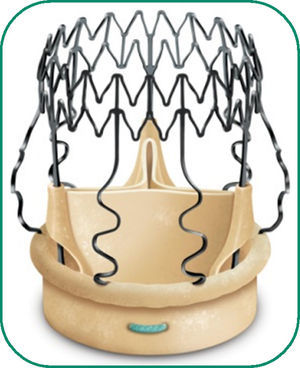
La prótesis sin sutura Perceval S corresponde a una nueva generacio¿n de válvulas aórticas biolo¿gicas que no precisan suturas definitivas para su implante. Está compuesta de una válvula de pericardio bovino montada sobre un armazón o stent de nitinol (aleacio¿n metálica de ni¿quel y titanio) (fig. 1).
El nitinol tiene la propiedad de ser maleable y poder plegarse fácilmente a temperatura fría y recuperar su forma original con el calentamiento. Una vez realizada la medición del anillo nativo (hay 4 posibles tamaños de prótesis: S [19-21mm], M [21-23mm], L [23-25mm] y XL [25-27mm]), la prótesis elegida se reduce de tamaño mediante colapsado sobre un vástago que permite su introduccio¿n en el anillo ao¿rtico y su despliegue posterior. La prótesis queda fijada por la propia tensión radial del stent de nitinol.
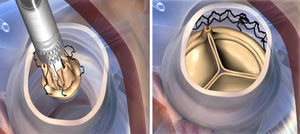
La incisión quirúrgica se realizó, o bien por esternotomía media completa, o bien por miniesternotomía superior en J por el 4.o espacio intercostal.
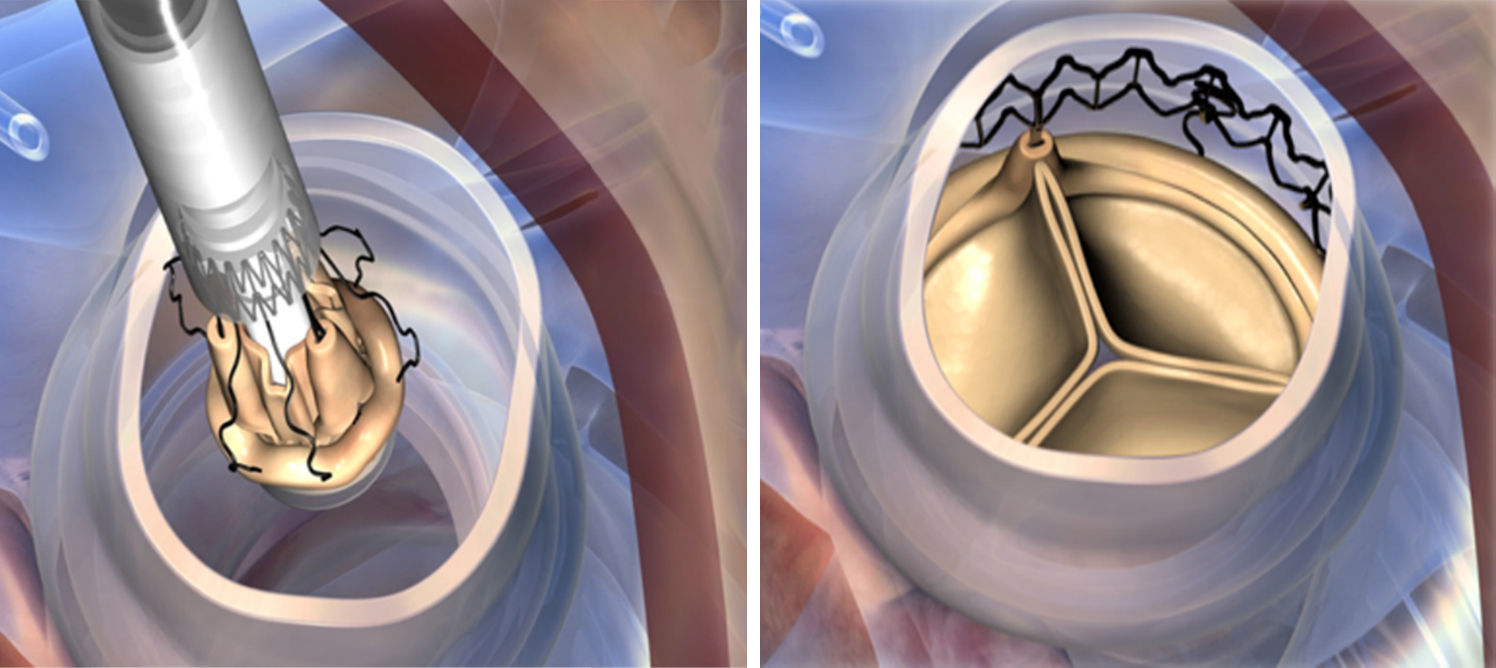
Tras una aortotomía alta (a 4cm del plano valvular) y transversal, se realiza una resección de los velos decalcificando completamente el anillo aórtico. Posteriormente, se procede a la medición del tamaño de la prótesis utilizando los 4 posibles medidores correspondientes (S, M, L, XL).
Mientras se realiza la reducción valvular, se colocan 3 puntos guía de Prolene 4-0, equidistantes, en la parte más baja (nadir) de cada comisura, se pasan los puntos guía por los ojales presentes en la prótesis ya montada, implantándola en posición anular con visión directa. Tras la liberación del sistema y despliegue de la válvula, se realiza una valvuloplastia para acabar de expandir completamente el armazón de nitinol (presión de inflado de 4 atmosferas), mientras aplicamos suero caliente (durante 30s). Una vez desplegada, se retiran las suturas guía y se procede a cerrar la aortotomía (figs. 2 y 3).
En este estudio se describe la mortalidad hospitalaria y en el seguimiento, la relacionada con la prótesis y las principales complicaciones postoperatorias utilizando las recomendaciones de la literatura13,14.
Se recogen las variables demográficas, factores preoperatorios, datos intraoperatorios (la vía de acceso, el tiempo de isquemia, el tiempo de circulación extracorpórea) y datos postoperatorios (estancia hospitalaria y reingresos precoces tras el alta).
Se realizó seguimiento clínico y ecocardiográfico intraoperatorio, al alta hospitalaria, a los 6 meses, y cada año durante el seguimiento.
Análisis estadísticoSe realizó un análisis descriptivo de las características demográficas, clínicas y ecocardiográficas de todos los pacientes. Para las variables cualitativas se calcularon las frecuencias absolutas y sus porcentajes. Las variables cuantitativas fueron descritas mediante media y desviación estándar. La curva de supervivencia y libre de eventos se realizó mediante el método Kaplan-Meier.
Se define como mortalidad operatoria la ocurrida durante la hospitalización y en los primeros 30 días tras el alta. La tasa de eventos postoperatorios se calcula como el porcentaje de pacientes que experimentan dicho evento dividido por el número de pacientes.
Las variables categóricas se expresan como número y porcentaje.
ResultadosDatos demográficos y operatoriosLa edad media de los pacientes estudiados fue de 77,97±6,12 años; el 35% eran octogenarios y el 56,49% de sexo femenino. Todos los pacientes eran de alto y muy alto riesgo (Euroscore numérico: 8,74±0,28). El Euroscore log I medio fue de 14,18±1,38% y el Euroscore log II de 7,46±1,11%. La tabla 1 muestra las características demográficas y de comorbilidad de la población.
Características demográficas preoperatorias
| Variable | n=262 n (%) o media±DE |
|---|---|
| Sexo masculino/femenino | 114 (43,51%)/148 (56,49) |
| Edad media (años) | 77,97±6,12 |
| IMC (kg/m2) | 29,7±16,35 |
| SC (m2) | 1,73±0,17 |
| Obesidad (IMC superior 32kg/m2) | 50 (19,08) |
| EPOC moderado/severo | 54 (20,61) |
| Diabetes mellitus | 92 (35,11) |
| Insuficiencia renal crónica (4 pacientes en HD) | 54 (20,61) |
| AVC previo | 23 (8,78) |
| Vasculopatía periférica/carotídea | 31 (11,8) |
| HTP severa (>55mmHg) | 36 (13,74) |
| FE ≤30% | 16 (6,1) |
| Reintervención | 26 (9,9) |
AVC: accidente cerebrovascular; DE: desviación estándar; EPOC: enfermedad pulmonar obstructiva crónica; FE: fracción de eyección; HTP: hipertensión pulmonar; IMC: índice de masa corporal; SC: superficie corporal.
En 176 pacientes (67,18%) se realizó una sustitución valvular aórtico aislada; de estos, en un 36,9% de los casos (65 pacientes) se realizó una miniesternotomía superior en J hacia el 4.o espacio intercostal. En el resto de los pacientes de la serie, la sustitución valvular aórtica se asoció a otros procedimientos (tabla 2).
Procedimiento quirúrgico
| Sustitución valvular aórtica aislada | 176 |
| SVAo+coronarias | 62 |
| SVAo+procedimiento mitral (reemplazo o plastia)±procedimiento tricúspide | 16 |
| SVAo+SVM+coronarias | 6 |
| SVAo+coronarias+otros con CEC (ablación FA, restore) | 1 |
| SVAo+sustitución aorta | 1 |
CEC: circulación extracorpórea; FA: fibrilación auricular; SVAo: sustitución valvular aórtica aislada; SVM: sustitución de la válvula mitral.
En 6 de los primeros 50 casos, fue necesario volver a entrar en circulación extracorpórea con nuevo período de pinzamiento aórtico por quedar una fuga periprotésica moderada residual al control de ETE. La prótesis fue retirada de su zona de implante con facilidad, recolapsada y reposicionada con éxito.
En quirófano, el tiempo medio de isquemia miocárdica fue de 54,95±3,35min (34,14±0,72min en reemplazo valvular aislado) y el tiempo medio de circulación extracorpórea fue de 80,56±4,69min (54,18±2,56min en sustitución valvular aislada). No hubo ningún caso de obstrucción de los ostia coronarios.
En 49 pacientes (18,7%) se implantó una prótesis de tamaño S (19-21mm), en 99 (37,79%) M (21-23mm), en 84 (32,06%) L (23-25mm) y en 30 (11,45%) XL (25-27mm).
Morbilidad; mortalidad precoz, tardía y clase funcionalLa mortalidad a 30 días ocurrió en 12 pacientes (4,58%), y fue significativamente inferior a la estimada por las escalas de riesgo Euroscore (el Euroscore log I medio fue de 14,18±1,38% y el Euroscore log II de 7,46±1,11%).
La estancia media en la unidad de cuidados intensivos fue de 4,4±9,06 días y la estancia global, de 13,67±1,52 días.
El reingreso precoz (antes de 30 días tras el alta) se produjo en un 4,72% de los pacientes. Al alta solo un 11% de los pacientes fueron derivados a centros sociosanitarios o al hospital de referencia para la convalescencia.
Las complicaciones mayores observadas en el postoperatorio se resumen en la tabla 3.
Morbilidad postoperatoria
| Reoperación por sangrado | 7 (2,6%) |
| IAM peroperatorio | 3 (1,14%) |
| Traqueostomía por VM de larga duración | 8 (3,0%) |
| Insuficiencia renal (cifras de creatinina basal × 2) | 69 (26,33%) |
| Insuficiencia renal que precisa HF o diálisis | 4 (1,52%) |
| AVC transitorio | 3 (1,15%) |
| AVC con secuelas | 1 (0,38%) |
| Isquemia intestinal | 4 (1,5%) |
| MCP permanente | 24 (9,1%) |
| RS normal a MCP permanente | |
| Primeros 30 pacientes | 8 (33,3%) |
| Resto (11/232) | 16 (6,1%) |
| Caída en FA | 82 (31,3%) |
| Transfusión | 41% (70% de pacientes Hb<12) |
AVC: accidente cerebrovascular; FA: fibrilación auricular; Hb: hemoglobina; HF: hemofiltración; IAM: infarto de miocardio; MCP: marcapasos; RS: ritmo sinusal; VM: ventilación mecánica.
En el control ecocardiográfico al alta, solamente en 2 casos se objetivó la presencia de una fuga periprotésica moderada (0,98%). Ambos pacientes se mantienen en clase funcional NYHA II y sin repercusión sobre el ventrículo izquierdo en el seguimiento.
La incidencia de bloqueo auricular ventricular completo con necesidad de implante de MCP permanente ha sido del 9%. Hay que destacar que en los primeros casos con desbridamiento parcial del anillo e implantación de la prótesis muy baja, la incidencia fue de más del 30%. El cambio de técnica de implantación, con desbridamiento completo del calcio del anillo e implante a nivel anular, ha disminuido la incidencia hasta el 6,8% en los 232 pacientes posteriores.
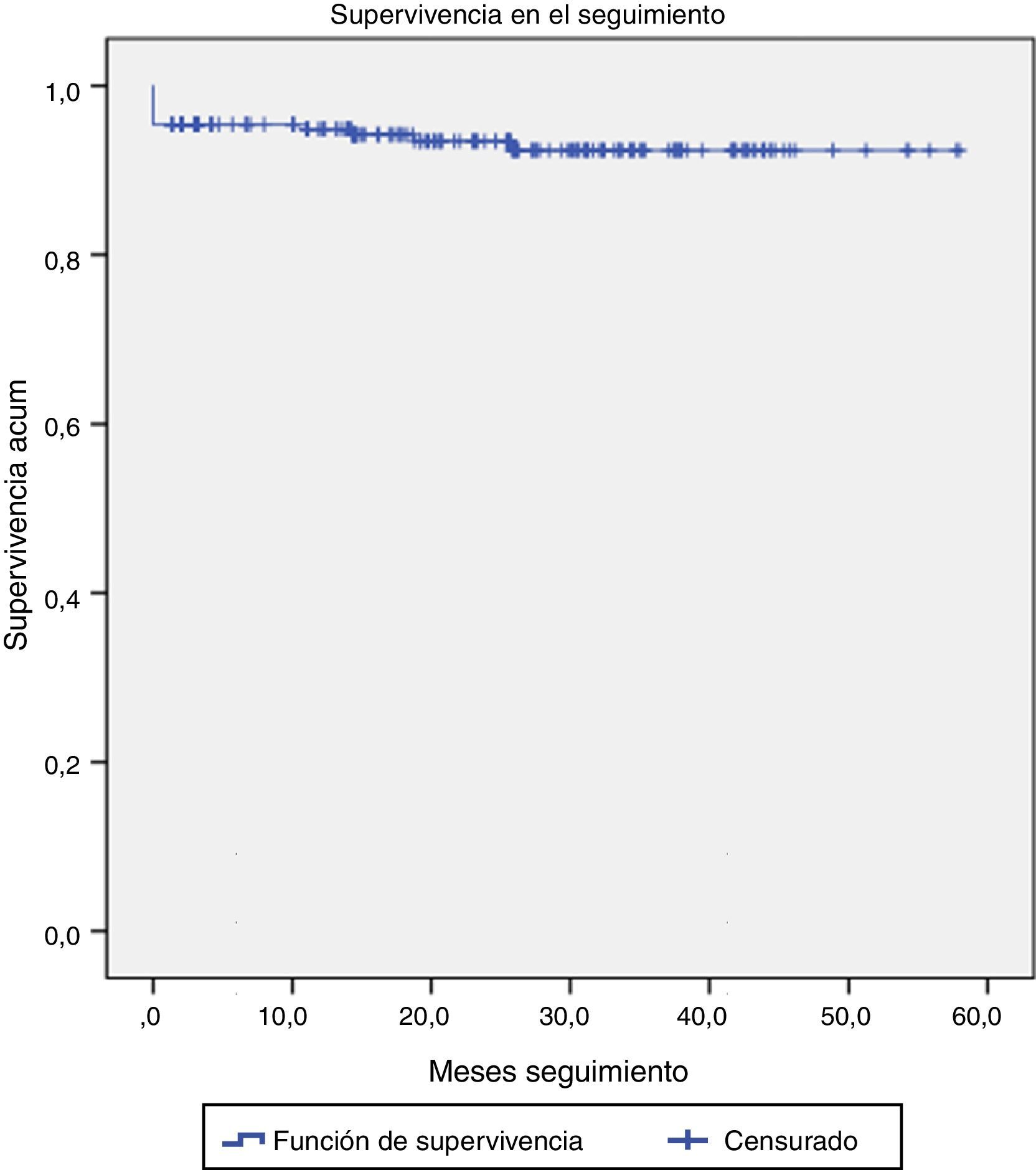
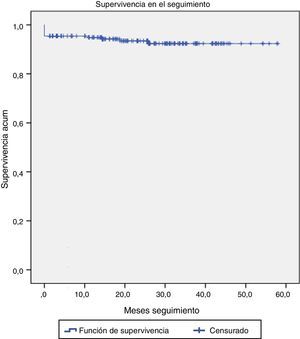
El seguimiento fue completo (100% de los pacientes). La media de seguimiento se sitúa en los 26 meses, con un máximo de 50 meses.
Dos pacientes presentaron endocarditis protésica en el primer año tras el alta hospitalaria. Uno de ellos falleció durante la reintervención, y el otro se mantiene estable bajo tratamiento médico.
No se han descrito migraciones, trombosis o deterioro estructural de la válvula durante su seguimiento.
Solamente destaca una reintervención precoz tras el alta motivada por fuga moderada-severa tras un procedimiento percutáneo con intento de colocación de stent coronario que dislocó la prótesis previamente implantada.
No se ha observado deterioro estructural precoz.
Durante el seguimiento, 4 pacientes fallecieron por causa no cardíaca: uno a los 4 meses por insuficiencia hepática autoinmune fulminante, otro a los 12 meses por insuficiencia renal terminal y los otros 2 por enfermedad neoplásica diagnosticada de novo (fig. 4).
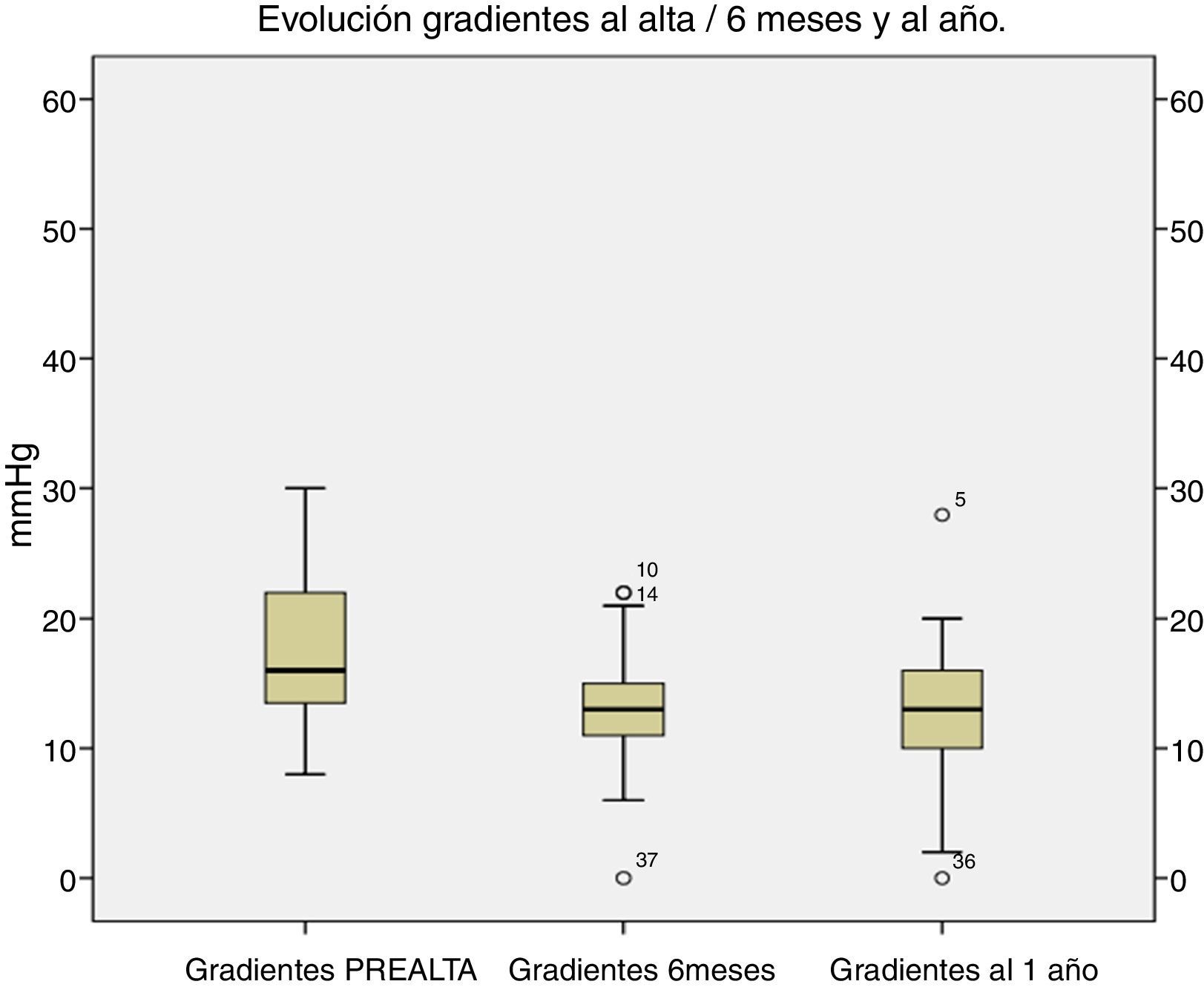
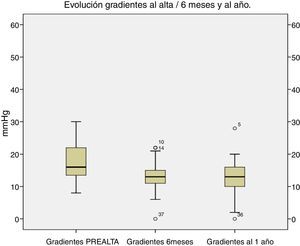
El comportamiento hemodinámico a medio plazo ha sido excelente, con gradientes residuales transprotésicos bajos. Al año, los gradientes medios para todos los tamaños fueron de 10,2±7mmHg (fig. 5).
Los 2 pacientes con fugas moderadas en el postoperatorio inmediato permanecen estables, y solamente un 8% tienen fugas mínimas o ligeras.
Después del alta hospitalaria, solamente un paciente precisó implante de MCP definitivo.
DiscusiónLa sustitución valvular aórtica es el gold standard para el tratamiento de pacientes con estenosis valvular aórtica sintomática. El envejecimiento progresivo de la población y el aumento de la comorbilidad de los pacientes referidos a cirugía han aumentado significativamente el riesgo y la fragilidad de esta población. La aparición de prótesis que permiten disminuir los tiempos de circulación extracorpórea, favorecer abordajes mínimamente invasivos, disminuir la agresión quirúrgica y una menor manipulación de la raíz de la aorta pueden ser una alternativa para mejorar los resultados en este conjunto de pacientes.
Nuestra experiencia con la nueva prótesis sin sutura Perceval S (Livanova, Saluggia, Italia) nos ha permitido evaluar su comportamiento clínico y hemodinámico.
En la actualidad, hay estudios en marcha, comparativos y aleatorizados, para comparar los resultados entre prótesis soportadas y sin sutura (PERSIST-AVR Clinical Trial).
Dada la actual coyuntura de pacientes cada vez más añosos y de alta comorbilidad, junto con una realidad de recursos limitados, también era importante valorar si la prótesis Perceval S podía ser una alternativa para algunos pacientes orientados a un procedimiento TAVI.
En nuestra experiencia, el uso de la prótesis Perceval S nos ha permitido mejorar significativamente los resultados de mortalidad hospitalaria, con una mortalidad real del 4,2%, muy por debajo de la esperada según las escalas Euroscore log I (14,9%) y log II (7,47%), al igual que en otras series descritas15,16.
Existen estudios17,18 que demuestran que el aumento en los tiempos de circulación extracorpórea/pinzamiento aórtico son factores independientes de morbimortalidad en pacientes sometidos a cirugía de sustitución valvular aórtica o procedimientos combinados. La disminución en los tiempos de pinzamiento, sobre todo en los procedimientos combinados, hace que se reduzca la morbimortalidad en cirugía de sustitución valvular aórtica, especialmente en la población geriátrica, diabética y con disfunción ventricular.
Tiempos de isquemia y de circulación extracorpóreaEs conocida la relación existente entre un mayor tiempo de isquemia y de circulación extracorpórea y los resultados de morbimortalidad tras cirugía de sustitución aórtica17-19. En nuestra experiencia, la prótesis Perceval S nos ha permitido disminuir los tiempos de isquemia y de circulación extracorpórea, respecto al mismo período, en pacientes de características similares, sometidos a cirugía de sustitución valvular aislada o combinada con prótesis soportadas, en un un 28,2 y 19,8%, respectivamente.
Comportamiento hemodinámico de la prótesis Perceval S (Livanova, Saluggia, Italia). Fugas residualesGracias a las características de la prótesis Perceval S, el comportamiento hemodinámico es satisfactorio, con gradientes medios bajos que se mantienen estables en el seguimiento, incluso para tamaños pequeños.
En un reciente estudio prospectivo, las prótesis sin sutura demostraron una reducción del riesgo de «patient-prosthesis» mismatch respecto a las convencionales y se han postulado como de elección en anillo aórtico pequeño20.
En nuestra serie, los gradientes postoperatorios han sido también bajos, con gradientes medios de 10,2±7mmHg al año, manteniéndose estables en los 3 primeros años de seguimiento.
En relación con la presencia de fugas perivalvulares significativas residuales con esta nueva prótesis, se ha documentado una incidencia global de fuga moderada o moderada-severa del 3,43% a lo largo de un período de 5 años, pasando de un 6,5% en 2009 a menos del 1% en 201421.
Esta evolución refleja la curva de aprendizaje de los grupos, con mayor experiencia en la actualidad, y la disminución de la misma se debe fundamentalmente al perfeccionamiento de la técnica quirúrgica, así como a la decalcificación completa del anillo.
En nuestra serie de pacientes, tan solo 2 fueron dados de alta con una fuga residual de carácter moderado (estables en el seguimiento). En un 8% adicional existía una fuga residual ligera o mínima.
En los primeros 50 pacientes, hasta en 4 ocasiones fue necesario un nuevo período de pinzamiento aórtico y circulación extracorpórea por la presencia de una fuga residual significativa en el control de ETE intraoperatorio. La prótesis fue reposicionada de forma efectiva sin problemas. En los últimos 150 pacientes, superada ya la curva de aprendizaje, solo en una ocasión fue necesario reposicionar la prótesis.
La visión directa del explante e implante valvular, así como la decalcificación del anillo, hacen que se disminuya la probabilidad de eventos neurológicos o fugas paravalvulares.
La incidencia de eventos neurológicos en nuestra serie fue del 1,11%. Solo hubo un accidente cerebrovascular permanente y un accidente isquémico transitorio en pacientes con arteriopatía periférica previa, algo menor a lo descrito respecto a otros procedimientos (TAVI), que es del 2,2-3,5%15,22. A pesar de la existencia de un 8% de fugas perivalvulares ligeras, estas se mantienen estables a lo largo del seguimiento. La decalcificación del anillo más exhaustiva, dejando una superficie simétrica, permite reducir las fugas y eventos embólicos.
La prótesis Perceval S favorece los abordajes mínimamente invasivosPor la facilidad de implante, la escasa manipulación de la raíz de aorta que se requiere, el acortamiento de los tiempos de pinzamiento y circulación extracorpórea, y su gran utilidad en raíz aórtica de pequeño tamaño, la prótesis Perceval S se ha posicionado como una herramienta que facilita los abordajes menos invasivos23.
En nuestra experiencia, solo el 31,9% se realizó por miniesternotomía, sin embargo, actualmente cerca del 70% de los procedimientos aislados (tanto en prótesis sin sutura o stented) se realiza por un abordaje mínimamente invasivo.
La prótesis Perceval S: una herramienta muy versátilLa prótesis Perceval S ha sido muy útil en los casos de raíz aórtica pequeña. El hecho de implantarse de forma plegada y con visión directa del anillo aórtico permite colocar fácilmente la prótesis en anillos de pequeño diámetro y muy calcificados. Hecho que cobra importancia en nuestro medio, disminuyendo la probabilidad de aparición de mismatch.
Un 9,9% de nuestra serie son reintervenciones con anillos pequeños o raíces complicadas. La versatilidad de la prótesis Perceval S nos ha permitido reoperar a estos pacientes, aortas rígidas, pequeñas y poco elásticas, con resultados excelentes.
Las reintervenciones sobre una prótesis aórtica degenerada se asocia a una mayor morbimortalidad, incluyendo una elevada necesidad de MCP definitivo24. Esa es la principal razón por la cual una gran cantidad de pacientes con deterioro estructural de su válvula no son remitidos a grupos de cirugía ni son reoperados. En la serie de Kaneko et al. solamente un 10,3% de esos pacientes eran operados, teniendo una mortalidad en el grupo de un 4,6%, inferior a lo esperado25.
En la actualidad, han aparecido nuevas posibilidades terapéuticas como los procedimientos «valve-in valve» con las prótesis aórticas transcatéter, que permiten implantar una nueva válvula en el interior de la bioprótesis degenerada26.
Sin embargo, no todas las bioprótesis tienen un diseño adecuado, y existe el peligro de oclusión de los ostia coronarios o de malposición de la nueva válvula. Además, los gradientes residuales altos o muy altos son frecuentes cuando la bioprótesis degenerada es de un tamaño inferior a 23mm.
La prótesis Perceval S también nos ha permitido realizar cirugía de reemplazo valvular aórtico asociada a un procedimiento mitral. En 7 pacientes se realizó cirugía reparadora mitral con anuloplastia con anillo semirígido o flexible y en 2 se implantó una bioprótesis mitral. Cuatro pacientes más ya tenían una cirugía previa con prótesis mitral mecánica (3) o biológica (1). En todos los casos, el posicionamiento de la prótesis Perceval S fue óptimo, sin conflicto de espacio ni fugas significativas.
Prótesis Perceval S y trombocitopenia transitoria postimplanteTras la implantación de la prótesis Perceval S, se ha descrito un descenso moderado y transitorio del número de plaquetas en las analíticas postoperatorias, que se recupera paulatinamente en los días siguientes (a las 48h en nuestro grupo), y que no parece estar ligado a una mayor incidencia de sangrado postoperatorio o transfusiones15.
La trombocitopenia severa (<50.000plaq/l) solamente se observó en un 2% de las prótesis Perceval S.
Podría estar relacionado con el tipo de prótesis, al tratarse de una prótesis solo montada sobre un stent, de la que ya se conoce que puede ocasionar trombocitopenia27-29.
Es un dato significativo a tener en cuenta en pacientes añosos y/o pacientes con trombocitopenia.
Prótesis Perceval S y necesidad de implante de marcapasos definitivoLa aparición de bloqueo auriculoventricular completo es una complicación relativamente frecuente (1,8-3,6%) tras la sustitución valvular aórtica con prótesis convencionales. La incidencia con las nuevas prótesis TAVI es aún mayor, entre el 6 y el 26% de los pacientes. Para las prótesis sin sutura Perceval S se han reportado incidencias muy variadas que van desde un 4,9 a un 17%, con una media del 5,6%30.
Nuestra experiencia ha sido variable a lo largo del tiempo. En los primeros casos la incidencia de bloqueo auriculoventricular completo y MCP definitivo fue muy alta (20,9%). Posteriormente cambiamos radicalmente la técnica de implante, desbridando totalmente el anillo e implantando la prótesis a nivel del anillo y no más baja. La incidencia bajó hasta el 8,2%. En los últimos 100 casos, con mayor experiencia, la incidencia se mantiene entre un 6 y un 7%.
En nuestra experiencia, la técnica de implante, tras un análisis multivariante, identificó la presencia de bloqueo auricular ventricular de primer grado preoperatorio y la desviación hacia la izquierda del eje QRS como factores independientes predictivos de necesidad de MCP tras el implante31.
Estabilidad y durabilidad de la prótesis. Seguimiento a medio plazoEl seguimiento medio de la serie ha sido de 26 meses, durante el cual hemos tenido 2 endocarditis pero ningún deterioro o trombosis estructural de la prótesis.
En la actualidad se han implantado más de 15.000 prótesis Perceval S en todo el mundo y han aparecido múltiples trabajos y artículos en las revistas especializadas, teniendo información de seguimientos a largo plazo (5-8 años).
En la experiencia más larga reportada (Shrestha et al.), la supervivencia a 1 y 5 años fue del 92,1 y 74,7%, respectivamente, y no existieron migraciones, deterioro estructural ni trombosis de la válvula32.
Aunque es necesario un seguimiento más largo para estas bioprótesis (más allá de los primeros 10 años), la demostración de que el colapso de la prótesis para su implantación no afecta la estructura del colágeno, los bajos gradientes conseguidos con ausencia de mismatch y el flujo nada turbulento auguran una larga durabilidad.
Prótesis Perceval S como alternativa a la valvuloplastia aórtica transcatéter (TAVI)En nuestra serie de 262 pacientes, a los cuales se les implantó una prótesis Perceval S, 51 pacientes tenían un perfil de muy alto riesgo (Euroscore log >20%) y se descartó realizar un procedimiento TAVI.
En este grupo (Euroscore log I de 34,01±4,24%, Euroscore log II de 20,42±4,94%), la mortalidad fue de 6 pacientes (2,2%), con un ictus transitorio y ninguna fuga paravalvular significativa. Al año de seguimiento, la supervivencia era del 93,3%.
En los últimos años, los procedimientos transcatéter en pacientes aórticos de alto riesgo han ido creciendo en todo el mundo hasta alcanzar un 40% del total de procedimientos sobre la válvula aórtica en países como Alemania o Dinamarca33,34, y existe acuerdo en elegir un procedimiento TAVI en aquellos pacientes inoperables o de muy alto riesgo35. Sin embargo, todavía hay serias dudas en su utilización sistemática en pacientes de riesgo bajo, intermedio o alto25.
Para esos pacientes aórticos de alto riesgo, la nueva prótesis sin sutura Perceval S, especialmente con un abordaje miniinvasivo, podría ser una alternativa a la TAVI, con mejores resultados, menos complicaciones neurológicas y menor tasa de fuga paravalvular significativa residual9,36.
ConclusionesEn nuestra experiencia, el implante de la prótesis sin sutura Perceval S (Livanova, Saluggia, Italia) en los pacientes con estenosis aórtica severa ha sido seguro, reproducible y eficaz.
El uso de la prótesis ha permitido disminuir los tiempos de isquemia y de circulación extracorpórea. En los pacientes aórticos de alto riesgo, ha permitido disminuir la mortalidad, las estancias hospitalarias y las complicaciones postoperatorias mayores.
El comportamiento hemodinámico de la prótesis ha sido óptimo incluso en tamaños pequeños, siendo inexistente el mismatch y manteniéndose estable en el seguimiento a medio plazo.
Ha favorecido los abordajes mínimamente invasivos y se ha mostrado muy versátil en pacientes de alta complejidad técnica: anillo aórtico pequeño, raíz aórtica calcificada, reintervenciones-bioprótesis con degeneración estructural y/o procedimientos combinados mitro-aórticos y coronarios.
Posiblemente, cuando existan seguimientos a más largo plazo, las nuevas prótesis sin sutura irán ganando terreno a las prótesis clásicas, y no solo se emplearán en pacientes de alto riesgo, sino en cualquier paciente aórtico con indicación de bioprótesis.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.