La situación Fallot tiene excelente supervivencia posquirúrgica, aunque presenta morbilidad tardía que ocasionalmente precisa reintervención: el 26% de nuestros pacientes seguidos en la unidad de cardiopatías congénitas del adulto han requerido reoperación. Analizamos estas cirugías con sus resultados.
MétodosEstudio retrospectivo (1991-2014), de 90 reoperaciones en 84 adultos con situación Fallot operada.
ResultadosEdad media 33±10 años, 59% varones, 2±1 cirugías previas/paciente, clase funcional NYHA I-II: 46,4% y III-IV: 53,6%; antecedentes de arritmia en el 45%. Indicación quirúrgica principal: insuficiencia y/o estenosis pulmonar (76,7%), insuficiencia aórtica (11,1%), defectos septales residuales (7,8%) e insuficiencia tricuspídea (4,4%). Las reoperaciones precisaron circulación extracorpórea, evitando pinzado aórtico en el 34%. Técnicas quirúrgicas realizadas: a nivel pulmonar 81,1% (implante bioprótesis 68,9%), cierre de cortocircuito residual 50%, a nivel tricuspídeo 25,5% o aórtico 18,9%. Mortalidad hospitalaria: 4,4%. Seguimiento medio: 5,9±6,2 años. Durante el seguimiento fallecieron 3 pacientes, 12 se reoperaron y 9 precisaron procedimientos percutáneos. La supervivencia a los 3 y 11 años fue, respectivamente, del 96 y el 90%. Actualmente, el 92,2% mantiene grado funcional I-II y el 82,3% está en ritmo sinusal. Comparando cardiorresonancias pre y postoperatorias observamos que la bioprótesis pulmonar significativamente reduce la insuficiencia pulmonar y los volúmenes del ventrículo derecho (p = 0,001), sin modificar su contractilidad.
ConclusionesNuestra indicación principal para reoperar adultos con Fallot se localiza a nivel pulmonar y requiere implantar una bioprótesis. Realizamos estas reintervenciones con buena supervivencia, objetivando posteriormente mejoría clínica y reducción volumétrica ventricular derecha.
Fallot has excellent post-surgical survival, although it has late morbidity including re-operations. Of all the Fallot patients currently followed-up in our Adult Congenital Heart Disease (ACHD) Unit, 26% needed re-operation. An analysis is performed on these late re-operations and the outcomes achieved.
MethodsRetrospective study (1991-2014): 90 re-operations in 84 Fallot patients previously operated in the ACHD unit.
ResultsMean age: 33±10 years, 59% males, 2±1 previous surgeries/patient. Preoperative functional NYHA class I-II: 46.4%, III-IV: 53.6%; arrhythmia: 45%. Main surgical indications: pulmonary insufficiency and/or stenosis (76.7%), aortic insufficiency (11.1%), residual septal defect (7.8%), and tricuspid insufficiency (4.4%). Re-operations were performed with extracorporeal circulation, and without clamping aorta in 34%. Surgical techniques employed: 81.1% received pulmonary surgery (68.9% bio-prosthesis), 50% septal defect closure, 25.5% tricuspid, and 18.9% aortic valve surgery. Hospital mortality: 4.4%. Mean follow-up: 5.9±6.2 years. During this period 3 patients died, 12 received new surgery, and there were 9 percutaneous interventions. Survival at 3 and 11 years was 96% and 90% respectively. Currently, 92.2% patients are in functional class I-II, and 82.3% in sinus rhythm. Pre- and post-operative cardiovascular magnetic resonance studies show that pulmonary bioprosthesis significatively improves pulmonary regurgitation and reduces right ventricle function (P=.001), without changing right ventricle function.
ConclusionsMain indications for reintervention in Fallot in the ACHD Unit are pulmonary valve dysfunction requiring a bioprosthesis implant. Good survival was achieved in these re-operations, improving patients symptoms and reducing right ventricle volumes.
La situación Fallot (SF) es la cardiopatía congénita cianótica más frecuente pasado el año de vida1, siendo predominante en nuestra unidad de cardiopatías congénitas del adulto (UCCA). Presenta una comunicación interventricular (CIV) no restrictiva, más estenosis o atresia entre el ventrículo derecho (VD) y la arteria pulmonar (AP).
Su reparación quirúrgica se realiza en el mundo desde hace más de 50 años2 y consiste en cerrar la CIV con parche y ampliar la salida del VD hacia la AP con parche, que habitualmente es transanular. Históricamente, esta reparación completa se hacía pasado el quinto año de vida, con paliación previa si era necesario por la cianosis. La supervivencia posquirúrgica es del 80% tras 40 años3, siendo la muerte súbita la causa predominante de mortalidad tardía.
Gracias al mejor manejo médico-quirúrgico de estos pacientes durante las últimas décadas, la mortalidad hospitalaria (MH) ha disminuido y la supervivencia tardía ha mejorado. Estos hechos han propiciado la aparición de una población nueva de SF operada adulta con importante complejidad, que debe atenderse en una UCCA4. Los adultos con SF operada presentan morbilidad tardía consistente en residuos, secuelas y/o complicaciones derivadas de su propia patología y/o de las intervenciones realizadas, y requieren ocasionalmente una nueva cirugía convencional o inclusión en lista de trasplante cardíaco5. Las referencias bibliográficas mayoritariamente provienen del extranjero6, siendo escasas las nacionales7, y nos muestran que el implante de bioprótesis pulmonar es su reoperación más común, quedando por definir el momento exacto para operar y el sustituto valvular8 ideal. Estas reoperaciones consiguen mejoría clínica con baja MH.
El objetivo del presente trabajo es estudiar las reoperaciones con circulación extracorpórea requeridas por los adultos con SF operada que se siguen en nuestra UCCA. Analizamos nuestros resultados posquirúrgicos, comparándolos con la bibliografía publicada.
Material y métodosEn nuestra UCCA actualmente se sigue a 3.776 pacientes, siendo SF 318. De este total, requirieron cirugía con circulación extracorpórea durante la vida adulta el 34%, ya sea reoperación en 84 pacientes (26%) con reparación completa previa, o bien reparación completa en 27 pacientes (8%) que estaban sin operar o solamente paliados9.
Presentamos a continuación una revisión retrospectiva de 90 reoperaciones en 84 adultos con SF operada, realizadas durante 23 años (desde noviembre de 1991 hasta diciembre del 2014). En la recolección de datos de nuestros pacientes se codificaron tanto el nombre, el número de historia clínica, el teléfono de contacto, como la fecha de nacimiento para no vulnerar la ley de protección de datos. Contamos con la aprobación del comité ético de nuestro hospital para la realización de este trabajo.
Población de estudioIncluimos casos con tetralogía de Fallot, doble salida del VD tipo Fallot, estenosis pulmonar más CIV y atresia pulmonar con CIV y 6.° arco presente (buenas ramas pulmonares confluentes), que precisan técnicas quirúrgicas similares. Excluimos a pacientes con canal aurículo-ventricular asociado y atresias pulmonares con CIV y sin 6.° arco que reciben flujo pulmonar desde grandes colaterales aorto-pulmonares, porque estos casos requieren diferentes técnicas quirúrgicas. El anexo muestra las variables estudiadas.
Indicaciones quirúrgicas para la reintervención de adultos con situación de FallotNuestras indicaciones siguen las recomendaciones de las sociedades cardiológicas americana10, canadiense11 y europea12 (tabla 1). Nos basamos en la repercusión clínica de las lesiones y también consideramos su repercusión funcional en el tiempo para indicar una reoperación.
Resumen de nuestras indicaciones quirúrgicas según las guías clínicas de manejo de adultos con cardiopatía congénita de las sociedades cardiológicas americana, canadiense y europea
| Tipo de indicación-nivel de evidencia | Indicación de reintervención |
|---|---|
| I-B | DAI como prevención secundaria tras episodio de muerte súbita resucitada |
| I-C | RVP por IP severa sintomática y/o estenosis severa con PSVD > 60mmHg RVAo por IAo severa sintomática o con disfunción ventricular izquierda La cirugía de estos pacientes debe ser realizada por cirujanos con experiencia en cardiopatías congénitas |
| IIa-B | DAI como prevención primaria en pacientes seleccionados de alto riesgo de arritmias ventriculares malignas |
| IIa-C | RVP por IP severa asintomática y/o estenosis severa más alguno de los siguientes: progresiva dilatación/disfunción de VD, deterioro de grado funcional en ergometría, IT progresiva, PSVD > 80mmHg, arritmias auriculares o ventriculares sostenidas Cierre de CIV residual hemodinámicamente significativa con QP/QS > 1,5 o si hay indicación de cirugía a nivel pulmonar Recambio de raíz aórtica o de aorta ascendente si diámetro > 55mm Combinación de varias lesiones (p. ej., CIV y/o doble lesión pulmonar moderada, que causen síntomas o dilatación/disfunción del VD) |
CIV: comunicación interventricular; DAI: desfibrilador automático implantable; IAo: insuficiencia aórtica; IP: insuficiencia pulmonar; IT: insuficiencia tricúspide; PSVD: presión sistólica estimada en ventrículo derecho; RVAo: recambio valvular aórtico; RVP: recambio valvular pulmonar; VD: ventrículo derecho.
La cirugía más frecuente en estos pacientes, como veremos más adelante, es la sustitución valvular pulmonar. Una bioprótesis implantada según las recomendaciones de la clínica Mayo13 es nuestro sustituto valvular pulmonar de elección. Tras una incisión longitudinal entre el VD y la AP, explantamos el parche previo, asegurando una correcta salida hacia las ramas pulmonares. Suturamos una bioprótesis con stent porcina de manera ortotópica sobre el teórico anillo valvular pulmonar, techando posteriormente dicha apertura con un parche de vena yugular bovina.
Definición de mortalidad y eventos del seguimientoLlamamos MH a cualquier muerte ocurrida en los 30 días poscirugía o durante la hospitalización posquirúrgica y si esta ocurre posteriormente la llamamos mortalidad tardía. Consideramos fin de seguimiento en cada paciente si este fallece o vive en la última revisión. Una bioprótesis pulmonar disfunciona si tiene gradientes ecocardiográficos medios superiores a 40mmHg y/o presenta insuficiencia severa, y esta falla cuando su disfunción condiciona un nuevo implante quirúrgico o percutáneo.
Estudio estadísticoHemos realizado el análisis con el paquete estadístico SPSS-15.0 para Windows. Presentamos las variables cuantitativas como media±desviación estándar si la distribución es normal o como mediana con rango intercuartílico si no lo es, y las variables cualitativas como porcentajes. Hacemos la comparación de medias entre variables cuantitativas con t de Student o test de Wilcoxon, y comparamos las variables cualitativas con test de la chi al cuadrado o de Fisher, según precise cada caso. Mostramos un análisis univariable de factores de riesgo de morbimortalidad hospitalaria. Las curvas de supervivencia actuarial y de libertad de reintervención siguen el método de Kaplan-Meier. Comparamos las variables de cardiorresonancia pre y postoperatorias con la prueba t de Student para datos pareados. Consideramos significativo un valor p inferior a 0,05.
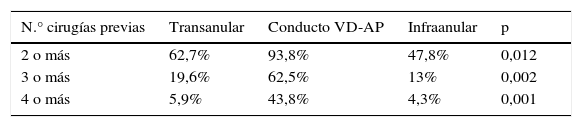
ResultadosLa edad media de nuestros pacientes es 33±10 años (rango: 18-61), el peso medio 65±14kg y el 59% son varones. La edad mediana en su reparación completa fue de 6 años (RIC: 3-9), resolviéndose la estenosis pulmonar con parche transanular en 51 casos (56,7%), parche infraanular en 23 (25,6%) y conducto VD-AP en 16 (17,8%). El número medio de cirugías previas por paciente fue 2±1 (rango: 1-5), con fístula sistémico-pulmonar paliativa en el 54,5%. Los pacientes portadores de conducto VD-AP significativamente tenían más cirugías previas comparados con las otras técnicas (p<0,01, tabla 2). El intervalo temporal medio entre reparación completa y reoperación fue de 25±10 años.
Relación entre el número de cirugías previas y el tipo de conexión entre el ventrículo derecho y la arteria pulmonar realizadas en la reparación completa inicial
| N.° cirugías previas | Transanular | Conducto VD-AP | Infraanular | p |
|---|---|---|---|---|
| 2 o más | 62,7% | 93,8% | 47,8% | 0,012 |
| 3 o más | 19,6% | 62,5% | 13% | 0,002 |
| 4 o más | 5,9% | 43,8% | 4,3% | 0,001 |
Los datos se expresan como porcentajes de pacientes según tengan respectivamente 2, 3, 4 o más cirugías previas.
Conducto VD-AP: conducto entre el ventrículo derecho y la arteria pulmonar; N.°: número; p: significación estadística.
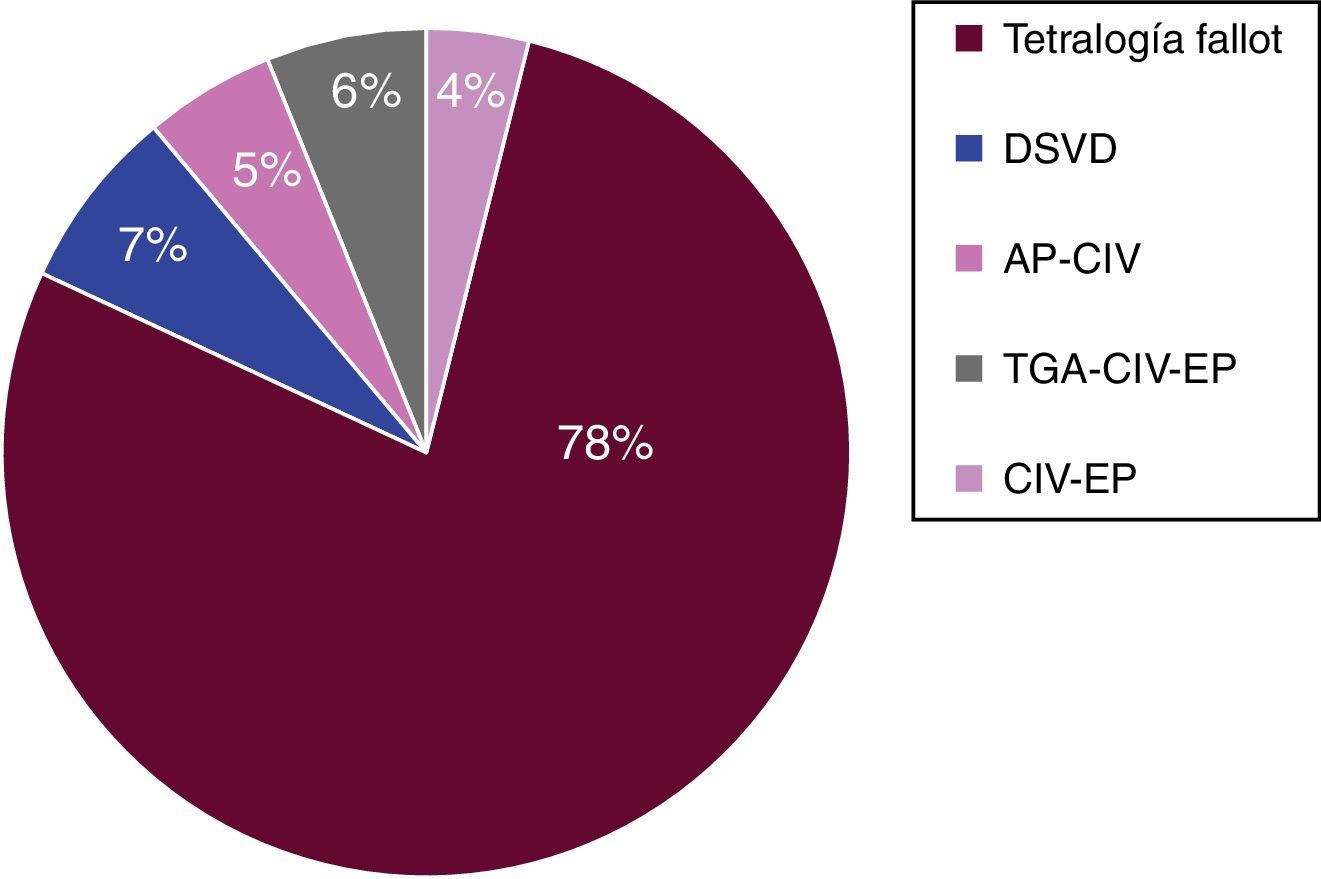
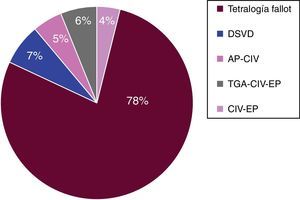
El diagnóstico preoperatorio (fig. 1) en 78% de los casos corresponde a tetralogía de Fallot. Encontramos diversas anomalías asociadas (anexo), destacando los defectos septales residuales seguidos de insuficiencia aórtica severa.
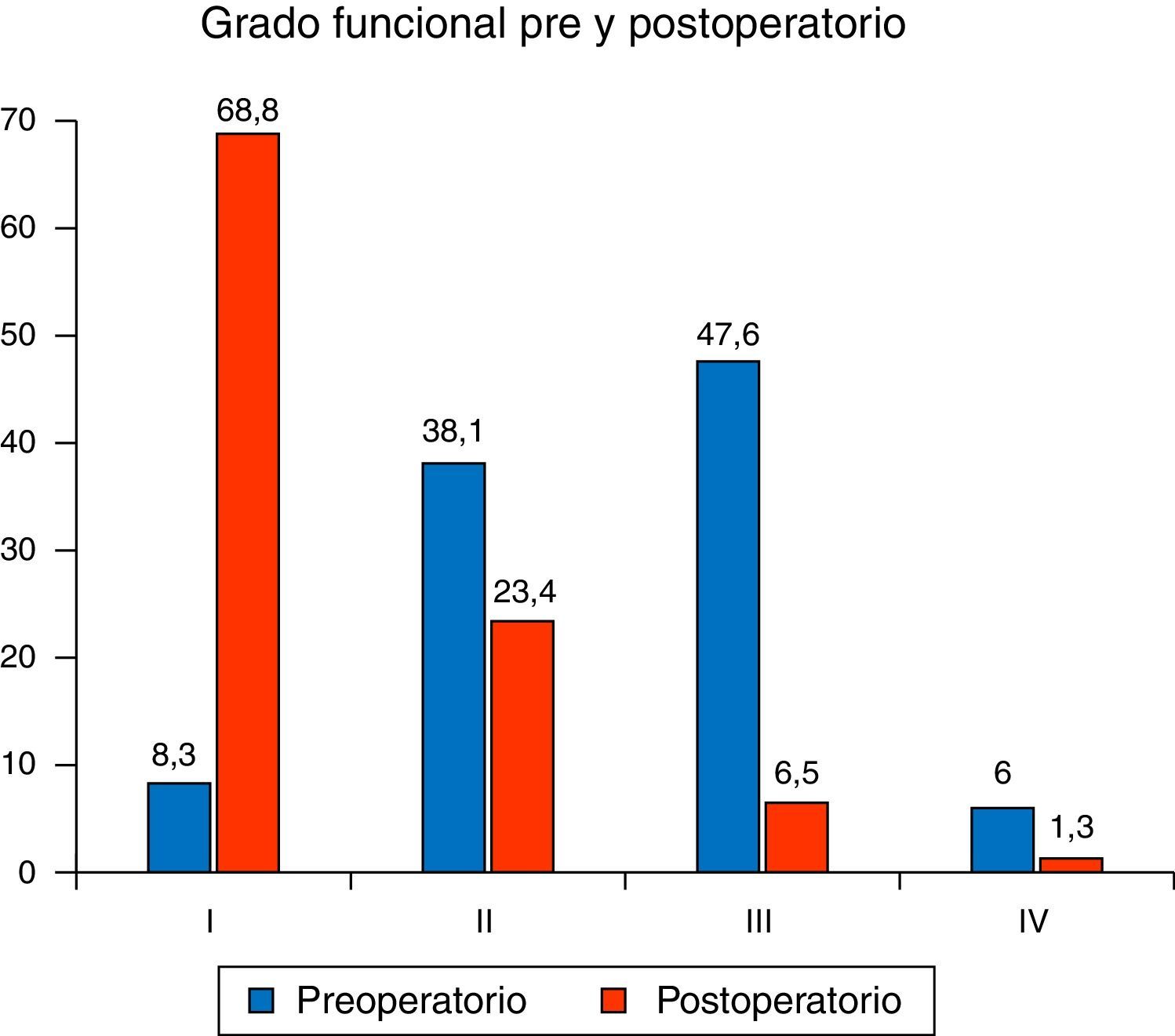
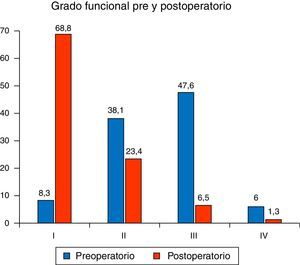
Clínicamente, suelen referir disnea de esfuerzo, estando 40 pacientes (47,6%) en grado funcional iii de la escala NYHA, 32 (38,1%) en grado funcional ii, y en grado funcional iv 5 (6%). Presentaron arritmia 39 pacientes (45%), siendo esta generalmente supraventricular.
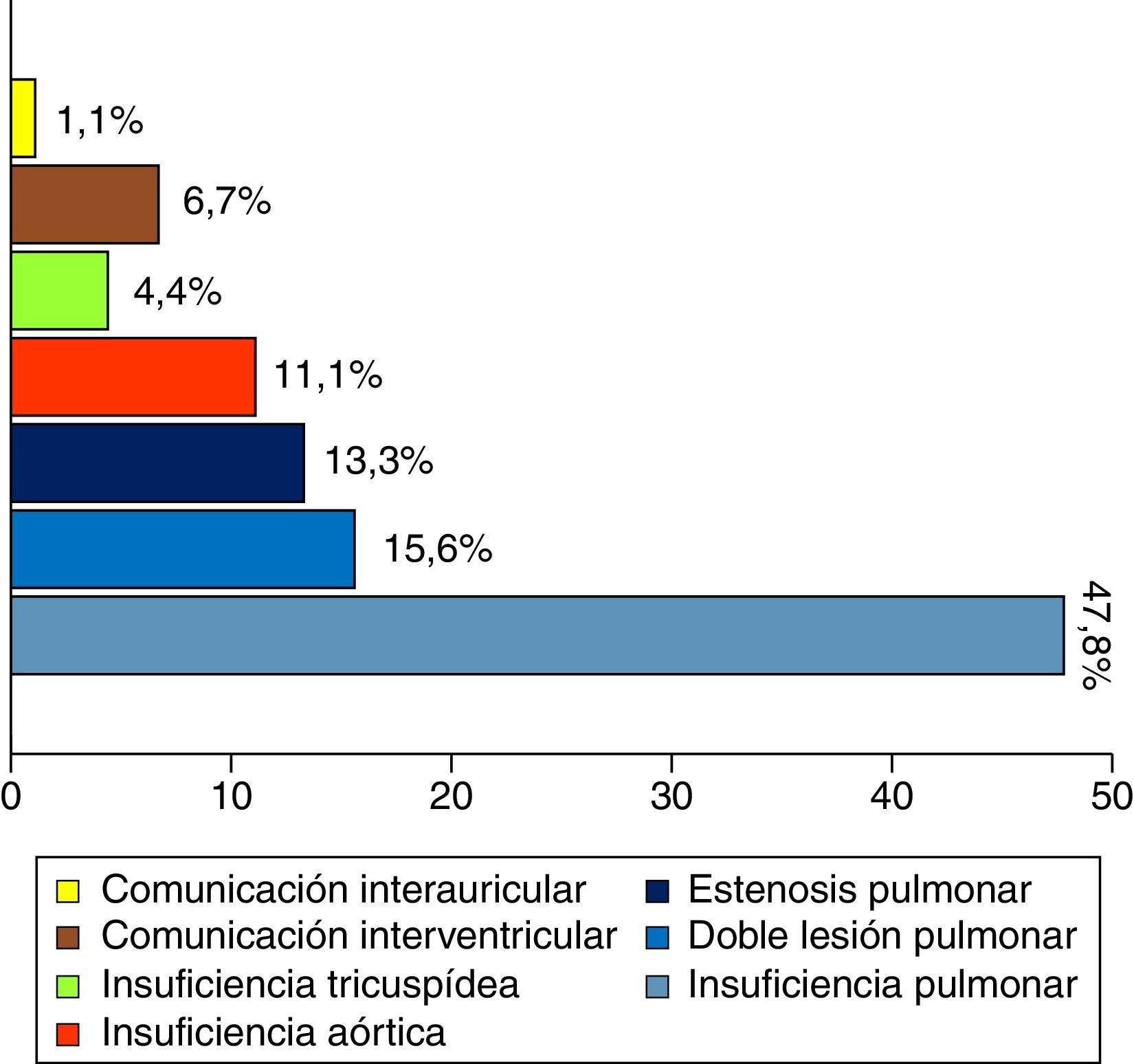
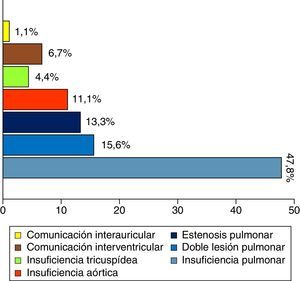
La indicación quirúrgica principal de reintervención (fig. 2) se asoció a patología de la válvula pulmonar en 69 pacientes (76,7%): la insuficiencia estaba relacionada con parche transanular (36 de 43 pacientes) o infraanular previo, y la estenosis con conducto VD-AP previo (11 de 12 pacientes).
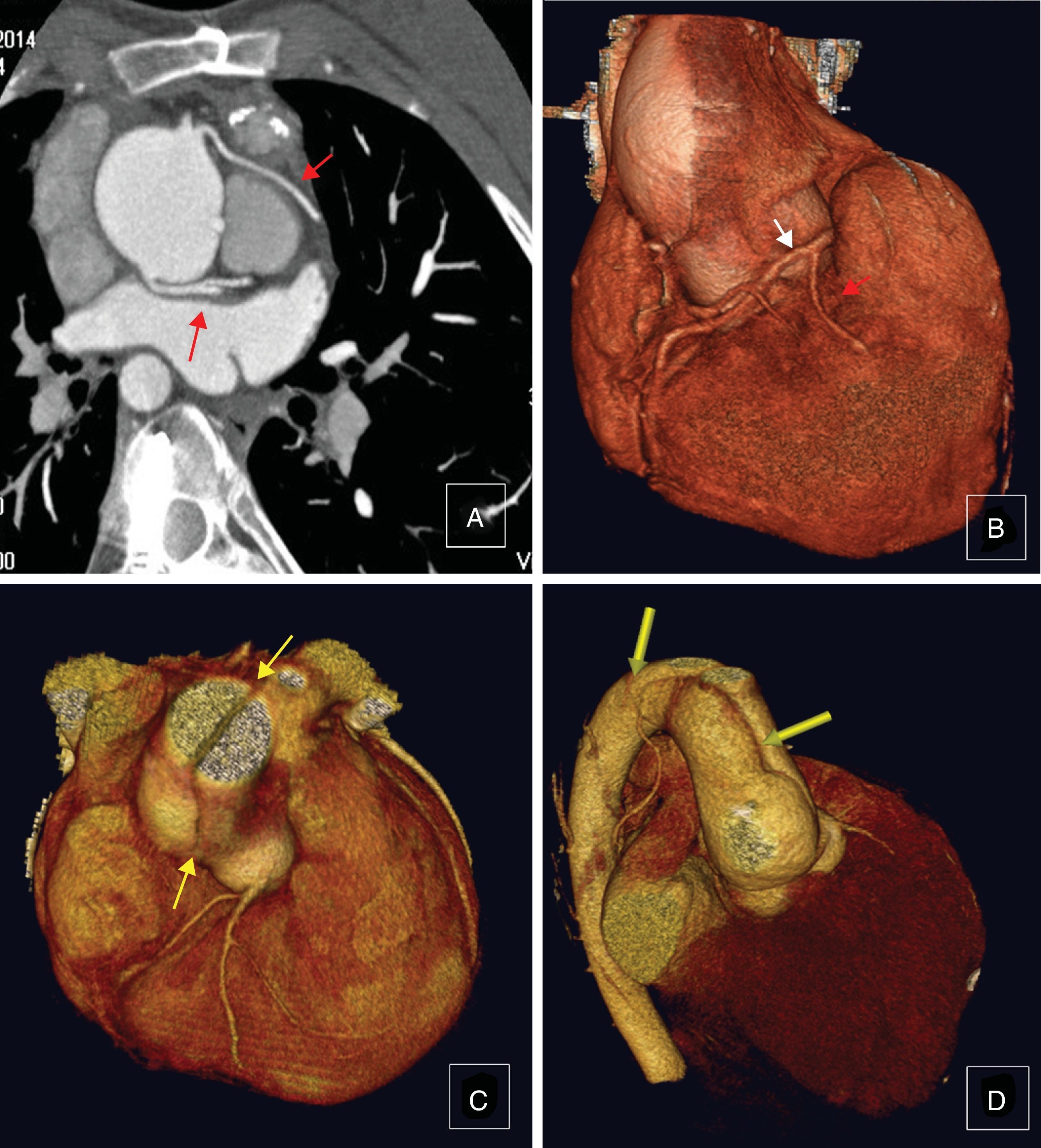
Todos los pacientes se estudiaron con ecocardiografía, 72 (80%) con cateterismo y 61 (67,8%) con resonancia magnética, empleada rutinariamente desde el año 2005. Utilizamos la tomografía computarizada cuando está contraindicada la resonancia (fig. 3). De acuerdo con su indicación quirúrgica (tabla 3), en estos pacientes predomina la insuficiencia pulmonar, el 32% asocia insuficiencia tricuspídea y el VD suele estar dilatado y disfuncionante, mientras que el ventrículo izquierdo se contrae bien.
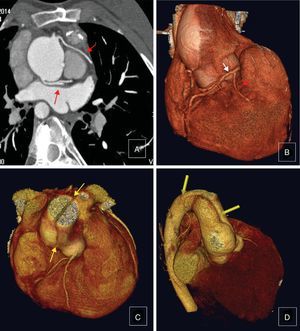
Tomografía computarizada en adultos con situación Fallot reparada. A) Corte sagital mostrando descendente anterior anómala que sale del ostium coronario derecho y pasa anteriormente al infundíbulo del VD (flecha). B) Reconstrucción tridimensional observándose arteria coronaria derecha (flecha blanca) con rama conal grande (flecha roja) próxima al parche transanular. C-D) Reconstrucción tridimensional de disección aórtica tipo A.
Resultados de las pruebas complementarias preoperatorias en los adultos con situación Fallot operada que requirieron nueva operación
| Ecocardiograma (90 pacientes) | Cateterismo (72 pacientes) | Resonancia magnética (61 pacientes) | |
|---|---|---|---|
| Gradiente VD-AP | 34±33mmHg | 28±29mmHg | |
| Insuficiencia pulmonar | No 5,9% Leve 21,2% Moderada 16,5% Severa 56,5% | No 13,6% Leve 22,7% Moderada 10,6% Severa 53% | FRP 44±22% |
| Ventrículo derecho | Normal 34,9% Disf. leve 20,9% Disf. moderada 36% Disf. severa 8,1% | VTDVD 171±55ml/m2 VTSVD 101±37ml/m2 FEVD 41±10% | |
| Ventrículo izquierdo | Normal 77,9% Disf. leve 16,3% Disf. moderada 3,5% Disf. severa 2,3% | FEVI 55±10% | |
| Insuficiencia tricúspide | No 23,5% Leve 45,9% Moderada 12,9% Severa 17,6% | No 39,7% Leve 36,5% Moderada 4,8% Severa 19% | No 34,7% Leve 32,7% Moderada 12,2% Severa 20,4% |
Los valores marcados en negrita se citan en el texto, por ser los más significativos en la patología de estos pacientes.
Disf.: disfunción; FEVD: fracción de eyección del ventrículo derecho; FEVI: fracción de eyección del ventrículo izquierdo; FRP: fracción de regurgitación pulmonar; Gradiente VD-AP: gradiente ventrículo derecho-arteria pulmonar; VTDVD: volumen telediastólico del ventrículo derecho, VTSVD: volumen telesistólico del ventrículo derecho.
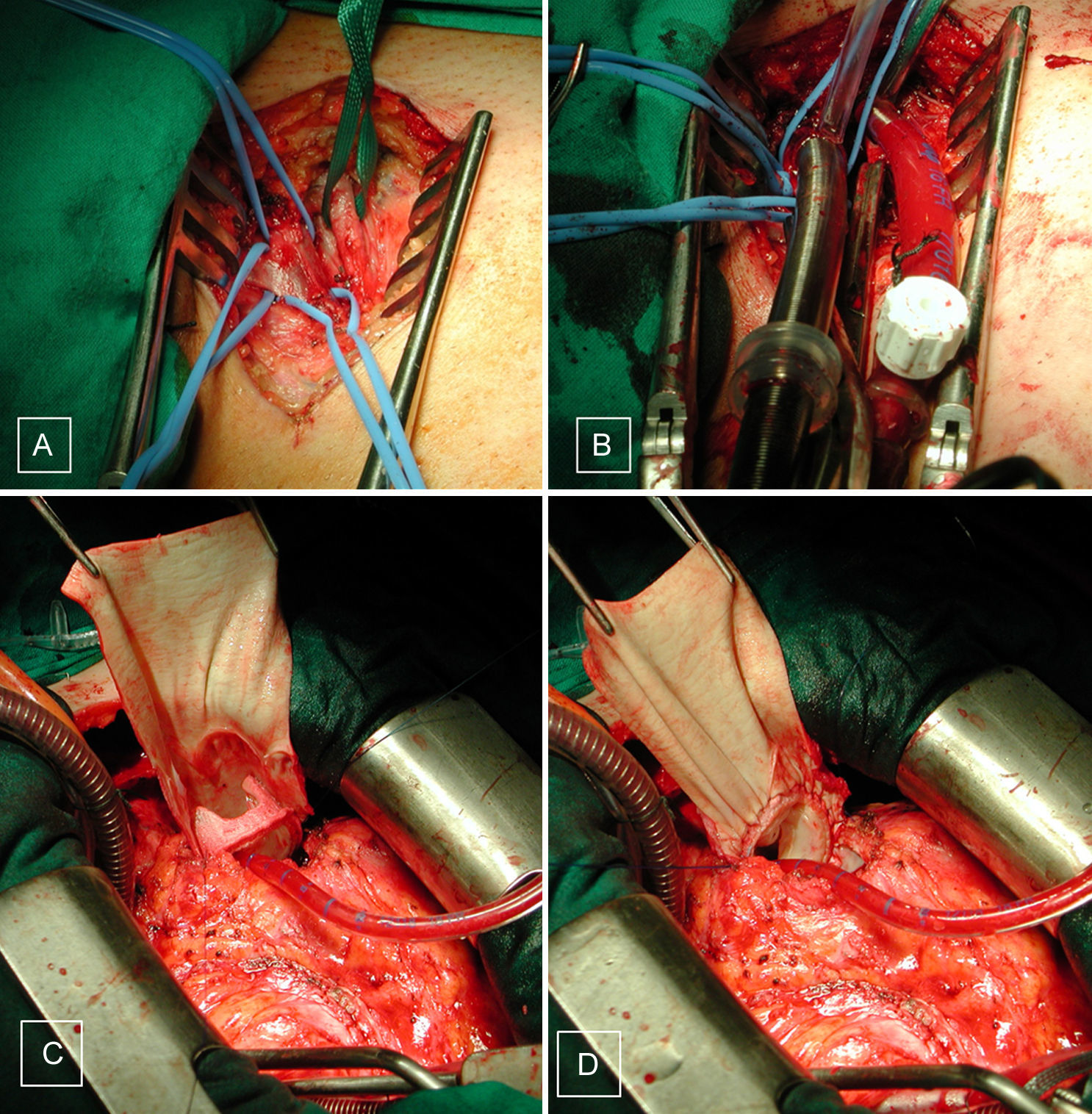
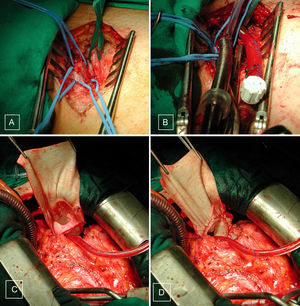
Las reesternotomías requirieron circulación extracorpórea e hipotermia moderada. La canulación fue central de aorta y bicava en el 55% y periférica en el 45% restante para minimizar una posible injuria cardíaca asociada a la reapertura esternal (fig. 4), individualizándose esta decisión en cada paciente según el grado de dilatación del VD y sus adherencias con la pared torácica. En 31 pacientes (34%) sin defecto septal residual en los que solamente había que trabajar en las cavidades cardíacas derechas, operamos con el corazón latiendo para evitar la isquemia miocárdica y los 59 restantes (66%) requirieron pinzado aórtico y parada cardíaca. Los tiempos medios de circulación extracorpórea y pinzamiento aórtico fueron 175±91 y 63±65 min, respectivamente.
Imágenes intraoperatorias de disección inguinal izquierda (A), con vena medial y arteria lateral, posteriormente con las cánulas colocadas en dichos vasos (B), para iniciar la circulación extracorpórea. Interposición de bioprótesis pulmonar (C), con techo de vena yugular bovina (D).
La conexión VD-AP no se tocó en 17 pacientes (18,9%); se interpuso una bioprótesis pulmonar en 62 pacientes (68,9%). En los 11 pacientes restantes (12,2%) se realizó otra conexión como interposición de conducto valvulado en 7 y parches infra/transanular en 4. El tamaño de las bioprótesis más frecuentemente implantadas fue 27 y 29mm. Recibieron bioprótesis pulmonar aislada 20 pacientes (22,2%).
La insuficiencia valvular aórtica en 17 pacientes (18,9%) requirió intervención: 15 recibieron prótesis mecánica (asociada con cirugía de Bentall-DeBono en uno y con conducto supracoronario en 3) y en los 2 casos restantes hicimos una plastia valvular (asociada con reparación de seno de Valsalva roto en uno).
Requirieron cirugía tricuspídea 23 pacientes (25,5%): la mayoría (19) recibieron anuloplastia (de Vega en 10, anillo protésico en 9) y los otros 4 con su válvula no susceptible de arreglo precisaron sustitución por una bioprótesis.
Hasta un 45 pacientes (50%) tenían cortocircuito residual auricular (27) y/o ventricular (25), que se cerró quirúrgicamente con parche o puntos sueltos. En el anexo detallamos otras cirugías asociadas.
La MH fue del 4,4% (tabla 4). No falleció ningún paciente con bioprótesis pulmonar aislada ni ningún portador de conducto VD-AP disfuncionante. Aparecieron complicaciones en 37 pacientes (42,5%), destacando entre todas la arritmia supraventricular. Las medianas de tiempo de intubación fueron 10 h (RIC: 6-20), de estancia en reanimación 3 días (RIC: 2-5), y de estancia hospitalaria posquirúrgica total 12 días (RIC: 8-15).
Mortalidad y morbilidad hospitalarias tras la reintervención en adultos con situación Fallot
| N.° paciente y cirugía realizada | Mortalidad hospitalaria: día postoperatorio y causa | N.° paciente y cirugía realizada | Mortalidad hospitalaria: día postoperatorio y causa |
|---|---|---|---|
| 1) cambio conducto VD-AP+cierre CIV+recambio valvular aórtico | día +1: fallo multiorgánico | 3) 5.ª reoperación para doble recambio valvular pulmonar y mitral+plastia tricuspídea | día +68: fallo multiorgánico |
| 2) cierre CIA+recambio valvular pulmonar | día +1: IAM masivo debido a compresión coronaria por el stent de la bioprótesis | 4) Bentall y cierre CIV | día +6: enclavamiento cerebral |
| Morbilidad hospitalaria | N.° pacientes | Morbilidad hospitalaria | N.° pacientes |
|---|---|---|---|
| Arritmia | 11 | Implante DAI | 2 |
| Infecciosa | 9 | IAM | 2 |
| Neurológica | 5 | Parálisis frénica | 1 |
| Reoperación | 7 5 sangrado, 1 mediastinitis, 1 infección superficial de la esternotomía | Insuficiencia mitral moderada | 1 |
| Fallo renal agudo | 4 | Sd. compartimental MII | 1 |
| Neumotórax | 4 | Linforragia inguinal | 2 |
CIA: comunicación interauricular; CIV: comunicación interventricular; DAI: desfibrilador automático implantable; IAM: infarto agudo de miocardio, N.°: número; MII: miembro inferior izquierdo; Sd.: síndrome; VD-AP: ventrículo derecho-arteria pulmonar.
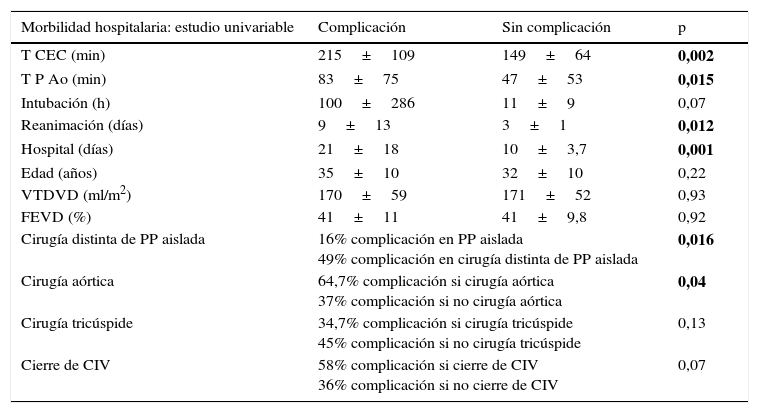
Los tiempos prolongados de circulación extracorpórea (p = 0,03) y las complicaciones del postoperatorio inmediato (p = 0,03) fueron los únicos factores de riesgo de MH que encontramos en el estudio univariable. La morbilidad hospitalaria se relaciona significativamente con los tiempos quirúrgicos prolongados (p<0,02), la cirugía distinta del implante de prótesis pulmonar aislada (p = 0,016), la cirugía aórtica (p = 0,04) y la estancia posquirúrgica prolongada (p<0,001) en el estudio univariable (tabla 5).
Morbilidad hospitalaria tras la reintervención en adultos con situación Fallot
| Morbilidad hospitalaria: estudio univariable | Complicación | Sin complicación | p |
|---|---|---|---|
| T CEC (min) | 215±109 | 149±64 | 0,002 |
| T P Ao (min) | 83±75 | 47±53 | 0,015 |
| Intubación (h) | 100±286 | 11±9 | 0,07 |
| Reanimación (días) | 9±13 | 3±1 | 0,012 |
| Hospital (días) | 21±18 | 10±3,7 | 0,001 |
| Edad (años) | 35±10 | 32±10 | 0,22 |
| VTDVD (ml/m2) | 170±59 | 171±52 | 0,93 |
| FEVD (%) | 41±11 | 41±9,8 | 0,92 |
| Cirugía distinta de PP aislada | 16% complicación en PP aislada 49% complicación en cirugía distinta de PP aislada | 0,016 | |
| Cirugía aórtica | 64,7% complicación si cirugía aórtica 37% complicación si no cirugía aórtica | 0,04 | |
| Cirugía tricúspide | 34,7% complicación si cirugía tricúspide 45% complicación si no cirugía tricúspide | 0,13 | |
| Cierre de CIV | 58% complicación si cierre de CIV 36% complicación si no cierre de CIV | 0,07 | |
Se muestran distintas variables y en la columna de la derecha el valor p de significación estadística.
Las 8 primeras variables están expresadas en media ± desviación estándar, y las 4 últimas en porcentajes.
En negrita aparecen marcados los valores de p con significación estadística.
CIV: comunicación interventricular; FEVD: fracción de eyección del ventrículo derecho; PP: prótesis pulmonar; T CEC: tiempo de circulación extracorpórea; T P Ao: tiempo de pinzado aórtico; VTDVD: volumen telediastólico del ventrículo derecho.
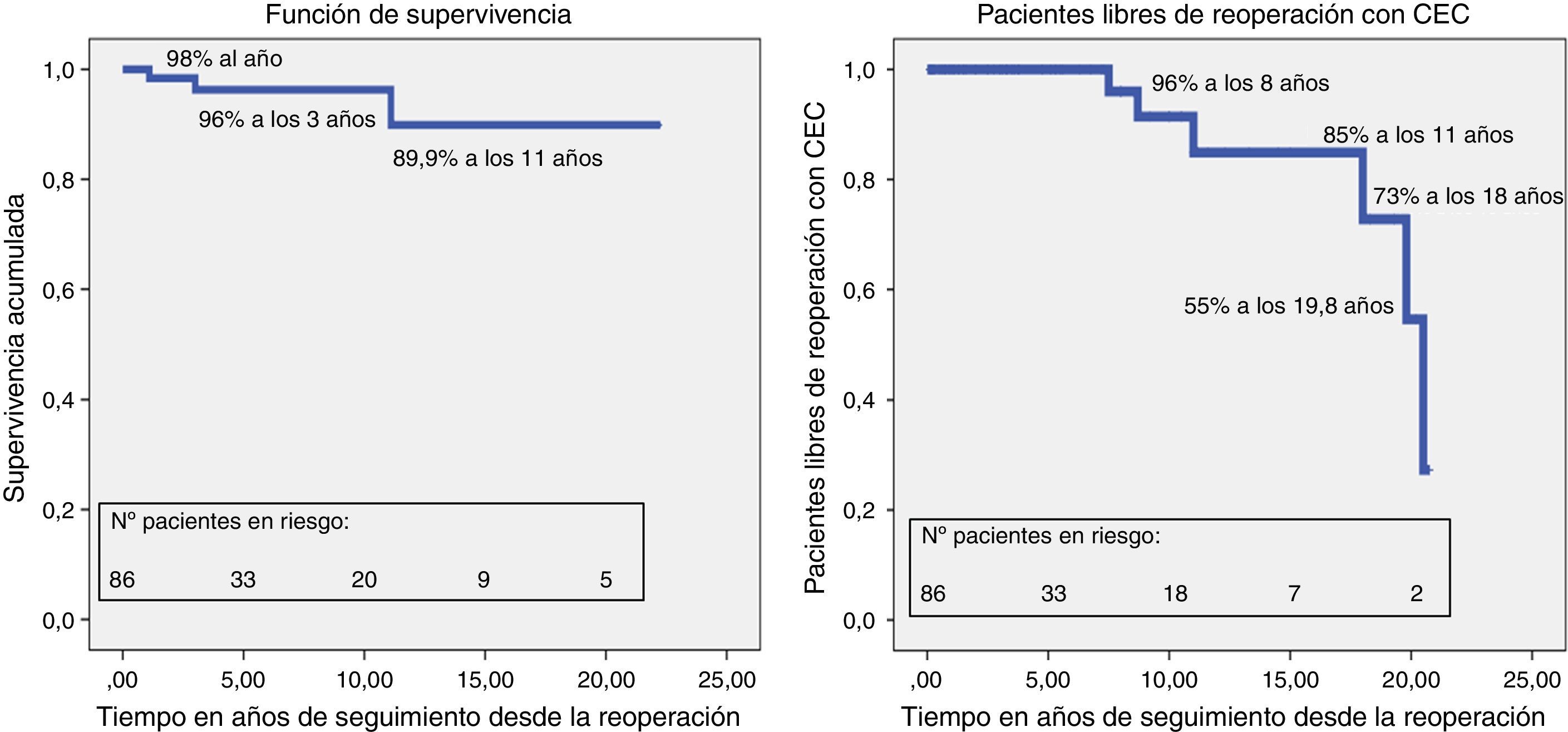
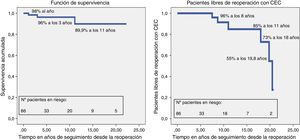
El seguimiento medio de los pacientes es 5,9±6,2 años (rango: 0,1-23 años) y está completo en el 97,8% (2 pacientes perdidos). Tres pacientes fallecieron tardíamente: uno por muerte súbita, otro por una hemorragia cerebral fatal y la última paciente falleció tras una nueva reintervención (incluida previamente en la mortalidad hospitalaria). La curva de supervivencia (excluyendo la MH) muestra que pasados 1 y 11 años tras la reoperación, el 98 y el 89,9% de estos pacientes sobreviven, respectivamente (fig. 5).
Doce pacientes (14%) se reoperaron nuevamente durante el seguimiento: 6 requirieron circulación extracorpórea y están incluidos en este estudio como nuevas reoperaciones, y los 6 restantes precisaron cirugías cerradas relacionadas con marcapasos y/o desfibrilador. Al cabo de 8, 11 y 18 años están libres de una nueva reoperación con circulación extracorpórea el 96, el 85% y el 73% de los pacientes, respectivamente.
Nueve pacientes (10,6%) precisaron procedimientos percutáneos durante el seguimiento: 3 de carácter hemodinámico con angioplastia sobre ramas pulmonares y 6 ablación percutánea de arritmias supraventriculares.
Tres pacientes (3,4%) presentaron endocarditis derecha en el seguimiento: uno sobre desfibrilador requiriendo explante del mismo, otro tuvo endocarditis candidiásica de bioprótesis pulmonar tratada farmacológicamente, pero falleció meses después por una hemorragia cerebral, y el tercero tuvo endocarditis de su bioprótesis pulmonar, tratándose medicamente, con buena evolución clínica.
En la última revisión, el 82,3% de los pacientes mantienen ritmo sinusal y la mayoría está en grado funcional i (53 pacientes, 68,8%). La figura 6 muestra la mejoría clínica asociada a nuestras reoperaciones.
El último ecocardiograma del seguimiento muestra un gradiente medio de 12±9mmHg, la mayoría (87,3%) no tienen insuficiencia pulmonar o esta es leve, el VD tiene buena contractilidad en el 46,8% y disfunción leve en el 26,6%, y la válvula tricúspide es competente en el 84,8%. Solo una de las 62 bioprótesis implantadas está disfuncionante (insuficiencia severa postendocarditis) y el resto sigue normofuncionante.
Sobreviven 22 de los 23 pacientes con cirugía tricuspídea, 21 de ellos disminuyeron su insuficiencia (sin diferencias significativas entre las distintas plastias ni con la bioprótesis).
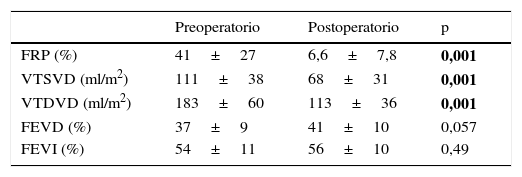
Durante el seguimiento, en 31 pacientes (43%) se hizo cardiorresonancia de control. La tabla 6 muestra la repercusión que tiene sobre el VD el implante de una bioprótesis pulmonar, objetivándose disminución de la insuficiencia pulmonar y reducción de los volúmenes del VD significativas, aunque la contractilidad biventricular no se modifique.
Datos correlacionados de 23 pacientes con implante de bioprótesis pulmonar y resonancia magnética pre y postoperatoria
| Preoperatorio | Postoperatorio | p | |
|---|---|---|---|
| FRP (%) | 41±27 | 6,6±7,8 | 0,001 |
| VTSVD (ml/m2) | 111±38 | 68±31 | 0,001 |
| VTDVD (ml/m2) | 183±60 | 113±36 | 0,001 |
| FEVD (%) | 37±9 | 41±10 | 0,057 |
| FEVI (%) | 54±11 | 56±10 | 0,49 |
En las columnas desde la izquierda hasta la derecha se consignan, respectivamente, los valores preoperatorios, postoperatorios y el valor p de significación estadística, que resulta de la comparación de los valores anteriores.
En negrita aparecen marcados los valores de p con significación estadística.
FEVD: fracción de eyección del ventrículo derecho; FEVI: fracción de eyección del ventrículo izquierdo; FRP: fracción de regurgitación pulmonar; VTDVD: volumen telediastólico del ventrículo derecho; VTSVD: volumen telesistólico del ventrículo derecho.
Nuestros adultos con SF operados durante su niñez sobrevivieron a las primeras reparaciones completas realizadas en nuestro país. Habitualmente, presentan grandes ventriculotomías e insuficiencia pulmonar severa como secuelas asociadas al parche transanular. Sus indicaciones más frecuentes de reintervención (76,7%) se relacionan con la patología valvular pulmonar en consonancia con otras publicaciones14. Nuestra segunda causa de reintervención es la patología valvular aórtica (11,1%), seguida por los defectos septales residuales (7,8%) y la patología tricúspide (4,4%).
La insuficiencia pulmonar, aunque se tolera clínicamente bien durante muchos años, sobrecarga de volumen al VD, que primero se dilata y finalmente deteriora su contractilidad. Entonces aparece la clínica, acompañada de disfunción ventricular izquierda si además se altera la sincronía biventricular.
El recambio valvular pulmonar para tratar una insuficiencia pulmonar severa en un paciente sintomático y/o con progresiva dilatación o disfunción del VD es indudable. El momento ideal de hacerlo en los asintomáticos no está claro15. Las guías clínicas valoran principalmente para indicar una reintervención el deterioro clínico y/o las arritmias relacionadas con la insuficiencia pulmonar. En pacientes asintomáticos importa más el progresivo deterioro del VD medido con resonancias seriadas que los valores absolutos16, la insuficiencia tricúspide progresiva y la existencia de otras lesiones residuales que requieran cirugía.
Respecto al sustituto valvular pulmonar de elección, aunque todos los que actualmente existen en el mercado tienen duración limitada y precisan reoperaciones, parece haber consenso internacional hacia los biológicos. Los homoinjertos no precisan anticoagulación, su hemodinamia inicial es excelente y en jóvenes asocian una degeneración precoz que acorta su durabilidad17. Las bioprótesis no requieren anticoagulación permanente, su duración a 20 años supera el 80%18 y permiten hacer intervencionismo a su través. Las prótesis mecánicas exigen siempre una óptima anticoagulación, dificultan o imposibilitan los procedimientos hemodinámicos a su través y en posición pulmonar no duran más que las bioprótesis19.
La prótesis pulmonar percutánea es un abordaje complementario a la cirugía prometedor, aunque actualmente no similar, puesto que tiene que demostrar una durabilidad equiparable a esta. La experiencia reportada20 muestra escasas complicaciones periimplante haciendo coronariografía y pre-stent previos; en 2 años de seguimiento medio, hasta un 30% necesita otro nuevo procedimiento percutáneo o quirúrgico. Las complicaciones más frecuentes son las fracturas del stent, que producen gradientes elevados con disfunción protésica, necesidad de reintervenciones y endocarditis. Por todo esto, pensamos que debe individualizarse este implante percutáneo, indicándolo actualmente de manera colegiada en pacientes con prohibitivo riesgo quirúrgico.
El implante quirúrgico de una bioprótesis elimina la insuficiencia pulmonar y permite tratar las lesiones asociadas. Posteriormente, los síntomas mejoran, se reducen los volúmenes y la masa del VD en casi todos los pacientes, optimizándose el llenado ventricular izquierdo y la sincronía biventricular21. Esta reducción del VD se observa a partir de los 6 meses postimplante y se cuantifica con resonancia magnética, aunque su recuperación contráctil solo aparece operando en las fases iniciales de dilatación. Los jóvenes sintomáticos parecen beneficiarse más del recambio valvular pulmonar22 y también presentan mayor deterioro estructural del sustituto pulmonar, acortándose su durabilidad23. La bioprótesis pulmonar no parece modificar la incidencia de taquicardia ventricular ni muerte súbita a lo largo del seguimiento24, por lo que no hay evidencia de una mejor supervivencia posterior de estos pacientes.
Actualmente, se recomienda interponer la bioprótesis antes de que el fallo del VD sea irreversible. Varios estudios comparan el VD con cardiorresonancia pre y postinterposición de válvula pulmonar, intentando ajustar el momento idóneo para reoperar las SF, indicando volúmenes telediastólico y telesistólico inferiores a 170 y 90ml/m2, respectivamente. Otros calculan la fracción de eyección del VD ajustándola a las insuficiencias valvulares y cortocircuitos residuales (estos pacientes aumentan el gasto cardíaco para mantener un adecuado flujo pulmonar25), observándose siempre mejoría contráctil del VD tras la interposición de una válvula pulmonar.
Nuestra cirugía de recambio valvular pulmonar aislado tiene resultados óptimos, sin mortalidad hospitalaria. Tampoco falleció ningún paciente portador de conducto VD-AP a pesar del riesgo asociado que tienen por su mayor número de operaciones previas. Observamos importantes grados de dilatación del VD que precisaron una disección laboriosa de sus adherencias con canulación periférica previa, prolongando de esta manera los tiempos quirúrgicos y aumentando el riesgo de morbimortalidad hospitalaria. Recomendamos reoperar a estos pacientes porque mejoran clínicamente y el VD se reduce tras la bioprótesis pulmonar, aunque no siempre mejore su contractilidad. Consideramos la resonancia magnética como la prueba de imagen de elección para cuantificar la patología pulmonar y su repercusión sobre el VD, así como para optimizar las indicaciones quirúrgicas. Como sustituto valvular pulmonar elegimos la bioprótesis porcina con stent por su excelente duración a medio-largo plazo (normofuncionan 61 de 62 implantadas). Nuestra experiencia es mejor que otras publicadas26, probablemente por emplear grandes bioprótesis en lugar de homoinjertos y tener a pacientes mayores respecto a otras series que incluyen adolescentes27.
Las arritmias son la segunda complicación en frecuencia del adulto con SF operada siendo más prevalentes a partir de la quinta década. Generalmente, se trata de taquicardias supraventriculares originadas por reentrada en el 30% y ventriculares en el 10% de los pacientes, causando con frecuencia muerte súbita28. Las arritmias ventriculares se relacionan con las cirugías previas, la anchura del QRS, el VD hipertrófico29 y la disfunción ventricular. Igualmente, nuestra experiencia (963 adultos, 23% de ellos son SF) indica que la disfunción del ventrículo sistémico es el principal factor de riesgo de muerte súbita durante el seguimiento30.
Mongeon et al. revisan a 474 adultos operados de SF31 y observan que tanto la prevalencia de dilatación de raíz aórtica, como de insuficiencia aórtica moderada o severa, son bajas. La insuficiencia aórtica significativa sobrecarga de volumen y dilata progresivamente el ventrículo izquierdo, con disfunción en fase final. Influyen en su fisiopatología el fallo de coaptación central asociado a una dilatación anular, el prolapso de algún velo e incluso la rotura de un seno de Valsalva aneurismático. Si la insuficiencia aórtica precisa cirugía, en seleccionados casos se reparará la válvula, aunque la mayoría requerirá sustitución por una prótesis mecánica que garantiza un funcionamiento óptimo y duradero, aunque necesitando anticoagulación indefinida. Cuando existe indicación de recambiar la raíz aórtica completa con reimplante coronario32, empleamos la técnica de Bentall-DeBono si también hay que sustituir la válvula aórtica y, excepcionalmente, conservamos la válvula según la técnica de David. En los pacientes con aorta ascendente aneurismática (diámetro mayor de 55mm) y raíz aórtica no patológica suele bastar con el implante de un tubo supracoronario.
Nuestra experiencia confirma que la patología aórtica en las reoperaciones de adultos con SF operada es poco frecuente, afectando al 5% de los pacientes seguidos en nuestras consultas. Dentro de estas reoperaciones, afectan a la válvula aórtica el 18,9% y el síndrome aórtico agudo es excepcional (1,1%). La mayoría de los pacientes recibieron una prótesis mecánica bivalva y en 4 de ellos también sustituimos la aorta ascendente. Dos de los 4 pacientes fallecidos hospitalariamente asociaban patología aórtica: aunque con estos escasos números no alcancemos significación estadística, la patología aórtica parece aumentar su riesgo quirúrgico, puesto que precisaron técnicas quirúrgicas más complejas que prolongaron los tiempos de circulación extracorpórea y de pinzado aórtico.
La insuficiencia tricuspíde aparece hasta en el 30% de los pacientes operados de Fallot y tiene origen multifactorial: la dilatación anular asociada a la del VD produce mala coaptación de los velos e insuficiencia central; además, puede existir patología intrínseca secundaria a velos displásicos, rotos o retraídos por iatrogenia previa, alterando su correcta movilidad. Actuamos sobre esta válvula si la insuficiencia es moderada o severa, ya que los grados menores se consideran funcionales y mejoran solamente con valvular la pulmonar33, y siempre antes de que aparezca disfunción del VD para minimizar los riesgos asociados a la reintervención. La reparación valvular con anuloplastia suele ser suficiente. En los raros casos con válvula no reparable, esta será sustituida por una bioprótesis.
Nuestros resultados en los pacientes con SF y cirugía tricuspídea asociada son buenos, ya que prácticamente en todos disminuye la severidad de su insuficiencia y esto se mantiene en el tiempo. El tipo de anuloplastia fue decisión individualizada del cirujano y no encontramos diferencias significativas entre las distintas técnicas empleadas.
La presencia de cortocircuitos residuales a nivel auricular o ventricular puede causar insuficiencia cardíaca congestiva por hiperaflujo pulmonar y aumento del trabajo cardíaco, embolias paradójicas o mayor riesgo de endocarditis. Por estos motivos, aunque el cortocircuito residual no sea la indicación principal de reintervención del adulto con SF; este debe cerrarse al mismo tiempo quirúrgico, siendo necesario pinzar la aorta y parar el corazón. La dificultad técnica aparece con las comunicaciones interventriculares de localizaciones atípicas, sobre parches previos calcificados. Una vez visualizados los defectos, se cerrarán directamente con puntos o parche desde la cavidad cardíaca más favorable.
Nuestra experiencia reoperando a estos adultos con SF es similar a la descrita en la literatura34: las reintervenciones son seguras con baja MH (4,4%), siendo realizadas por cirujanos especialistas en cardiopatías congénitas35. Existe una importante morbilidad en el postoperatorio inmediato (42,5%) que prolonga la hospitalización, aunque no suele asociar secuelas tardías36. La mayoría de los pacientes presentan insuficiencia o doble lesión pulmonar con repercusión hemodinámica y VD dilatado. A los 10 años, sobrevive el 96% y está libre de reintervención el 91%. Ciertamente, nuestras cirugías mejoran su calidad de vida, aunque solo el tiempo nos contestará si también mejoran su cantidad de vida.
ConclusionesLa SF operada tiene un magnífico pronóstico a largo plazo, aunque presenta una importante morbilidad secundaria. Actualmente, reoperamos al 26% de estos pacientes seguidos en nuestra UCCA, con resultados equiparables a los centros de referencia internacionales, que son: baja MH, mejoría clínica y reducción volumétrica del VD.
El implante de una bioprótesis pulmonar es su reoperación más frecuente, sin MH cuando este es aislado. La clínica es nuestro indicador fundamental para implantar una válvula pulmonar, seguida de la insuficiencia tricúspide y/o la dilatación del VD progresivas medidas por cardiorresonancia. La bioprótesis pulmonar debe implantarse antes de que aparezcan disfunción y excesiva dilatación del VD para minimizar la morbilidad hospitalaria. Debemos individualizar cada caso considerando que la prótesis pulmonar mejora la clínica y reduce el VD, aunque no siempre mejora su contractilidad ni podemos asegurar que prolongue la supervivencia posterior.
La patología aórtica de estos pacientes exige pinzado aórtico y parada cardíaca, requiere técnicas quirúrgicas más complejas y asocia una tendencia hacia una mayor morbimortalidad hospitalaria.
La insuficiencia tricúspide suele ser funcional y cuando requiere cirugía es mejor repararla que interponer una bioprótesis. Tanto la anuloplastia con anillo protésico como la técnica de de Vega ofrecen buenos resultados.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Fuente de financiaciónninguna
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.