En esta revisión presentamos una introducción a la cirugía de reparación robótica de la válvula mitral, sus indicaciones y contraindicaciones, y una visión detallada de la técnica quirúrgica que utilizamos. Además, queremos también compartir nuestra experiencia inicial, que actualmente se aproxima al centenar de casos. Finalmente, hemos buscado resumir el desarrollo de esta tecnología en cirugía cardíaca y la evidencia acumulada hasta ahora, aportando nuestra visión sobre este fascinante campo de la especialidad.
In this review, we present an introduction to robotic mitral repair surgery, its indications and contraindications, and a detailed description of our surgical technique. In addition, we wish to share our initial experience, now approaching a hundred cases. Finally, we also wanted to summarize the evolution of this technology in cardiac surgery and the evidence available, sharing our view on this fascinating field of our specialty.
La cirugía mitral mínimamente invasiva moderna (HeartPort® o PortAccess) comenzó a mediados de los 90 de la mano de avances técnicos en la canulación periférica para circulación extracorpórea (CEC), dispositivos de oclusión endoaórtica con balón e instrumentos específicamente diseñados, que permitieron a los cirujanos comenzar a realizar intervenciones mitrales a través de pequeñas toracotomías anterolaterales utilizando visualización toracoscópica1. La cirugía robótica se inició apenas unos años después y las primeras reparaciones mitrales con el sistema Da Vinci® (Intuitive Surgical, EE. UU.) fueron realizadas en Europa por Carpentier et al.2 y Mohr et al.3 en 1998. y posteriormente en el año 2000 se realizó la primera sustitución mitral en EE. UU. por Chitwood4. La cirugía mitral robótica se ha expandido con lentitud, aunque actualmente es el método quirúrgico preferido para la reparación mitral en muchos programas de amplia experiencia y alto volumen. La única plataforma robótica en uso clínico actualmente continúa siendo el sistema Da Vinci®, que actualmente se encuentra en su cuarta generación con los sistemas X y Xi. Ambos sistemas son capaces de realizar cirugía mitral y aportan algunas ventajas con respecto al modelo previo Si, que sin embargo sigue siendo preferido por algunos grupos para la cirugía coronaria.
En comparación con la cirugía toracoscópica, la telemanipulación robótica permite al cirujano recuperar gran parte de la destreza que se pierde por el uso de instrumentos toracoscópicos y proporciona una excelente visualización en 3D de alta definición con una magnificación de hasta 10×. Esta tecnología evita las palancas («fulcrum effect») inherentes al uso de instrumentos toracoscópicos convencionales, proporciona una precisión incomparable en el interior del tórax y recupera todos los grados de libertad de la mano humana con un rango de movimiento incluso mayor5. Otra gran ventaja en el campo de la cirugía mitral es la capacidad de utilizar de forma simultánea un tercer brazo robótico equipado con un retractor auricular dinámico específicamente diseñado. Este instrumento proporciona una excelente exposición de la válvula, adaptándose a la anatomía particular de cada paciente, y se controla con la misma precisión y destreza que el resto de instrumentos, sin interrumpir el flujo de trabajo. Al ser la exposición y visualización de la válvula y el aparato subvalvular excelente, todas las técnicas de reparación se pueden reproducir de forma robótica, incluidas las más complejas como el reposicionamiento de los músculos papilares o el «sliding plasty». Los resultados reportados por centros experimentados son excelentes, tanto en la tasa de reparación como en la incidencia de complicaciones postoperatorias. La cirugía mitral robótica ha demostrado una estancia hospitalaria y en la unidad de cuidados intensivos (UCI) más corta, una mejor calidad de vida posoperatoria y un mejor resultado estético en comparación con la cirugía convencional6,7.
Evaluación preoperatoriaComo todos los pacientes evaluados para reparación mitral, los candidatos a cirugía robótica deben someterse a una evaluación ecocardiográfica (transtorácica o transesofágica) de alta calidad para tener una buena comprensión de su valvulopatía que permita planificar la intervención necesaria y anticipar las complicaciones relacionadas con la técnica, como por ejemplo el riesgo de movimiento sistólico anterior.
La selección adecuada de los pacientes es fundamental para evitar complicaciones postoperatorias. Si bien existen pocas contraindicaciones absolutas, los antecedentes de cirugía torácica previa, radiación o traumatismo torácico en el lado derecho deben descartarse antes de la intervención y pueden contraindicar el abordaje robótico8–10. Recientemente estamos viendo problemas no anticipados por la presencia de adherencias pleuropulmonares densas en pacientes que han sufrido una infección por COVID-19, incluso en casos oligosintomáticos que nos han obligado a realizar una extensa disección de las adherencias o incluso a descartar el abordaje robótico. La cirugía robótica es también más compleja en pacientes con obesidad mórbida y en aquellos con cavidades torácicas pequeñas. Otros problemas anatómicos que pueden complicar la intervención son las deformidades torácicas como la escoliosis y el pectus excavatum, la parálisis frénica y la herniación intratorácica de vísceras abdominales.
La necesidad de canulación periférica para la CEC exige una evaluación exhaustiva del sistema vascular y un tamaño adecuado de los vasos femorales. Un examen físico detallado y angiografías preoperatorias por tomografía computarizada torácica, abdominal y pélvica son muy útiles para garantizar una operación segura. En nuestro centro actualmente realizamos este estudio de forma sistemática en todos los candidatos. La evaluación del sistema venoso en busca de signos de trombosis u oclusión (vena cava inferior interrumpida, presencia de filtros cava o compresión extrínseca) también se logra con estos exámenes. Una ventaja de esta estrategia es que permite evaluar la circulación coronaria en una gran proporción de pacientes, con lo que podemos limitar las coronariografías invasivas a aquellos casos en que no se puede descartar la presencia de lesiones coronarias relevantes o es necesaria para confirmar los hallazgos de la tomografía.
La cirugía robótica requiere ventilación unipulmonar en las fases iniciales y finales de la intervención. Esta maniobra provoca hipoxia e hipercapnia y aumento de la presión arterial pulmonar y de la postcarga del ventrículo derecho. Los pacientes con enfermedad pulmonar crónica avanzada o hipertensión pulmonar deben someterse una evaluación funcional detallada para determinar si pueden tolerarla con seguridad. En estos casos la ventilación unipulmonar puede minimizarse o incluso evitarse por completo a expensas de una mayor duración de la CEC, por lo que debe realizarse una evaluación de riesgo-beneficio detallada para estos pacientes11.
Indicaciones y contraindicaciones de la cirugía robóticaIndicacionesLa cirugía mitral mínimamente invasiva sigue las mismas indicaciones que se aplican a la cirugía convencional, como se describe en las guías actuales publicadas por las principales sociedades científicas europeas y americanas de cirugía cardíaca y cardiología12,13. Es posible realizarla en la insuficiencia mitral primaria y secundaria y en todo el espectro de la enfermedad.
También es posible asociar otros procedimientos concomitantes frecuentes, como la reparación tricúspide, el cierre de defectos septales, el cierre de la orejuela izquierda y la ablación de la fibrilación auricular.
Contraindicaciones- •
Enfermedad de las arterias coronarias que requiera revascularización quirúrgica.
- •
Cirugía previa en el tórax derecho.
- •
Deformidades graves de la pared torácica.
- •
Enfermedad vascular periférica grave o aneurismas de la aorta torácica descendente o abdominal.
- •
Dilatación de la aorta ascendente >45mm (para pinzamiento endoaórtico o transtorácico) o calcificación extensa (para pinzamiento transtorácico).
- •
Estenosis o regurgitación aórtica de moderada a grave.
- •
Calcificación grave del anillo mitral.
- •
Disfunción pulmonar grave o hipertensión pulmonar.
Todas las situaciones anteriores dificultarían los pasos básicos para una cirugía robótica afectando su seguridad. Sin embargo, ciertos aspectos de la técnica como la canulación periférica o la protección miocárdica pueden modificarse para poder realizarla.
Técnicas de reparación mitral utilizadas en cirugía robóticaSeguimos los mismos principios básicos de reparación mitral independientemente del abordaje utilizado, siguiendo la línea establecida por Carpentier et al. hace más de 30 años14. Se puede resumir en estos 3 principios básicos:
- 1.
Conservación o restauración de la movilidad normal de los velos.
- 2.
Creación de una buena superficie de contacto entre el velo anterior y posterior a lo largo de toda la línea de coaptación.
- 3.
Remodelado y estabilización del anillo mitral mediante una banda o anillo de anuloplastia.
La mayoría de las técnicas descritas y utilizadas en cirugía abierta para reparar la válvula mitral también se pueden utilizar en cirugía robótica, pero en algunos casos se deben implementar ligeras modificaciones para adaptar su uso.
- a)
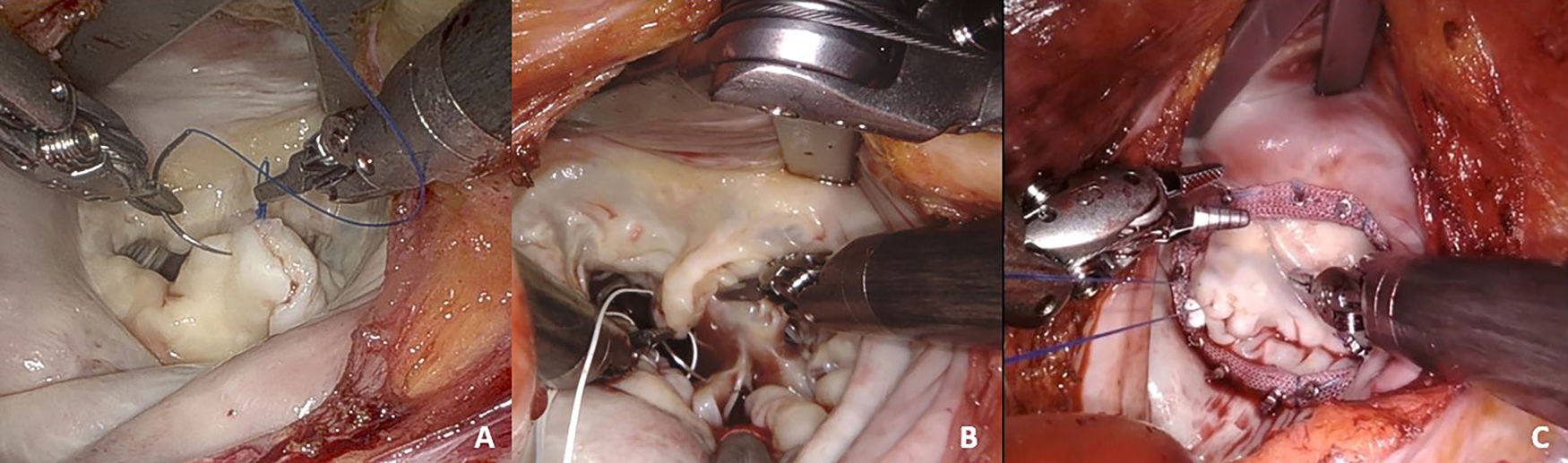
Resecciones triangulares y cuadrangulares: ideales para tratar un prolapso localizado del velo posterior. La reconstrucción del velo se puede lograr con suturas interrumpidas o continuas. Generalmente preferimos utilizar una técnica de doble sutura continua de polipropileno 4/0 o GoreTex® CV-5 (fig. 1A). En caso de requerir la plicatura del annulus posterior empleamos suturas trenzadas irreabsorbibles interrumpidas de 2/0 apoyadas en pledgets de teflón.
- b)
Sustitución de cuerdas: el implante de neocuerdas de politetrafluoroetileno (PTFE) ha ido aumentando progresivamente en nuestro centro, y es nuestra opción preferida para el prolapso del velo anterior. Se construyen utilizando suturas de GoreTex® CV-4 que se anclan entre la punta del músculo papilar y el borde libre del segmento que prolapsa (fig. 1B).
Existen algunas razones que favorecen su uso en cirugía robótica:
- –
Sencillez: es una forma simple de tratar problemas complejos.
- –
Disponibilidad: se pueden implantar en cualquier número y longitud para adaptarse a cualquier anatomía.
- –
Reversibilidad: en caso de un resultado subóptimo, es fácil quitarlas y reemplazarlas en cualquier momento durante la operación.
- –
Precisión: ajustar la longitud de las cuerdas permite optimizar la coaptación, esto se puede realizar durante la prueba de agua para simular el cierre sistólico. En casos de velos muy redundantes, la aplicación de más restricción en el velo posterior acortando las neocuerdas puede prevenir la obstrucción del tracto de salida.
- –
Reproducibilidad y buena durabilidad a largo plazo: utilizando una técnica estandarizada, la reparación mitral con este enfoque ha demostrado también ser muy efectiva y duradera.
- a)
Anuloplastia mitral: implantamos un anillo en todas las reparaciones. La elección del tipo depende de la etiología y disfunción del paciente. Favorecemos en general las bandas flexibles para los casos con prolapso mitral y los anillos rígidos completos para la regurgitación funcional e isquémica. Los anillos se pueden implantar utilizando suturas interrumpidas o continuas. En los casos robóticos, preferimos utilizar la técnica de sutura continua con suturas monofilamento, debido a la importante ganancia de tiempo y la simplicidad que proporciona al aprovechar al máximo la mayor movilidad de los instrumentos robóticos. Es muy importante prestar la adecuada atención a la distribución correcta de las suturas a lo largo del annulus y la banda, particularmente en anillos muy dilatados que requieren un remodelado importante (fig. 1C).
Después de la inducción de la anestesia, se intuba al paciente y se coloca una sonda de ecocardiografía transesofágica. La intubación se puede realizar con un tubo endotraqueal de doble luz o con un tubo de una sola luz y un oclusor bronquial con balón. Se coloca al paciente en decúbito supino, lo más cerca posible del lado derecho de la mesa quirúrgica, se eleva ligeramente el tórax derecho colocando un apoyo a lo largo del hemitórax derecho y se deja que el brazo derecho caiga hacia atrás para exponer toda la pared lateral. Se debe tener cuidado de proteger el brazo para evitar lesiones neurales debido a la compresión contra la estructura de la mesa.
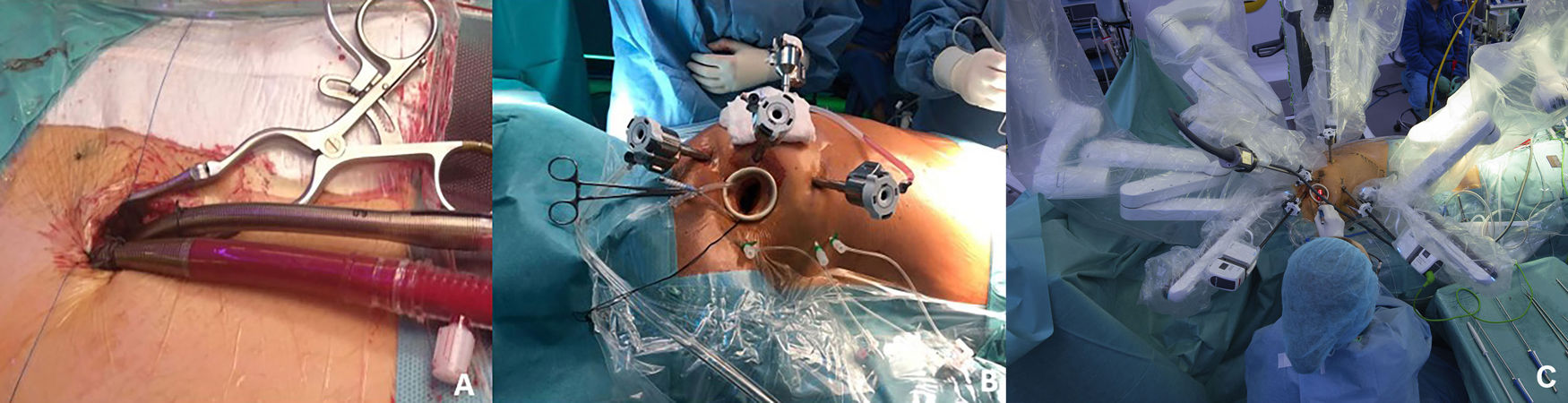
La circulación extracorpórea (CEC) se realiza mediante la canulación de los vasos femorales comunes derechos, utilizando una pequeña incisión de unos 3cm para exponer la cara anterior de ambos vasos (fig. 2A). La disección se reduce al mínimo para disminuir el riesgo de formación de seromas. Se colocan 2 bolsas de polipropileno 5/0 de forma rectangular siguiendo el eje longitudinal de ambos vasos. La canulación se realiza mediante la técnica de Seldinger y bajo control estricto con ecocardiografía transesofágica. Nuestra técnica habitual consiste en la colocación de una única cánula venosa multiperforada de 25Fr conectada a un sistema de drenaje activo. Solamente colocamos una cánula adicional de drenaje yugular en casos de cirugía del lado derecho (como comunicaciones interauriculares amplias o cirugía tricuspídea). La selección del tamaño de la cánula arterial se determina por el diámetro del vaso y típicamente varía entre 15 a 19Fr. En muy raras ocasiones, cuando tenemos que utilizar una cánula que ocluye completamente la luz y el procedimiento planificado es largo, colocamos una línea de perfusión distal para prevenir la isquemia de la extremidad. Para ello, utilizamos un introductor de 6Fr conectado a la línea arterial.
Preparación del paciente. La figura 2A es una imagen de canulación femoral. Las figuras 2B y C muestran la disposición de los puertos y el acoplamiento del robot a los mismos.
Comenzamos con la introducción de un trócar de 8mm en el cuarto espacio intercostal entre las líneas clavicular media y axilar anterior mediante disección roma; que servirá como puerto para la cámara. Tras su inserción, el puerto de la cámara se conecta a una línea de CO2 para crear un capnotórax controlado usando un límite de presión de 10mmHg. Con la cámara se inspecciona el espacio pleural derecho y bajo visualización toracoscópica, se insertan 3 introductores de 6F a lo largo de la línea axilar posterior en los espacios intercostales 4.°, 6.° y 7.°, que serán utilizados para exteriorizar las suturas de tracción colocadas en el diafragma y el pericardio. Después procedemos a insertar bajo visión directa el resto de trócares (todos de 8mm). El trócar del brazo derecho se introduce en el sexto espacio intercostal, aproximadamente 2cm posterior al puerto de la cámara. A continuación, el trócar del brazo izquierdo se inserta en el segundo o tercer espacio intercostal al mismo nivel que el puerto de la cámara. Finalmente, el trócar para el retractor auricular se inserta en el sexto espacio intercostal cercano a la línea clavicular media, evitando lesionar la arteria torácica interna. Una vez colocados todos los trócares, se realiza una toracotomía de 2-3cm lateral al puerto de la cámara, en el mismo espacio intercostal, para que sirva como puerto de trabajo, con un retractor de partes blandas (fig. 2B).
Una vez completados todos los pasos torácicos, se administra la heparina y se canulan los vasos femorales como se describió anteriormente en detalle. Tras conectar y asegurar las cánulas, el sistema Da Vinci® se puede acoplar al paciente. Es extremadamente importante conectar los trócares en la dirección en la que se moverán para evitar posibles conflictos entre los brazos. El puerto de la cámara se conecta al brazo número 2 y, bajo visualización endoscópica, los instrumentos se colocan en los brazos 1 y 4 y se introducen dentro del tórax para el control del cirujano desde la consola (fig. 2C). En esta etapa se puede iniciar la CEC, aunque en algunos pacientes con una anatomía favorable se puede abrir el pericardio y retraer el diafragma antes de iniciar la CEC. Para la retracción diafragmática y pericárdica, normalmente utilizamos suturas de GoreTex® CV-4.
El retractor auricular se inserta bajo visión directa en el brazo robótico número 3 y se usa para separar la aorta de la cava superior y exponer el seno transverso. La pinza aórtica transtorácica se inserta a través de una incisión de 5mm en la axila. Una vez que la pinza aórtica está en su lugar, se coloca una bolsa de tabaco en la aorta ascendente y se inserta una aguja cardiopléjica larga a través del puerto de trabajo bajo visión toracoscópica. Nuestra técnica habitual de protección miocárdica consiste actualmente en una sola dosis de cardioplejia cristaloide anterógrada tipo Bretschneider (Custodiol®).
Una vez que se completa la reparación o el reemplazo mitral, la aurícula izquierda se cierra con dos suturas continuas desde ambos extremos de la incisión. Después de comprobar la ausencia de aire en las cavidades izquierdas, de despinza la aorta y se desconecta al paciente de la CEC. En este punto, se retira el tercer brazo y se utiliza el trócar para insertar un drenaje dentro del pericardio, que se aproxima con dos suturas. Una vez revertida la heparina, los trócares restantes se extraen y se comprueba si hay sangrado con la cámara, dejando un tubo de drenaje a través del trócar del brazo derecho. Habitualmente al final de la intervención extubamos al paciente en la mesa de quirófano y posteriormente lo trasladamos a la UCI de cirugía cardiovascular.
ResultadosEl objetivo principal de la reparación mitral robótica es, como en la cirugía abierta, lograr una reparación valvular exitosa y duradera. A pesar de su complejidad técnica, los centros experimentados han informado excelentes resultados de reparación con un 95% de ausencia de regurgitación mitral a los 5 años, incluso en patología mitral compleja15–18. Adicionalmente, la cirugía mitral robótica tiene como objetivo una recuperación más rápida y una mayor satisfacción del paciente, ya que la agresión quirúrgica es menor. Series recientes informan de una mayor calidad de vida y un retorno más temprano al trabajo tras cirugía mínimamente invasiva16; además, varias publicaciones han demostrado que a pesar de los tiempos de CEC y de pinzamiento aórtico más prolongados, la cirugía mínimamente invasiva se asocia con una tasa de complicaciones muy baja, una menor pérdida de sangre y una estancia hospitalaria y en la UCI más corta17,19.
Iniciar un nuevo programaLos centros de mayor éxito en cirugía mitral mínimamente invasiva suelen ser centros de referencia de gran volumen con vasta experiencia en reparación mitral cuando comenzaron sus programas. La cirugía mínimamente invasiva, y aún más la cirugía robótica, requieren el desarrollo de nuevas habilidades como la canulación periférica, la oclusión intraaórtica y el uso de visión toracoscópica e instrumentos especiales. No es solo el cirujano, sino todo el equipo quirúrgico (anestesiólogos, perfusionistas, enfermeras de quirófano, etc.) el que tiene que aprender a utilizar estas nuevas herramientas y técnicas20.
Según nuestra propia experiencia, hay un aumento de la complejidad para todo el equipo al pasar de la cirugía abierta a la toracoscópica, que es aún más pronunciada cuando se pasa desde allí a la cirugía robótica. Por ello, consideramos imprescindible que todo el equipo quirúrgico se someta a una formación específica en profundidad en cirugía cardíaca toracoscópica y robótica como primer paso básico antes de iniciar un programa exitoso. Después de esta formación inicial los miembros del equipo quirúrgico deben realizar un trabajo de observación repetida de casos en instituciones con experiencia y durante las primeras fases de su experiencia deberían contar con la ayuda de supervisores expertos que puedan brindar el apoyo necesario para garantizar la calidad del procedimiento y la seguridad del paciente21.
La mejor manera de establecer un programa exitoso es evitar la superposición de curvas de aprendizaje. Los resultados son mejores durante las fases iniciales si un programa robótico es iniciado por equipos con amplia experiencia en reparación mitral y existe un estricto protocolo de selección de pacientes. A medida que los programas adquieren experiencia, existe una tendencia a extender la indicación a pacientes más complejos. Los cirujanos deben prestar mucha atención a sus resultados para detectar cualquier cambio en la aparición de complicaciones al tiempo que amplían sus criterios de inclusión y los ajustan en consecuencia22,23.
Experiencia y resultados en el Hospital Clínic de BarcelonaNuestro programa de cirugía cardíaca robótica se inició en su concepción y diseño inicial en 2018 y se materializó en 2019, empezando con la planificación clínica y económico-administrativa y posteriormente con la formación completa de todo el equipo multidisciplinario encargado de su puesta en marcha. Los cirujanos, anestesiólogos, perfusionistas y profesionales de enfermería quirúrgica implicados completamos toda la formación teórica y práctica requerida para la acreditación del personal y de la institución. En noviembre de 2019 realizamos nuestra primera intervención: una pericardiectomía por pericarditis inflamatoria. Este caso permitió poner a punto todos los circuitos y personal implicados en un contexto de menor complejidad y presión. Una semana después realizamos nuestra primera reparación mitral en un paciente con prolapso del velo posterior.
Desde entonces hemos mantenido una actividad regular, con un caso programado semanalmente, que nos ha permitido alcanzar rápidamente un nivel de eficiencia adecuado y unos resultados clínicos comparables a los de nuestro programa de cirugía toracoscópica. A medida que hemos avanzado en la curva de aprendizaje hemos ido expandiendo nuestras indicaciones a casos más complejos y a otros tipos de procedimientos. En el momento de escribir este artículo, hemos realizado un total de 85 intervenciones de forma robótica (tabla 1) y todas ellas han sido completadas de forma exitosa, sin ningún caso de conversión a cirugía abierta.
Relación de los procedimientos realizados
| - 63 reparaciones mitrales (2 con ablación de fibrilación auricular concomitante):• Degenerativa mixoide: 54• Isquémica/funcional: 4• Endocarditis infecciosa: 3• Reumática: 3 |
| - 7 sustituciones mitrales por estenosis mitral reumática |
| - 8 cierres de comunicaciones interauriculares (2 con anuloplastia tricúspide concomitante y una con cierre de un cleft mitral) |
| - 5 derivaciones coronarias de arteria mamaria interna a descendente anterior sin CEC |
| - Una resección de un fibroelastoma de la válvula aórtica |
| - Una resección de un tumor ventricular |
| - Una pericardiectomía |
CEC: circulación extracorpórea.
Como se observa en la actividad realizada, nuestro programa se centra especialmente en la reparación mitral. Esto es debido al importante volumen de pacientes con IM que atendemos al ser centro de referencia para una amplia población, a nuestra tradición en el manejo de esta patología y al hecho de ser un centro de referencia nacional CSUR para la reparación mitral compleja. Actualmente la cirugía robótica ya se ha convertido en la forma más habitual de tratamiento de la IM degenerativa aislada en nuestro centro, desplazando en 2020 a la cirugía mini-invasiva toracoscópica, que hasta la llegada de la robótica constituía el tratamiento que realizábamos en más del 70% de estos pacientes.
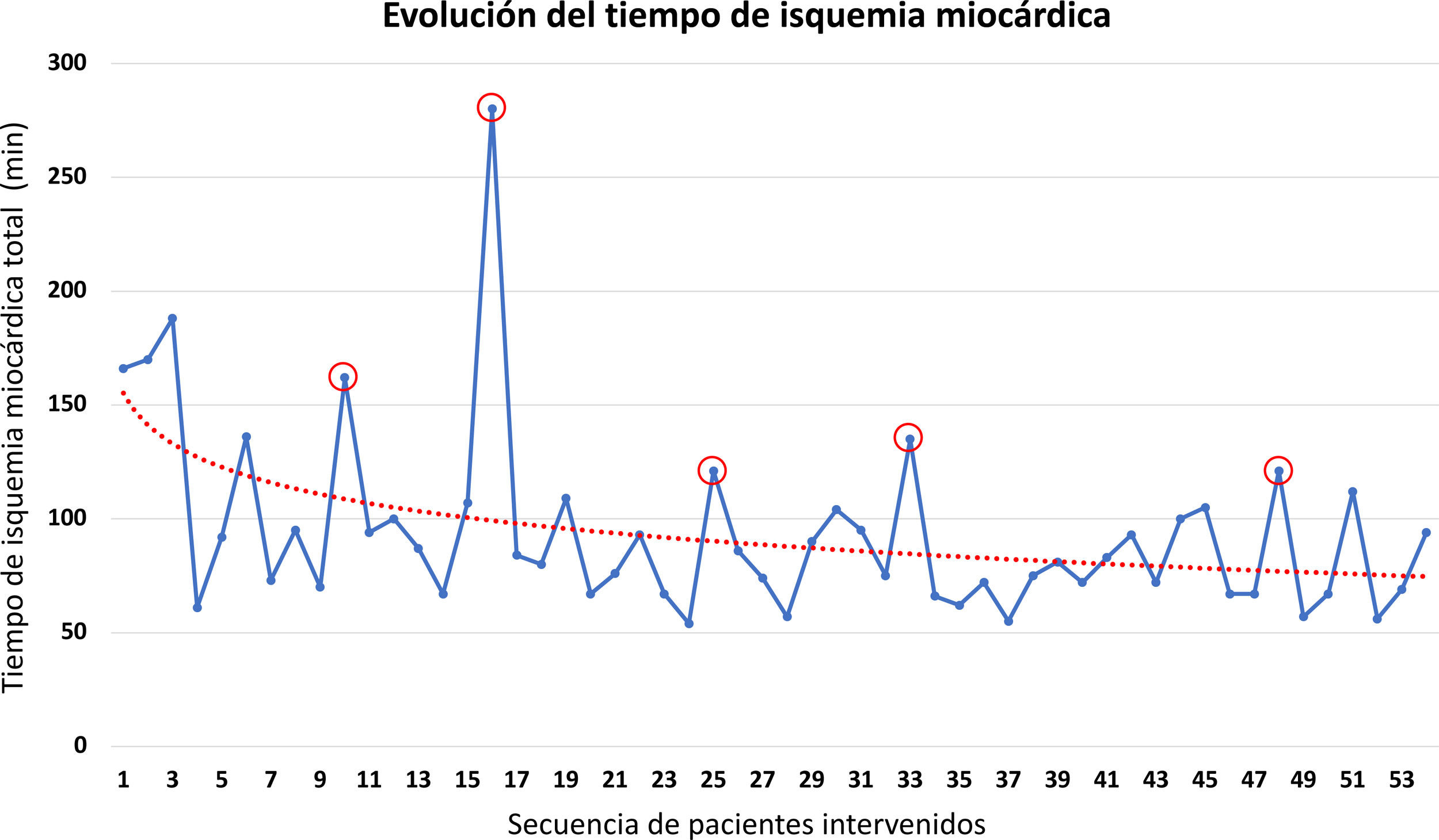
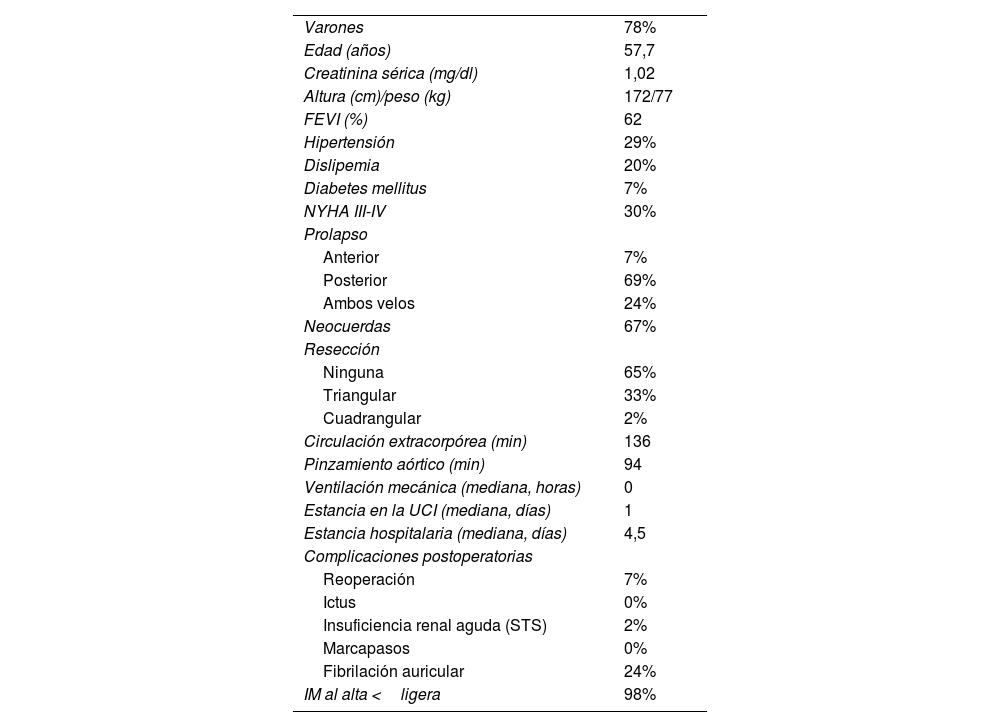
En este grupo de pacientes con IM degenerativa intervenidos de forma robótica hemos podido reparar la válvula de forma satisfactoria en todos los casos, con una tasa de complicaciones baja, muy similar a nuestros resultados previos con cirugía convencional y mini-invasiva toracoscópica19. La descripción detallada de esta cohorte se muestra en la tabla 2. En nuestra experiencia hemos visto claramente la presencia de una curva de aprendizaje, que se evidencia en la evolución de los tiempos de pinzamiento y CEC y en la aparición de algunas complicaciones al inicio de la serie, principalmente respiratorias. Con la acumulación de experiencia, la revisión crítica de cada caso y el refinamiento constante de todos los pasos de la intervención, hemos podido ir adaptando el procedimiento y mejorando nuestros resultados progresivamente hasta llegar a un punto de estabilidad, alcanzado aproximadamente tras los primeros 10 casos (fig. 3). A nuestro juicio hay dos factores claves que han influido positivamente en nuestra curva de aprendizaje: en primer lugar, la formación de un equipo estable compuesto por dos cirujanos que realizan siempre juntos todos los procedimientos y, en segundo lugar, nuestra experiencia previa en cirugía toracoscópica. Estos dos factores han sido clave para suavizar y acortar la curva y para conseguir llegar de una forma segura y rápida a un nivel de resultados adecuado. También nos ha permitido expandir muy rápidamente las indicaciones a la práctica totalidad de pacientes con IM e ir incorporando más patologías y procedimientos a nuestro programa. Una ilustración de esto último es nuestro primer caso de cirugía aórtica robótica, uno de los primeros en Europa24.
Características de la cohorte intervenida de IM degenerativa
| Varones | 78% |
| Edad (años) | 57,7 |
| Creatinina sérica (mg/dl) | 1,02 |
| Altura (cm)/peso (kg) | 172/77 |
| FEVI (%) | 62 |
| Hipertensión | 29% |
| Dislipemia | 20% |
| Diabetes mellitus | 7% |
| NYHA III-IV | 30% |
| Prolapso | |
| Anterior | 7% |
| Posterior | 69% |
| Ambos velos | 24% |
| Neocuerdas | 67% |
| Resección | |
| Ninguna | 65% |
| Triangular | 33% |
| Cuadrangular | 2% |
| Circulación extracorpórea (min) | 136 |
| Pinzamiento aórtico (min) | 94 |
| Ventilación mecánica (mediana, horas) | 0 |
| Estancia en la UCI (mediana, días) | 1 |
| Estancia hospitalaria (mediana, días) | 4,5 |
| Complicaciones postoperatorias | |
| Reoperación | 7% |
| Ictus | 0% |
| Insuficiencia renal aguda (STS) | 2% |
| Marcapasos | 0% |
| Fibrilación auricular | 24% |
| IM al alta <ligera | 98% |
IM: ; UCI: unidad de cuidados intensivos.
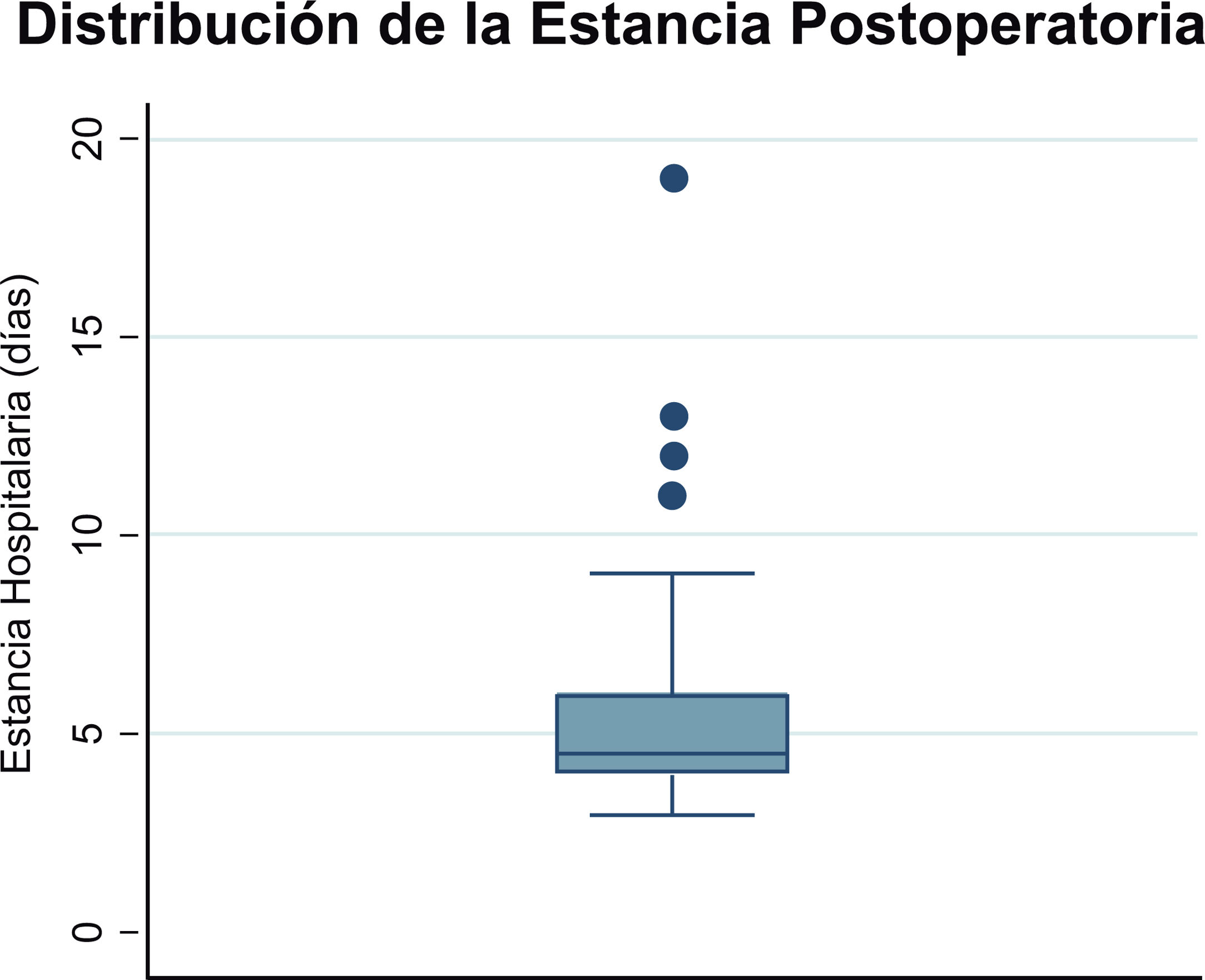
En cuanto a los resultados obtenidos y su comparación con las demás opciones en nuestro centro, nos ha llamado la atención la reducción significativa de las estancias postoperatorias. Al comparar nuestra cohorte de pacientes intervenidos de forma robótica por IM degenerativa aislada con los resultados que publicamos hace 2 años sobre este mismo tipo de pacientes con cirugía convencional y mini-invasiva19, hemos observado una reducción en la mediana en la estancia hospitalaria de 3 días y 2 días, respectivamente (fig. 4). Este hallazgo es llamativo, considerando que estamos al comienzo de nuestra experiencia en cirugía robótica. Necesitaremos más pacientes en el grupo robótico para poder hacer análisis más detallados que controlen la presencia de confusores y mitiguen un posible sesgo de selección antes de poder obtener conclusiones más definitivas, pero los resultados iniciales son muy alentadores.
Distribución de la estancia postoperatoria. El boxplot de la figura muestra la distribución de la estancia postoperatoria en los 54 pacientes intervenidos robóticamente de insuficiencia mitral degenerativa, con una mediana de estancia 4,5 días y un 75% de los pacientes dados de alta antes del sexto día.
En nuestra opinión, la cirugía robótica es un avance claro que se añade a nuestro repertorio de opciones y que viene a mejorar significativamente la cirugía mitral. Si bien es un procedimiento altamente complejo y que supone un aumento del costo de la intervención, se trata de una tecnología que ofrece una capacidad de movimientos, precisión y visualización superior al resto de alternativas mini-invasivas y con la capacidad de reducir al máximo la agresión quirúrgica y la duración de la recuperación tras la cirugía.
Consideraciones éticasEl presente trabajo cumple con todos los estándares éticos de investigación biomédica.
FinanciaciónLos autores declaran no tener ningún conflicto de intereses.
Conflicto de interesesEl autor de correspondencia [DP], recibe retribuciones de Edwards Lifesciences® por actividades docentes y de proctorización.