Evaluar los resultados clínicos y ecocardiográficos a medio plazo de la reparación valvular mitral mediante el uso de neocuerdas.
Material y métodosSe evaluó una muestra de 110pacientes (edad media 63±14años) sometidos a reparación mitral mediante uso de neocuerdas de politetrafluoroetileno expandido (PTFE) durante un periodo de 7años. Se analizó a medio plazo la recurrencia de insuficiencia mitral (IM)≥2 y el episodio clínico combinado: reintervención y muerte (Kaplan-Meier) y los predictores de recurrencia de IM>2 con un modelo de Cox.
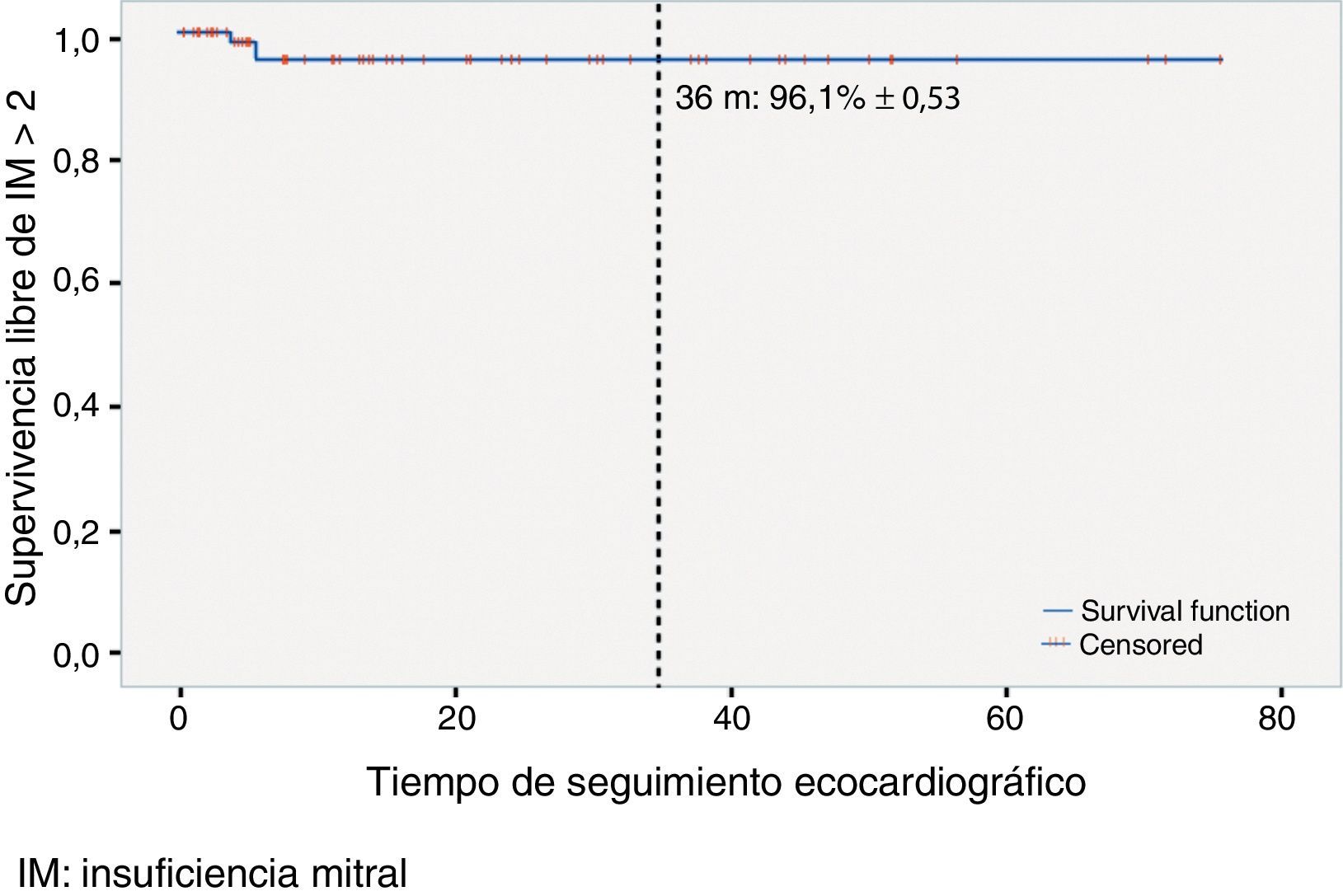
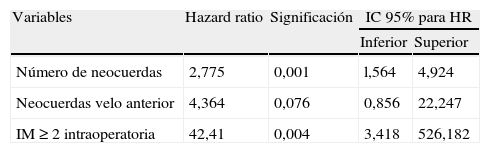
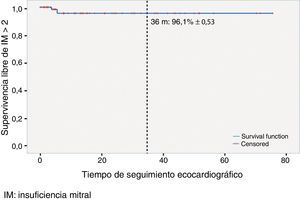
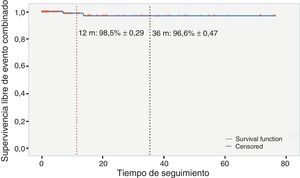
ResultadosSe implantaron una media de 2,5±1,3 pares de neocuerdas por paciente. Cincuenta y ocho (52,7%) pacientes presentaban prolapso aislado del velo posterior, 28 (25,5%) de velo anterior y 24 (21,8%) de ambos velos. En 19 (17,27%) pacientes se realizó ablación quirúrgica de la fibrilación auricular (FA). Con un seguimiento mediano de 15meses (rango interquartílico 28,2meses), 2pacientes presentaban IM residual >2, y la supervivencia libre de IM>2 fue del 96,1% (±0,53) a 36meses. Hubo 3reintervenciones (2 en el seguimiento), con una supervivencia libre de episodio combinado del 98,5% (±0,29) y del 96,6% (±0,47) a los 12 y 36meses, respectivamente. En el modelo de Cox se identificaron como predictores independientes de recurrencia de IM≥2 el número de neocuerdas (hazard ratio [HR], intervalo de confianza [IC] 95%: 2,77 [1,56-4,9]) y el grado de IM intraoperatoria (HR, IC95%: 42,41 [3,41-526,182]).
ConclusionesEl uso de neocuerdas en la reparación valvular mitral obtiene resultados a medio plazo adecuados en términos de durabilidad y evolución clínica.
This study examines the mid-term clinical and echocardiographic results of mitral valve repair using chordal replacement.
MethodsA cohort of 110patients (mean age 63±14years) underwent mitral valve repair using expanded polytetrafluoroethylene (PTFE) neochordae in a 7-year period. We analyzed the mid-term survival freedom of recurrent mitral regurgitation (MR)>2 and combined event (reoperation and death) (Kaplan-Meier), also the independent predictors of recurrent MR>2 with a Cox model.
ResultsA mean of 2.5±1.3 pairs of neochordae per patient were implanted. Fifty eight (52.7%) patients had isolated posterior leaflet prolapse, 28 (25.5%) anterior leaflet prolapse and 24 (21.8%) bileaflet prolapse. Nineteen (17.27%) patients underwent Maze procedure. With a median follow-up of 15months (interquartile range 28.2months), 2patients had residual MR>2, and regurgitation-free survival percentage was 96.1% (±0.53) at 36months. There were 3reoperations (2 at the follow-up), with a combined event-free survival percentage of 98.5% (±0.29) and 96.6% (±0.47) at 12 and 36 months, respectively. The Cox model identified as independent predictors of recurrent MR≥2, the number of neochordae HR, 95%CI: 2.77 (1.56-4.9) and the intraoperative MR grade HR, 95%CI: 42.41(3.41-526.182).
ConclusionsNeochordae use in mitral valve repair obtains adequate mid-term results in terms of durability and echocardiographic results.
Actualmente la reparación mitral es el método de elección para el tratamiento de la insuficiencia mitral (IM) degenerativa, pues ha mostrado disminuir la mortalidad perioperatoria y las complicaciones relacionadas con las válvulas protésicas, preservar la función ventricular y aumentar la supervivencia1–4. Se han descrito múltiples técnicas de reparación mitral, según la patología y el velo afectado: diversos tipos de resecciones de velo posterior, transferencia y acortamiento de cuerdas y el uso de neocuerdas de politetrafluoroetileno expandido (PTFE). Desde su introducción en 1980 por David5 y Frater et al.6, las neocuerdas de PTFE (Gore-tex, WL Gore and Associates, Inc., Flagstadd, AZ) han sido utilizadas ampliamente para la reparación de prolapsos del velo anterior, y posteriormente del velo posterior, evitando así resecar tejido valvular.
Diferentes centros han publicado sus resultados con el uso de neocuerdas de PTFE, mostrando que es una técnica segura, efectiva y reproducible, y en este momento es una técnica ampliamente extendida entre los cirujanos7.
El objetivo de este estudio fue analizar los resultados clínicos y ecocardiográficos a corto y medio plazo, en nuestro centro, además de identificar los predictores de recurrencia de la IM en nuestra cohorte.
Material y métodosPoblación en estudioDesde enero de 2005 a enero de 2012 se implantaron neocuerdas de PTFE en 110 pacientes, cuyos datos se recogieron en la base de datos de nuestro servicio: Sistema Informático de Cirugía Cardiaca (SICCS) (Biomenco, Barcelona, España). De forma retrospectiva, se analizaron datos clínicos (edad, género, clase funcional de la New York Heart Association [NYHA], presencia de ritmo sinusal, entre otros) y ecocardiográficos (tipo de valvulopatía mitral, fracción de eyección de ventrículo izquierdo [FEVI], diámetro de la aurícula izquierda, diámetros telesistólico [DTSVI] y telediastólico [DTDVI] del ventrículo izquierdo, presión sistólica de la arteria pulmonar [PSAP], cuantificación de la IM de 0 a 4) intraoperatorios y postoperatorios. Realizamos el seguimiento clínico y ecocardiográfico en consulta, y vía telefónica en el 5% de la muestra en que fue necesario. Además se recogieron datos de la intervención quirúrgica (número de neocuerdas implantadas, uso de anillo y tamaño, EuroSCORE, cirugía concomitante, tiempo de circulación extracorpórea [CEC] y pinzamiento, entre otros) y datos de la evolución postoperatoria intrahospitalaria y a medio-largo plazo (tiempo de intubación orotraqueal, tiempo de estancia intrahospitalaria, complicaciones posquirúrgicas, mortalidad, recurrencia de la IM, reintervención y clase funcional de la NYHA, anticoagulación).
Técnica quirúrgicaTodos los pacientes fueron intervenidos mediante esternotomía media, CEC con canulación bicava, canulación de aorta ascendente, cardioplejía fría hemática intermitente e hipotermia a 32°C. Se accedió a la aurícula izquierda a través del surco interauricular. En todos los casos se realizó plastia mediante uso de neocuerdas de PTFE 5/0 (Gore-tex, WL Gore and Associates, Inc., Flagstadd, AZ). Tras pasar las 2agujas de los extremos del goretex por la cabeza del músculo papilar, se pasó por el borde libre del velo desde la cara ventricular a auricular, donde se dieron 3nudos. Posteriormente se pasó nuevamente de la cara auricular a la ventricular, donde se realizó el anudado final. Para obtener el nivel de anudado se tomó como referencia un punto de prolene 4/0 entre A1-P1. En 109casos se implantó además anillo mitral. La competencia de la plastia se comprobó en todos los casos mediante la realización del test de agua y ecocardiograma transesofágico tras la salida de CEC.
Estudio ecocardiográfico y seguimientoA todos los pacientes se les realizó un ecocardiograma transtorácico y transesofágico prequirúrgico e intraoperatorio y transtorácico postoperatorio prealta, al mes y posteriormente de forma anual.
Los estudios de eco-Doppler fueron realizados con un equipo Philips IE-338 (Philips Medical Systems, DA Best, Países Bajos). Las mediciones se realizaron siguiendo las recomendaciones de Sociedad Europea de Ecocardiografía (Recommendations for chamber quantification»8,9. La proyección en el eje paraesternal largo en modoM se utilizó para medir los diámetros auricular izquierdo, telesistólico y telediastólico ventriculares izquierdos. La fracción de eyección se calculó por el método biplano de Simpson, empleando las proyecciones bidimensionales de 2 y 4cámaras. La presión sistólica de la arteria pulmonar se calculó añadiendo la presión estimada de la aurícula derecha al gradiente entre el ventrículo derecho y aurícula derecha, obtenido a través de la regurgitación tricuspídea según la ecuación simplificada de Bernouilli.
La IM se cuantificó en 5grados (0:sin IM, 1:IM ligera, 2:IM leve a moderada, 3:IM moderada a severa, 4:IM severa), según el tamaño de la vena contracta, el método PISA (proximal isovelocity surface area) y otros parámetros semicuantitativos.
Se realizó seguimiento en las consultas externas de nuestro servicio al primer mes postoperatorio, y posteriormente de forma anual con ecocardiograma transtorácico, recogiendo múltiples parámetros ecocardiográficos como IM grado 0 a 4, FEVI, PSAP, diámetros VI entre otros, y recogiendo datos clínicos como la clase funcional según la NYHA, anticoagulación, reintervención, reingreso por insuficiencia cardiaca congestiva y ritmo en electrocardiograma de 12derivaciones al momento de la consulta.
Se definió como episodio clínico combinado: reintervención y muerte, y se analizó a medio plazo la recurrencia de IM>2, así como los predictores de recurrencia de IM10.
Análisis estadísticoLas variables categóricas se expresan mediante porcentajes y las continuas como media±desviación estándar (DE) o mediana con rango intercuartílico (RIQ) si no siguen una distribución normal. La comparación de las medidas de cambio intrasujeto se realizó mediante t de Student para datos emparejados (prueba de t de Wilcoxon si no existía una distribución normal). Los factores predictores se calcularon mediante regresión de Cox, incluyendo en dicho análisis las variables que tuvieron una p<0,01 en el análisis multivariante. El episodio combinado y la recurrencia de IM>2 fue determinada mediante el método de Kaplan-Meier. Todos los análisis estadísticos se hicieron con SPSS versión 18 (SPSS Inc.).
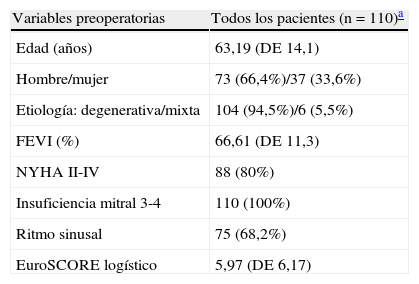
ResultadosCaracterísticas de la poblaciónEntre enero de 2005 y enero de 2012 se realizaron 110plastias mitrales en las cuales se usaron neocuerdas de PTFE (Gore-tex, WL Gore and Associates, Inc., Flagstadd, AZ). Ciento cuatro pacientes presentaban patología degenerativa: déficit fibroelástico y degeneración mixoide; 6 (5,5%) pacientes presentaban patología mixta (degenerativa e isquémica). La edad media fue 63,19 (DE14,10) años. Setenta y tres (66,4%) eran hombres. El 80% se encontraban preoperatoriamente en clase funcional ii a iv de la NYHA, y 68,2% en ritmo sinusal. La FEVI prequirúrgica media fue 66,61 (DE11,3). El grado de IM preoperatoria fue 3-4 en el 100% de la muestra. El EuroSCORE logístico medio fue 5,97 (DE6,17). Los datos preoperatorios se exponen en la tabla 1.
Datos preoperatorios de la muestra
| Variables preoperatorias | Todos los pacientes (n=110)a |
| Edad (años) | 63,19 (DE 14,1) |
| Hombre/mujer | 73 (66,4%)/37 (33,6%) |
| Etiología: degenerativa/mixta | 104 (94,5%)/6 (5,5%) |
| FEVI (%) | 66,61 (DE 11,3) |
| NYHA II-IV | 88 (80%) |
| Insuficiencia mitral 3-4 | 110 (100%) |
| Ritmo sinusal | 75 (68,2%) |
| EuroSCORE logístico | 5,97 (DE 6,17) |
DE: desviación estándar; FEVI: fracción de eyección del ventrículo izquierdo; IM: insuficiencia mitral grado 3-4/4; NYHA: New York Heart Association.
La tabla 2 muestra los datos intraoperatorios de nuestra serie. Fueron implantadas una media de 2,50 (DE1,29) pares de neocuerdas. Cincuenta y ocho (52,7%) pacientes presentaban prolapso aislado del velo posterior, 28 (25,5%) de velo anterior y 24 (21,8%) de ambos velos. En 109pacientes se implantó un anillo mitral concomitante, en 103 Physio Carpentier-Edwards (Edwards Life-sciences™, Irving, California, EE.UU.) y en 6 Carpentier-McCarthy-Adams IMR ETlogix®, con un diámetro medio de 33,91 (DE3,10). Otros procedimientos sobre la válvula mitral asociados fueron papilotomía (3pacientes), resección triangular (3pacientes) y resección cuadrangular (9pacientes). Además, en 19 (17,27%) pacientes se asoció ablación quirúrgica de la fibrilación auricular (FA), en 14 (12,72%) cirugía coronaria y en 9 (8,18%) anuloplastia tricúspide (5 según la técnica de De Vega y 4 con anillo Physio o MC3), entre otros procedimientos asociados.
Datos intraoperatorios de la muestra
| Variables intraoperatorias | Todos los pacientes (n=110)a |
| Prolapso | |
| Velo posterior aislado | 58 (52,7%) |
| Velo anterior aislado | 28 (25,5%) |
| Ambos velos | 24 (21,8%) |
| Pares de neocuerdas | 2,5 (DE 1,3) |
| Neocuerdas | |
| Velo posterior | 79 (71,8%) |
| Velo anterior | 53 (48,2%) |
| Anillo | |
| Physio | 103 (93,6%) |
| IMR | 6 (5,5%) |
| N.° anillo | 33,91 (DE 3,1) |
| Otras mitral | |
| Resección cuadrangular | 9 (8,2%) |
| Resección triangular | 3 (2,7%) |
| Papilotomía | 3 (2,7%) |
| Anillo dilatado | 25 (22,7%) |
| Tiempo de CEC (min) | 89,24 (DE 28,08) |
| Tiempo de pinzamiento (min) | 71,55 (DE 20,33) |
CEC: circulación extracorpórea; DE: desviación estándar; IMR: Carpentier-McCarthy-Adams IMR ETlogix Annuloplasty Ring; Physio: Carpentier-Edwards Physio Annuloplasty Ring.
Los tiempos medios de CEC y de pinzamiento aórtico fueron 89,24 (DE28,08) y 71,55 (DE20,33), respectivamente.
Tras la salida de CEC se realizó en todos los pacientes un ecocardiograma transesofágico, en el que 109pacientes presentaron IM residual ≤2.
Resultados postoperatorios inmediatosDurante la estancia hospitalaria fallecieron 5pacientes (4,54%), 2 por muerte cardiaca, 2 por sepsis y fallo multiorgánico secundario, y uno por accidente cerebrovascular arterial extenso. Un paciente fue reintervenido en el periodo posquirúrgico inmediato por presentar IM>2 e implantando una prótesis mitral mecánica. La estancia media en la UVI fue de un día (DE4,76) y la mediana de intubación orotraqueal fue de 6,5h (RIQ6,0). En cuanto a las complicaciones postoperatorias, 22 (20%) pacientes presentaron FA, 7 (6,4%) insuficiencia renal aguda, 4 (3,6%) fueron reoperados por sangrado posquirúrgico y uno (0,9%) tuvo un accidente cerebrovascular arterial.
Seguimiento clínico y ecocardiográficoSe completó el seguimiento clínico en el 95,2% de los pacientes y el seguimiento ecocardiográfico en el 86,5% de los pacientes, con un tiempo de seguimiento medio de 21,1 (DE20,5) (mediano 15; RIQ28,2) y de 15,7 (DE18,6) meses, respectivamente.
Durante el seguimiento se observó que el 92,7% de los pacientes se encontraban en clase funcional i de la NYHA y el resto en clase funcional ii de la NYHA. El 75,3% se encontraban en ritmo sinusal.
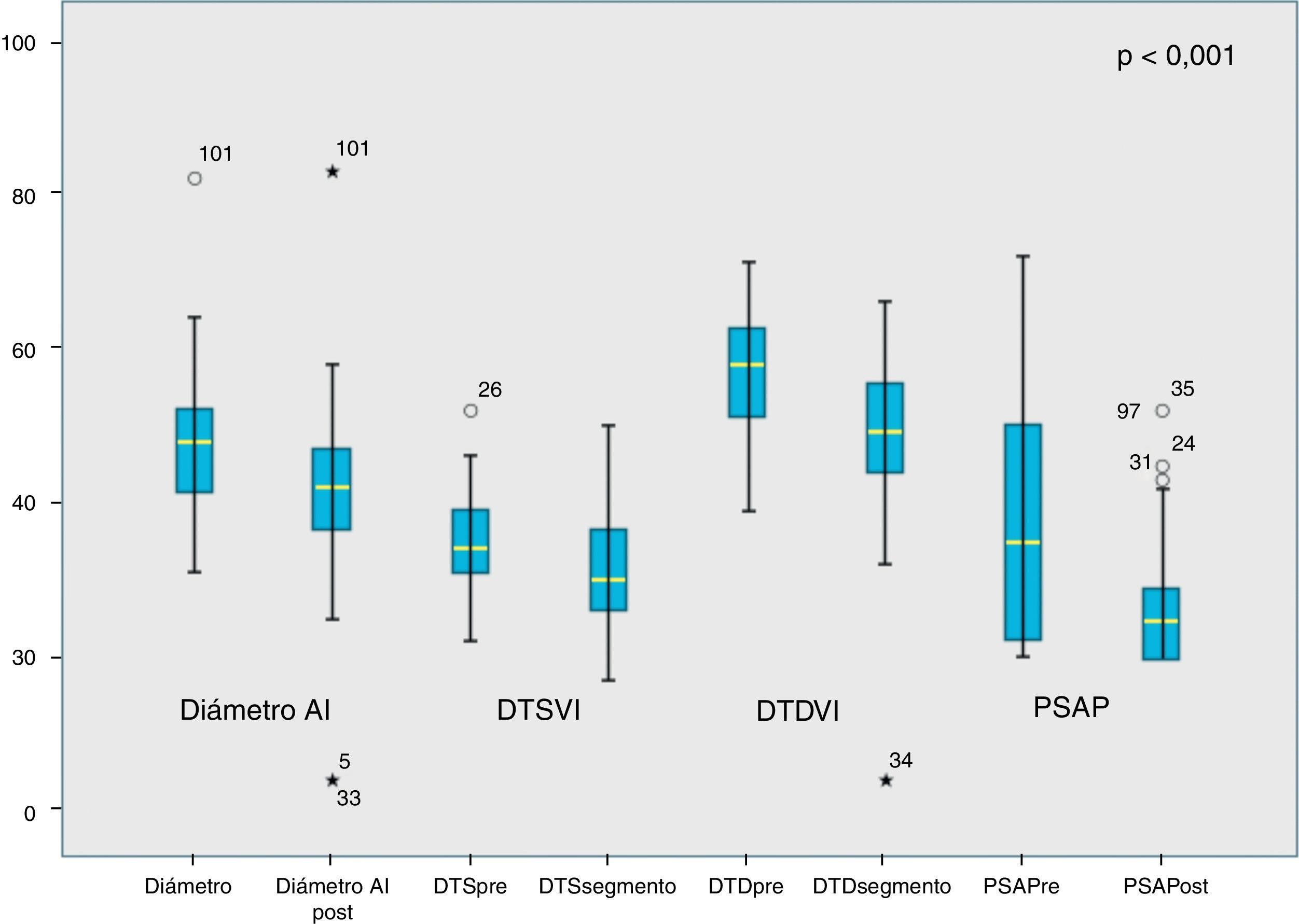
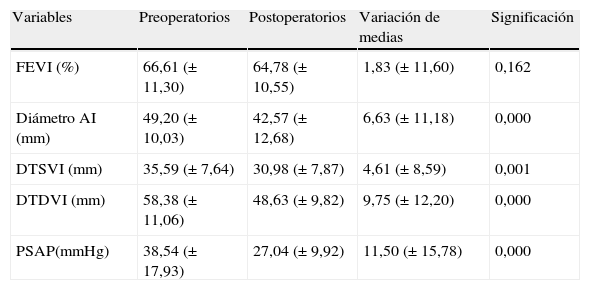
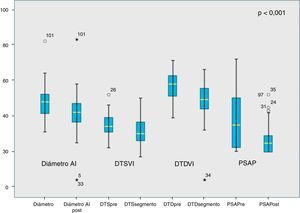
En toda la cohorte se apreció una reducción significativa, respecto al preoperatorio, del diámetro de la aurícula izquierda de 6,63mm (p<0,001); DTSVI 4,6mm (p<0,001); DTDVI 9,75mm (p<0,001) y PSAP 11,5mmHg (p<0,001) (tabla 3 y fig. 3).
Comparación de medias (t de Student de datos emparejados): datos ecocardiográficos prequirúrgicos y posquirúrgicos
| Variables | Preoperatorios | Postoperatorios | Variación de medias | Significación |
| FEVI (%) | 66,61 (± 11,30) | 64,78 (± 10,55) | 1,83 (± 11,60) | 0,162 |
| Diámetro AI (mm) | 49,20 (± 10,03) | 42,57 (± 12,68) | 6,63 (± 11,18) | 0,000 |
| DTSVI (mm) | 35,59 (± 7,64) | 30,98 (± 7,87) | 4,61 (± 8,59) | 0,001 |
| DTDVI (mm) | 58,38 (± 11,06) | 48,63 (± 9,82) | 9,75 (± 12,20) | 0,000 |
| PSAP(mmHg) | 38,54 (± 17,93) | 27,04 (± 9,92) | 11,50 (± 15,78) | 0,000 |
AI: aurícula izquierda; DTDVI: diámetro telediastólico del ventrículo izquierdo; DTSVI: diámetro telesistólico del ventrículo izquierdo; FEVI: fracción de eyección del ventrículo izquierdo; PSAP: presión sistólica de la arteria pulmonar.
Diferencia de medias entre las preoperatorias y las postoperatorias.
Ningún paciente presentó estenosis mitral significativa en el seguimiento. Tres pacientes reingresaron por insuficiencia cardiaca congestiva; 2 de ellos presentaban recurrencia de la IM>2 y fueron reintervenidos realizando sustitución valvular mitral.
La supervivencia libre de IM>2 a los 36meses fue del 96,1% (±0,53) (fig. 1).
Durante el seguimiento no murió ningún paciente, y la supervivencia libre de episodio combinado (muerte y reintervención) a los 12 y 36meses fue del 98,5% (±0,29) y del 96,6% (±0,47), respectivamente (fig. 2).
En cuanto a los predictores independientes de recurrencia de IM≥2, los únicos factores que fueron significativos en el modelo de Cox fueron la IM intraoperatoria residual HR, IC95%: 42,41 (3,41-526,182) y el número de neocuerdas HR, IC95%: 2,77(1,56-4,9). El prolapso del velo anterior se acercó a la significación estadística (tabla 4).
Factores predictores independientes de recurrencia de IM ≥ 2. Regresión de Cox
| Variables | Hazard ratio | Significación | IC 95% para HR | |
| Inferior | Superior | |||
| Número de neocuerdas | 2,775 | 0,001 | l,564 | 4,924 |
| Neocuerdas velo anterior | 4,364 | 0,076 | 0,856 | 22,247 |
| IM ≥ 2 intraoperatoria | 42,41 | 0,004 | 3,418 | 526,182 |
HR: hazard ratio; IC: intervalo de confianza; IM: insuficiencia mitral.
La reparación mitral se ha convertido en la técnica de elección en el tratamiento de la IM degenerativa desde su introducción por Carpentier11. Esto se ha debido a las ventajas observadas sobre la sustitución valvular, que incluyen disminución significativa de la morbimortalidad a largo plazo y preservación de la geometría ventricular con la consiguiente preservación de la función del ventrículo izquierdo4. Por otra parte, diferentes grupos han publicado sus resultados de supervivencia y recurrencia de IM a largo plazo con distintas técnicas, obteniendo excelentes resultados12,13. Además, pese a que la reparación mitral con compromiso del velo anterior ha mostrado peores resultados frente a la del posterior, con el uso de neocuerdas y la expansión de la técnica estos resultados se han ido igualando14.
En la literatura científica se han descrito algunas técnicas de reparación mitral, que han ido evolucionando o que han sido abandonadas al ser poco reproducibles y mostrar altas tasas de recurrencia de IM15. Algunas de ellas son el acortamiento o la transferencia de cuerdas. Así mismo, siguiendo la filosofía del «respetar más que resecar», se han ido abandonando técnicas de plicatura y resección, que al requerir cortar parte del velo causaban limitación del movimiento de estos, además de disminuir la superficie de coaptación16,17.
Observando estos inconvenientes, y pese a que la resección cuadrangular continúa siendo la técnica estándar de reparación en el prolapso del velo posterior aislado, la reparación mitral con neocuerdas de PTFE ha emergido como una técnica que permite respetar el tejido, evitando así la rigidez de los velos, aumentando la superficie de coaptación y el área efectiva, factores que han demostrado ser predictores de durabilidad a largo plazo16-19.
En busca del material ideal para el reemplazo de las cuerdas tendinosas, las neocuerdas de PTFE han mostrado ser un material confiable, con larga duración y pocas complicaciones descritas7. La técnica de reparación con neocuerdas de PTFE, introducida en los años ochenta por David para la reparación de prolapsos de velo anterior, se ha extendido actualmente a prolapsos de ambos velos, con excelentes resultados.
David publicó su experiencia en reparación mitral en 2005, teniendo en cuenta prolapsos aislados de velo posterior, anterior o de ambos velos, obteniendo a 12años una supervivencia total del 75%, libertad de reintervención del 94% y libertad de recurrencia de IM≥3 del 89%10.
Estos resultados son superponibles a los publicados por otros grupos, como Perier et al.20, quienes en 2008 reportan sus resultados a 10años en reparación de prolapso aislado del velo posterior mitral con neocuerdas, obteniendo una supervivencia de 87% y una supervivencia libre de reintervención de 93%. Kuntze et al.21 publicaron en 2008 sus resultados con el uso de neocuerdas de PTFE tanto en velo anterior como posterior, con la técnica del loop, exponiendo una supervivencia libre de reintervención a 3años del 97% y supervivencia a 6años del 86,2%. Kobayashi et al.22 revisaron también su experiencia en 74pacientes, con una supervivencia libre de reintervención de 82% a 12años, entre otros.
Teniendo en cuenta los resultados satisfactorios publicados por los diferentes grupos, decidimos analizar nuestros resultados con el uso de neocuerdas de PTFE y valorar los predictores de recurrencia en nuestra cohorte.
En nuestra muestra, la supervivencia libre de episodio combinado (muerte y reintervención) fue del 98,5% a un año y del 96,6% a los 3años, y la de recurrencia de IM>2 fue del 96,1% a los 3años, resultados comparables a los descritos por otros grupos. Objetivamos una reducción significativa de parámetros ecocardiográficos postoperatorios (diámetro de la aurícula izquierda, DTSVI, DTDVI, PSAP), hallazgo que se corresponde con resultados publicados por otros grupos y que son resultado de las ventajas de la reparación mitral sobre la sustitución valvular1-4 (tabla 3 y fig. 3).
Al analizar nuestros resultados, observamos que nuestra muestra presenta una edad media mayor a la de la mayoría de grupos de reparación mitral (Perier: 60,7±12,9años; Kobayashi: 55,3±14,8años). También presentamos una mayoría absoluta de pacientes sintomáticos (80% en NYHAII a IV) y con peores parámetros ecocardiográficos (dilatación ventricular y auricular, hipertensión pulmonar), lo que se tradujo en un EuroSCORE medio elevado (5,97%). Todo esto podría estar relacionado con la elevada mortalidad intrahospitalaria presentada en nuestra muestra. Además, cabe destacar que los pacientes que fallecieron intrahospitalariamente coinciden con los pacientes del comienzo de la implementación de la técnica en nuestro centro.
Por otra parte, la mejoría clínica fue importante en nuestra muestra, con el 100% de los pacientes en clase funcional i-ii de la NYHA y el 75,3% en ritmo sinusal en el seguimiento.
Han sido descritos varios predictores independientes de recurrencia de IM por distintos grupos, entre ellos, el sexo femenino, la FEVI<40%, el prolapso del velo anterior, la IM residual postoperatoria y la cirugía concomitante de raíz y/o válvula aórtica10. Dentro de nuestra muestra, alcanzaron la significación estadística como predictores de recurrencia de IM, la IM residual intraoperatoria HR, IC95%: 42,41 (3,41-526,182) y el número de neocuerdas HR, IC95%: 2,77 (1,56-4,9) (tabla 4).
Estos resultados parecen estar relacionados con que la reparación más difícil es la que requiere el mayor número de neocuerdas, y esto podría correlacionarse con la complejidad de la IM. De hecho, el prolapso del velo anterior, aunque no alcanzó significación estadística (p=0,076), se acercó a esta como predictor de la IM, con un HR, IC95%: 4,36 (0,85-22,24).
Limitaciones del estudioNuestra limitación más importante fue el tamaño de la muestra y el tiempo corto de seguimiento. Además, pese a que se recogió la etiología, no se analizaron los resultados respecto a esta. Por otra parte, no se han medido otros parámetros ecocardiográficos de relevancia en este tema y que podrían asociarse con recurrencia, como son la superficie de coaptación y la altura de los velos, entre otros.
ConclusionesDe acuerdo con nuestros resultados, confiamos en la técnica de reparación valvular mitral con neocuerdas de PTFE como una técnica reproducible, eficaz y segura en el tratamiento de la IM en el prolapso aislado del velo posterior, del anterior o de ambos velos. Teniendo en cuenta la muestra pequeña y el corto periodo de seguimiento, continuaremos vigilando de cerca a nuestros pacientes en el seguimiento, y reportando regularmente nuestros resultados con esta técnica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.