La reparación de la válvula aórtica ha experimentado una evolución constante en las 2 últimas décadas y se ha beneficiado notablemente de una mejor comprensión de la geometría de la válvula y de la raíz aórtica normal. Actualmente, las investigaciones se centran en algunos aspectos especiales, tales como la técnica óptima para la reparación o sustitución de los velos, la estabilización del anillo basal y el material ideal a emplear. El prolapso de los velos en las válvulas aórticas bicúspides y tricúspides es la causa más frecuente de insuficiencia aórtica en los países industrializados. Con base en la más reciente literatura, así como en nuestra propia experiencia, ofrecemos una serie de recomendaciones para un adecuado manejo quirúrgico de los pacientes con insuficiencia aórtica por patología valvular. Detallamos el diagnóstico y el análisis sistemático intraoperatorio que debe seguirse, así como las distintas técnicas quirúrgicas que se deben emplear. Presentamos los resultados obtenidos en 1.808 pacientes sometidos a distintas técnicas de reparación valvular aórtica en nuestra institución.
Aortic valve repair has evolved dynamically in the past two decades, and has markedly benefitted from a better understanding of normal aortic root and valve geometry. Current research focuses on some special aspects, such as technique for cusp repair or replacement, stabilization of the basal ring, and ideal material for the repair. Cusp prolapse in bicuspid and tricuspid aortic valves is the most frequent cause of aortic regurgitation in industrialized countries. On the basis of recent literature, as well as on our own experience, several recommendations are suggested for the most appropriate surgical management of the patients with aortic regurgitation due to cusp pathology. Details are presented on the diagnosis and intraoperative systematic analysis to be followed, as well as the different surgical techniques to be employed. The results obtained in 1808 patients undergoing aortic valve repair in our institution are presented.
La cirugía reparadora de la insuficiencia valvular aórtica se inició ya en la década de los 60 e incluso 501,2. Sin embargo, con las opciones de entonces, incluso antes del desarrollo de la ecocardiografía, fue difícil la valoración del mecanismo patogénico de la insuficiencia valvular, así como del resultado quirúrgico. Por ello, la sustitución de la válvula aórtica, al ser una técnica de fácil reproducibilidad, fue la opción que revolucionó el tratamiento de las valvulopatías. Posteriormente, se desarrollaron múltiples mejoras en las prótesis mecánicas e incluso aparecieron las nuevas prótesis biológicas3,4. A pesar de estas mejoras, ambos tipos protésicos mostraron una incidencia importante de complicaciones relacionadas con la propia prótesis5,6.
Sobre la base de los resultados positivos de la reparación valvular mitral, se iniciaron los primeros intentos para desarrollar conceptos y técnicas reproducibles en la reparación valvular aórtica. Duran et al.7 y Cosgrove et al.8 publicaron en 1992 los primeros resultados sobre la reparación aislada de la válvula aórtica. Ya en 1986, Frater publicó una técnica en la que una prótesis vascular conectada a la unión sinotubular permitía corregir la insuficiencia valvular causada por un aneurisma de aorta ascendente9. Yacoub10 y David11 publicaron sus técnicas para la sustitución de la raíz aórtica con preservación valvular. Estos 2 procedimientos, que están ampliamente establecidos y reconocidos, no deberán de tenerse en cuenta en la presente publicación para obtener un mejor enfoque en la reparación valvular aórtica aislada.
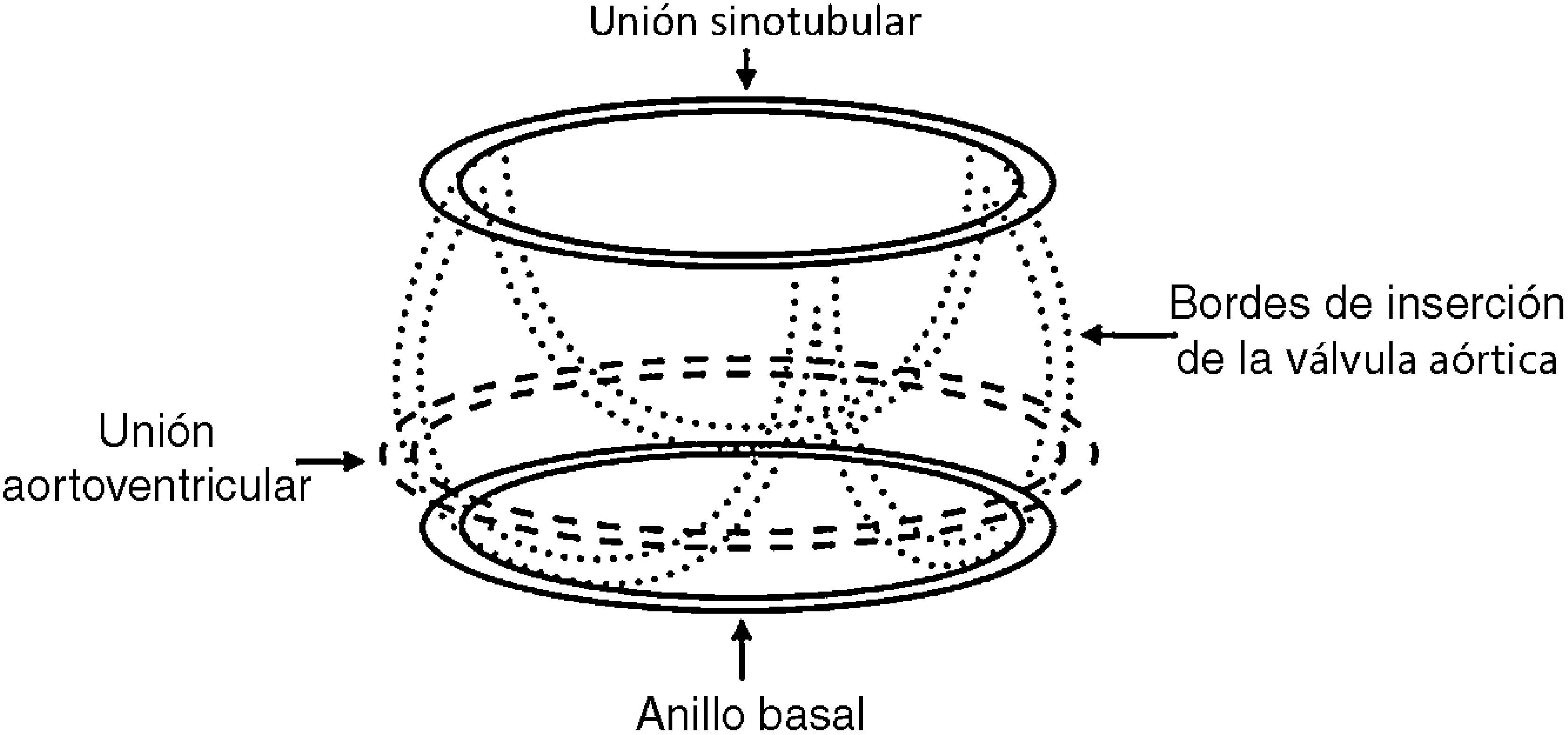
La experiencia en la sustitución de aorta con preservación valvular puso de manifiesto que una reparación funcional de la válvula aórtica no es reproducible y que solo se puede lograr en un determinado número de pacientes. Estas dificultades específicas distinguen la reparación valvular aórtica de las técnicas de reparación mitral. La anuloplastia se ha convertido en una parte esencial de la reparación mitral. Mientras que, en la válvula mitral, el anillo y sus dimensiones son relativamente fáciles de definir, en la válvula aórtica nos encontramos con la cuestión de si la dimensión más importante es la del anillo basal (fig. 1), la de la transición aorto-ventricular, la unión sinotubular o de la compleja forma de inserción de los bordes valvulares. De estas cuestiones, así como de los detalles anatómicos de la raíz aórtica, depende el obtener el mejor concepto de anuloplastia, siendo este actualmente el objetivo de múltiples estudios experimentales y clínicos12-14.
El segundo obstáculo que nos encontramos es la ausencia de información objetiva. Hasta hace pocos años no había casi ninguna información que pudiera utilizarse para evaluar el tamaño normal y la configuración de los senos de la válvula aórtica. Swanson y Clark15 ofreció valores relativos de ciertas dimensiones, sin embargo, estos eran difíciles de emplear para tomar decisiones intraoperatorias. Otras mediciones16 se realizaron en un pequeño número de homoinjertos aórticos y sin exponerlos a la presión que existe en condiciones fisiológicas. En definitiva, todos estos valores parecen poco plausibles17.
Una segunda diferencia radica en que la válvula aórtica se expone en sentido de su «flujo de salida», mientras que la válvula mitral se visualiza y valora en dirección a su «flujo de entrada». Por último, la forma y la función de la válvula aórtica dependen de la presión que existe en condiciones fisiológicas. Después del pinzamiento aórtico y la administración de cardioplejía, la forma de la raíz se modifica y la evaluación de las alteraciones morfológicas es entonces considerablemente más difícil.
Si en una reparación valvular no se tienen en cuenta estos aspectos de forma sistemática, el éxito de la intervención dependerá en gran medida de la sensibilidad del cirujano y los procedimientos seguirán siendo poco reproducibles.
En los últimos 10 años, se han desarrollado una serie de conceptos que han permitido evitar esta problemática. Sobre la base de estudios ecocardiográficos, la diferencia de altura entre los bordes de coaptación de los velos y el anillo basal (altura efectiva) se ha podido establecer como un parámetro de configuración constante18. La disponibilidad de un instrumento de medida especial ha permitido la determinación intraoperatoria de la altura efectiva. Además, se había observado que los resultados de la reparación valvular no eran buenos cuando existía una retracción de los velos. Otros estudios han permitido definir la altura del tejido de los velos de una válvula aórtica normal (altura geométrica)17. Estas mediciones han permitido objetivar qué velos valvulares tienen suficiente tejido para realizar una reparación y qué velos deberían ser reemplazados debido a la retracción que presentan y que condiciona un tejido insuficiente para la reparación.
Anatomía de la válvula aórtica. Patología de la insuficiencia aórtica. Selección para reparación valvular aórticaActualmente, se aceptan la válvula aórtica y la raíz aórtica como una unidad funcional. La raíz está limitada cranealmente por la unión sinotubular y caudalmente por una estructura virtual, el anillo basal (fig. 1). Sin embargo, las dimensiones normales de los velos están todavía por determinar, aunque se acepta que en una configuración valvular tricúspide la altura es de 20mm17. Las dimensiones de la raíz aórtica, entre sus 2 límites, junto con el tejido de los velos aórticos, son los parámetros que determinan la configuración de los velos de una válvula aórtica. Los valores estándar para el diámetro del anillo basal y la unión sinotubular siguen estando solo parcialmente establecidos. Probablemente, debería considerarse como ensanchado un diámetro basal superior a 25mm y una unión sinotubular de más de 30 a 35mm. Las válvulas aórticas normales presentan una configuración específica, caracterizada por una diferencia de altura de 9-10mm entre el anillo basal y la posición diastólica de los velos (altura efectiva)18.
Para una reconstrucción exitosa de la válvula aórtica, es importante definir los mecanismos de la insuficiencia y corregirlos. El mecanismo patogénico más común es la dilatación de la aorta. Una dilatación relevante de la raíz aórtica (> 45mm en caso de válvula aórtica tricúspide, > 40-42mm en válvulas aórticas bi o unicúspides) requiere, por lo general, un reemplazo de la raíz y no lo incluiremos en el contexto de la presente comunicación. Cuando las dimensiones de la raíz aórtica se mantienen dentro de los límites y la válvula aórtica es tricúspide, el prolapso de los velos suele ser el mecanismo patogénico de la insuficiencia aórtica (IA). El prolapso generalmente afecta a uno y, con menor frecuencia, a 2 o incluso los 3 velos. La etiología es, en la gran mayoría de los casos, la degeneración mixoide; en raras ocasiones el prolapso se produce como resultado de una fenestración con la consiguiente elongación o rotura de las estructuras de inserción de los velos. En dichos casos, es siempre conveniente la reparación valvular, siempre que en la ecocardiografía no se evidencie la existencia de fibrosis, retracciones tisulares o calcificaciones.
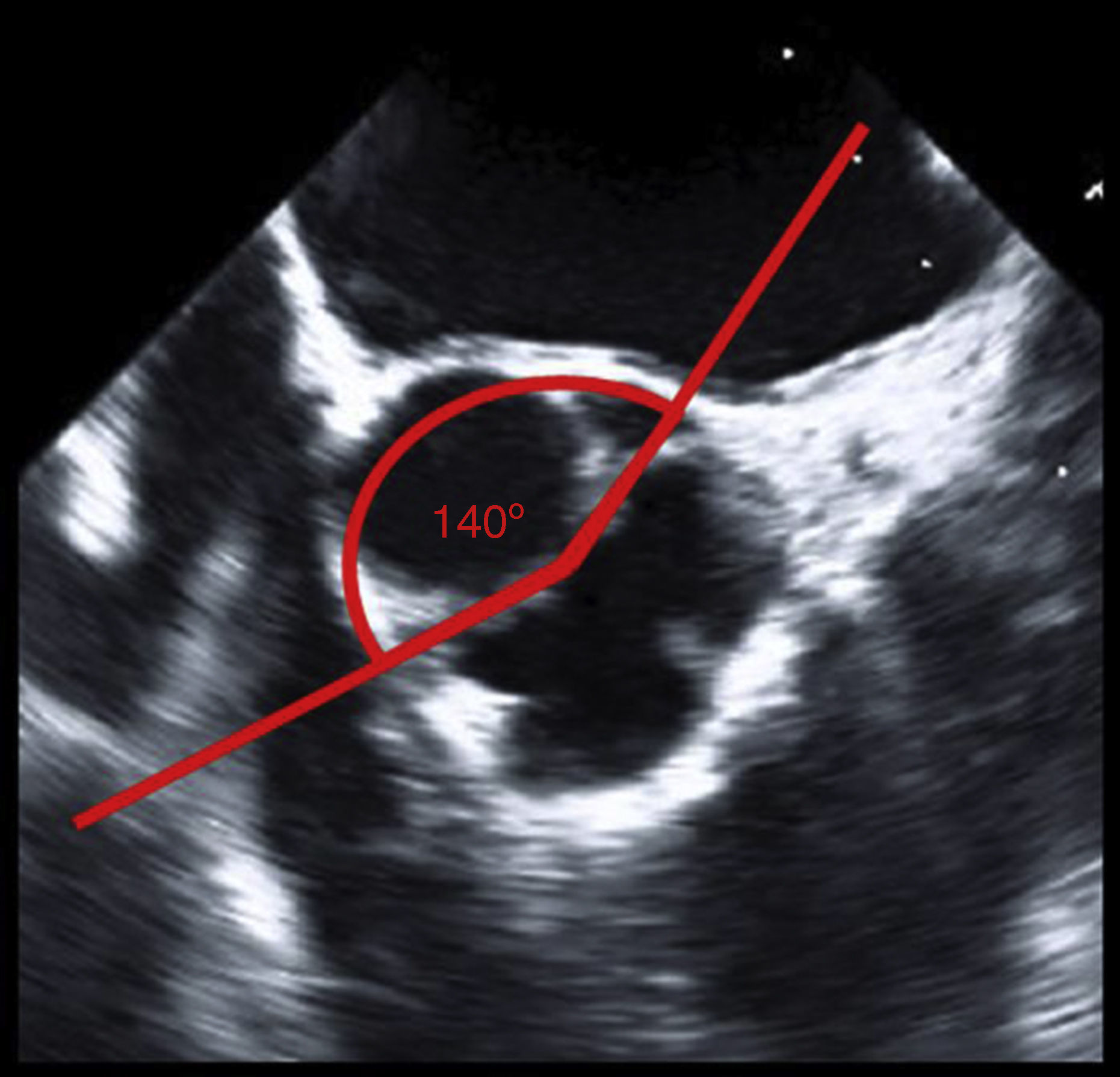
La válvula aórtica bicúspide implica unas condiciones más complejas. En ella, 2 velos están fusionados congénitamente y la comisura común es hipoplásica. La fusión puede tener diferentes patrones, la disposición circular de las comisuras del velo no fusionado puede variar entre 120 y 180° (fig. 2). El velo no fusionado es más grande que el velo de una válvula tricúspide. El mecanismo más común de regurgitación aórtica es un prolapso del velo fusionado; sin embargo, en las mediciones intraoperatorias encontramos que hasta en un 50% de los casos también existe un prolapso del velo no fusionado. En raras ocasiones, la causa de la insuficiencia es la retracción del velo fusionado. En la mayoría de los pacientes afectados se observa una dilatación añadida del anillo basal, pudiendo acompañarse en ocasiones de una dilatación de la raíz aórtica. Una orientación circular de las comisuras del velo no fusionado > 140 a 150° y la ausencia de calcificaciones son características que nos indican una alta probabilidad de reparación exitosa. Los componentes patológicos más comunes de la insuficiencia de la válvula aórtica bicúspide son el prolapso del velo fusionado y la dilatación del anillo basal; en raras ocasiones, también se asocia a un prolapso del velo no fusionado. En estos casos, una orientación de la comisura del velo no fusionado ≥ 150° y la ausencia de calcificaciones son las condiciones más adecuadas para una reparación19. Cuando sea necesario, los pequeños depósitos de calcio bajo el rafe medio pueden extraerse.
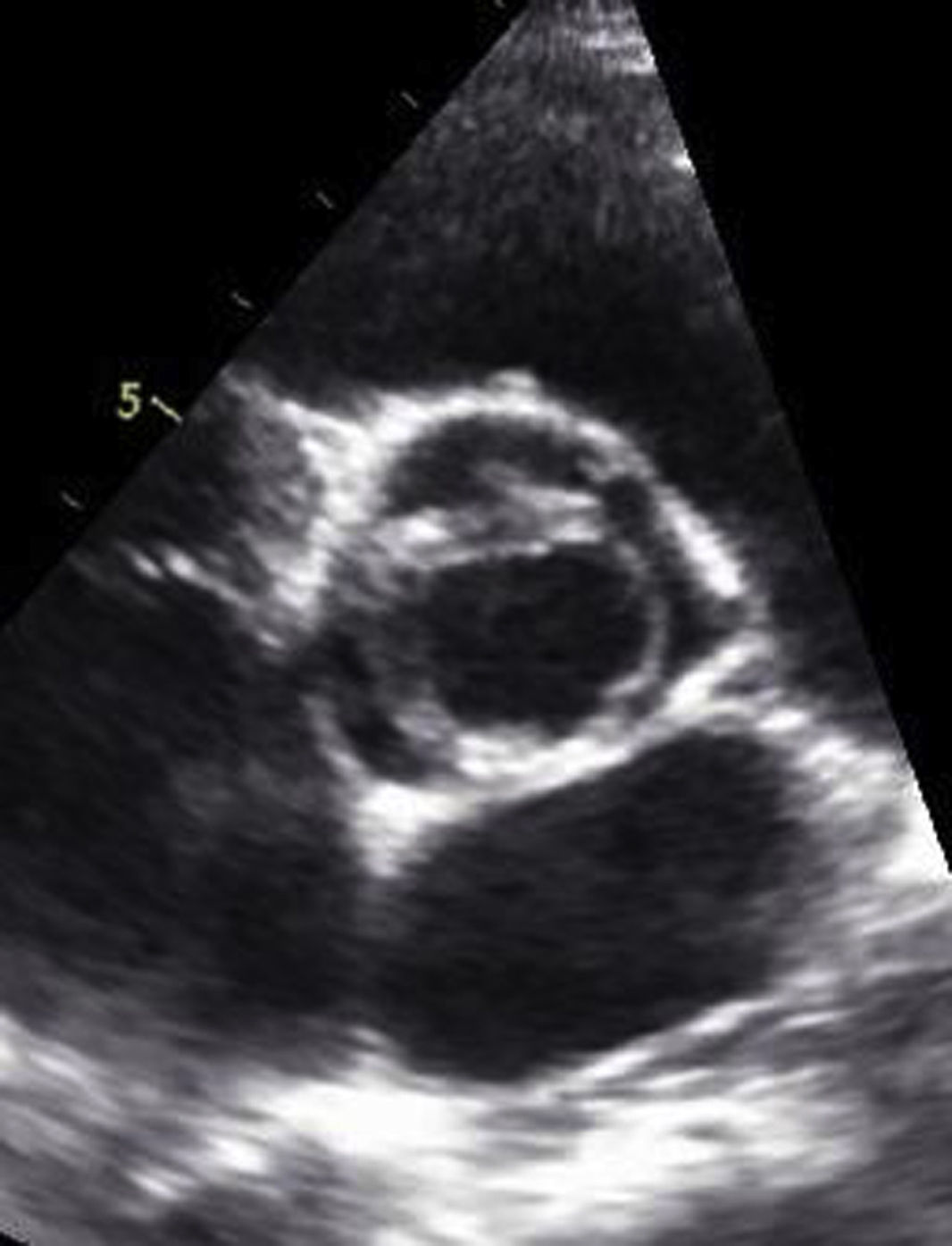
La ecocardiografía confunde a menudo la válvula aórtica unicúspide con la presencia de 2 cúspides, aunque la anatomía es fundamentalmente diferente20. La válvula aórtica bicúspide está caracterizada por la presencia de 2 comisuras de altura normal, las comisuras más altas se sitúan según los orificios coronarios correspondientes y solo la comisura hipoplásica tiene un nivel inferior a la normal. Por el contrario, la válvula aórtica unicúspide se caracteriza por una única comisura desarrollada normalmente y generalmente situada entre el seno no coronario y el coronario izquierdo. Ecocardiográficamente, el fenómeno característico es una abertura excéntrica en el eje corto (fig. 3). El mecanismo patogénico de la insuficiencia se produce por dilatación anular, por la displasia del velo de la coronaria derecha y por la posición anormal del velo derecho en la raíz aórtica. Generalmente, el jet de insuficiencia ecocardiográfico es central, mientras que en la válvula aórtica bicúspide el jet es excéntrico. La distinción es de gran importancia, puesto que la válvula aórtica unicúspide tiene una geometría diferente y requiere un enfoque distinto para su reparación. Es frecuente la presencia de calcificaciones en el velo coronario derecho; sin embargo, la extensión del calcio a los velos coronario izquierdo y no coronario crean una situación poco favorable para la reparación. Los componentes patológicos más importantes de la IA en casos de válvula aórtica unicúspide son la anomalía de las comisuras y la displasia del velo de la coronaria derecha, asociándose a menudo a una dilatación del anillo basal. En principio, la reparación sería factible si los velos están poco engrosados y no existen calcificaciones sobre el velo de la coronaria derecha21.
La válvula aórtica cuadricúspide es la malformación más infrecuente; en ella se observan 4 velos y 4 comisuras. El mecanismo de la insuficiencia se produce generalmente por la restricción de los velos debido a la presencia de una comisura adicional, además puede aparecer en combinación con una dilatación más o menos pronunciada de la aorta.
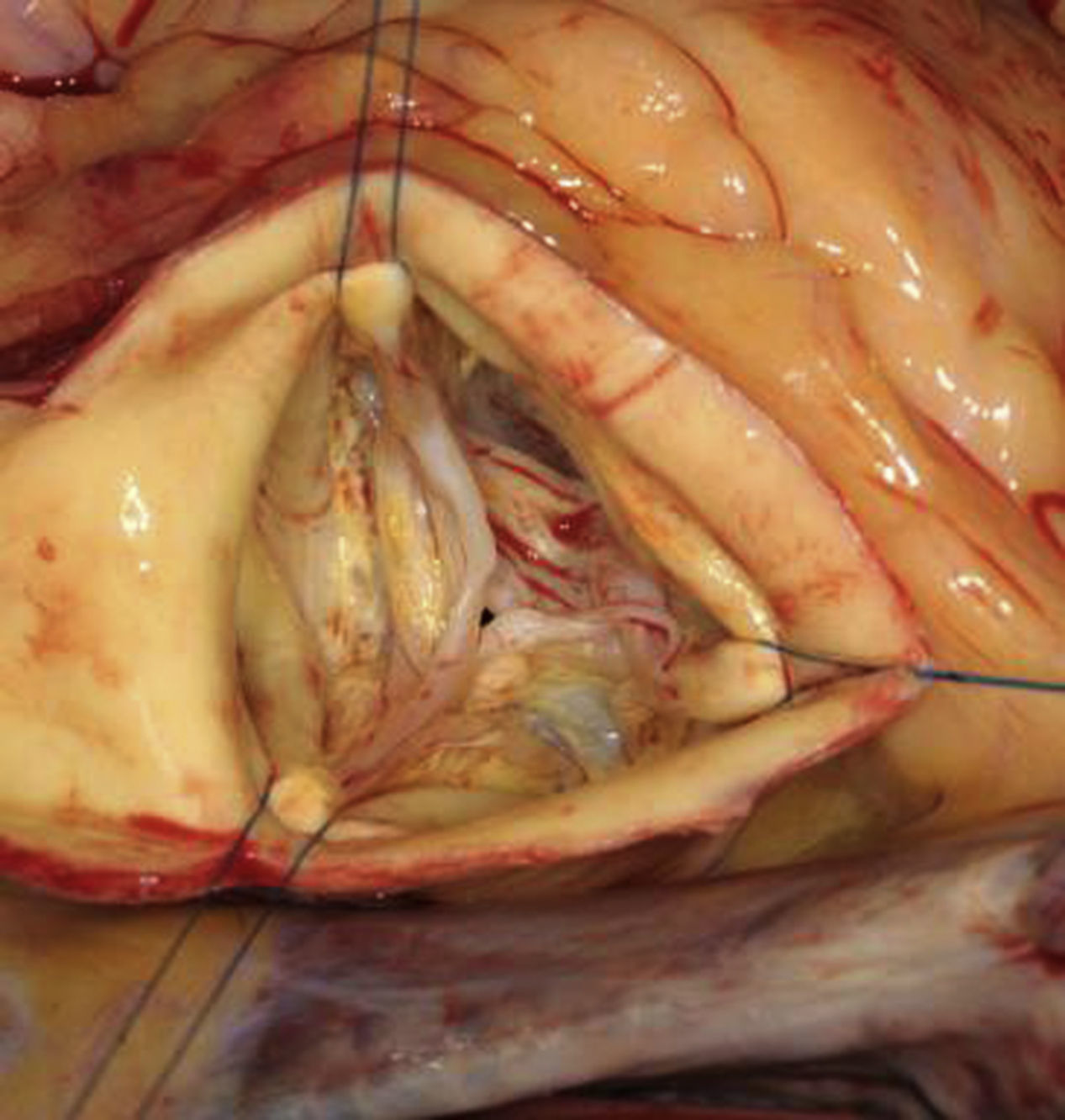
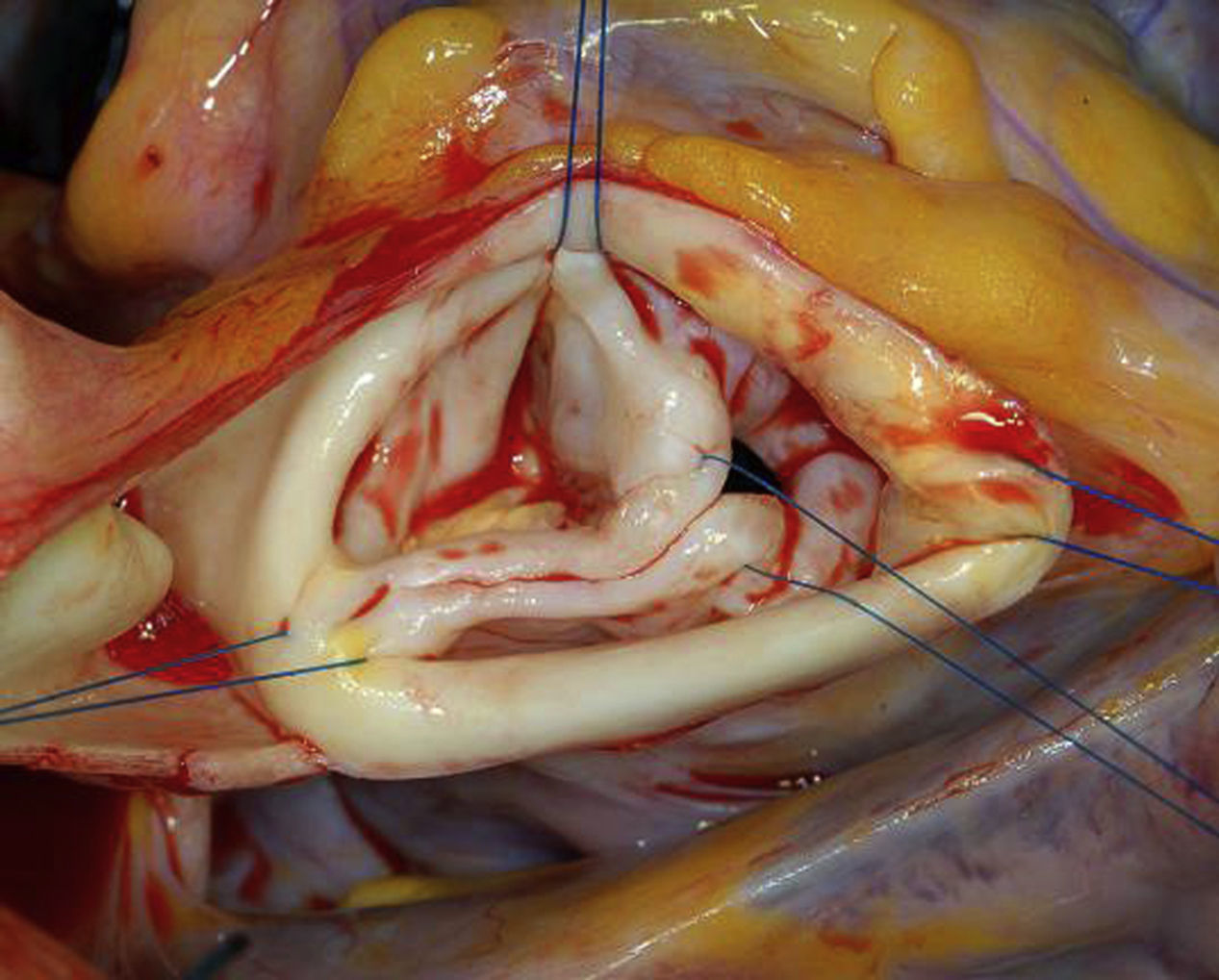
Exposición y exploración sistemáticaEl acceso indicado es la esternotomía media convencional con canulación aórtica y de aurícula derecha. La aortotomía se realiza mediante una incisión transversal 10mm por encima de la unión sinotubular. La cardioplejía se administra directamente en los ostium coronarios. Una exposición óptima y estable es esencial para el correcto diagnóstico del tipo de patología, así como para realizar una reparación que sea reproducible. Se deben aplicar puntos de tracción de polipropileno 4-0 desde el tejido de cada comisura y fijarse en la pared torácica bajo tracción. Es importante asegurar y mantener una orientación circunferencial de las comisuras y que la tracción de los puntos sea uniforme (fig. 4).
Para que la reparación sea reproducible, es necesario realizar una exploración y un diagnóstico sistemático. Se debe medir la altura geométrica de los velos (fig. 5) para excluir una posible retracción de alguno de ellos17. Si existe alguna retracción del tejido, generalmente no conseguiremos una reparación estable y satisfactoria. La variabilidad anatómica de la válvula aórtica bicúspide hace que solo una medición en el velo no fusionado sea suficiente. La altura debe ser de al menos 18mm en válvulas aórticas tricúspides y de 20mm en las bicúspides17.
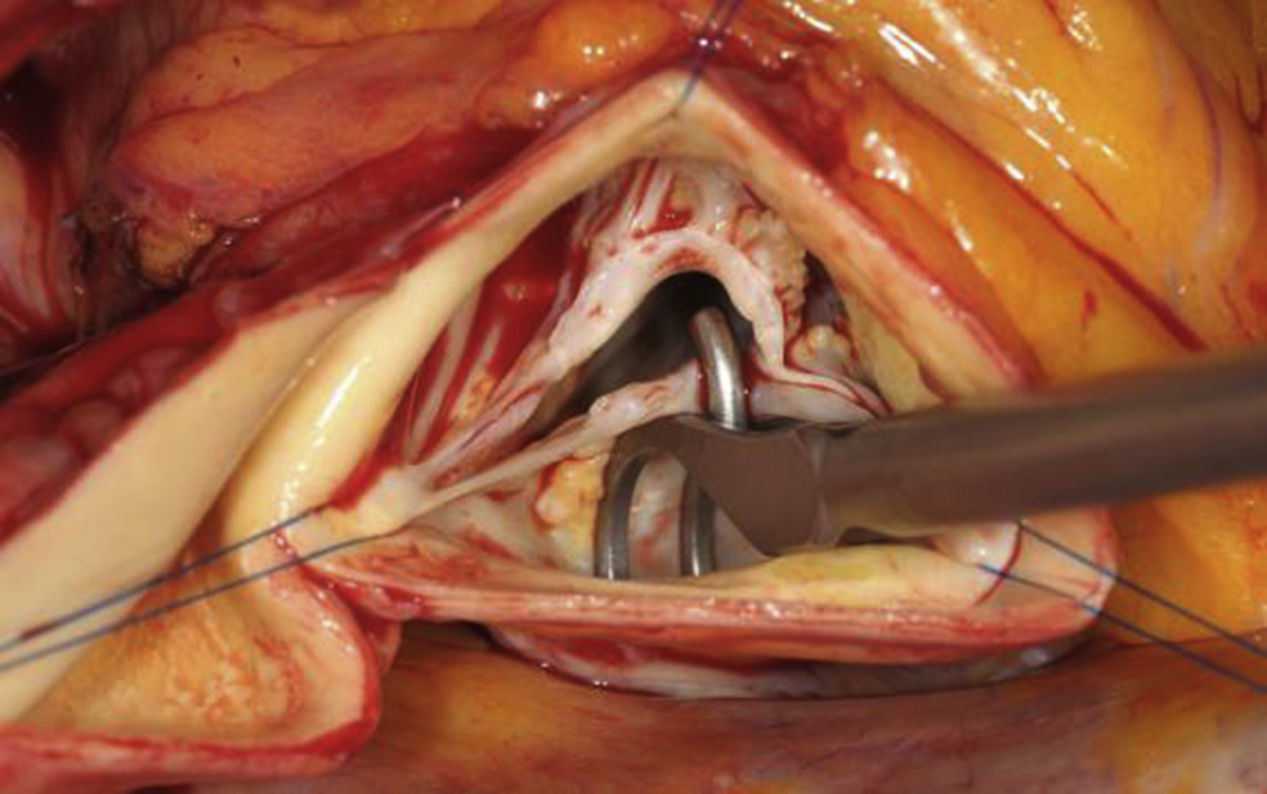
La medición de la altura efectiva de los velos se ha establecido como un parámetro de configuración reproducible y en ella se mide la diferencia de altura entre el punto más bajo del seno y el borde libre del velo. Esta altura se puede medir durante la intervención mediante un pie de rey (fig. 6) y en adultos normales tiene un valor de 9 a 10mm. Cuando la válvula aórtica es bicúspide, solo es útil la medición del velo no fusionado, ya que la inserción del velo fusionado en la raíz aórtica es muy variable.
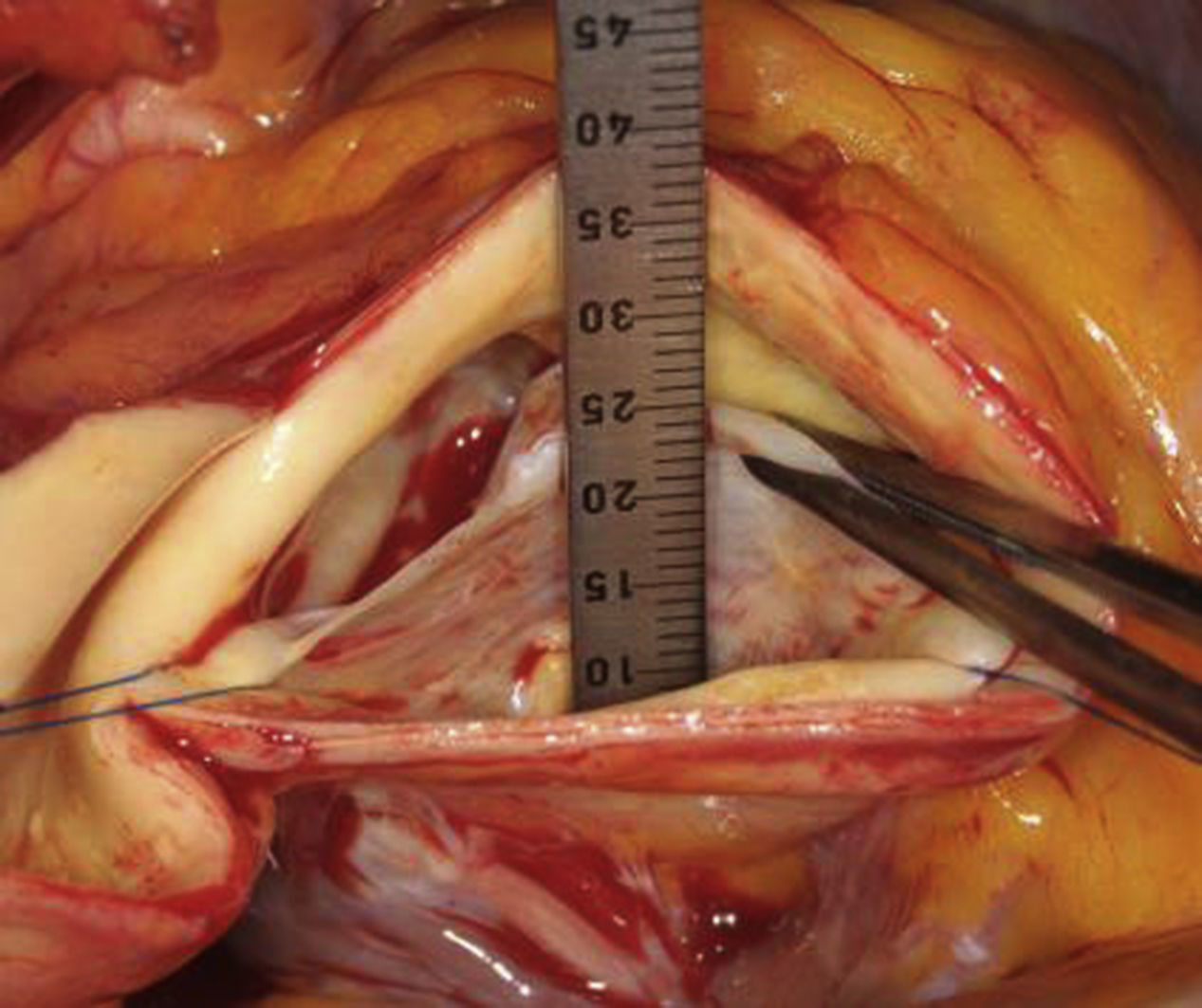
Como tercer parámetro de exploración sistemática, incluimos la medición del diámetro basal mediante un Hegar; esto nos permite establecer la necesidad de una anuloplastia. A menudo, la medición ecocardiográfica subestima el diámetro real, especialmente en los casos de válvulas bicúspides o unicúspides hemos observado que la medición intraoperatoria del diámetro supera en más de un 1cm la obtenida mediante estudio ecocardiográfico.
TécnicaVálvula aórtica tricúspideDespués de colocar las suturas comisurales en una orientación de 120°, seguimos un análisis sistemático de los componentes anatómicos-patológicos de la válvula y de la raíz donde planificamos la reparación. Esto incluye la medición de las alturas geométricas y efectivas de los 3 velos, así como de la determinación del diámetro basal. Para una altura geométrica de 19 a 20mm, la altura efectiva debería ser de unos 9-10mm. Cuando existe una desviación de ≥ 2mm, consideramos que existe prolapso. Del mismo modo, es importante realizar una inspección comparativa de la altura de los bordes de los velos. En la mayoría de las ocasiones, el prolapso se presenta en el velo de la coronaria derecha, con menos frecuencia se afecta el velo del no coronario, mientras que el prolapso del velo de la coronaria izquierda es raro. Ante la presencia de un prolapso, es importante explorar la existencia de fenestraciones paracomisurales. Estas fenestraciones (fig. 7) son anomalías congénitas y pueden observarse también en válvulas funcionalmente normales y ante dimensiones normales de la raíz. Habitualmente, se sitúan en la zona de coaptación de los velos y no causan ninguna insuficiencia, por lo que no requieren actuación sobre ellas. Sin embargo, si se localizan en un velo prolapsante, las fenestraciones deben tratarse y cerrarse.
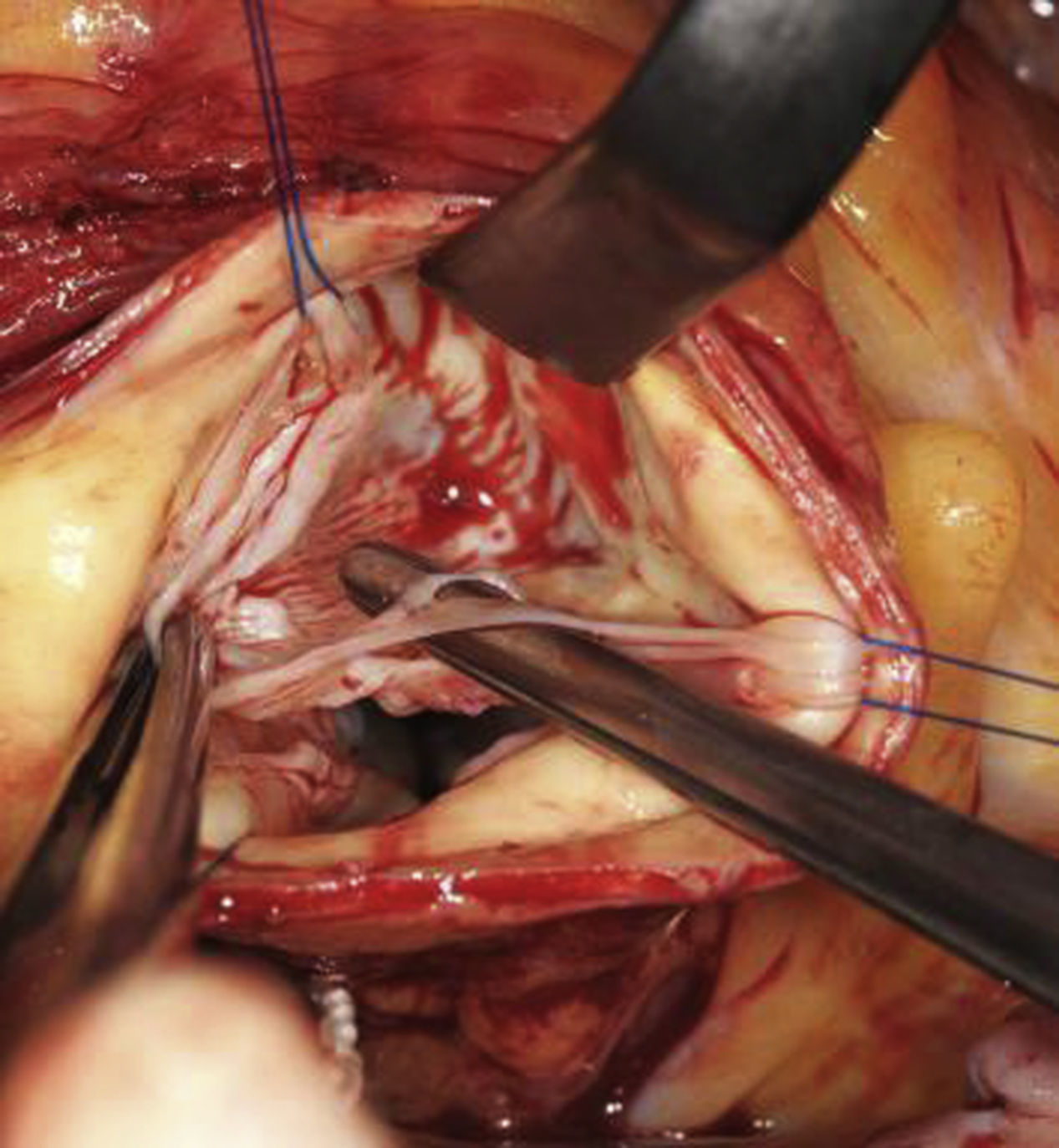
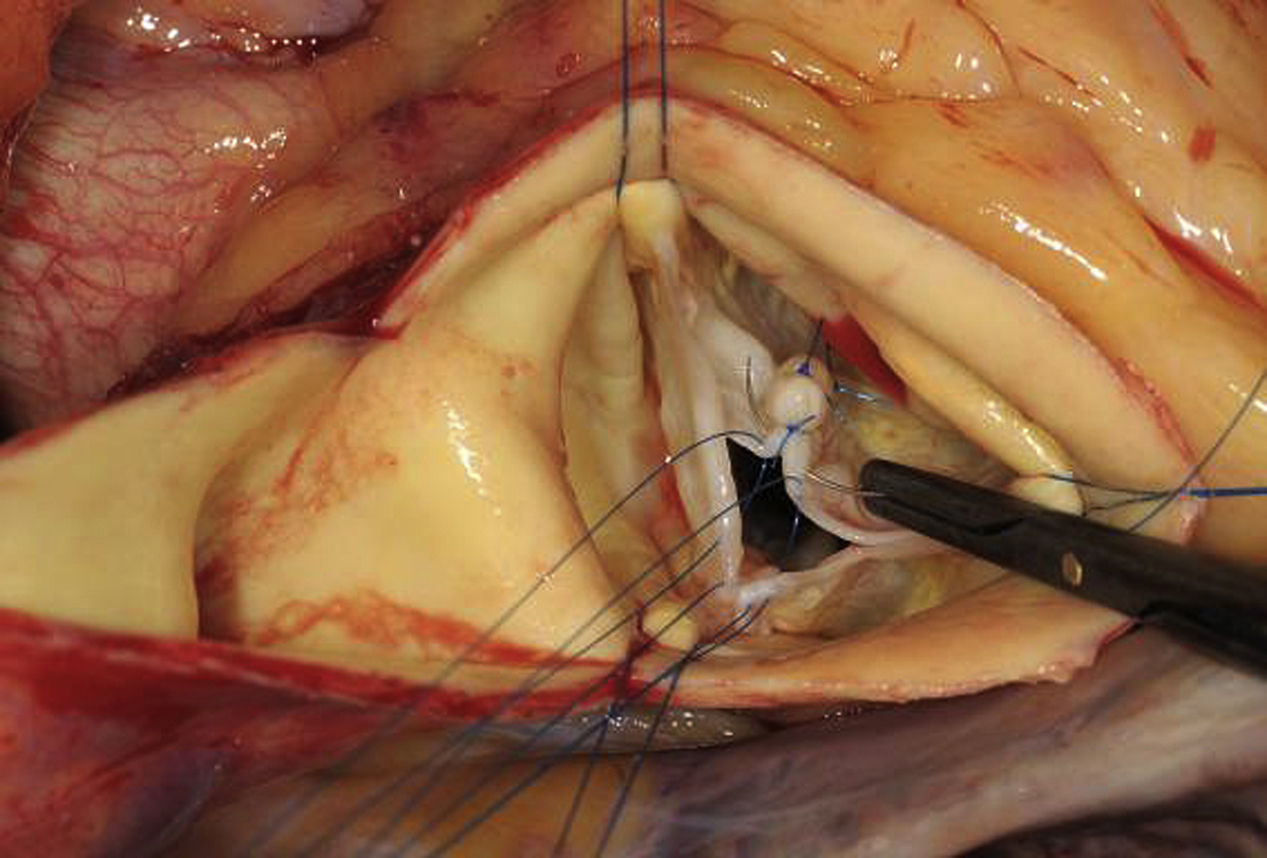
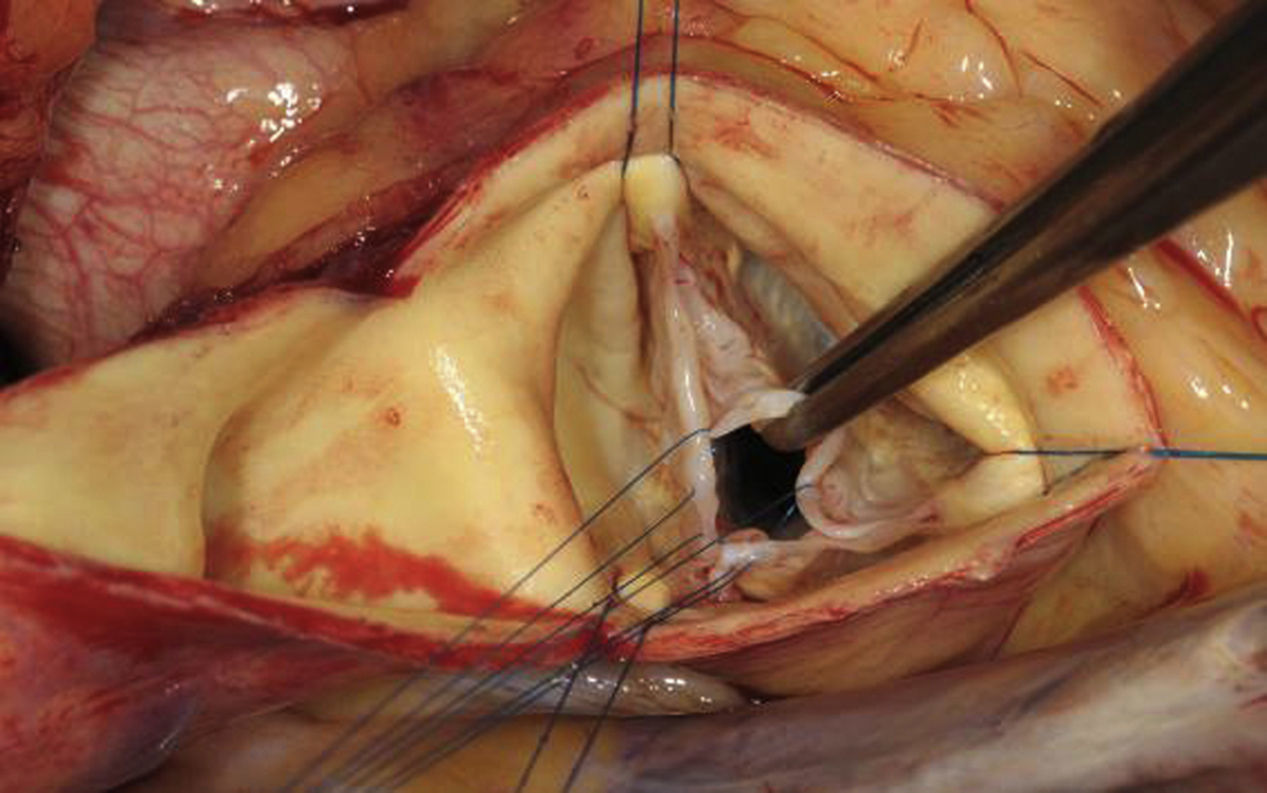
Ante la presencia de una dilatación significativa del diámetro basal, se requiere realizar una anuloplastia para lograr una estabilización de la válvula. Las posibilidades terapéuticas incluyen las suturas subcomisurales22, el empleo de un anillo23 o la anuloplastia circular con sutura12. Nosotros preferimos la anuloplastia circular con sutura de PTFE. Para realizarla, se debe abrir el espacio entre la aorta y el tronco pulmonar, y cuidadosamente crear un túnel dorsal entre la aorta y la arteria coronaria izquierda. La aorta, en la parte del seno no coronario, se diseca y separa de la aurícula derecha e izquierda. La preparación debe permitir la colocación de la sutura a nivel del anillo basal, es decir, acceder a los puntos más inferiores de los tres senos. Se emplea una sutura con doble aguja de PTFE (CV- 0), iniciándose el primer punto a través del tabique interventricular (fig. 8a), y después dorsal a la aorta, evitando la arteria coronaria izquierda hacia la derecha o lateralmente (fig. 8b). El punto se dirige a la parte media del seno no coronario y tangencial a través de la adventicia se exterioriza y fija. El segundo brazo de la sutura se inicia en el miocardio del ventrículo derecho a nivel del anillo basal, de forma que la sutura se sitúe externamente delante del septo membranoso. El área del septo membranoso se respeta y la sutura se fija en la adventicia del seno no coronario, a la altura de la inserción de la válvula. Para estabilizar y reducir el anillo a la dimensión deseada, se introduce en el tracto de salida del ventrículo izquierdo un Hegar adecuado al paciente y se anuda la sutura circular sobre el mismo. El Hegar empleado será de 25mm en hombres o pacientes altos (> 2 m2 de superficie corporal) y de 23mm en mujeres o pacientes más pequeños.
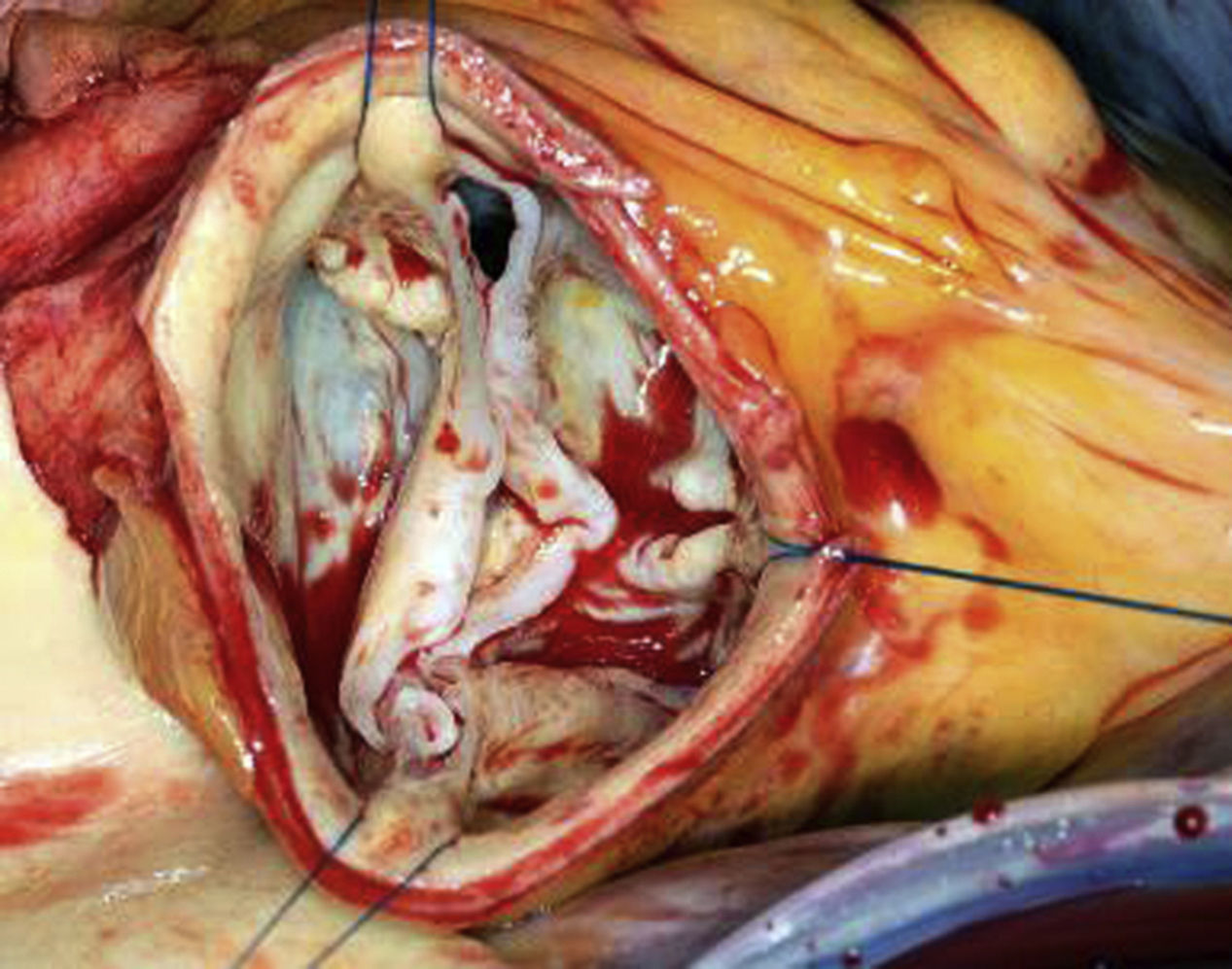
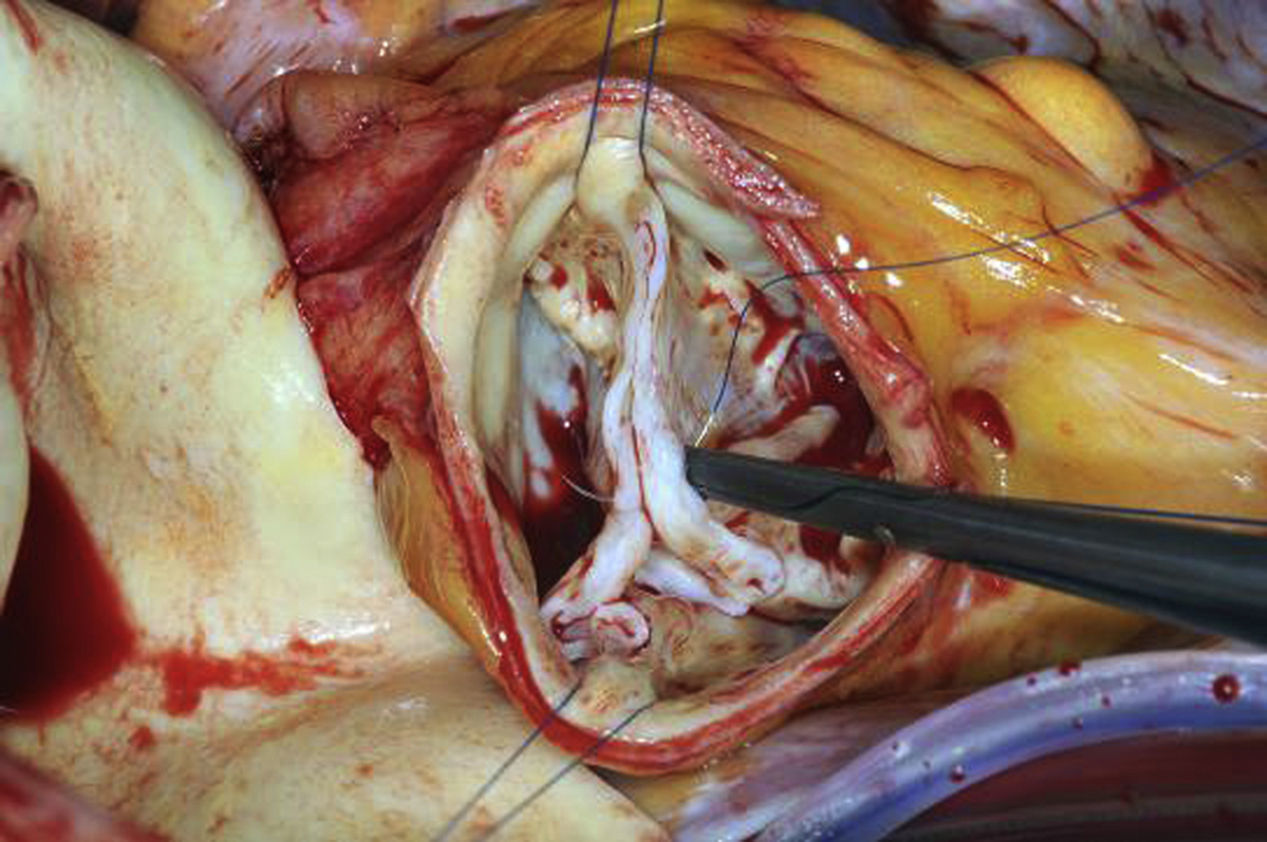
Seguidamente, se realiza la corrección del prolapso valvular. Se puede realizar mediante la plicatura del borde libre a nivel central1 o con el empleo de una sutura fina de PTFE a lo largo del borde libre24. Nosotros preferimos la plicatura con sutura en la parte central del velo, puesto que la tensión en esta zona es menor que en otras áreas. Con una sutura de polipropileno 5-0 o 6-0, se plican unos 3-4mm de tejido del velo; posteriormente, se verifica mediante la medición de la altura y la inspección, si el prolapso se corrige adecuadamente. Si una única sutura no es suficiente, se pueden colocar suturas adicionales hasta conseguir la configuración deseada. En el caso de que se produzca una tracción excesiva del tejido, puede ser aconsejable prolongar caudalmente la plicatura hacia el fondo del velo, con el fin de lograr una configuración lo más normal posible (fig. 9).
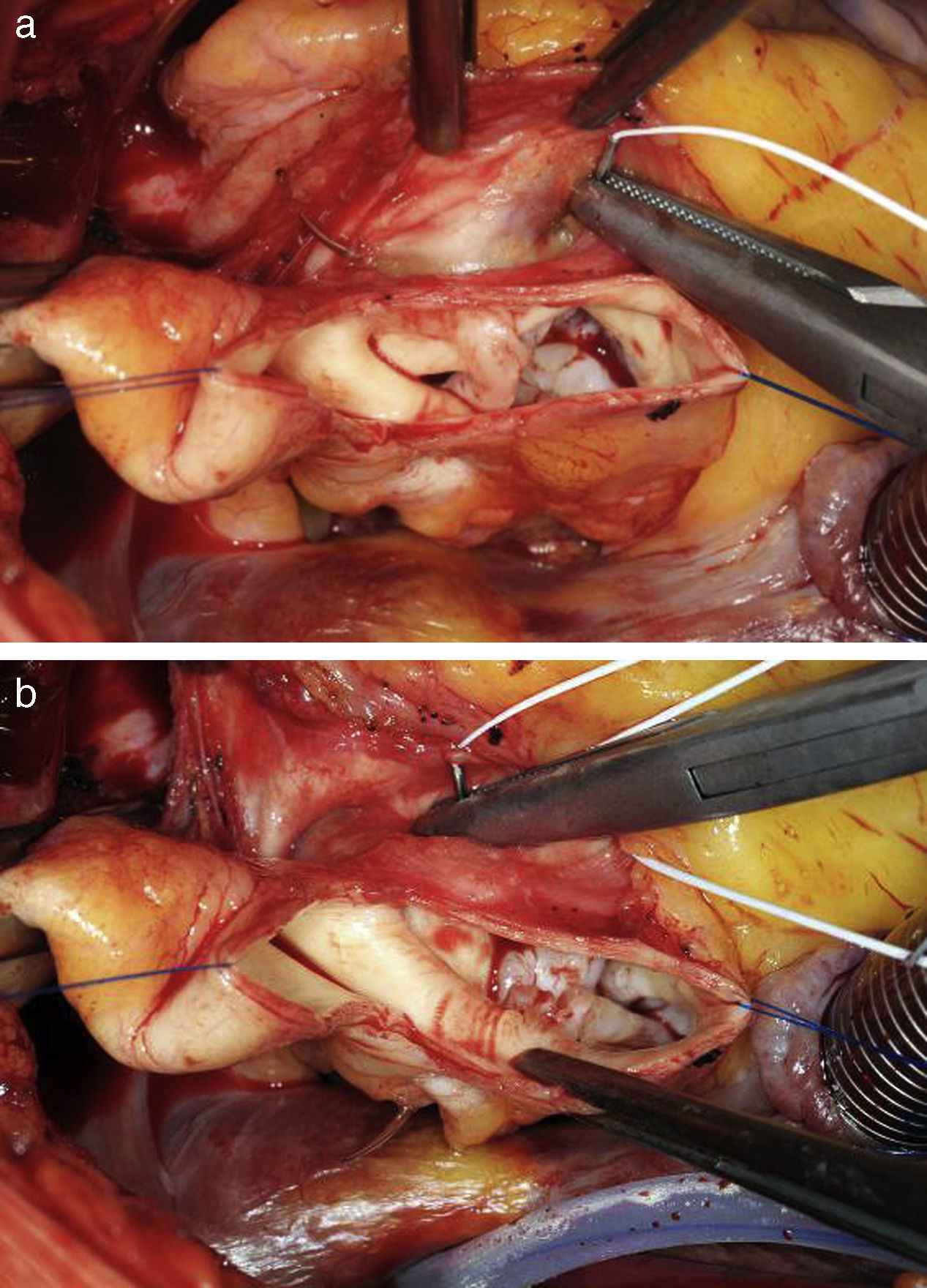
Cuando el prolapso afecta a un solo velo, la evaluación cuantitativa del exceso de tejido se realiza mediante el implante de suturas de tracción en el borde libre del velo. Para ello se coloca una sutura fina (p. ej., 6-0) en los bordes libres de los velos, de modo que la distancia a la comisura debe ser idéntica y la sutura permanecer tan central como sea posible. En el velo que prolapsa, el tejido redundante que debe ser eliminado quedará entre las suturas de tracción (fig. 10).
Después de la reparación, es esencial realizar de nuevo un control cuidadoso de la válvula y valorar la presencia de una configuración normal. Tras el cierre de la aortotomía, es imprescindible una revisión mediante ecocardiografía transesofágica (ETE). No siempre es posible conseguir una competencia completa de la válvula, por lo que puede aceptarse una insuficiencia residual trivial, así como una insuficiencia central ligera. Si existe insuficiencia, esta suele ser ecocardiográficamente más pronunciada en los primeros minutos de la reperfusión que en el momento del destete de la circulación extracorpórea. Es frecuente que la dirección de los chorros de reflujo cambie cuando la válvula se somete a presión. Al final de la intervención, la insuficiencia residual debe ser como mucho de grado ligero y el jet indicar que no hay prolapso residual.
Válvula aórtica bicúspideLa técnica de reparación de una válvula aórtica bicúspide es un procedimiento similar al descrito en la anatomía tricúspide, sin embargo, deben considerarse ciertas peculiaridades específicas de la anatomía bicúspide. Lo importante es la selección de los pacientes; el paciente ideal es aquel que presenta una válvula bicúspide simétrica. El procedimiento que se describe a continuación se emplea cuando las 2 comisuras del velo no fusionado tienen una orientación de > 140 a 150°, es decir, cuando la válvula es casi simétrica. Cuando la disposición de las comisuras se asemeja más a una válvula tricúspide, serán necesarios otros procedimientos, puesto que en esta disposición anatómica todavía no se ha desarrollado ningún criterio adecuado para la reparación valvular.
En una válvula aórtica bicúspide, durante la colocación de suturas comisurales se debe tener en cuenta la orientación variable de las comisuras (fig. 11). Cualquier distorsión puede hacer que el resultado de la reparación sea impredecible. Por ello es necesario un análisis sistemático de los componentes anatomopatológicos de la válvula y de la raíz a fin de planificar el procedimiento reparador. Deben valorarse visualmente la orientación circular de las comisuras y la extensión (completa o parcial) de la fusión. Las mediciones de la altura geométrica y efectiva se limitan al velo no fusionado; este debe tener una altura geométrica de al menos 20mm y una altura efectiva de al menos 10mm17,18. Una altura efectiva < 10mm se considera prolapso y, por tanto, será necesario corregirlo. La gran variabilidad existente en el tipo de fusión y el aspecto anatómico hace que no tenga sentido realizar mediciones adicionales en el velo fusionado. En su lugar, deberán compararse la longitud y la altura del borde libre de los velos fusionados con el del no fusionado. El diámetro basal de la raíz de la aorta se valorará mediante un medidor de Hegar. Se tendrá en cuenta que la abertura oval que presentan las válvulas bicúspides puede precisar el empleo de un Hegar más pequeño y además que sea necesario una estimación del tamaño real. Generalmente, se suele encontrar una dilatación significativa del anillo basal. La combinación más común es una dilatación anular y un prolapso del velo fusionado, aunque en más del 40% de los casos se aprecia también un prolapso del velo no fusionado.
Debido a la frecuente presencia de dilatación del anillo basal, la anuloplastia en una válvula aórtica biscúspide es incluso más importante que en una válvula tricúspide. En la anatomía bicúspide se ha demostrado que la reducción del anillo mediante suturas subcomisurales no crea una estabilización adecuada; además, en algunos casos, y como resultado directo de estas suturas, se han observado erosiones o cambios inflamatorios en los velos25 (El Khoury, comunicación oral). En estos casos, utilizamos la anuloplastia con sutura circular12. La técnica es idéntica al procedimiento empleado en la anatomía tricúspide. Frecuentemente, las válvulas bicúspides presentan un tronco coronario principal izquierdo corto, por lo que se debe tener especial cuidado y garantizar la protección de la arteria circunfleja. También en estos casos, la elección del tamaño del medidor de Hegar se realiza de acuerdo con la superficie corporal del paciente.
No está claro si en el rafe medio se requiere realizar algún tipo de intervención. En los casos en los que el engrosamiento y la retracción del tejido provoquen una restricción evidente de los velos fusionados, será necesario cortarlos o resecar el tejido engrosado.
La configuración de válvula se conserva y mantiene; sin embargo, partiendo de una válvula bicúspide deformada, se crea una nueva válvula cuya morfología permite una función casi normal. La creación de una anatomía tricúspide es geométricamente desafiante y poco reproducible. De acuerdo con el análisis inicial, después de realizar la anuloplastia proseguimos con la corrección del prolapso. Si el velo no fusionado presenta una altura efectiva de 10mm, este se puede utilizar como referencia del velo fusionado. Del mismo modo que en el anterior procedimiento y con el objeto de obtener un enfoque conciso, se sujetarán los bordes libres de los velos fusionados y del no fusionado con finas suturas de tracción (fig. 12). Si existe una configuración normal, la distancia entre las suturas de tracción debe ser idéntica en ambos velos; si, por el contario, existiera una diferencia de longitud, será necesario eliminar el tejido realizando una plicatura del mismo. Ante la presencia de cambios fibróticos o calcificaciones en la zona de fusión, se puede realizar una resección triangular limitada. En este caso, las 2 partes restantes del velo fusionado se adaptaran con puntos sueltos. Si después de realizar la resección triangular queda un defecto extenso, este debe cerrarse mediante la sutura de un parche de pericardio. Debe valorarse cuidadosamente la necesidad de suturar un parche, ya que el uso del mismo se asocia a un riesgo relevante de reoperación en los primeros 5 años19.
La revisión de la competencia valvular por ETE es esencial, siendo además necesario garantizar, antes de finalizar la intervención, que los gradientes sistólicos son aceptables. En nuestra experiencia, un gradiente medio de más de 15mmHg raramente se encuentra en una válvula bicúspide. En el caso de que aparezca un gradiente relevante (pico > 35mmHg, medio > 20mmHg), debe evaluarse la necesidad de la sustitución valvular. Tras haber abandonado el empleo de suturas subcomisurales, solo en ocasiones excepcionales hemos observado gradientes de dicha magnitud.
Válvula aórtica unicúspideLa reparación de la válvula aórtica unicúspide debe tener en cuenta sus peculiares condiciones anatómicas e intentar crear una válvula con una morfología más propicia. La transformación en una configuración tricúspide se ha llevado a cabo por algunos grupos con poca reproducibilidad y escaso éxito. Por el contario, hemos desarrollado el concepto de «bicuspidización», el cual ha resultado ser geométricamente sencillo y muy reproducible21. El objetivo es crear una nueva comisura de altura normal, que quede ubicada idealmente enfrente de la comisura normal. En la mayoría de los casos, se debe resecar el tejido displásico y de posición no provechosa del velo de la coronaria derecha, mientras que el velo de la coronaria izquierda y el no coronario se agrandan empleando un parche de pericardio, de manera que se consigue la configuración de una válvula bicúspide simétrica.
Las suturas de tracción extienden la raíz aórtica (fig. 13). Durante el análisis, la atención debe centrarse en los componentes de la válvula cuya preservación está prevista, por tanto, la altura geométrica del velo de la coronaria izquierda y del no coronario debería ser superior a 20mm. Es importante valorar el grado de engrosamiento displásico o calcificación. Si estos cambios están limitados y localizados en el velo derecho, la reparación se puede realizar con una durabilidad aceptable. Sin embargo, si se requiere la resección de una parte del velo coronario izquierdo y el no coronario, será necesario el empleo de parches muy grandes para reparar el defecto, con lo que la probabilidad de reoperación aumenta significativamente. Generalmente, la medición del anillo basal solo es factible después de la resección del velo de la coronaria derecha, algo que siempre debe realizarse por las razones anatómicas anteriormente mencionados.
Procedemos ahora a establecer la posición de la nueva comisura anterior. Esta deberá ubicarse a la derecha del ostium de la arteria coronaria derecha, para quedar lo más simétrica posible a la comisura entre los velos de la coronaria izquierda y el no coronario. Idealmente, debería alojarse craneal al ostium para asemejarse lo máximo posible a las proporciones normales. Seguidamente, se procede a la medición de diámetro basal; si este es superior a 27mm, será necesario realizar una anuloplastia. Para llevarla a cabo, preferimos la anuloplastia con una sutura fuerte de PTFE, al igual que en las otras variantes anatómicas.
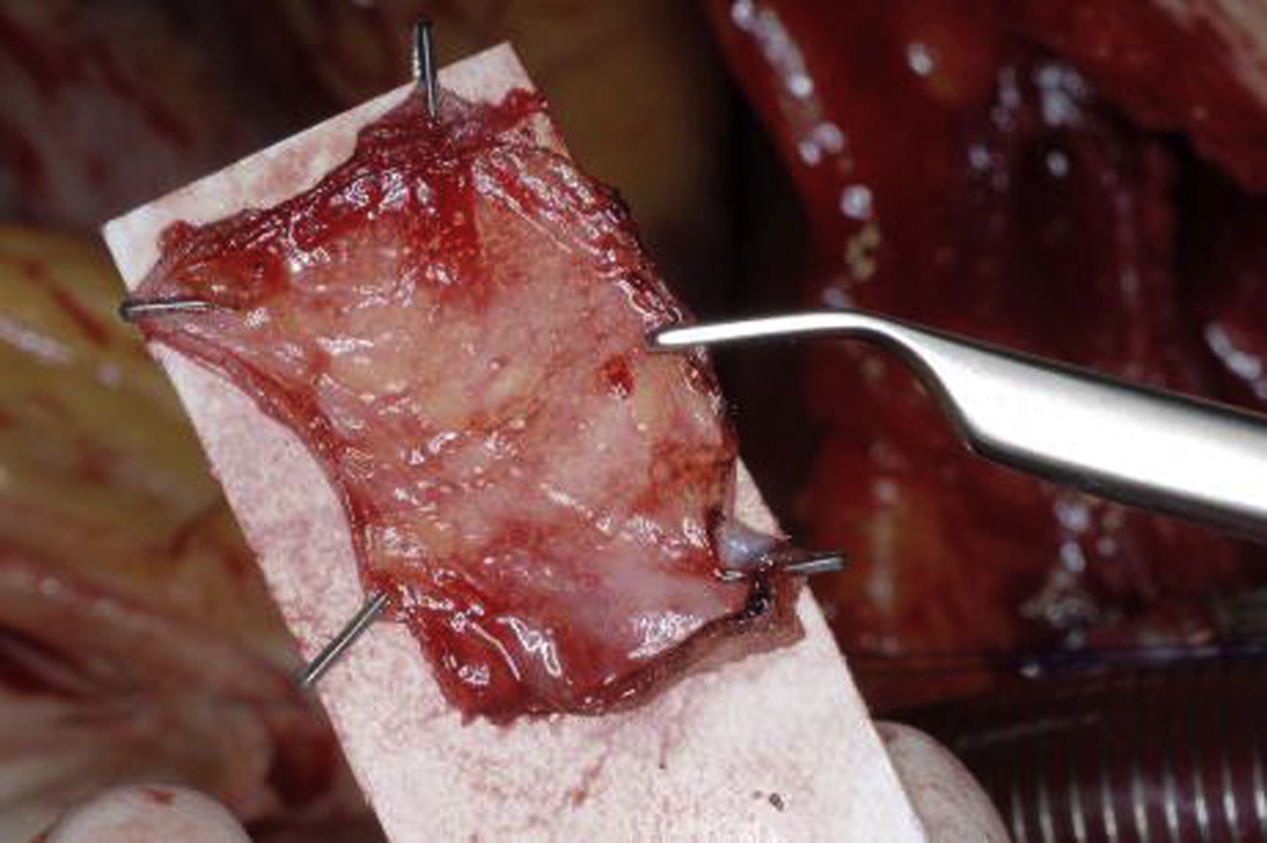
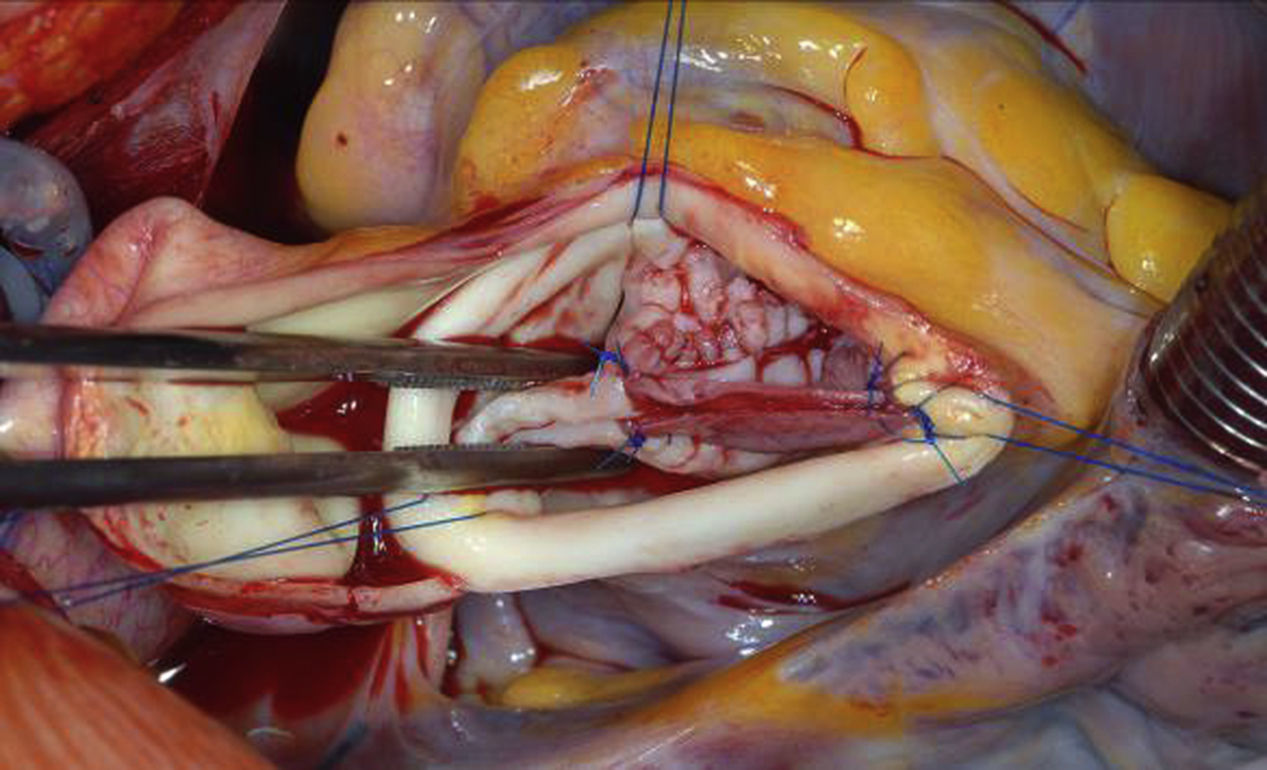
Para salvar la distancia entre el velo izquierdo o el no coronario y la nueva comisura anterior, será necesario en empleo de un parche. Para ello, el pericardio autólogo o heterólogo es el material más comúnmente empleado. Para este propósito, nosotros preferimos el pericardio autólogo; lo fijamos con clips sobre un fragmento de cartón y lo tratamos durante 3 min con glutaraldehído al 1,5% (fig. 14); finalmente, se irriga durante 3 min con solución salina. Se prepara un parche rectangular con una anchura de 2×2,5cm, aproximadamente, realizando en el mismo un corte lateral que coincida con la curva de inserción de la válvula. Siempre con la superficie lisa hacia arriba, el parche se sutura en la raíz aórtica entre el velo izquierdo y la comisura anterior. A continuación, se procede a revisar la configuración del nuevo velo: según la experiencia con las válvulas aórticas bicúspides, el nuevo velo debería de tener una altura geométrica de al menos 20mm y una altura efectiva de 10 a 11mm. Si la altura efectiva es menor, se debe plicar el borde libre con suturas interrumpidas hasta que se logre la configuración deseada. Finalmente, un segundo parche se sutura entre el velo no coronario y la nueva comisura. Mediante tracción radial en las 2 comisuras, se comparan la longitud y la altura del borde libre de los velos. El nuevo velo izquierdo nos servirá como referencia y las correcciones se realizarán del mismo modo que en la reparación de la válvula aórtica bicúspide (fig. 15).
En la técnica de reparación de una válvula aórtica cuadricúspide deben tenerse en cuenta las características específicas de su disposición. En la selección de los pacientes, se valorará principalmente la presencia de unos velos con un tejido preservado y no fibrótico.
La orientación de las comisuras debe tenerse en cuenta en el momento de colocar las suturas comisurales. Se procede entonces a un análisis sistemático de la válvula y de la raíz con el fin de planificar el procedimiento reparador. El objetivo será el de convertir la válvula preferiblemente en una válvula tricúspide26. Esto se puede conseguir si uno o 2 de los velos son más pequeños que los otros en su circunferencia. La medición de la altura geométrica y la altura efectiva nos dará información acerca de la existencia de distorsiones o retracción de los velos. Estos deberían de tener una altura geométrica de al menos 18mm y una altura efectiva de al menos 9mm. El diámetro basal se medirá mediante un tallo de Hegar, aunque, hasta el momento, no hemos observado nunca una dilatación.
Si no existe dilatación del anillo, la anuloplastia basal como tal no será necesaria. De lo contrario, se aplicarán los mismos conceptos establecidos para la válvula aórtica tricúspide.
La configuración de la válvula se deberá modificar mediante la eliminación de una comisura y la unión de los 2 velos correspondientes a la misma. La creación de una anatomía tricúspide es geométricamente poco exigente y relativamente reproducible. Posteriormente, los velos se deberán analizar según el procedimiento descrito para una válvula tricúspide. Si se demuestra la existencia de un prolapso, este deberá de corregirse mediante una plicatura del mismo con suturas. Del mismo modo, si se requiere aumentar el velo, se realizará mediante un parche de pericardio.
No es infrecuente que la funcionalidad y la competencia valvular evaluada mediante ETE muestren una insuficiencia residual central. Dicho hallazgo no se asocia a una pobre estabilidad de la reparación valvular, siempre y cuando la vena contracta sea estrecha (< 2mm).
ResultadosLos resultados de la reparación valvular aórtica son muy dependientes de la anatomía y los cambios patológicos que presente la válvula. Desde 1996, hemos realizado 1.808 intervenciones de este tipo, de los cuales 951 se realizaron en válvulas aórticas con anatomía tricúspide, 693 en bicúspide y 157 en válvulas unicúspides, estando presente la anatomía cuadricúspide en 7 casos.
En casos de anatomía tricúspide con retracción de los velos, la cirugía de reparación valvular aórtica se asocia a un riesgo de recurrencia del 30% en los primeros años27. Un resultado tan insatisfactorio se podría evitar mediante la medición exhaustiva de la altura geométrica o bien realizando una sustitución valvular primaria, eludiendo la reparación en estas condiciones. Cuando la reparación de un prolapso, debido a degeneración mixoide o por elongación y/o rotura de una fenestración, logra una configuración normal de la válvula aórtica, la estabilidad de la reparación puede llegar al 95% entre los 5 y 10 años28. Otros autores también han reportado a medio plazo unos resultados similares29.
En la válvula aórtica bicúspide, los resultados de la reparación dependen claramente de las características anatómicas de la válvula. Los factores de riesgo para la reoperación incluyen una orientación de las comisuras de < 150-160°, de la necesidad de implantar un parche de pericardio y de la dilatación del anillo basal > 28 mm19. Cuando estos factores de riesgo no están presentes y la válvula tiene una configuración optima (≥ 9mm altura efectiva), la estabilidad de la reparación es del 90-95% a los 10 años. La realización de una anuloplastia elimina el riesgo de una dilatación anular posterior, aunque actualmente todavía no se disponen de datos a largo plazo12. El tratamiento óptimo, en casos de válvulas bicúspides cuya orientación comisural es ≤ 140°, sigue siendo controvertido, pudiendo realizarse un reemplazo de la raíz aórtica con ajuste de su orientación, o bien una reparación valvular como una válvula aórtica tricúspide. Según otros grupos, la estabilidad a medio plazo de la reparación varía del 80 al 95% a los 5 años, aunque las características anatómicas valvulares no se describen claramente en sus publicaciones30,31.
En cuanto a la reparación de la válvula aórtica unicúspide, existen actualmente pocos datos disponibles acerca de su durabilidad. Una configuración simétrica ofrece claros beneficios hemodinámicos comparada con una configuración asimétrica32, lo que posiblemente conlleve también una mejor estabilidad. La ausencia de reoperación a los 5 años es, en niños, del 87% siendo los resultados mejores que en adultos. Los resultados iniciales de la anuloplastia con sutura de PTFE indican que, en un futuro, este concepto también se podría utilizar en pacientes adultos con una estabilidad aceptable. Sin embargo, no hay disponibles publicaciones similares de otros grupos al respecto.
Hasta la actualidad, la válvula aórtica cuadricúspide se ha corregido consiguiendo una buena estabilidad en todos los pacientes; sin embargo, también todos ellos presentaron una insuficiencia ligera residual26.
La frecuencia de las complicaciones asociadas a la válvula son bajas en todas las formas de reparación valvular aórtica33. La necesidad de una reoperación es la complicación más común. Las complicaciones tromboembólicas o hemorrágicas aparecen, bajo tratamiento con aspirina, durante 2 meses, solo en el contexto de una fibrilación auricular. En nuestra experiencia, la probabilidad de endocarditis se establece en el 0,15% por paciente y año.
ConclusionesLa reparación de la válvula aórtica se ha convertido en los últimos 10 años en una alternativa aceptable a la sustitución valvular. La probabilidad de complicaciones relacionadas con la válvula es baja, siempre que se haya conseguido una estabilidad suficiente de la válvula. Un enfoque sistemático, en cuanto al análisis y la corrección de la patología subyacente, permite, de forma reproducible, poder excluir sustratos subóptimos para una reparación, así como definir que válvulas son adecuadas para una reparación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.