La sustitución valvular ha modificado la historia natural de la valvulopatía aórtica y constituye la piedra angular del tratamiento quirúrgico. Sin embargo, conlleva de por vida un elevado riesgo acumulado de complicaciones relacionadas con las prótesis (tromboembolismos, endocarditis, deterioro estructural de las prótesis biológicas, reintervenciones) y con la necesidad de anticoagulación. Por eso, la reparación valvular emerge con fuerza como alternativa en el manejo de la insuficiencia aórtica, particularmente en los individuos más jóvenes. Se realiza hoy con una mortalidad quirúrgica baja y los grupos quirúrgicos con gran experiencia reportan buenos resultados en términos de durabilidad. Además, el desarrollo y la difusión de las técnicas de cirugía conservadora de la válvula aórtica para el tratamiento del aneurisma de aorta ascendente han mejorado nuestra comprensión del papel destacado de la raíz de aorta en la función valvular y han conducido al desarrollo de soluciones quirúrgicas adaptadas a cada caso de insuficiencia aórtica, con o sin enfermedad de la raíz.
Valve replacement has changed the natural history of aortic valve disease and is the keystone of surgical treatment. However, it carries a high accumulated risk of complications related to the replacement valve (thromboembolisms, endocarditis, structural deterioration of biological replacements) and the need for anticoagulants. For these reasons, valve repair is strongly emerging as an alternative in the management of aortic insufficiency, particularly in younger patients. It is now performed with a low surgical mortality rate, and surgical groups with wide experience report good results in terms of durability. Furthermore, the development and knowledge of aortic valve conservative surgical techniques for the treatment of ascending aortic aneurysm has improved our understanding of the role played by the aortic root in valvular function, and has led to the development of surgical solutions adapted to each individual case of aortic insufficiency, with or without root disease.
La sustitución valvular ha modificado la historia natural de la valvulopatía aórtica y constituye la piedra angular del tratamiento quirúrgico. Sin embargo, conlleva de por vida un elevado riesgo acumulado de complicaciones relacionadas con las prótesis (tromboembolismos, endocarditis, deterioro estructural de las prótesis biológicas, reintervenciones) y con la necesidad de anticoagulación. Por eso, la reparación valvular emerge con fuerza como alternativa en el manejo de la insuficiencia aórtica, particularmente en los individuos más jóvenes. Se realiza hoy con una mortalidad quirúrgica baja y los grupos quirúrgicos con gran experiencia reportan buenos resultados en términos de durabilidad1,2. Además, el desarrollo y la difusión de las técnicas de cirugía conservadora de la válvula aórtica para el tratamiento del aneurisma de aorta ascendente han mejorado nuestra comprensión del papel destacado de la raíz de aorta en la función valvular y han conducido al desarrollo de soluciones quirúrgicas adaptadas a cada caso de insuficiencia aórtica, con o sin enfermedad de la raíz3.
Esta aproximación quirúrgica nos obliga a replantearnos el abordaje diagnóstico de las lesiones valvulares4, añadiendo la valoración de la reparabilidad. La selección de los procedimientos quirúrgicos más adecuados en cada paciente individual se basa en el diagnóstico de las lesiones anatómicas de los velos y de la raíz de aorta («aparato supravalvular») y en reconocer cómo falla la función valvular cuando se producen estas lesiones (mecanismos). En sus inicios, las decisiones sobre reparación valvular se tomaban sobre la base de las observaciones del cirujano, encontradas con el corazón parado y la aorta vacía de volumen en quirófano. Por lo tanto, una de las principales aportaciones de la ecocardiografía en el campo de la regurgitación aórtica es la posibilidad de obtener imágenes detalladas de la válvula y la raíz aórtica funcionando bajo el efecto de la presión arterial in vivo. El desarrollo de la ecocardiografía transesofágica intraoperatoria nos ha permitido realizar, antes de la toracotomía, una aproximación sistemática en tiempo real a la estructura, la función y, lo que es más importante, la interrelación estructura-función, es decir, a la anatomía funcional de la insuficiencia aórtica in vivo.
Clasificación funcional de la insuficiencia aórticaComo en el caso de la reparación valvular mitral, la movilidad de las cúspides de la válvula aórtica constituye el criterio básico en el que descansan las distintas clasificaciones funcionales de la insuficiencia aórtica.
En 1997, Haydar distingue 3 tipos de insuficiencia valvular aórtica sobre los que se establecen las primeras bases para estandarizar las técnicas de reparación en la población pediátrica5. El tipo 1 se caracterizaba por dilatación del anillo con movilidad normal de los velos; el tipo 2 lo constituían aquellas válvulas con excesiva movilidad de las cúspides, siendo el prolapso aórtico su principal exponente, y el tipo 3 lo formaban válvulas con movimiento restrictivo de velos, fundamentalmente por déficit de tejido. En esta clasificación no encontraban lugar ni la perforación de las cúspides ni la patología de la raíz de la aorta, pero sienta las bases de futuras clasificaciones más exactas.
En 2005, El Khoury et al.6 publican una clasificación revisada en la que la raíz y la válvula aórtica se identifican como una unidad funcional y se reconocen la unión ventrículo-aórtica y la unión sinotubular (UST) como los anillos aórticos funcionales. Utilizando estos conceptos, establecen una clasificación de la insuficiencia en 3 mecanismos básicos con una orientación básicamente médico-quirúrgica:
1. Tipo 1: insuficiencia aórtica con velos normales y movimiento normal secundaria a la dilatación de los anillos funcionales. Según la forma anátomo-clínica de dilatación de aorta se distinguen:
- –
Ia: dilatación de la UST y de la aorta ascendente.
- –
Ib: dilatación de los senos de Valsalva y de la UST.
- –
Ic: dilatación de la unión ventrículo-arterial o anillo.
- –
Id: perforación de una cúspide sin dilatación del anillo.
2. Tipo 2: insuficiencia aórtica secundaria a prolapso valvular por tejido mixoide o excesivo y por disrupción de una comisura.
3. Tipo 3: insuficiencia aórtica secundaria al movimiento restrictivo de los velos con lesión estructural.
En cualquiera de los casos, lo interesante de estas clasificaciones es que permiten al cirujano elegir la técnica quirúrgica de reparación más adecuada en cada caso según el mecanismo responsable.
Ecocardiografía transesofágica intraoperatoria en la reparación valvular aórticaLas más recientes guías de práctica clínica recomiendan encarecidamente el empleo de la ecocardiografía transesofágica durante los procedimientos sobre la válvula aórtica. La ecocardiografía transesofágica intraoperatoria (ETEIO) demostró inicialmente su utilidad para describir el mecanismo de la regurgitación en la disección aórtica7 y, más recientemente, se ha publicado que también permite una descripción precisa de los mecanismos de la incompetencia valvular en todas las formas de insuficiencia aórtica, que tiene una elevada tasa de acuerdo con las observaciones quirúrgicas, y que predice adecuadamente la aplicabilidad de las técnicas de cirugía conservadora de válvula aórtica, el procedimiento de sustitución de aorta ascendente y el resultado postoperatorio8.
En un primer estudio de referencia se correlacionan los hallazgos de la ETEIO en una población de 163 pacientes con una edad media de 58±14 años con los hallazgos de la inspección quirúrgica y con el procedimiento elegido por el cirujano7. La ETEIO predijo correctamente la reparabilidad en el 86% de los casos y la necesidad de sustitución valvular en el 93% de los pacientes. Hay que destacar que el éxito de la reparación no dependía del grado de regurgitación preoperatorio ni de la técnica quirúrgica empleada, sino más bien de la descripción ecocardiográfica y del abordaje quirúrgico sistemático del mecanismo de la insuficiencia, encontrando los autores una correlación significativa entre la clasificación funcional de la insuficiencia aórtica y la reparabilidad. En el segundo estudio, nuestro grupo confirmó la utilidad de la ETEIO en la reparación valvular aórtica9. En 66 pacientes, la precisión diagnóstica de la ecocardiografía con respecto al examen directo del cirujano en quirófano fue del 87%, resultando el prolapso valvular la principal causa de discrepancia entre las técnicas (85%). El mecanismo de la insuficiencia se diagnosticó correctamente en el 85% de los casos y se correlacionó significativamente con el éxito de la reparación (p<0,05).
A continuación, repasaremos los hallazgos ecocardiográficos en los distintos mecanismos fisiopatológicos de la insuficiencia aórtica y los signos ecocardiográficos que nos permiten afirmar que el resultado quirúrgico es o no óptimo.
Ecocardiografía preoperatoria en el análisis de la raíz y de la válvula aórticaEl análisis de las lesiones anatómicas y funcionales debe tener en cuenta las siguientes variables:
- 1
Cúspides:
a Número: normal (tricúspide), 2 velos (bicúspide), 4 velos (cuadricúspide), un velo (unicúspide).
b Calidad del tejido:
- –
Calcificación y fibrosis o extensa destrucción tisular: enfermedad degenerativa calcificada, afectación reumática, vegetaciones endocardíticas y perforaciones extensas del cuerpo de los velos o rotura.
- –
Velos flexibles con escasa lesión estructural: fenestraciones del borde libre o perforación, calcificación o fibrosis poco extensa con distribución focal, prolapso valvular verdadero (si un velo desciende por debajo del plano del anillo) o relativo (si un velo desciende por debajo de los otros) o velos anatómicamente normales.
c. Líneas de coaptación.
- –
- 2
Dirección del chorro regurgitante: central o excéntrico.
- 3
Descripción de la geometría de la raíz aórtica: normal o dilatada, entendiendo que la aorta ascendente constituye parte del complejo de la válvula aórtica y que existen 2 anillos funcionales: la unión ventrículo-arterial o anillo aórtico y la unión sinotubular.
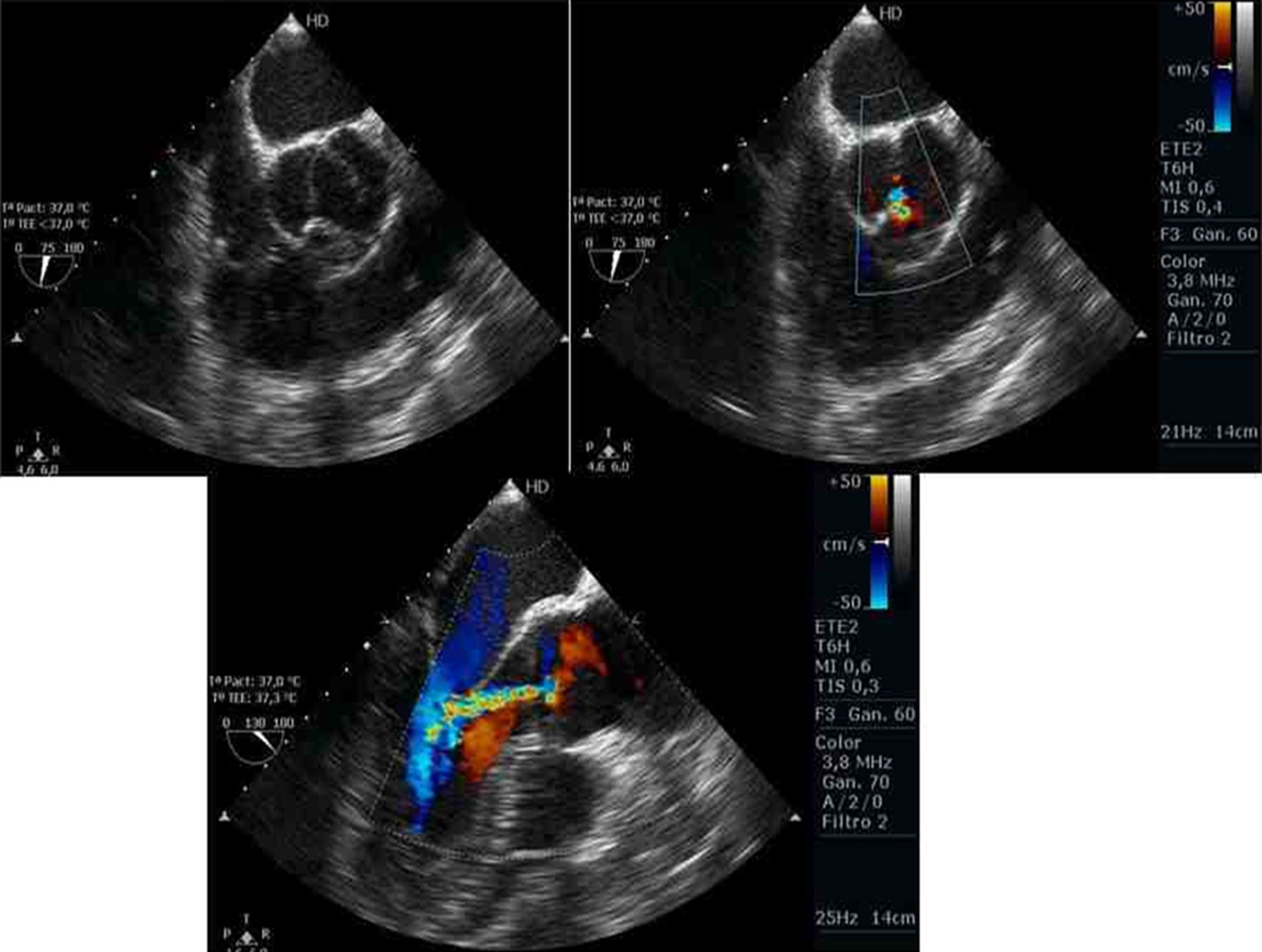
El examen debe comenzar con el análisis bidimensional (2D) de la válvula aórtica en eje corto desde proyecciones medioesofágicas, rotando el ángulo de la sonda multiplanar a 30°-60° (vídeo 1). Se describen número y simetría de las cúspides, su engrosamiento, fusión comisural y movimiento y aspecto del borde libre durante todas las fases del ciclo cardiaco. No obstante, una visión adecuada de la válvula aórtica es difícil con eco 2D por varios motivos. En primer lugar, las valvas son muy finas y solo tienen grosor cerca del borde libre. Por ello, no puede valorarse el bien el cuerpo de los velos ni la superficie de coaptación. Además, es difícil obtener planos tomográficos en el eje corto perfectamente paralelos al orificio valvular, particularmente cuando la aorta ascendente está dilatada o los corazones adoptan una posición horizontal. Finalmente, el movimiento del plano del anillo AV debido a la excursión longitudinal activa de la base del ventrículo izquierdo puede impedir la visión adecuada de la morfología de la válvula a lo largo de todo el ciclo cardiaco. La reconstrucción volumétrica mediante ecocardiografía 3D en tiempo real (3DTR) permite resolver estos problemas en muchos de nuestros pacientes (vídeo 2).
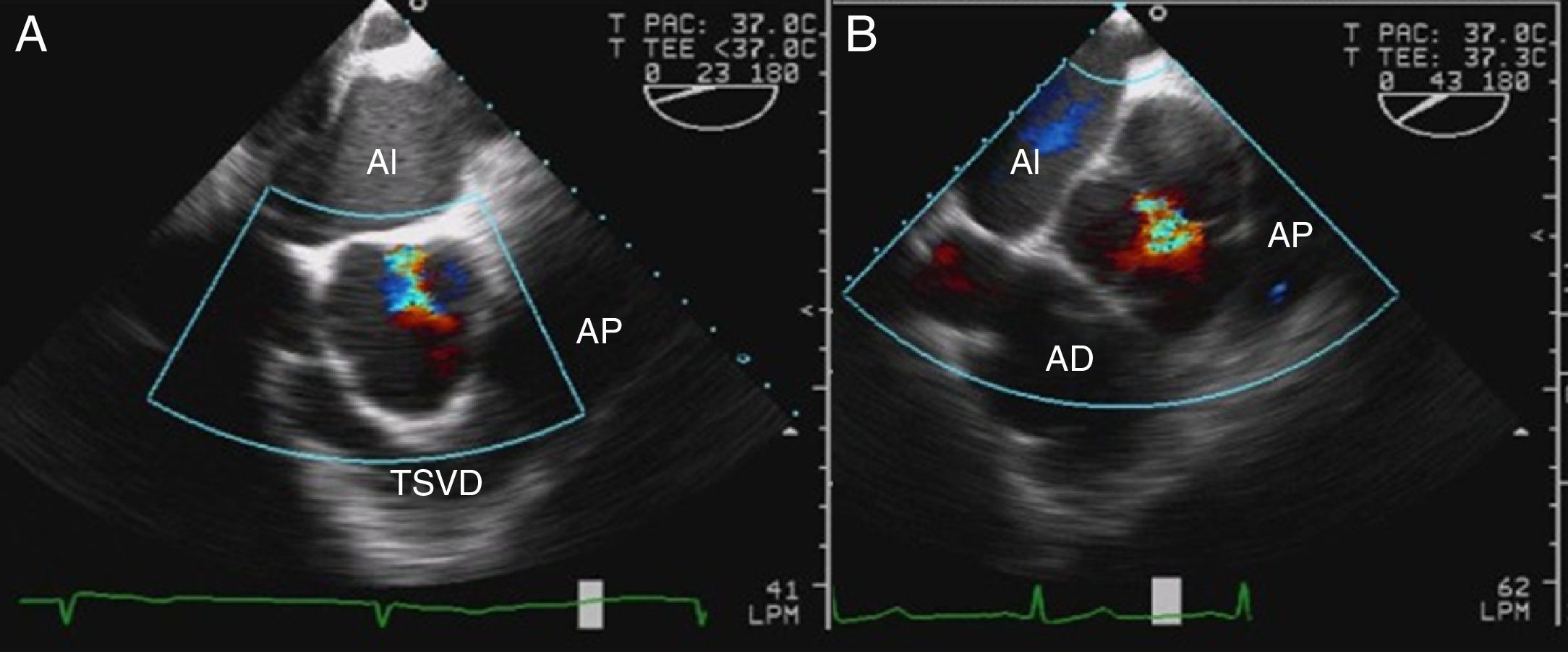
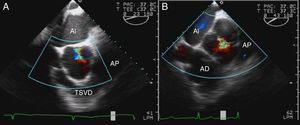
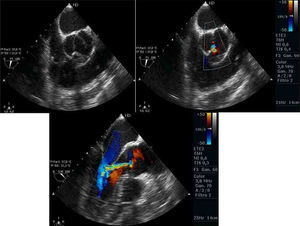
Utilizando en estas proyecciones del Doppler color, podemos localizar el origen del jet y analizar las líneas de coaptación. Puede identificarse el origen en una comisura, a lo largo de una de las líneas de coaptación o en el medio de alguna de las cúspides (fig. 1). Para que este análisis sea correcto, es importante no realizar planos que corten la válvula oblicuamente. Además, en presencia de prolapsos, el Doppler color permite identificar el velo responsable de que exista un jet excéntrico, puesto que el flujo de aceleración se dirige hacia la comisura entre los otros 2 velos.
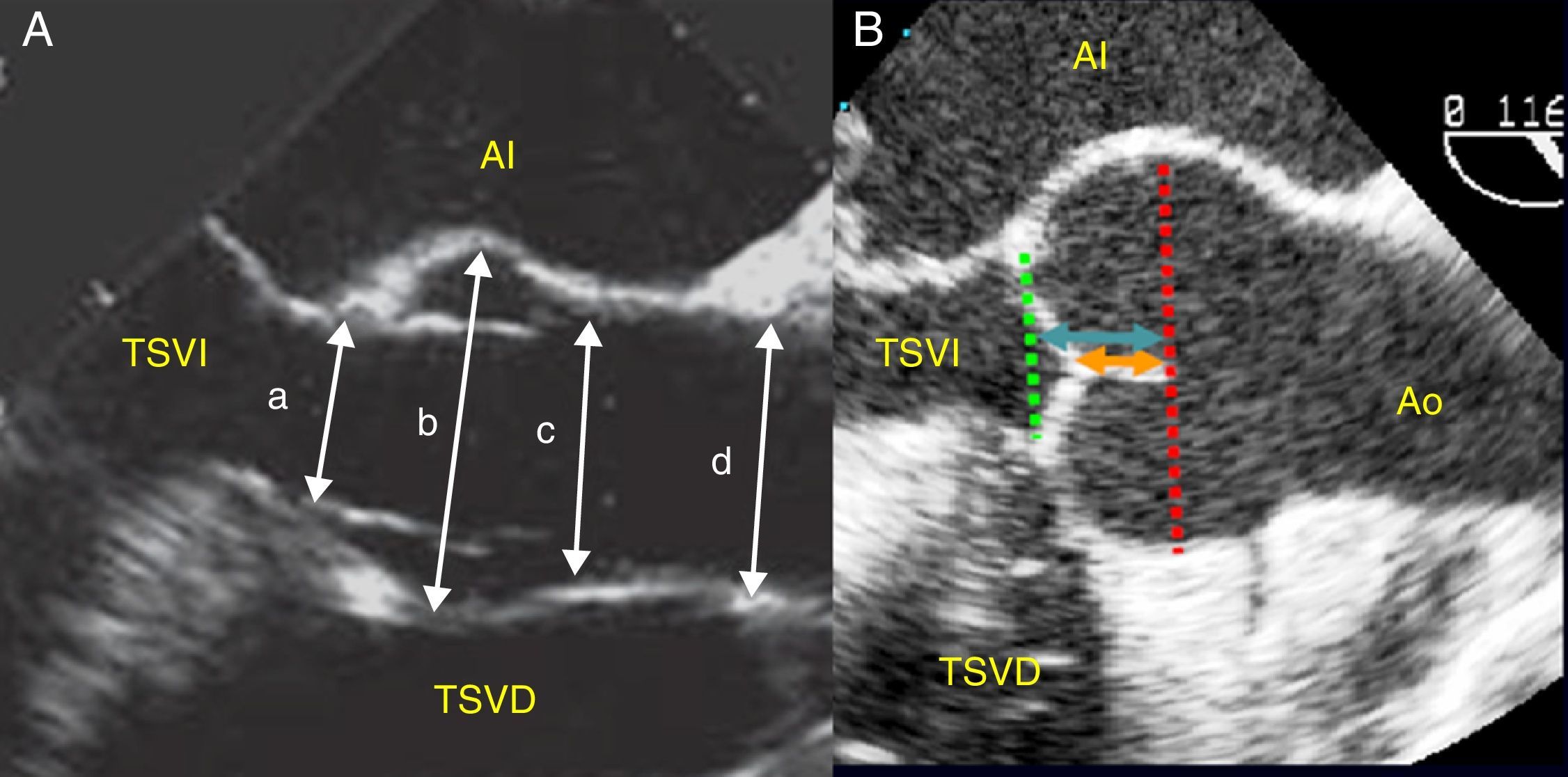
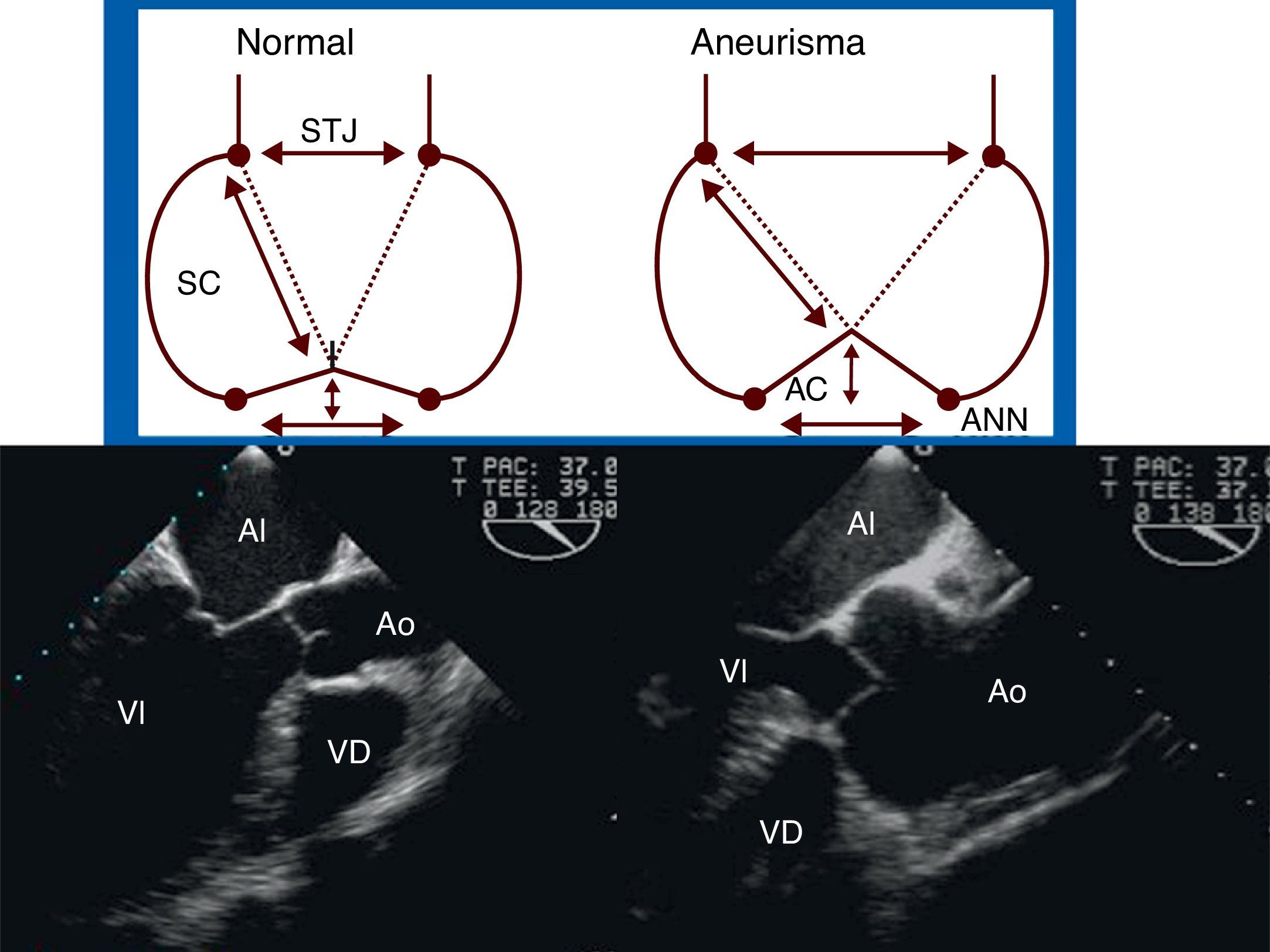
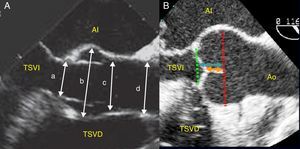
Sistemática del examen ecocardiográfico de la raíz de aortaLa raíz de aorta y la aorta ascendente se pueden analizar desde la proyección eje largo medioesofágica, rotando el ángulo hasta 120-145°, midiendo las dimensiones de todos sus componentes (anillo, senos de Valsalva, UST y aorta ascendente) y la relación geométrica entre ellos, como el cociente entre UST:anillo (normal <1:2) y la distancia anillo-UST o la altura de los senos de Valsalva (siendo normal la ratio altura/anillo <1), la longitud y la altura de coaptación y la altura efectiva de los velos (fig. 2). Estos 2 últimos son considerados como los índices de reserva funcional y permiten describir la geometría de los velos.
Dimensiones de los componentes de la raíz aórtica en eje largo de aorta medioesofágico en ecocardiografía transesofágica (A). a: anillo; b: senos de Valsalva o raíz aórtica; c: unión sinotubular o UST; d: aorta ascendente; e índices de reserva funcional (B): longitud de coaptación (flecha negra); altura efectiva del velo (flecha blanco).
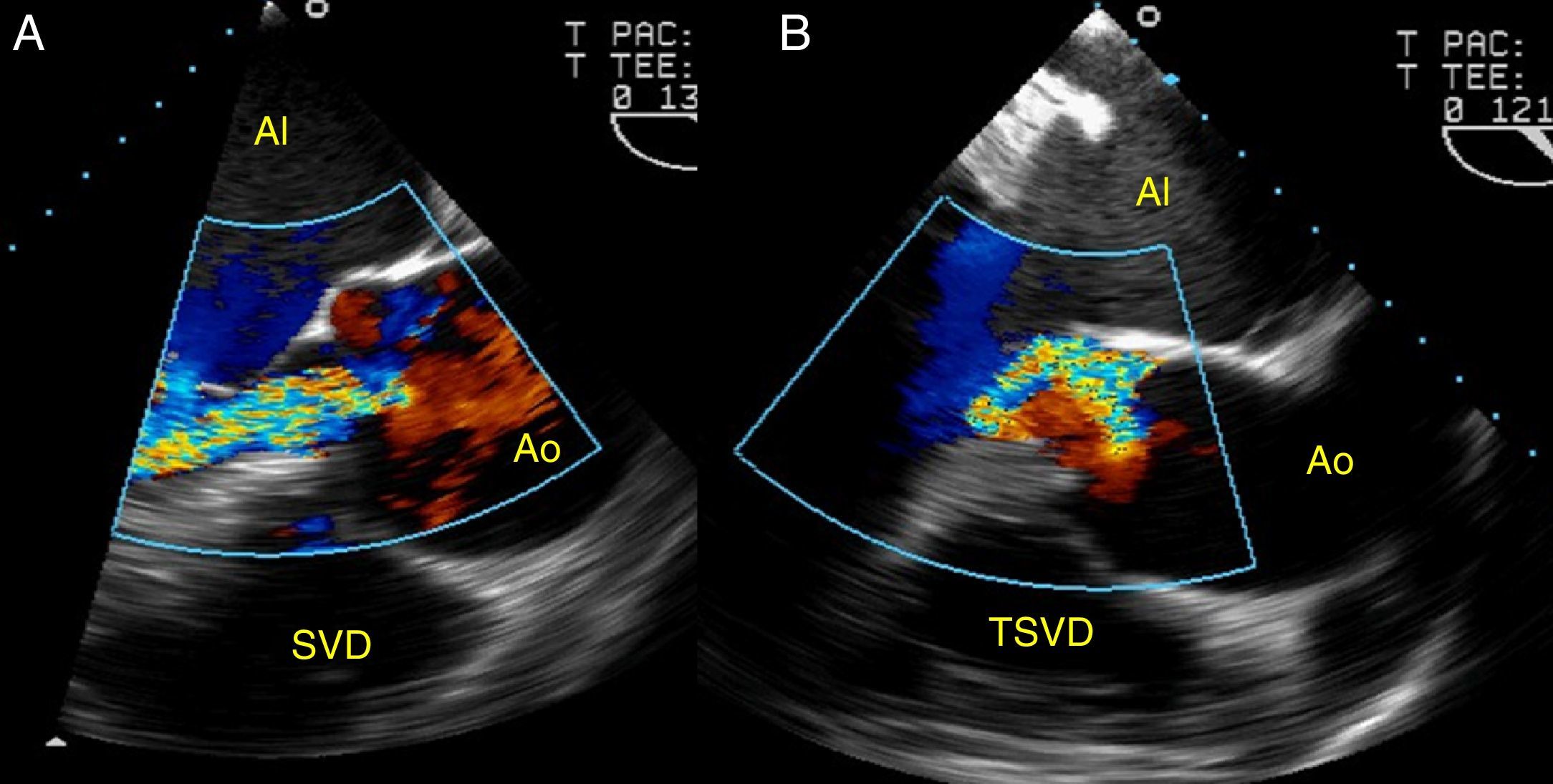
Desde esta proyección de aorta en eje largo, se analiza también la dirección, central o excéntrica, del jet regurgitante con Doppler color (fig. 3).
En la aorta ascendente, las medidas de las dimensiones obtenidas por ecocardiografía son precisas y reproducibles cuando se obtienen siguiendo estándares de calidad:
- –
Proyecciones transversales, no oblicuas, que nos permitan obtener una dimensión real en eje corto. Las mediciones deben realizarse siempre perpendiculares al eje mayor del vaso.
- –
Ajustes de ganancia adecuados.
- –
Según las convenciones estándares de medición: los diámetros aórticos se miden desde el borde anterior de la pared anterior hasta el borde anterior de la pared posterior. En determinadas situaciones especiales (particularmente en ecocardiografía transesofágica), se acepta tomar la distancia existente entre ambos bordes interiores, por ser una medida más fácilmente reproducible.
En los pacientes con dilatación de aorta es importante medir las dimensiones en varias localizaciones, especificar el lugar de las diferentes medidas y garantizar que el protocolo de medición empleado (borde anterior-borde anterior o borde interno-borde interno) sea el mismo en los estudios de seguimiento. Estas mediciones incluyen:
- 1
Anillo aórtico, medido desde el borde interno al borde interno a nivel del implante de las sigmoideas y en protosístole (mejor correlación con la medida quirúrgica del anillo aórtico).
- 2
Los senos de Valsalva o raíz de aorta.
- 3
La unión sinotubular.
- 4
La aorta ascendente.
- 5
El arco aórtico.
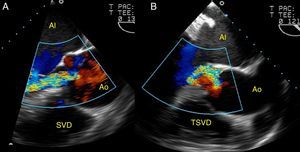
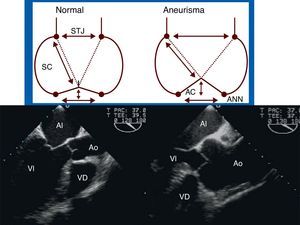
Estas medidas nos permiten distinguir 3 formas anátomo-clínicas de dilatación de la aorta ascendente (fig. 4):
- a
Aneurismas de aorta ascendente (A): dilatación de aorta ascendente y de la unión sinotubular, con raíz aórtica y anillo valvular no dilatados.
- b
Aneurismas de la raíz de aorta (B): la geometría de la raíz de aorta se caracteriza por una dilatación marcada de los senos de Valsalva y del anillo, proximal a la unión sinotubular, con o sin dilatación de la aorta ascendente.
- c
Anuloectasia aórtica (C): dilatación de aorta ascendente, unión sinotubular, raíz aórtica y anillo valvular.
Cuando se trata de evaluar la reparabilidad de una válvula aórtica insuficiente mediante ecocardiografía transesofágica intraoperatoria, cuantificar la regurgitación es mucho menos importante que describir los mecanismos en presencia del cirujano. Esta descripción se fundamenta en el análisis detallado de la geometría de los velos, de la dirección del jet regurgitante y de las dimensiones de los componentes de la raíz de aorta. Es importante recordar que, en no pocas ocasiones, la insuficiencia aórtica es causada por múltiples mecanismos.
Aneurisma de aorta ascendente o insuficiencia aórtica tipo 1Aunque probablemente la rotura o disección sean las consecuencias más importantes de los aneurismas de aorta ascendente, la dilatación de aorta es una de las primeras causas de insuficiencia aórtica aislada en nuestro medio. El complejo papel de la raíz de aorta en la función valvular consiste en mantener una configuración adecuada de las cúspides. Esta configuración o geometría de los velos depende en gran parte de las relaciones geométricas entre los componentes.
Mecanismos de la insuficiencia aórtica asociada al aneurisma de aorta ascendenteSe ha demostrado experimentalmente que la insuficiencia aórtica funcional en el aneurisma de aorta ascendente (tipo 1a) se produce por dilatación, no del anillo aórtico, sino de la unión sinotubular, donde precisamente tienen inserción las comisuras de los velos. Furukawa et al.10, utilizando un modelo de corazón canino y evaluando la coaptación de la válvula tanto in vitro como en el corazón latiendo mediante imagen endoscópica directa, observan que este cierre incompleto central se produce cuando se ejerce tracción sobre las comisuras al nivel de la UST y no cuando se hace sobre los senos de Valsalva. Los autores indican, por tanto, que el mecanismo de la incompetencia valvular asociado a la dilatación de la UST es el desplazamiento de las comisuras hacia fuera, que restringe el libre movimiento de los velos valvulares y evita que coapten en el centro en diástole.
Recientemente, la disposición en tienda de campaña de los velos valvulares en imagen bidimensional o tenting diastólico se ha descrito como el signo ecocardiográfico que identifica la limitación a la movilidad de velos sin lesión estructural impuesta por la dilatación de la unión sinotubular (insuficiencia aórtica funcional), cuya magnitud (medida como altura de coaptación o como área de tenting) es un determinante de la severidad de la regurgitación en el aneurisma de aorta ascendente11. Se mide desde el anillo aórtico hasta el extremo proximal de la coaptación de los velos (fig. 5).
Representación esquemática de tenting diastólico e imagen ecocardiográfica en eje largo de la válvula aórtica con raíz aórtica normal (A) y de una válvula aórtica normal en un paciente con raíz de aorta dilatada (B). Obsérvense la superficie extensa de contacto entre ambos velos (reserva de coaptación) y la altura de coaptación. En la raíz dilatada, los velos adoptan disposición en tienda de campaña, la reserva de coaptación es muy escasa y la altura de coaptación es mayor que en la válvula normal.
En nuestra experiencia, en los casos de insuficiencia aórtica funcional, sea cual sea la forma anatómica de la dilatación de aorta, existe característicamente:
- 1
Ratio UST/anillo crítica>1,5.
- 2
Altura de tenting o coaptación >7,5mm.
- 3
Dirección central del jet regurgitante.
En el aneurisma de la raíz o anuloectasia aórtica (tipo 1b), el mecanismo de la regurgitación puede ser el mismo descrito previamente. No obstante, la dilatación de los senos de Valsalva puede causar remodelado tisular de los velos. El remodelado pretende compensar la sobrecarga mecánica que sufre el velo cuando la aorta pierde su geometría y resulta en alargamiento, engrosamiento y calcificación del borde libre. Además, cuando existe dilatación del anillo en la anuloectasia aórtica, los triángulos intervalvares ensanchan la base, la altura de las comisuras desciende y el borde libre, alargado, puede prolapsar en el tracto de salida ventricular izquierdo. En estos casos, la dirección del jet regurgitante es excéntrica y el análisis de la geometría de los velos muestra una altura efectiva reducida (< 9-10mm) y una longitud de coaptación <5mm8.
Finalmente, la presencia de fenestraciones o soluciones de continuidad del borde libre de los velos pueden ser responsables de jets excéntricos en ausencia de prolapso valvular7.
Prolapso valvular aórtico o insuficiencia aórtica tipo 2En estudios publicados previamente en la literatura, el diagnóstico se basa en parámetros poco específicos, como la dirección excéntrica del jet regurgitante y en la apariencia ecocardiográfica de prolapso en eje largo (una o más cúspides que acabalgan sobre el plano del anillo aórtico y descienden, total o parcialmente, en el tracto de salida ventricular izquierdo)12.
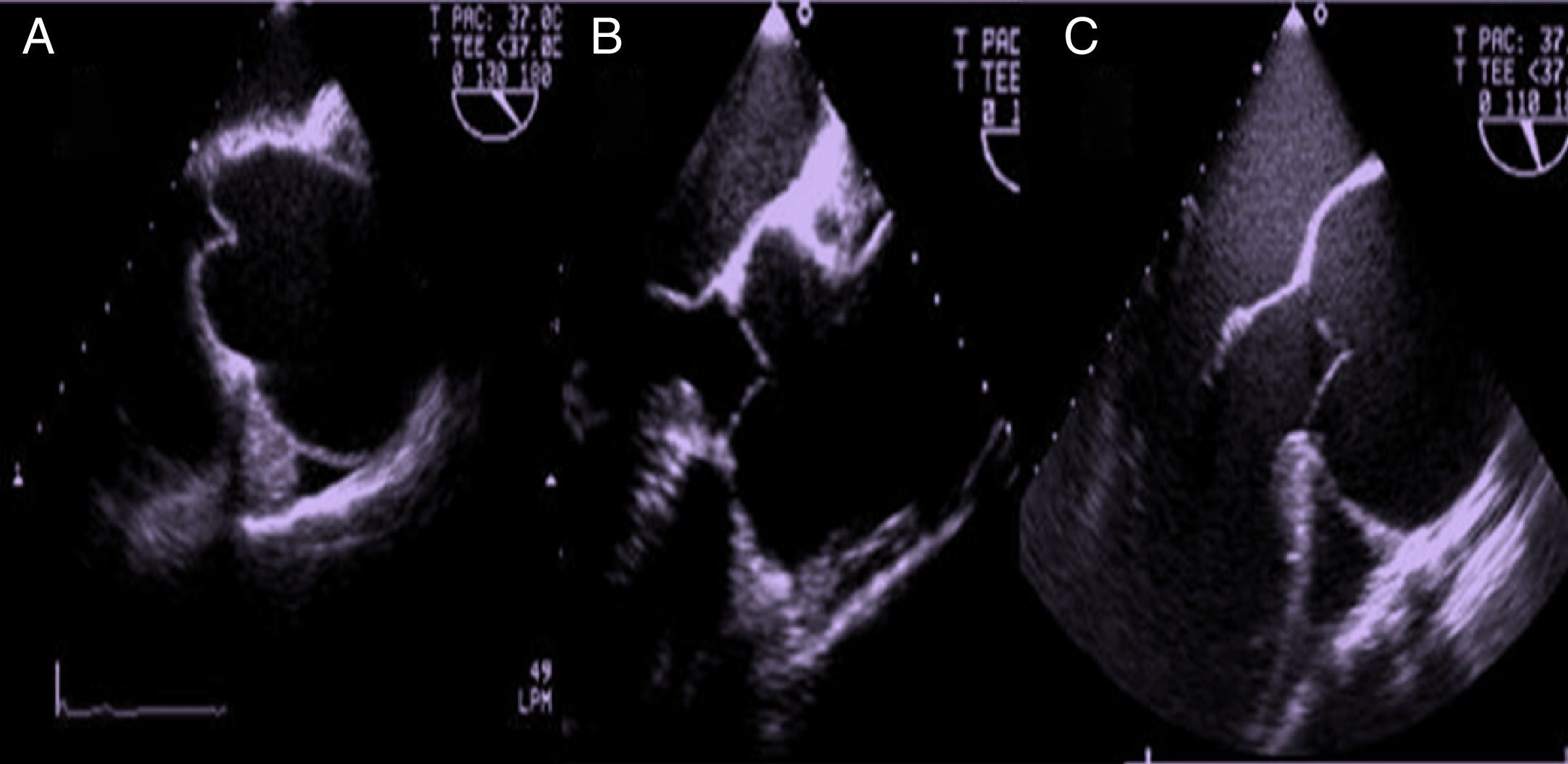
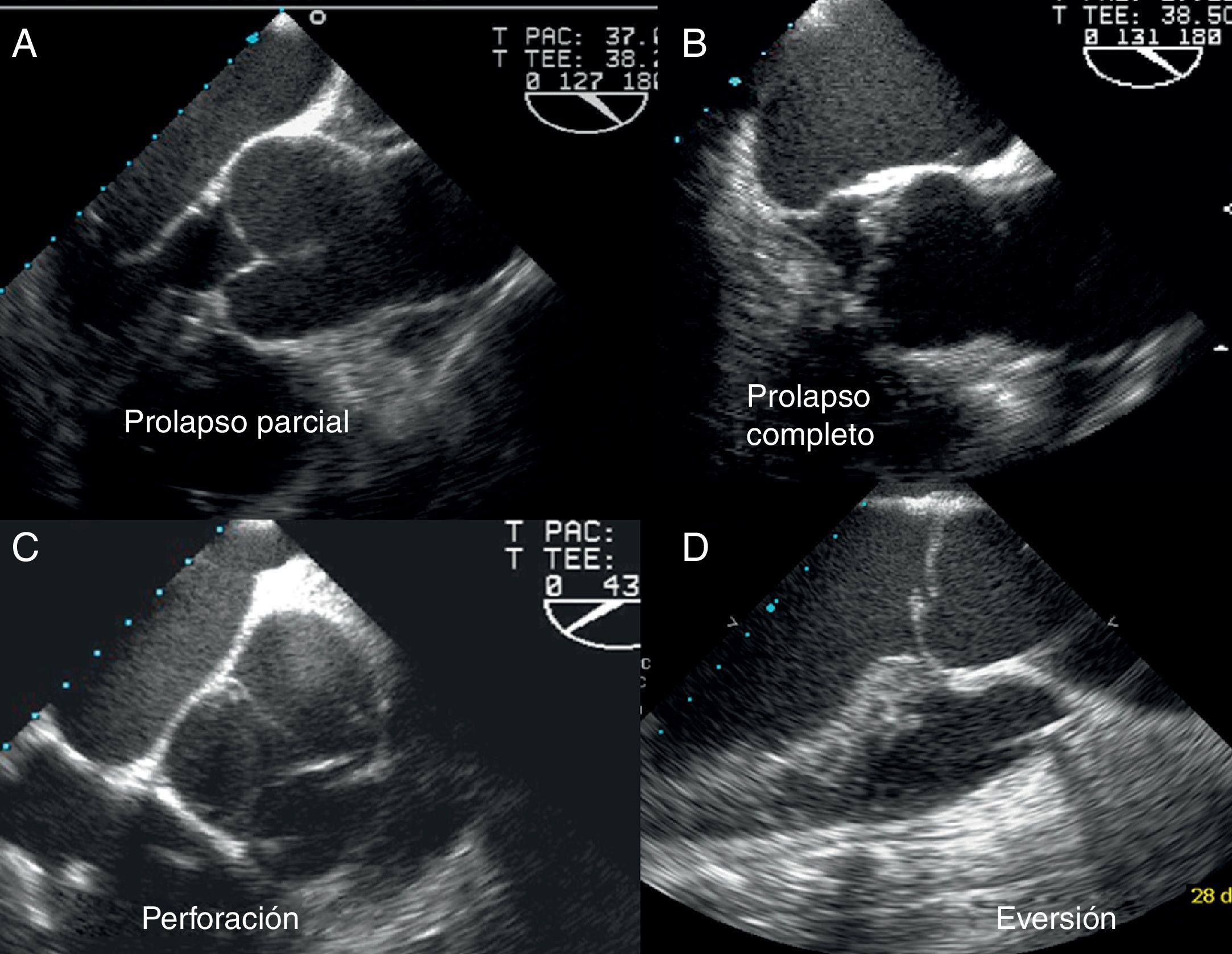
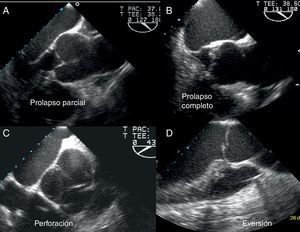
Existen 2 tipos de prolapso valvular, completo o parcial7. En el primero, el borde libre de la cúspide acabalga sobre el anillo aórtico y el cuerpo del velo abomba en el tracto de salida. Sin embargo, en el prolapso parcial es la parte distal de la cúspide la que prolapsa en el tracto de salida, existiendo un pliegue del cuerpo visible en eje largo y eje corto, que generalmente es fibroso y está engrosado (fig. 6).
Imágenes ecocardiográficas que ejemplifican los hallazgos característicos en distintas formas de prolapso y/o lesiones de los velos en las que existe un jet excéntrico. A) Prolapso completo. B) Prolapso parcial. C) Fenestración o perforación lineal del borde libre. D). Eversión del borde libre de la válvula aórtica.
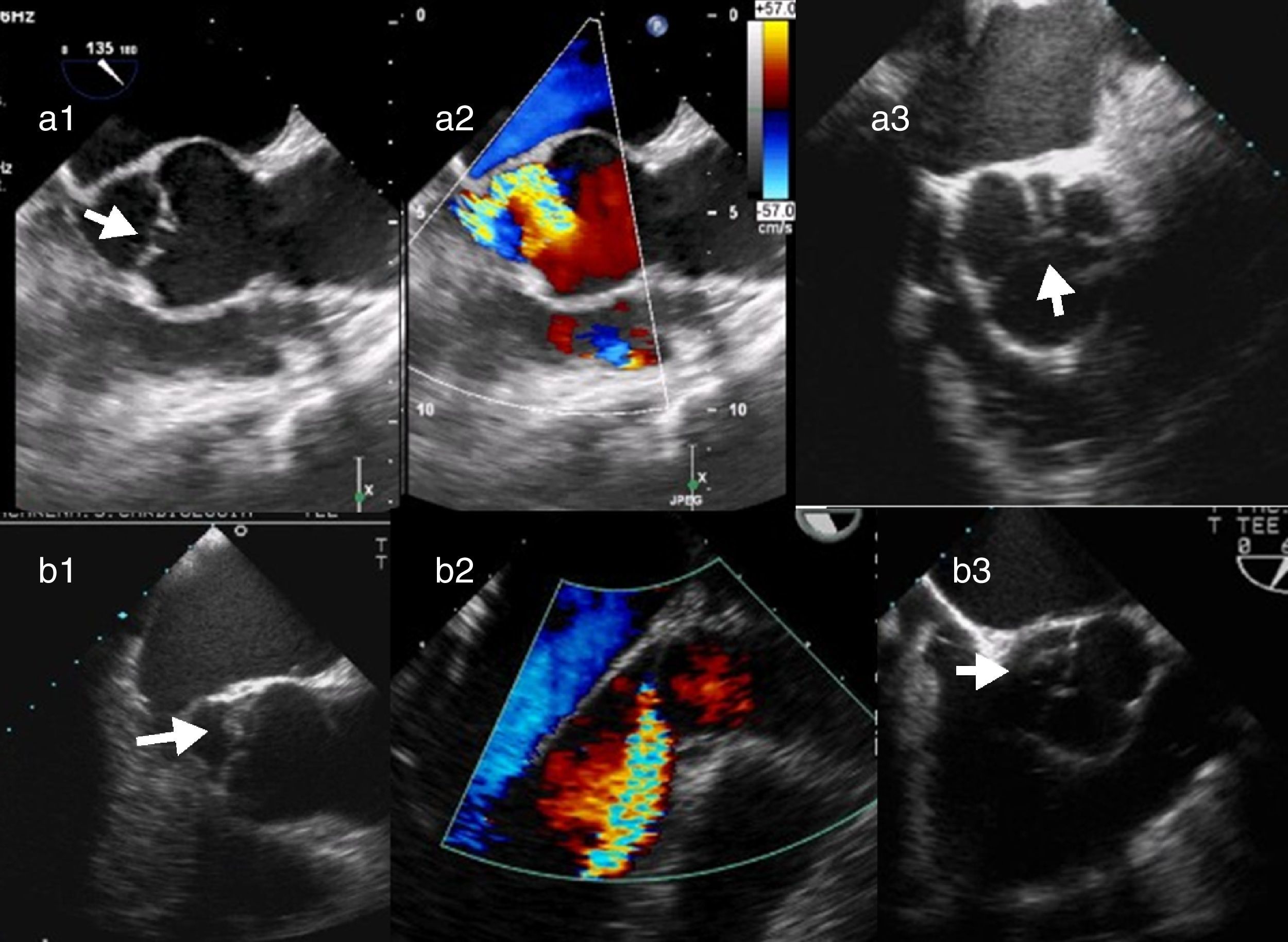
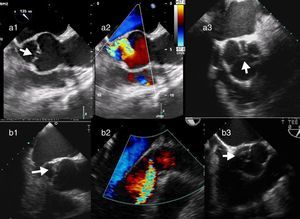
Característicamente, en el prolapso del velo coronario derecho, el jet regurgitante se dirige posteriormente hacia el velo anterior mitral. Sin embargo, cuando la dirección del jet es anterior, el velo que prolapsa puede ser el velo no coronario o el velo coronario izquierdo. En estos casos, debe analizarse un eje corto de la válvula aórtica con y sin Doppler color para analizar el movimiento de los bordes libres y las líneas de coaptación e identificar el velo responsable (fig. 7).
Imágenes ecocardiográficas en eje largo y en eje corto de prolapsos de distintos velos. En el prolapso del velo coronario derecho (a1), el jet regurgitante se dirige posteriormente hacia el velo anterior mitral (a2). En el prolapso del velo no coronario (b1), la dirección del jet es anterior (b2) y en eje corto de la válvula aórtica se identifica el velo responsable (a3 y b3).
En este caso, la válvula está engrosada y, en ocasiones, calcificada. El grado de calcificación, y si esta está limitada al borde libre o si se extiende al cuerpo de los velos, son los principales determinantes de reparabilidad. Generalmente, la válvula abre en cúpula y puede existir un grado variable de estenosis asociada, cuantificable con Doppler continuo desde planos transgástricos. En este grupo, identificar si existe déficit tisular es importante para decidir sobre la reparabilidad. Aunque la medida de la altura geométrica de los velos es un concepto básicamente quirúrgico13, el uso de la imagen multiplanar mediante ecocardiografía tridimensional podría ser de utilidad para valorar este aspecto.
Ecocardiografía transesofágica postoperatoria: predictores de fracaso a medio-largo plazoEl primer factor de riesgo de fracaso de la reparación valvular es la presencia de insuficiencia aórtica residual, particularmente cuando se trata de jets excéntricos de grado >214. Aunque en ocasiones se considera que la severidad de la insuficiencia pudiera estar sobreestimada en los momentos iniciales después de despinzar la aorta, la insuficiencia residual continúa siendo un predictor independiente de riesgo en diversos análisis multivariados (odds ratio 5,3; intervalo de confianza 1,47-6,57; p=0,01).
El segundo parámetro predictor de riesgo de fracaso es un nivel de la coaptación de los velos por debajo del plano del anillo15: tipo A es por encima del anillo, tipo B es en el plano del anillo y tipo C por debajo. El tipo C se ha asociado a un riesgo de recurrencia de la insuficiencia aórtica del 78% y a una tasa de reintervención del 48%. Por lo tanto, un nivel tipo C de coaptación debería obligar a revisar el procedimiento aun en ausencia de insuficiencia aórtica (vídeo 3).
El tercer parámetro es una longitud de coaptación <4mm14, que, en presencia de insuficiencia aórtica residual, se asocia a un riesgo de recurrencia de la insuficiencia aórtica del 47% y a una tasa de reintervención del 28% aun en presencia de un nivel de coaptación adecuado vs. un riesgo de recurrencia de la insuficiencia aórtica del 5% y a una tasa de reintervención del 0% cuando la coaptación es >4mm (vídeo 4).
Finalmente, la coaptación también puede medirse en términos de altura efectiva de las cúspides (distancia desde el anillo al borde libre de cada cúspide)16. Una altura efectiva >8mm posreparación se asocia significativamente a la ausencia de insuficiencia aórtica significativa.
En resumen, podemos decir que la competencia de la válvula después de la reparación debe entenderse como la recuperación de la geometría normal: una coaptación por encima del plano del anillo con una longitud de coaptación >4mm y una altura efectiva >8mm con ligera insuficiencia aórtica central residual pueden considerarse un resultado óptimo.
Ecocardiografía transesofágica intraoperatoria en la insuficiencia de la válvula aórtica bicúspideLa válvula aórtica bicúspide es la anomalía congénita más frecuente (1-2% de la población general)17. Se asocia al desarrollo de patología valvular y a enfermedad de la pared aórtica secundaria a la alteración histopatológica conocida como degeneración de la capa media. La insuficiencia aórtica por válvula bicúspide se ha convertido en una de las principales indicaciones quirúrgicas por insuficiencia aórtica severa en menores de 50 años en nuestro medio. Por tanto, la mayor parte de los pacientes que requieren cirugía por una válvula bicúspide insuficiente son jóvenes con una esperanza de vida postoperatoria larga. En estos individuos, la implantación de prótesis mecánicas supone un elevado riesgo acumulado de complicaciones (trombosis, fenómenos tromboembólicos y hemorragias), por lo que la reparación valvular constituye desde hace años una alternativa atractiva a la sustitución protésica. Es un procedimiento técnicamente posible, con resultados semejantes e incluso mejores que en los casos de reparación de la válvula aórtica tricúspide. Sin embargo, a pesar de que se han publicado resultados excelentes de la durabilidad de la reparación de una válvula bicúspide a largo plazo18, equiparables a los de la reparación valvular mitral (que también es una válvula con una única línea de coaptación), este no es un procedimiento totalmente estandarizado.
En la VAB, la selección de candidatos para las técnicas de reparación valvular es compleja. En un estudio retrospectivo realizado por Nash et al.19 en 75 individuos en los que se realizó una reparación valvular de una VAB se encontraron como factores predictores de éxito de la reparación la existencia de un jet de IAo excéntrico por prolapso de un velo, la ausencia de engrosamiento y la calcificación de las cúspides y la ausencia de engrosamiento o fusión comisural. Probablemente, la válvula aórtica bicúspide constituye el mejor exponente de mecanismos complejos en la insuficiencia aórtica e ilustra cómo, incluso en presencia de una alteración funcional dominante, existen otras lesiones asociadas que contribuyen a la severidad de la regurgitación.
Descripción ecocardiográfica de los mecanismos de la insuficiencia aórtica por válvula bicúspideEn el caso de la válvula aórtica bicúspide, el principal mecanismo de la insuficiencia es la lesión de las cúspides.
Patrones de fusión de los velos y mecanismosIndependientemente de cuál sea el fenotipo de la válvula aórtica bicúspide (antero-posterior o lateral), para abordar la reparación valvular lo que interesa al cirujano es el patrón de fusión de los velos (clasificación modificada de Sievers)20,21:
- 1
Tipo 1: VAB «real», con 2 velos generalmente de la misma longitud, sin rafe y 2 senos; mecanismo de la regurgitación → prolapso de uno de los velos originando un jet excéntrico de IAo (fig. 8).
- 2
Tipo 2: VAB originada por la fusión de 2 de los velos con un rafe, generalmente calcificado y fibrosado, que restringe el movimiento del velo. En estos casos, puede haber 2 senos o 3, siendo 2 de ellos rudimentarios con un comisura de menor tamaño; mecanismo de la regurgitación → seudoprolapso del velo fusionado, con un jet excéntrico de regurgitación o bien falta de coaptación central de los velos por retracción del rafe calcificado, con un jet de regurgitación central (fig. 9).
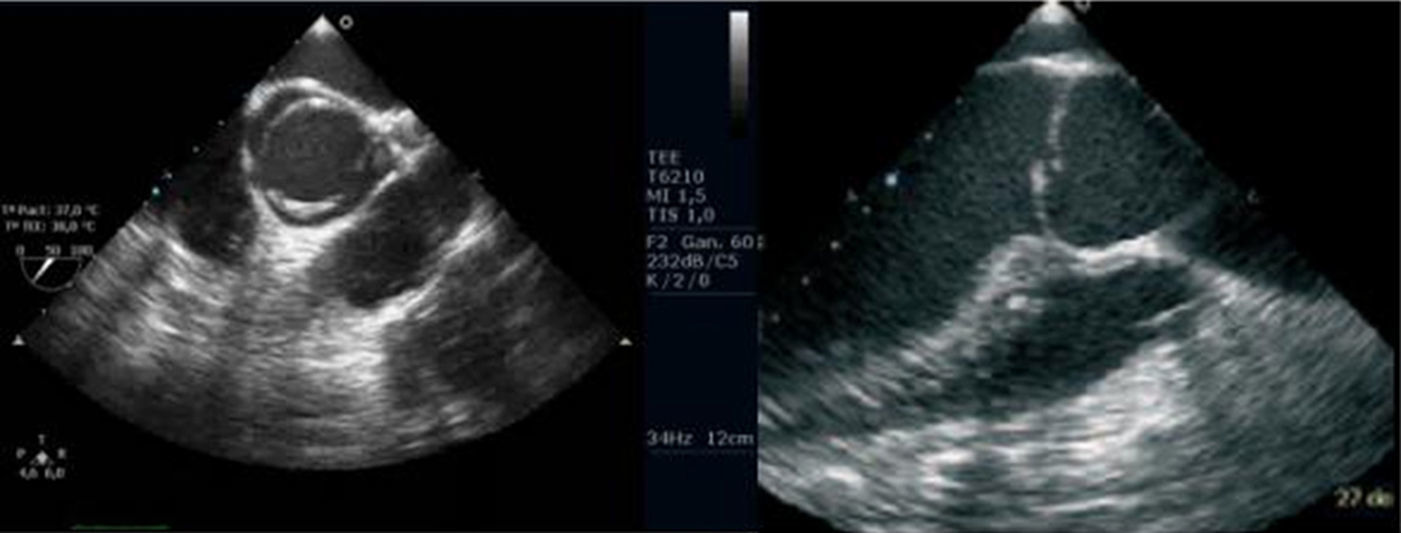
Figura 9.Ecocardiografía transesofágica de una válvula aórtica bicúspide tipo 2 en eje corto y eje largo, bidimensional y con Doppler color. Existe un rafe fibroso y parcialmente calcificado en la fusión entre los velos coronario derecho y no coronario, 3 senos de Valsalva. Existe un déficit de coaptación central de los velos por restricción en el movimiento secundaria a la fibrosis del rafe.
(0.22MB). - 3
Tipo 3: seudo-VAB con un gran velo y 2 velos adicionales de menor tamaño con una comisura entre ambos o una verdadera VAB con 2 senos uno de ellos con un cleft; mecanismo de la regurgitación → defecto de coaptación central por retracción degenerativa del borde libre 2 velos de menor tamaño originando un jet de regurgitación central.
La principal limitación del éxito inicial de las técnicas de cirugía conservadora en la válvula bicúspide, como ocurre con la reparación de una válvula tricúspide22,23, es la lesión orgánica extensa de los velos o distorsión grave de las comisuras, principalmente la restricción o el déficit de tejido flexible. Perforaciones, vegetaciones o lesiones degenerativas resultaron en sustitución valvular por prótesis en todos nuestros pacientes y solo se repararon 4 casos con prolapso valvular y velos flexibles y redundantes. En esta línea, 2 nuevos índices ecocardiográficos de la calidad y cantidad del tejido de las cúspides, llamados índice de normalidad tisular e índice de deficiencia de coaptación, respectivamente, han sido recientemente publicados por Petterson et al.24 y se han propuesto, basados en un análisis retrospectivo, como buenos parámetros para seleccionar candidatos adecuados a las técnicas de reparación.
Factores relacionados con la durabilidad de la reparaciónAunque las estrategias individualizadas permitan un éxito precoz de la reparación, el pronóstico a largo plazo no es tan alentador. En los años de seguimiento que hasta ahora han sido publicados, el fallo estructural de los velos valvulares aórticos o la progresión a estenosis aórtica no se ha encontrado como causa de reintervención25.
Por otro lado, es bien conocido que la dilatación aórtica progresiva es un problema independiente de la patología valvular26. Además, la sustitución valvular aórtica aislada ha demostrado no ser suficiente para estabilizar el comportamiento de la aorta y evitar la dilatación a medio plazo27, como también ocurre en las enfermedades hereditarias del tejido conectivo. De hecho, la dilatación de los anillos funcionales (anillo y UST) parece ser un factor de riesgo para la recurrencia de la insuficiencia aórtica56 y la necesidad de segunda intervención en los pacientes con reparación valvular28. Por tanto, la durabilidad limitada de la reparación a largo plazo podría ser por un grado de dilatación de la raíz aórtica desestimado en el momento de la cirugía. Algunos autores proponen de hecho asociar a la reparación valvular técnicas de remodelado de la raíz aórtica a partir de 40mm de aorta ascendente o 33mm de diámetro al nivel de la UST29. Los resultados de estas nuevas técnicas de cirugía de sustitución de la aorta combinadas con la reparación valvular parecen aportar resultados más estables.
Finalmente, la orientación circunferencial de las 2 comisuras reales (> o<de 160°), estudiada mediante ecocardiografía transesofágica permite analizar la simetría de las cúspides y se relaciona con la durabilidad de la reparación30. En la medida en que ambos velos son simétricos o que el remodelado de la raíz permite corregir esta asimetría, los resultados de la reparación valvular son óptimos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Vídeo 1. Imagen bidimensional de la válvula aórtica en eje corto desde proyecciones medioesofágicas, rotando el ángulo de la sonda multiplanar a 30°-60° y desde la aorta ascendente en eje largo a 120-140°. Permite el análisis del número y simetría de las cúspides, su engrosamiento, fusión comisural y aspecto del borde libre. No obstante, la excursión longitudinal base-ápex del anillo impide la valoración del borde libre durante todo el ciclo cardiaco. Con Doppler color, se estudian las líneas de coaptación y el origen y la dirección del chorro de regurgitación.
Vídeo 2. Reconstrucción volumétrica mediante ecocardiografía 3D en tiempo real (3DTR) de una válvula aórtica con afectación reumática, vista de frente desde la unión sinotubular. Permite la visión adecuada de la morfología de la válvula a lo largo de todo el ciclo cardiaco.
Vídeo 3. Ecocardiograma transesofágico postoperatorio tras reimplantación valvular aórtica con técnica de David que muestra el nivel de la coaptación de los velos con respecto al plano del anillo aórtico en los 3 subtipos de reimplantación. Se aprecia nivel de coaptación muy bajo en el tipo C, con prolapso de las cúspides, e insuficiencia aórtica significativa postoperatoria con Doppler color.
Vídeo 4. Ecocardiograma transesofágico postoperatorio tras reparación de prolapso aórtico que muestra una geometría óptima con adecuada longitud de coaptación y altura efectiva <8mm.