El trasplante cardíaco es el tratamiento más eficaz y consolidado de los pacientes con insuficiencia cardíaca grado D. El número de trasplantes registrados en el mundo es superior a 80.000, y en España, hasta diciembre de 2009 estaban registrados 6.048 trasplantes, con un máximo de 353 trasplantes en el año 2000.
En este artículo se revisan las indicaciones y contraindicaciones, criterios de selección y mantenimiento del donante, técnica quirúrgica, complicaciones y resultados. La supervivencia y calidad de vida de los pacientes trasplantados ha mejorado, siendo el número de donantes potenciales la principal limitación del trasplante cardíaco. Este hecho debe condicionar la selección meticulosa de los receptores, para ofrecer este tratamiento a los pacientes que más lo necesitan y con expectativas de obtener los mejores resultados y sin otras posibilidades de tratamiento médico o quirúrgico.
Cardiac transplant is the most effective and consolidated treatment in patients with heart failure degree D. The number of transplants registered in the world is superior to 80,000, and until December 2009 6,048 transplants were registered in Spain with a maximum of 353 transplants in 2000.
In this paper are checked the indications and contraindications, selection criteria and maintenance of the donor, surgical technique, complications and results. The survival and quality of life of the transplanted patients has improved, being the number of potential donors the principal limitation of the cardiac transplant. This fact must determine the meticulous selection of the recipients to offer this treatment to the patients who more need it and with expectations of obtaining the best results and without other possibilities of medical or surgical treatment.
James D. Hardy, jefe del Departamento de Cirugía de la Universidad de Jackson (Mississipi), realizó entre los años 1956 y 1963 múltiples ensayos experimentales en perros, terneras, monos y cadáveres humanos con el objetivo de poner a punto la técnica quirúrgica para poder realizar el trasplante cardíaco en el ser humano. En enero de 1964 recibieron en su servicio a Boby Rush, un paciente de 68 años de edad con hipertensión arterial (HTA) y ateromatosis generalizada, al que se le había practicado la amputación de un miembro inferior por padecer una gangrena isquémica. El enfermo se encontraba en estado de insuficiencia cardíaca terminal. En una habitación del hospital próxima, se encontraba un paciente joven con una enfermedad encefálica degenerativa en fase terminal. El día 23 de enero de 1964, se condujo al quirófano al paciente Boby Rush y, tras conectarlo a la maquina corazón-pulmón, el corazón se detuvo. En ese momento se planteó en el equipo quirúrgico un «caso de conciencia humana». Se plantearon tres posibilidades: mantener al paciente en circulación extra-corpórea hasta que falleciera el potencial donante, detener la circulación extracorpórea y dejar morir al enfermo o intentar el trasplante de corazón de un chimpancé, una operación sin precedentes. La decisión fue sometida a votación entre los miembros del equipo, con el resultado de cuatro votos a favor y uno en contra. El paciente fue trasplantado con el corazón del chimpancé y desconectado de la circulación extracorpórea. El corazón se mantuvo latiendo de forma autónoma durante dos horas; posteriormente, el corazón fracasó debido a su pequeño tamaño, que no pudo soportar el exceso de retorno venoso.
Este primer intento fue muy comentado por los cirujanos especialistas de la época. En Houston, D.A. Cooley, pionero de la cirugía cardíaca abierta, pensó que la mejor solución para estas situaciones podría ser la puesta a punto de dispositivos capaces de poder suplir las funciones cardíacas que fallan; en ese momento, Cooley sueña con el «corazón artificial» en el que trabajaba junto con D. de Liota. El primer prototipo fue utilizado en el ser humano el 4 de abril de 1969.
Christian Neethling Barnard, el domingo 3 de diciembre de 1967, a las cuatro horas, en el quirófano de cirugía cardíaca del Hospital Grote Schurr en la Ciudad del Cabo, tras extraer el corazón enfermo del paciente Louis WashKansky y contemplar la cavidad pericárdica vacía, hizo la siguiente reflexión: «Mi toma de conciencia –el momento en que la enormidad de todo ello me dejó anonadado– fue precisamente después de haber extirpado el corazón de WashKansky. Bajé la vista y vi aquella cavidad vacía. La comprobación de que ante mí se hallaba un hombre tendido, un hombre sin corazón, pero vivo, me parece que fue el momento que me infundió más pavor». Tras 52 minutos de suturas cardíacas y un choque eléctrico de 25 J de energía, el corazón de Denise Anne Darvall (donante del primer trasplante de corazón en el mundo) comenzó a latir en el tórax de WashKansky; Barnard pronunció la siguiente frase: Jesus! Dit gant werk! («¡Jesús! ¡Esto va a funcionar!»). La operación del primer trasplante de corazón humano efectuado en el mundo había durado cuatro horas y cuarenta y cinco minutos.
La noticia estalló como una bomba en los círculos científicos de la cardiología y cirugía cardíaca de la década de 1960. El hecho no se detuvo en los aspectos médicos del trasplante, sino que alcanzó a los medios de comunicación, fue portada de la revista LIFE el 15 de diciembre de 1967 con el título «Gift a human Heart». La noticia fue percibida a escala mundial como uno de los grandes acontecimientos de la segunda mitad del siglo XX; su repercusión no se correspondería con la propia naturaleza del órgano, simple bomba, si bien es cierto que con características especiales, pero dotada en la creencia popular de una dimensión afectiva donde se mezclan creencias, sentimientos, fetichismo…
Un hecho menos conocido es que al mismo tiempo que se extrajo el corazón de Denise Darvall, otro equipo de cirujanos extirpó el riñón derecho, se empaquetó en hielo y fue transportado a toda velocidad al Hospital Kart Bremen, a veinte millas de distancia, donde fue trasplantado a Jonathan van Wyk, un niño de diez años de edad. Este dato, con escasa relevancia en el contexto del primer trasplante cardíaco mundial y con poca relevancia en la actualidad, supuso la posibilidad de efectuar extracciones multiorgánicas y practicar trasplantes a distancia, encontrándose donantes y receptores en hospitales a centenares de kilómetros de distancia.
Los cirujanos cardíacos N. Shumway y R. Lover habían comenzado en el año 1960 una serie de trasplantes cardíacos ortotópicos en perros en la Universidad de Stanford, en Palo Alto (California). Esta experiencia inicial les permitió poner a punto la técnica del trasplante cardíaco ortotópico estándar, que consiguieron simplificar a cuatro suturas cardíacas, entre ambas aurículas derecha e izquierda (donante-receptor), y arterias aorta y pulmonar (donante-receptor). Para el cirujano C. Carbol, la técnica de estos autores introdujo dos modificaciones importantes: simplificar las anastomosis y preservar el corazón durante la técnica del implante.
Uno de los avances más trascendentales para el desarrollo clínico de los trasplantes fue el advenimiento de la ciclosporina. Este hecho minimizó la importancia de las transfusiones previas y el grado de compatibilidad del sistema de antígenos leucocitarios humanos (HLA). La investigación tuvo lugar en el contexto de estudios sobre nuevos antibióticos en el Departamento de Microbiología de Sandoz, en Basilea. Una de las cepas del hongo Tolypocladium inflatum produce una serie de polipéptidos cíclicos denominados ciclosporinas. Uno de estos metabolitos, la ciclosporina A (CsA), presenta propiedades antifúngicas in vitro. J-F. Borel observó una inhibición selectiva de cultivos de linfocitos sin que se demostraran propiedades citostáticas más globales. Además, demostró que la CsA es trescientas veces más activa contra la proliferación de linfocitos de origen esplénico que frente a otras cepas celulares, y se diferencia claramente en este punto de los citostáticos clásicos y de los inmunosupresores existentes, ya sean los corticoides, la azatioprina o las globulinas antilinfocitarias1.
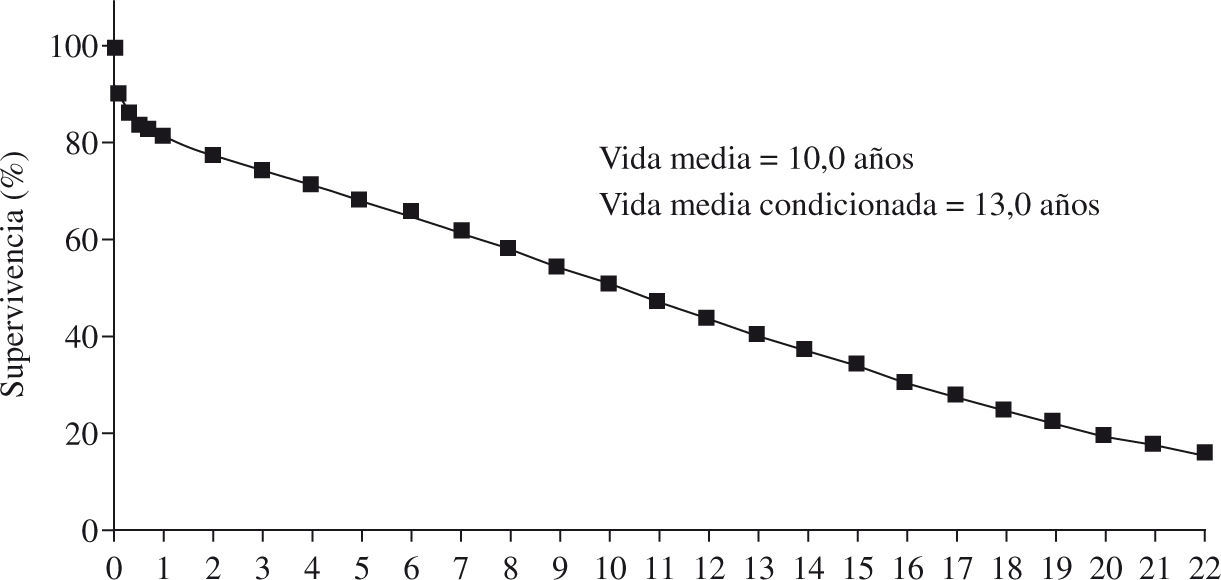
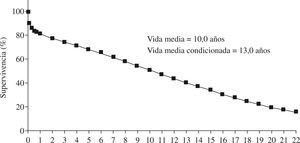
IntroductiónEl trasplante cardíaco se considera en la actualidad, junto a la asistencia circulatoria, el tratamiento más eficaz para mejorar de forma significativa el pronóstico de pacientes con insuficiencia cardíaca en fase terminal, que no es posible de conseguir con tratamientos médicos y/o quirúrgicos convencionales. La introducción de la ciclosporina en el año 1982 como tratamiento inmunosupresor supuso conseguir unas mejores tasas de supervivencia no alcanzadas hasta ese momento. En los últimos años, los resultados del trasplante cardíaco han mejorado progresivamente, especialmente gracias a los avances en la cirugía y la anestesia, los nuevos inmunosupresores y el mejor control de las infecciones, del rechazo (agudo y crónico) y de los tumores. Según el registro de la International Society of Heart and Lung Transplantation (ISHLT) en 2009, la supervivencia media de los adultos que reciben un trasplante cardíaco es superior al 50% a los 10 años, con una vida media de 13 años para los pacientes que consiguen sobrevivir los primeros seis meses tras el trasplante (Fig. 1).
Según el ISHLT, el número de trasplantes cardíacos registrados actualmente en el mundo es superior a los 80.000, sin embargo, el número probablemente es bastante superior, ya que algunos hospitales no verifican sus datos a este registro al ser voluntario. En España, hasta diciembre de 2009 se registraron 6.048 trasplantes cardíacos, con un máximo de 353 trasplantes en el año 2000, a partir del cual, el número anual se ha reducido progresivamente hasta 2007, año en el que se realizaron 241 trasplantes en 18 hospitales.
La disminución de los donantes óptimos, condicionada por la reducción de la mortalidad por traumatismo craneoencefálico por accidentes de tráfico, ha producido un aumento en los días de espera para obtener corazones óptimos pese a utilizar donantes de mayor edad. Además, aproximadamente el 20% de los candidatos a trasplante cardíaco en lista de espera fallecen por falta de donantes, o tienen que ser excluidos por la aparición de complicaciones que contraindican el trasplante. Para intentar paliar esta situación, además de concienciar a la población general de la necesidad de donaciones a través de la Organización Nacional de Trasplantes, se están utilizando, cada vez con mayor frecuencia, dispositivos de asistencia circulatoria que permiten mejorar una situación hemodinámica crítica, y de esta forma llegar en condiciones aceptables al trasplante cardíaco2.
SelecciÓn y extraccón del corazón donanteLa valoración y validación del corazón donante para trasplante cardíaco, al igual que ocurre con otros órganos para trasplante, se establece en tres fases sucesivas. La primera fase se lleva a cabo por el equipo coordinador de trasplantes del hospital que genera el donante, y consiste en averiguar datos sobre la causa y el diagnóstico de la muerte cerebral, superficie corporal del donante, peso, tamaño y diámetros del tórax, grupo sanguíneo, antecedentes sobre VIH, virus de hepatitis B y C, Toxoplasma cruzi, datos analíticos de laboratorio, hematológicos y gasométricos, evolución clinicohemodinámica del donante, y tipo y dosis de soporte inotrópico. La segunda fase consiste en la valoración cardiorrespiratoria y hemodinámica del donante. En este momento es obligatorio descartar la existencia de traumatismo que haya afectado al corazón y pulmones, enfermedad estructural de estos órganos y parada cardíaca previa; este hecho no es un impedimento absoluto si, tras la parada, la función cardíaca se mantiene normal. Durante esta fase es necesario constatar la evolución de la tensión arterial, la frecuencia cardíaca, los tipos y las dosis de catecolaminas, la diuresis y la función renal, además de verificar la ausencia de infecciones sistémicas y tumores. Es necesario objetivar que la radiografía de tórax, el electrocardiograma (ECG), el ecocardiograma, la gasometría arterial, los parámetros ventilatorios, el tiempo de ventilación mecánica y en ocasiones especiales la coronariografía sean normales. La valoración final se realiza por el equipo extractor, que confirma los datos obtenidos en las fases previas. La tercera fase la realiza el equipo extractor y consiste en contrastar los datos previos proporcionados por la coordinación de trasplantes. En este momento se valora la morfología, el tamaño y la motilidad cardíaca, así como la palpación de las arterias coronarias y la contracción de los ventrículos. Aunque estos datos son muy subjetivos, cuando el cirujano tiene gran experiencia, adquieren gran valor en la toma de decisiones.
Los criterios que aparecen en la tabla I de selección de donante para trasplante cardíaco son generales y carecen de valor absoluto. Deben ser considerados de forma relativa, teniendo en cuenta de forma conjunta los datos del donante y las características particulares del receptor al que se va a implantar el corazón.
Criterios generales de selección del donante para trasplante cardíaco
|
La creciente necesidad de obtener órganos sólidos para trasplante de corazón, hígado, riñón, pulmón, páncreas e intestino obliga a mejorar el aprovechamiento de los cadáveres-donantes disponibles. Esta realidad actual requiere optimizar la extracción multiorgánica en la que intervienen diferentes equipos quirúrgicos. Para conseguir este objetivo, es imprescindible mantener de forma adecuada el estado hemodinámico, la oxigenación y el equilibrio hidroelectrolítico del donante hasta el momento de la extracción, así como prevenir las posibles infecciones y reponer la pérdida de elementos sanguíneos si fuera necesario. La extracción multiorgánica exige que los cirujanos que participen se ajusten a las normas de conducta que favorezcan la extracción de todos los órganos previstos sin detrimento de alguno de ellos.
Los principios básicos se fundamentan en una disección precisa y adecuada de los órganos a extraer, hecho que va a permitir conocer variantes anatómicas, y de este modo, facilitar la extracción posterior; además, es necesario conseguir que el tiempo de «isquemia caliente» de todos los órganos extraídos sea de «cero» y que el enfriamiento tanto in situ como durante el transporte posterior sea el adecuado para cada órgano hasta el momento del implante. Finalmente, es necesario lograr que los pedículos vasculares de los órganos extraídos permanezcan íntegros, sin detrimento de los otros órganos cuando aquellos sean compartidos. El orden de extracción viene determinado por el tiempo de viabilidad del órgano en «isquemia fría»; por esta razón, en primer lugar se efectúa la extracción del corazón y los pulmones, y después el hígado, el páncreas, los riñones y el intestino, por este orden. En la mayoría de las extracciones multiorgánicas se practica una incisión desde el yúgulo esternal hasta la sínfisis del pubis (esternotomía y laparotomía media), lo que permite una adecuada exposición de los órganos torácicos y abdominales. En algunas ocasiones, cuando no se efectúa la extracción de órganos torácicos, puede sustituirse la incisión anterior por una laparotomía media prolongada en la parte superior por dos incisiones subcostales bilaterales. Una vez abierto el pericardio, el cirujano extractor valora la morfología del corazón, el aspecto macroscópico, la contracción cardíaca y la palpación de las arterias coronarias, determina la existencia de contusiones o lesiones miocárdicas asociadas y la existencia de malformaciones congénitas. Aunque la valoración de muchos de estos datos es subjetiva, cuando el cirujano tiene experiencia adquieren gran valor en la toma de decisiones. Cuando el corazón se considera válido para trasplante, se libera la aorta ascendente de sus adherencias al tronco de la arteria pulmonar, se diseca la vena cava superior extrapericárdica, distal a la desembocadura de la vena ácigos, y se separa la vena cava inferior de la reflexión pericárdica a este nivel; esto permite utilizar este vaso cuando es necesario compartirlo con la extracción hepática. En este momento se detiene la extracción cardíaca en espera de la preparación de los órganos abdominales. Al finalizar la disección de los órganos admitidos válidos como injertos para trasplante, se administra al donante una dosis de heparina sódica (3mg/kg de peso). En este momento se canulan la aorta y la vena cava abdominal para la infusión de las soluciones protectoras y el drenaje de los órganos abdominales que van a ser extraídos. Al mismo tiempo, se canula la aorta ascendente para infusión de la solución cardiopléjica. Una vez ocluida la aorta ascendente distal a la cánula, se inicia la infusión de un litro de solución cardiopléjica (1.000 ml de Celsior R) a 4 ºC a través de la cánula insertada en la aorta ascendente (Tabla II)14. En este punto, es importante evitar la sobredistensión de las cavidades cardíacas derechas e izquierdas; para evitar esto, se puede seccionar la vena cava superior distal a la desembocadura de la vena ácigos, alguna vena pulmonar, la orejuela de la aurícula izquierda y se hace insuficiente la válvula mitral, respectivamente, en el caso de que no exista extracción simultánea de los pulmones. Mientras se perfunde la solución cardiopléjica, el corazón se enfría de forma tópica con una solución de suero fisiológico también a 4 ºC.
Composición (por litro) de solución car-dioplégica celsior R
| Manitol | 10.930gr | 60mmol |
| Ácido lactobiónoco | 28.664gr | 80mmol |
| Ácido glutámico | 2.942gr | 20mmol |
| Hidróxido sódico | 4.000gr | 100mmol |
| Cloruro cálcico, 2 H2O | 0.037gr | 0,25mmol Ca++ |
| Cloruro potásico | 1.118gr | 15mmol K++ |
| Cloruro magnésico, 6 H2O | 2.642gr | 13mmol Mg++ |
| Histidina | 4.650gr | 30mmol |
| Glutation | 0.621gr | 3mmol |
| Agua para inyectable | c.p.s. | 1litro |
mmol: milimol
Una vez comprobada la parada electromecánica del corazón, la ausencia de distensión de las cavidades cardíacas y finalizada la infusión de la solución cardiopléjica, se produce la resección del corazón. Se secciona la aorta ascendente a nivel del tronco innominado y la arteria pulmonar a nivel de su bifurcación. En el caso de que no exista extracción pulmonar, las cuatro venas pulmonares se dividen a nivel de su entrada en el pericardio, la vena cava superior distal a la desembocadura de la vena ácigos y la vena cava inferior en su unión con la aurícula derecha. Cuando la extracción cardíaca coincide con la pulmonar, las venas pulmonares no se seccionan de forma independiente, sino que es preciso dejar el casquete posterior de la aurícula izquierda que incluya las cuatro venas pulmonares para, posteriormente, dividirlo en sentido craneocaudal, dejando unidas en dos bloques las venas del lado derecho e izquierdo. También es importante seccionar el tronco de la arteria pulmonar antes de la bifurcación para poder disponer de los dos troncos arteriales principales independientes para cada pulmón. Si la vena cava inferior se divide en la unión con la aurícula derecha, queda suficiente vena cava suprahepática para poder hacer la anastomosis de este vaso en el trasplante hepático. La cirugía de banco para preparar el injerto cardíaco puede hacerse en el momento de la extracción o momentos antes del implante. El tipo de preparación va a depender de la técnica de implante (técnica de Shumway y Lower, bicava, o anastomosis independiente de las venas pulmonares). En este momento se exploran las cavidades cardíacas, válvulas, tabique y paredes del corazón. En la práctica, como a la mayoría de los donantes cardíacos se les ha practicado un ecocardiograma, es difícil descubrir algún defecto o anomalía en el injerto que no se conociese previamente. La preservación del injerto y el transporte se realizan en un recipiente estéril sumergido en solución Celsior R enfriada a 8-12 ºC, que a su vez se introduce en tres bolsas de forma sucesiva para evitar la contaminación. Finalmente, el corazón se introduce en un recipiente isotermo para que el corazón se mantenga durante el transporte entre 8-12 ºC3.
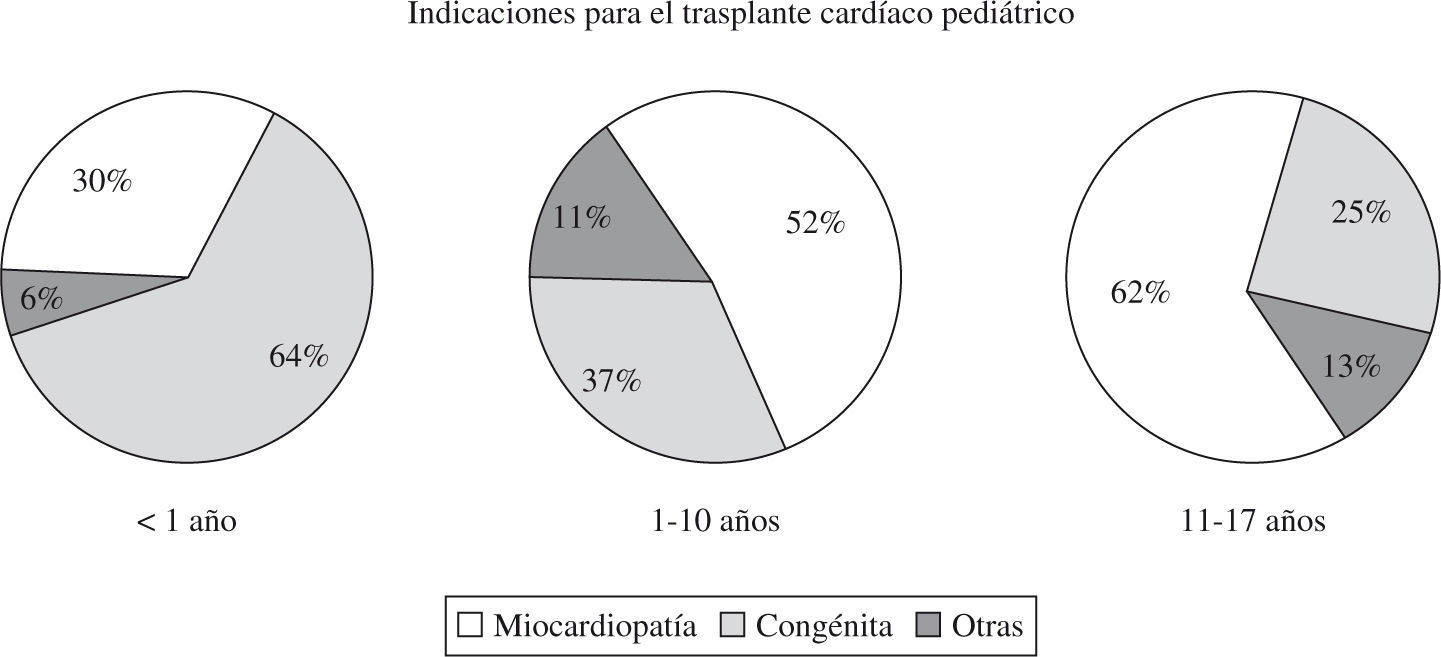
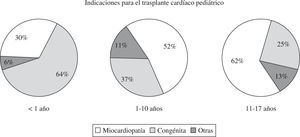
Con el desarrollo de los programas de trasplante cardíaco, los pacientes pediátricos con cardiopatías congénitas han ido ocupando un lugar en las indicaciones de trasplante (Fig. 2). En estos casos es necesario valorar el tipo anatómico de la cardiopatía congénita, así como si existen intervenciones quirúrgicas previas. Estos hechos van a condicionar la técnica de extracción, que va a permitir reparar las anomalías preexistentes y la reconstrucción de las mismas. Un aspecto fundamental a tener en cuenta en el momento de la extracción cardíaca es la necesidad de realizar técnicas reconstructoras que puedan afectar a las aurículas, venas cavas y grandes vasos arteriales en el momento del implante. En estos casos es necesario la extracción adicional con el corazón donante de la vena cava superior hasta el tronco innominado venoso, de la aorta ascendente, incluido el cayado aórtico con sus troncos, y la arteria pulmonar con las ramas principales. Las anomalías que afectan a la arteria aorta y que precisan ser consideradas para su reconstrucción varían de unos casos a otros. Incluyen desde la dilatación de la aorta ascendente, transposición de las grandes arterias, aorta ascendente hipoplásica asociada a ventrículo izquierdo hipoplásico en neonatos e hipoplasia del arco aórtico.
En las situaciones en que existe una desproporción entre el tamaño de la aorta del donante y la aorta hipoplásica del receptor, es preciso realizar una aortoplastia en la aorta del receptor que permita ampliar la cara anterior de la aorta ascendente; de este modo se trata la malformación aórtica y se adecuan los tamaños de las aortas ascendente del receptor y donante. Si el tamaño de la aorta ascendente del receptor es el adecuado a su superficie corporal, pero la aorta del donante es de mayor tamaño, puede efectuarse una aortoplastia en la aorta del receptor, o la técnica del telescopaje, que consiste en introducir y suturar la aorta del receptor dentro de la del donante. En los casos en los que existan procedimientos quirúrgicos previos o hipoplasia grave de la aorta ascendente y del arco aórtico, es necesario garantizar la longitud adecuada de la aorta del donante para sustituir la aorta ascendente y el cayado, que en ocasiones puede llegar hasta la zona del istmo (distal a la salida de la subclavia izquierda). Un hallazgo no infrecuente en los receptores, tanto en pacientes congénitos como en adultos, es la existencia de una vena cava superior izquierda con ausencia de vena innominada; en estos casos es necesario extraer en el donante tanto la vena cava superior como la vena innominada para que pueda ser anastomosada a la vena cava superior izquierda. Con el creciente desarrollo de los trasplantes pediátricos, cada día se plantean pacientes con cardiopatías más complejas y con intervenciones paliativas o correctoras previas. Estos nuevos retos obligan a modificar la estrategia de la extracción cardíaca, para lo cual es necesario conocer con precisión la anatomía de la cardiopatía congénita y el tipo de la intervención quirúrgica si las hubiera. Estos datos son fundamentales en el momento de extraer el corazón con la longitud adecuada de pedículos vasculares en vena cava, arteria pulmonar y aorta. En el caso de que la longitud de los vasos no sea suficiente para corregir la cardiopatía, pueden extraerse conductos vasculares aislados (arteriales y/o venosos) para ampliarlos con cirugía de banco3,4.
Indicaciones para el trasplante cardíaco pediátrico
Indicaciones de trasplante cardíacoDe forma general, el trasplante cardíaco está indicado en enfermos portadores de una cardiopatía grave en situación terminal, con una grave incapacidad física al esfuerzo, sin otras alternativas de tratamiento médico y/o quirúrgico, y sin otras enfermedades asociadas que contraindiquen o limiten la práctica de este tratamiento.
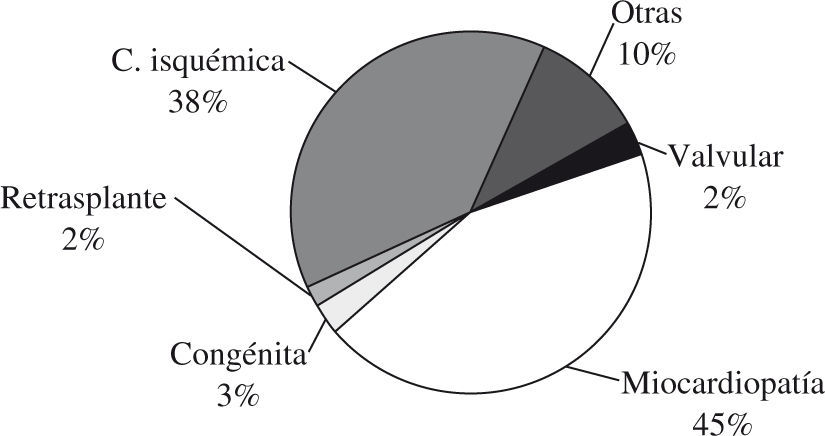
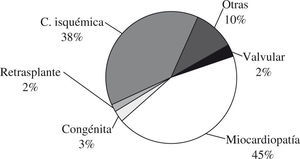
Las indicaciones de las enfermedades para el trasplante cardíaco en los adultos aparecen reflejadas en la figura 3, tomada del registro de la Sociedad Internacional de Trasplante Cardíaco y Pulmonar.
Los recientes avances en el tratamiento médico de la insuficiencia cardíaca (fármacos, dispositivos de resincronización, desfibriladores implantables) han producido importantes mejoras en cuanto a la supervivencia de estos pacientes y mejora en la calidad de vida. Por otro lado, hay que tener en cuenta que la mortalidad durante el primer año tras el trasplante cardíaco oscila entre el 15 y 20%, lo cual dificulta asegurar qué grupo de pacientes se beneficiaría realmente del trasplante. Se consideran indicaciones absolutas de trasplante cardíaco el shock cardiogénico refractario y aquellas situaciones en clase IV de la New York Heart Asociation (NYHA) con bajo gasto mantenido que precisan soporte inotrópico y/o mecánico. Otras indicaciones aceptadas son: la angina refractaria con disfunción ventricular izquierda no susceptible de ser tratada de forma percutánea ni quirúrgica y las arritmias malignas no tratables con fármacos ni con desfibrilador implantable. En la tabla III aparecen las indicaciones actuales absolutas, relativas e insuficientes para el trasplante cardíaco2–5.
Indicaciones absolutas, relativas e insuficientes para el trasplante cardíaco
|
Las contraindicaciones para el trasplante cardíaco son cada día más escasas, por ello se prefiere hablar de condiciones que aumentan la morbilidad y/o mortalidad postrasplante y que solas o combinadas pueden hacer desestimable el trasplante. En la práctica, la mayoría de los programas de trasplante diferencian entre contraindicaciones absolutas y contraindicaciones relativas menores (Tabla IV).
Contraindicaciones absolutas, relativas mayores y menores para trasplante cardíaco
|
La presencia de hipertensión pulmonar en el receptor puede ser causa de fallo del ventrículo derecho en el postoperatorio inmediato postrasplante. Aunque el grado de parámetros absolutos relacionados con la hipertensión pulmonar aún no estén establecidos para contraindicar el trasplante cardíaco, la mayoría de los centros que realizan trasplantes cardíacos aceptan como límite de inope-rabilidad cuando las resistencias arteriolares pulmonares superan las cinco unidades Wood. Otro parámetro comúnmente utilizado es el gradiente transpulmonar (presión media de la arteria pulmonar-presión capilar pulmonar) mayor de 15mmHg. En algunas situaciones, las resistencias vasculares pulmonares se pueden modificar a la baja mediante tratamiento farmacológico con inotrópicos (dobutamina, milrinona, levosimendán), vasodilatadores pulmonares (epo-prostenol, óxido nítrico, sildenafilo), o con dispositivos de asistencia circulatoria ventricular mecánica temporal. Por estas razones, antes de contraindicar formalmente un trasplante cardíaco debería intentarse una reducción de la presión pulmonar con estas alternativas.
Las infecciones sistémicas activas son contraindicación temporal hasta que se hayan resuelto, debido al tratamiento inmunosupresor, que favorece la mala evolución de ellas. La infección por el VIH es una contraindicación relativa, y debe ser valorada de forma individual según el grado de afectación orgánica y el estadio de la enfermedad.
Si el paciente tiene antecedentes de enfermedad tumoral, es necesario descartar evidencia de enfermedad residual, recurrencia o metastásica durante el tiempo suficiente para considerar que el proceso está curado. En estos casos, es aconsejable estratificar a los pacientes, junto con el oncólogo, para valorar de forma individual el riesgo de recurrencia tumoral.
La diabetes mellitus insulinodependiente, aunque no es una contraindicación absoluta para el trasplante cardíaco, empeora el pronóstico. El tratamiento crónico con corticoides dificulta el control metabólico de estos enfermos, además de presentar una mayor incidencia en las infecciones y complicaciones vasculares que disminuyen la expectativa de vida.
Las insuficiencias hepáticas y renales potencialmente reversibles secundarias a la insuficiencia cardíaca tras el trasplante cardíaco deben ser evaluadas de forma precisa. En general, la cirrosis hepática establecida y la insuficiencia renal avanzada (creatinina > 2,5mg/dl o aclaramiento de creatinina < 50 ml/min) se asocian a mala evolución postrasplante y se consideran contraindicaciones absolutas para trasplante cardíaco, excepto si es posible practicar un trasplante de hígado o riñón.
La edad del receptor para el trasplante cardíaco es un criterio controvertido. Según el registro de ISHLT, se han efectuado trasplantes cardíacos desde la edad perinatal hasta los 77 años, con una edad media de 50,7 años. Los trasplantes cardíacos en pacientes menores de un año tienen una mayor tasa de mortalidad quirúrgica (25%) condicionada por la complejidad quirúrgica de la técnica (cardiopatías congénitas complejas), dificultad de conseguir donantes con estas edades, imposibilidad legal de declarar la muerte cerebral de fetos anencéfalos según la legislación de algunos países y la imposibilidad de practicar la monitorización al rechazo cardíaco con biopsia endomiocárdica. En el límite superior de edad (65-70 años), se ha demostrado que la incidencia de rechazo parece ser menor al resto (posiblemente por una menor reactivación del sistema inmunitario), la morbilidad postoperatoria es significativamente mayor y el grado de recuperación funcional es inferior al de los pacientes con mediana edad. Partiendo del hecho de que el número de donantes es limitado, es obligatorio conseguir unos resultados óptimos en cuanto a la supervivencia y mejora funcional. Por otro lado, parece lógico pensar que este procedimiento terapéutico debería beneficiar en primer lugar a aquellos pacientes con mayores posibilidades de sobrevivir.
Desde este punto de vista, parece razonable pensar que la edad biológica fuera un mejor criterio para indicar el trasplante cardíaco que la edad cronológica.
La enfermedad pulmonar previa puede dificultar la extubación postoperatoria y aumentar el riesgo de infección. El valor del volumen espiratorio forzado en el primer segundo (FEV1) < 40% del predicho, una capacidad vital forzada (CVF) < 50% de lo normal, una capacidad de difusión de oxígeno (DLCO) < 40% de la teórica, a pesar de un tratamiento óptimo, contraindican de forma absoluta el trasplante cardíaco. El tromboembolismo pulmonar reciente y la formación de abscesos pulmonares en pacientes inmunodeprimidos aconseja esperar de uno a tres meses hasta conseguir la estabilización del foco trombogénico y la localización y el tamaño en el pulmón.
El consumo abusivo, continuado y activo de tabaco, alcohol, cocaína y otras drogas se considera una contraindicación absoluta para el trasplante cardíaco. Para poder incluir a estos pacientes en un programa de trasplante cardíaco es preciso demostrar al menos seis meses de abstinencia y que un equipo de psicólogos emita un informe favorable. Las psicopatías inestables, las conductas suicidas, las alteraciones importantes de la personalidad y las conductas previas documentadas de incumplimiento terapéutico se consideran también contraindicaciones absolutas.
En la actualidad no se ha demostrado que la obesidad tenga relación con un mayor riesgo de mortalidad, rechazo agudo o enfermedad vascular del injerto (EVI), aunque sí aumenta el riesgo de hipertensión, diabetes mellitus, hiperlipidemia, infecciones y osteoporosis. Aunque el peso es una variable continua, es difícil de establecer un corte; en general, se considera una contraindicación relativa cuando el peso es > al 120% del peso ideal6,7.
Implante cardíacoLa técnica quirúrgica descrita por Shumway y Lower para el implante del corazón en el trasplante cardíaco se conoce por los cirujanos cardíacos como «técnica clásica o de sutura biauricular»8. Yacoub en Inglaterra9 y Dreyfus10 en Francia introdujeron la técnica de «trasplante cardíaco total», que implica la sutura aislada de ambas venas cavas entre el corazón donante y el receptor. Esta modificación de la técnica original intentó mejorar la fisiología del corazón trasplantado a costa de una mayor complejidad técnica. Sarsam11, en 1993, intentó conseguir los beneficios de ambas técnicas como procedimiento intermedio con la técnica del «trasplante cardíaco con sutura bicava», una alternativa que pretende preservar mejor la morfología y fisiología de la aurícula izquierda, dejando la aurícula derecha del donante intacta.
La técnica de implante ortotópico biauricular de Shumway y Lower consiste en la anastomosis de las dos aurículas por separado (izquierda y derecha) entre el receptor y el donante, y de las arterias (aorta y pulmonar) entre el receptor y el donante. Tras la resección del corazón receptor quedan cuatro cavidades. Las dos aurículas, izquierda y derecha que incluyen las cuatro venas pulmonares y las dos cavas, respectivamente, y los dos troncos arteriales (aorta y pulmonar). Estas cuatro bocas se anastomosan con suturas continuas con las respectivas cámaras del corazón donante.
El implante ortotópico con técnica bicava consiste en anastomosar las dos venas cavas de forma independiente preservando la anatomía y la función de la aurícula derecha, el resto de las anastomosis se efectúan según la técnica clásica.
El implante ortotópico con sutura derecha bicava e izquierda bipulmonar («trasplante total») consiste en anastomosar de forma independiente las venas pulmonares izquierdas y derechas entre el receptor y el corazón donante. Posteriormente, se suturan también de forma independientes las dos venas cavas y finalmente las arterias aortas y pulmonares8–12.
Rechazo y tratamiento inmunosupresorEl rechazo del corazón trasplantado es la respuesta natural del injerto frente al huésped. La detección de antígenos extraños del corazón trasplantado desencadena la respuesta inmune, que lesiona los miocitos y las células endoteliales de los vasos, cuyo diagnóstico en la fase aguda puede realizarse a través de la biopsia endomiocárdica.
El rechazo hiperagudo supone la forma de rechazo de mayor riesgo. En la práctica clínica es poco frecuente y sucede en los primeros momentos u horas tras restablecer el flujo sanguíneo del receptor a través del injerto cardíaco. Se debe a anticuerpos preformados contra antígenos del sistema HLA del donante ABO (por incompatibilidad del grupo sanguíneo) o contra antígenos endoteliales. La patología de este tipo de rechazo se conoce a través de estudios experimentales y los escasos pacientes fallecidos por esta causa. La histopatología responde a zonas de hemorragias miocárdicas amplias, marginación de polimorfonucleares intravasculares y microtrombosis vasculares.
El rechazo agudo celular se corresponde al tipo más frecuente de rechazo cardíaco. Se detecta en alguna ocasión entre el 40 y 70% de todos los trasplantados cardíacos, y aunque puede ocurrir en cualquier momento tras el trasplante, es más común durante los primeros seis meses. La anatomía patológica se caracteriza por la presencia de infiltrados linfocitarios, polinucleares, edema de los miocitos y necrosis de los mismos; cuando aumenta la gravedad de la lesión se produce eosinofilia, vasculitis y hemorragias en el foco de lesión. La gran mayoría de este tipo de rechazo es clínicamente asintomático y el diagnóstico se establece mediante biopsia endomiocárdica13,14.
La necesidad de establecer tratamiento general depende del tiempo transcurrido tras el trasplante, la gravedad histológica del rechazo, el compromiso clinicohemodinámico y los protocolos terapéuticos de cada grupo de trasplantes. La lesión de los capilares miocárdicos, detección de inmunoglobulinas y/o activación del complemento en la pared de los pequeños vasos se establece mediante inmunofluorescencia o inmunohistoquímica. Este tipo de rechazo produce una grave depresión de la función sistólica ventricular, originada por la isquemia difusa secundaria a la pérdida de reserva vascular coronaria.
El rechazo crónico se conoce como EVI. Es la complicación tardía más importante en el trasplante cardíaco, ya que conduce frecuentemente a la muerte o a la necesidad del retrasplante. Se caracteriza por un rápido y progresivo estrechamiento concéntrico y difuso de las arterias coronarias del corazón trasplantado. Los criterios histológicos fueron definidos por Billingham y se caracterizan por hiperplasia tubular miointimal.
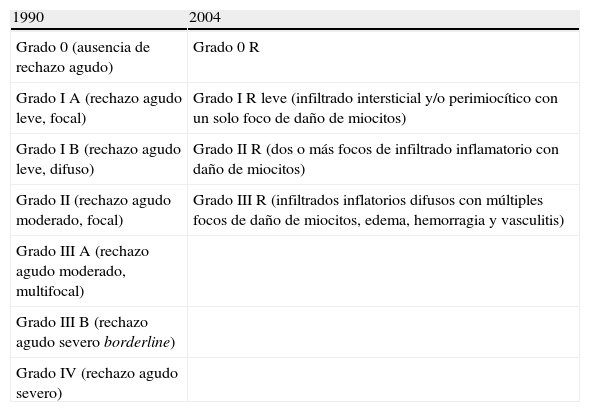
La clasificación del rechazo celular referido por la ISHLT aparece en la tabla V14.
Clasificación del rechazo celular referido por la ISHT
| 1990 | 2004 |
| Grado 0 (ausencia de rechazo agudo) | Grado 0 R |
| Grado I A (rechazo agudo leve, focal) | Grado I R leve (infiltrado intersticial y/o perimiocítico con un solo foco de daño de miocitos) |
| Grado I B (rechazo agudo leve, difuso) | Grado II R (dos o más focos de infiltrado inflamatorio con daño de miocitos) |
| Grado II (rechazo agudo moderado, focal) | Grado III R (infiltrados inflatorios difusos con múltiples focos de daño de miocitos, edema, hemorragia y vasculitis) |
| Grado III A (rechazo agudo moderado, multifocal) | |
| Grado III B (rechazo agudo severo borderline) | |
| Grado IV (rechazo agudo severo) |
Los grados de rechazo celular se designa numéricamente del 0 R al III R, el sufijo R significa «revisado».
Existe un rechazo agudo mediado por anticuerpos o rechazo humoral. Esta forma de rechazo es más controvertida y no existe consenso en su definición; por lo tanto, su incidencia es difícil de estimar. El diagnóstico de sospecha es clínico y está condicionado por síntomas y signos de disfunción del injerto sin evidencia de rechazo celular significativo en la biopsia15,16.
El diagnóstico se establece mediante la infiltración de células mononucleares y macrófagos cargadas de lípidos en los vasos respetando por lo general la lámina elástica interna y con escasa o nula calcificación. Es generalmente difusa y afecta a los vasos arteriales y venosos, epicárdicos, intramiocárdicos y capilares. Estos datos avalan las diferencias con la arteriopatía coronaria del corazón no trasplantado.
En la patogenia de la EVI se han implicado factores inmunológicos (como la disparidad entre el sistema HLA de receptor y donante, episodios repetidos de rechazo humoral o celular) y otros no inmunológicos (arteriosclerosis, o factores de riesgo cardiovascular en el donante, edad avanzada, sexo masculino, infecciones por citomegalovirus [CMV], dislipemia, obesidad, tabaquismo, hiperhomocisteinuria). El diagnóstico se realiza mediante coronariografía y especialmente con ecografía intracoronaria (ultrasonido intravascular [IVUS]). El IVUS permite valorar directamente el engrosamiento de la íntima y detectar la enfermedad en fases precoces cuando el angiograma aún es normal. El engrosamiento máximo de la íntima durante el primer año postrasplante valorado mediante IVUS ha demostrado ser un predictor del pronóstico a largo plazo. Una vez establecida la enfermedad, el único tratamiento efectivo hasta hace pocos años era el retrasplante. Sin embargo, la alta mortalidad en el segundo trasplante (cercana al 30%), la posibilidad de desarrollo de un nuevo EVI y la carestía global de corazones donantes hacen que esta alternativa esté reservada para pacientes muy seleccionados17.
La angioplastia coronaria, cuando es factible, obtiene buenos resultados iniciales, aunque con mayores tasas de reestenosis que en la arteriosclerosis clásica. En algunos casos con estenosis coronarias significativas y localizadas y con aceptables lechos distales se ha realizado by-pass aortocoronario18.
En los últimos años los objetivos van encaminados a desarrollar estrategias que prevengan o retrasen el desarrollo de la EVI. El control de los factores de riesgo cardiovascular clásicos puede ser eficaz. Las estatinas tienen efecto positivo en la supervivencia del trasplante, independiente de su efecto en reducir el colesterol de baja densidad (LDL). Los antagonistas del calcio han demostrado reducir la incidencia de EVI. Sirolimus y everolimus han demostrado reducir la proliferación de células musculares en los vasos coronarios. Sirolimus asociado a CsA puede prevenir el desarrollo de EVI en el trasplante cardíaco. Everolimus asociado a dosis bajas de CsA y corticoides es más eficaz en prevenir el rechazo agudo e infecciones por CMV que la combinación clásica de CsA, azatioprina y prednisona.
El tratamiento inmunosupresor va encaminado a evitar el rechazo y afectar lo menos posible a la capacidad de defensa del receptor frente a las infecciones y las neoplasias. La terapia inmunosupresora tiene tres objetivos: la inducción citolítica, el mantenimiento y el tratamiento de los episodios de rechazo. Se han utilizado múltiples agentes y estrategias con resultados diferentes, debido a que la mayoría de los fármacos empleados son poco específicos y producen efectos secundarios importantes.
El tratamiento precoz de inducción, a pesar de la amplia experiencia, sigue siendo controvertido. Se estima que en la actualidad solo se utiliza en la mitad de los pacientes trasplantados debido al riesgo de aumento de infecciones, posibilidad de desarrollar tumores y la liberación de citocinas. Su utilidad se basa en la capacidad inmunosupresora y la posibilidad de retrasar el uso de otros fármacos inductores más nefrotóxicos. Los anticuerpos antilinfocitarios, tanto monoclonales anti-CD3 (OKT3) como policlonales (globulinas antilinfocíticas [ALG], globulinas antitimocítica [ATG], timoglobulinas) utilizados ampliamente en el pasado, están siendo utilizados en la actualidad por nuevos anticuerpos monoclonales contra el receptor de la interleucina 2 (basiliximab, baciluzumab, etc.) debido a que parecen ofrecer una eficacia similar con una menor toxicidad.
El mantenimiento de la inmunosupresión clásica se basa en la combinación de triple terapia. Inhibidores de la calcineurina (ICN), CsA o tacrolimus (FK 506), un antiproliferativo (micofelonato mofetilo [MMF]), micofelonato sódico o azatioprina y esteroides. La utilización de uno u otro fármaco depende del perfil clínico de cada paciente, teniendo en cuenta los efectos adversos y la capacidad de prevenir episodios de rechazo. La CsA fue el primer INC desarrollado y en algunos países como España es el inmunosupresor más utilizado, aunque en la actualidad está siendo superado por el tacrolimus como INC de primera elección.
Se ha demostrado que CsA y tacrolimus tienen una eficacia similar para prevenir rechazos agudos y logran supervivencias equivalentes en seguimientos de cinco años. Ambos ICN son nefrotóxicos, pueden causar hipertensión e hiperlipemia, pero tacrolimus es más diabetógeno. Estos factores de riesgo cardiovasculares pueden exacerbarse aún más por el uso concomitante con esteroides.
Los fármacos antiproliferativos completan la acción inmunosupresora de los ICN. La azatioprina fue el primero en utilizarse, aunque ha sido superado por producir mielodepresión (leucopenia) y favorecer la aparición de neoplasias (sobre todo cutáneas). El MMF se utiliza en la actualidad en más del 75% de los trasplantados cardíacos, ofrece sobre la azatioprina una mejor supervivencia y una disminución del número de rechazos graves.
Los corticoides fueron los primeros inmunosupresores que se utilizaron en el trasplante cardíaco. En la actualidad se siguen utilizando en los regímenes inmunosupresores de inducción, mantenimiento y tratamiento del rechazo; sin embargo, presentan efectos secundarios como diabetes mellitus, osteoporosis, obesidad, HTA, miopatías, trastornos psiquiátricos, etc. A pesar de estos efectos adversos y aunque la tendencia es disminuir la dosis o suprimirla, la relación riesgo-beneficio no se conoce, por lo que según el ISHLT más del 60% de los pacientes a largo plazo reciben esteroides.
Sirolimus y everolimus actúan como fármacos antiproliferativos y su principal ventaja es la de prevenir el desarrollo de la EVI; sin embargo, tienen efectos secundarios como hipercolesterolemia, hipertrigliceridemia, trombocitopenia, neutropenia y anemia.
El tratamiento de los episodios de rechazo cuenta con pautas variables dependiendo del grado histológico, repercusión clínica, tiempo postrasplante y los programas de los centros. Las crisis de rechazo se suelen controlar con pulsos diarios de 500mg-1g de metilprednisolona. En casos de rechazo clínico agudo refractario a corticoides o con deterioro clínico o hemodinámico, el tratamiento de elección son los anticuerpos antilinfocitarios mono- o policlonales (OKT3, ATG). En casos excepcionales de rechazos múltiples se ha utilizado el metotrexato y la radiación linfoide corporal total19,20.
Otras complicaciones postrasplante cardíacoLos tumores son hasta un 3-4% veces más frecuente en los pacientes trasplantados de corazón que en la población general. A los cinco años del trasplante casi el 10% de los supervivientes han presentado esta complicación. Constituye la segunda causa de mortalidad a largo plazo en estos pacientes. Los tumores cutáneos suponen la mitad del total de los tumores, principalmente los carcinomas espinocelulares y basocelulares. El sarcoma de Kaposi es casi 500 veces más frecuente en inmunodeprimidos que en personas que no se encuentran en esa situación. También se ha asociado a infecciones por el herpes virus 8. Los tumores de órganos sólidos (pulmón, próstata, colon, riñón, mama, etc.) son más frecuentes que en la población no trasplantada. La enfermedad linfoproliferativa supone el 28% de los tumores no cutáneos, se piensa que pueden estar inducidos por el virus Epstein-Barr. La principal estrategia terapéutica es la detección precoz, debido a su alta mortalidad a pesar de un tratamiento radical. Los inhibidores de la mammalian target of rapamycin (mTOR) han mostrado un efecto antineoplásico, por esta razón, algunos programas de trasplante cardíaco utilizan esta terapia inmunosupresora en estos pacientes21.
Las infecciones son la principal causa de mortalidad durante el primer año tras el trasplante cardíaco. Este hecho se ha puesto en relación con dos factores de riesgo: la exposición a gérmenes patógenos responsables en el foco quirúrgico, pulmonar, urinario y en los catéteres endovasculares, así como de la potencia y duración del tratamiento inmunosupresor22.
A partir del primer mes, destacan las infecciones producidas por virus, hongos, protozoos y bacterias in-tracelulares. Su incidencia y gravedad aumentan en los casos de rechazo que requieren dosis elevadas de inmunosupresores y corticoides. Con el uso generalizado de tratamiento profiláctico se han reducido de forma notable las infecciones bacterianas y por hongos. Los virus en general y el CMV en particular hace años representaban un grave problema en el trasplante cardíaco debido al efecto directo, así como por las complicaciones derivadas de la infección, tales como el rechazo agudo y crónico y las complicaciones derivadas de otras infecciones. La mortalidad por esta causa ha disminuido considerablemente al introducir tratamientos activos como ganciclovir y foscarnet, y la instauración de profilaxis en pacientes de alto riesgo (receptores serológicamente negativos a CMV con donantes CMV positivo). La incorporación de valganciclovir oral, con eficacia similar a ganciclovir endovenoso, permite realizar profilaxis y tratamiento de forma ambulatoria.
La insuficiencia renal es una de las complicaciones más frecuentes en el trasplante cardíaco, y su incidencia aumenta conforme lo hace la supervivencia. A los cinco años del trasplante, el 8,5% de los enfermos presentan cifras de creatinina superiores a 2,5mg/dl y casi un 2% precisan hemodiálisis. El tratamiento de los trasplantados con CsA o tacrolimus, la disfunción renal pretrasplante, la diabetes mellitus, la HTA y la ateroesclerosis generalizada son factores predisponentes para su aparición. Para tratar de evitar esta complicación, es fundamental controlar los factores de riesgo. Los fármacos de elección para el control de la HTA son los antagonistas del calcio, los inhibidores de la enzima convertidora de angiotensina (IECA) y los antagonistas de los receptores de la angiotensina II (ARA II). Deben evitarse los fármacos nefrotóxicos como los antiinflamatorios no esteroideos (AINE), los contrastes radiológicos, la sobredosificación de inmunosupresores ICN y la deshidratación23.
La hipertensión arterial aparece entre el 70 y 90% de los pacientes tratados con CsA y en el 30-50% de los tratados con tacrolimus, por la nefrotoxicidad de dichos fármacos. Otros factores que contribuyen a la hipertensión son: el tratamiento con corticoides y la denervación cardíaca. El tratamiento incluye medidas generales como restricción de sal, ejercicio físico, pérdida de peso y tratamiento farmacológico con hipotensores, tales como antagonistas del calcio, los IECA y los ARA II.
La dislipemia se presenta en el 60-80% de los receptores cardíacos. Diversos fármacos contribuyen a su aparición (CsA, tacrolimus, sirolimus, everolimus, corticoides); la diabetes mellitus, la disfunción renal y la hipercolesterolemia previa contribuyen a esta complicación. Las estatinas son los fármacos de elección, pero deben administrarse con precaución por el riesgo de rabdomiólisis en estos pacientes24.
La osteoporosis está presente al menos en el 3% de los pacientes trasplantados. Un 35% presentan fracturas vertebrales, entre el 3 y el 6% padecen necrosis aséptica de la cabeza del fémur. Los corticoides implicados en el tratamiento crónico inhiben la acción de los osteoblastos y alteran la formación de colágeno en el proceso osteoblástico. El tratamiento va enfocado al ejercicio físico, reducción o supresión de los corticoides, administrar suplementos de calcio y vitamina D, y en casos refractarios bifosfonatos o calcitonina.
ConclusiónEl trasplante cardíaco constituye en la actualidad una terapéutica eficaz en el tratamiento de la insuficiencia cardíaca terminal que no es mejorable con tratamientos médicos y/o quirúrgicos convencionales. Los resultados actuales han mejorado la historia natural en cuanto a la supervivencia de estos pacientes y calidad de vida. Su principal limitación es la escasez de donantes disponibles. Este hecho y el elevado coste del procedimiento deben condicionar la selección meticulosa de los receptores para ofrecer este tratamiento a aquellos pacientes que por una parte más lo necesiten y en aquellos que puedan obtener los mejores resultados.