La enfermedad de Chagas es un problema de salud pública en América Latina con repercusión mundial por la globalización.
ObjetivoPresentar la experiencia acumulada después de 25 años de un único centro con trasplante cardíaco en la cardiomiopatía chagásica.
Método y casuísticaDe 417 pacientes sometidos a trasplante cardíaco desde marzo de 1985 hasta marzo de 2010, 111 (26,6%) eran portadores de cardiomiopatía chagásica: 77 (69,3%) estaban en clase funcional IV; 34 (30,6%) usaban agentes vasopresores y 17 (15,3%) recibían asistencia circulatoria mecánica.
ResultadosLa mortalidad hospitalaria fue 17,1% (19 casos), por infección en 6 (31,5%) casos, disfunción del injerto en 6 (31,5%), rechazo en 4 (21,1%) y muerte súbita en 2 (10,5%) casos, y debido a la falta de coincidencia ABO en 1 (5,3%) caso. la mortalidad tardía fue de 24,3% (26), distribuidos así: 6 (22,2%) por rechazo, 6 (22,2%) por infección, 4 (14,8%) por linfoma; 2 (7,4%) por Kaposi, 2 (7,4%) por pericarditis constrictiva y 1 (7,1%) por reactivación de la enfermedad del sistema nervioso central.
ConclusionesEl trasplante cardíaco es el único tratamiento actual eficaz de tratamiento de la enfermedad de Chagas en fase terminal. La reactivación de la enfermedad es un problema real que es fácilmente revertido con la introducción de la terapéutica farmacológica específica, restaurando los padrones histológicos del miocardio sin dejar secuelas. La inmunosupresión, en especial los corticoides, predisponen al desarrollo de neoplasias y a la reactivación de la enfermedad, exigiendo una atención especial su interrupción o reducción precoz.
Chagas’ disease is a public health problem in Latin America and with universal repercussions by globalization.
ObjectiveTo show the accumulated experience after 25 years with heart transplantation in Chagas’ disease in a single center.
Casuistic and methodFrom 417 patients underwent to heart transplantation since March 1985 to March 2010, 111 (26.6%) patients had Chagas’ disease and formed the current study group: 77 (69.3%) were in functional class IV, 34 (30.6%) in use of vasopressor agents of which 17 (15.3%) were under mechanical circulatory support.
ResultsHospital mortality was 17.1% (19 cases) due to the infection in 6 cases (31.5%), graft dysfunction in 6 (31.5%), rejection in 4 (21.1%), sudden death 2 (10.5%), and due to ABO mismatch in 1 (5.3%) case. Late mortality was in 24.3% (26 cases) during study period: 6 (22.2%) due to rejection, 6 (22.2%) infection, 4 (14.8%) lymphoma, 2 (7.4%) Kaposi, 2 (7.4%) constrictive pericarditis, and 1 (7.1%) for Chagas’ disease reactivation into central nervous system.
ConclusionsHeart transplantation is unique form to modify the natural evolution of the terminal chagasic cardiomyopathy; however, the operation is faced with peculiar problems that differ others patients by possibility of the disease reactivation and increase of neoplasias. The reactivation of the disease is a real problem which is easily reversed by introduction of specific pharmacological therapy, restoring the normal histological patterns without myocardial sequelae. immunosuppression, especially steroids, predisposes to neoplasias and reactivation of the disease, thus requiring special attention as to its use.
La enfermedad de Chagas o tripanosomiasis americana fue relatada en 1908 por el investigador brasileño Chagas1. La enfermedad es endémica en América Latina y representa un problema de salud pública, pues se estima que hay en torno a 12–14 millones de personas portadoras del parásito. La enfermedad se extiende desde México, incluyendo el sur de EE.UU., por la existencia en esa región de los vectores adecuados para la transmisión del parásito, hasta Argentina. Con la globalización y la mayor facilidad del flujo migratorio, casos aislados comenzaron a ser descritos también en EE.UU. y Europa2–4.
Se estima que 25% de los pacientes que adquieren la infección desarrollan síntomas de insuficiencia cardíaca crónica o muerte súbita5,6. Las manifestaciones clínicas de la agresión al corazón son variables, ocurriendo desde formas benignas asintomáticas, con alteraciones discretas de la conducción eléctrica del corazón hasta bloqueos auriculoventriculares completos, arritmias ventriculares complejas y lesión miocárdica grave.
El ventrículo izquierdo es la cámara cardíaca más afectada, y la insuficiencia cardíaca progresiva es la principal causa de muerte en esta enfermedad. La realización del trasplante en la cardiomiopatía chagásica fue inicialmente discutida y controvertida, pues la enfermedad es sistémica, tiene origen infeccioso y no es posible la esterilización del parásito. Con todo, rápidamente los resultados iniciales confirmaron sus ventajas y el método pasó a representar la alternativa más eficiente para rescatar al paciente en el estadio final de la cardiomiopatía. La expectativa de resultados inferiores del trasplante en esta forma de cardiomiopatía en relación con las demás no se confirmó, y paradójicamente se encontraron mejores tasas de sobrevida, probablemente por la resistencia pulmonar no elevada y por tratarse de un grupo que requirió atención especial.
El presente trabajo tiene por finalidad presentar la experiencia acumulada en un único centro en los últimos 25 años con trasplante cardíaco en la fase terminal de la cardiomiopatía chagásica, observando las características peculiares de esta enfermedad y la inmunosupresión.
Casuística y métodosEn el periodo de marzo de 1985 hasta marzo de 2010, 25 años, 417 pacientes fueron sometidos a trasplante cardíaco en el Instituto del Corazón de la Facultad de Medicina de la Universidad de São Paulo, siendo 111 (26,6%) de ellos portadores de la enfermedad de Chagas. El diagnóstico de la enfermedad de Chagas fue confirmado por los antecedentes epidemiológicos, reacciones de fijación del complemento e inmunofluorescencia inmunoglobulina G (IgG) positivas. Los pacientes portadores de megaesófago o megacolon, que representa una complicación de la enfermedad, fueron excluidos del programa de trasplante. La evaluación clínica preoperatoria obedeció a los criterios clásicamente aceptados por el protocolo del grupo.
La edad de los receptores varió entre 11–62 años (42,7±15,3 años), siendo 74 (71,1%) de ellos del sexo masculino, y el periodo de observación varió entre 7 días y 168 meses (132±14 meses). En este grupo las indicaciones para el trasplante fueron en 77 (69,3%) pacientes por estar en insuficiencia cardíaca en clase funcional IV New York Heart Association (NYHA), y fueron operados en forma electiva.
El valor de la fracción de eyección del ventrículo izquierdo determinado por ecocardiografía estuvo comprendido entre 13–62% (32,4±9,8%), la presión sistólica de la arteria pulmonar varió entre 30–60mmHg (48,5±8,9mmHg), el gradiente transpulmonar entre 9–32mmHg (11,6±7,9mmHg) y la resistencia vascular pulmonar entre 1,7-5,4 U Wood (3,6±2,8 U Wood).
La prueba cruzada de linfocitos fue analizada prospectivamente solamente en los pacientes que presentaban reactividad del panel de linfocitos superior a 10%. Más recientemente se usa la citometría de flujo con el uso de antígenos humanos leucocitarios (HLA) purificados que permite la detección y caracterización de los anticuerpos presentes en el suero de receptor, esta técnica también denominada crossmatch virtual. Apenas un paciente (0,9%) recibió accidentalmente incompatible para el sistema ABO.
Los pacientes operados en carácter de prioridad obedecieron las siguientes distribuciones: 34 (30,6%) por shock carcinogénico, donde 55,5% estaban en uso continuo de fármacos vasoactivos por vía endovenosa, 14 (12,6%) en uso de balón intraaórtico, y 3 (2,7%) estaban en asistencia circulatoria con ventrículo artificial. Finalizando, 3 (2,7%) pacientes estaban en clase funcional II-III, y la indicación principal del trasplante fue la presencia de arritmia maligna refractaria al tratamiento clínico.
Treinta y cuatro (30,6%) pacientes habían recibido estimulación cardíaca artificial previamente al trasplante, de los cuales 21 (61,7%) eran portadores de marcapasos, 8 (23,5%) de desfibrilador automático implantable, 3 (8,8%) pacientes recibieron un marcapasos y desfibriladores, secuencialmente, y 1 (2,9%) había recibido implante de células tronco y terapia de resincronización.
En el inicio de la serie se usó de preferencia la técnica clásica con anastomosis biatrial7, posteriormente el trasplante pasó a ser realizado por la técnica bicaval con anastomosis uniatrial izquierda. La anuloplastia de la válvula tricúspide fue introducida en el grupo a partir del año 2002, y fue realizada en 32 (28,8%) pacientes de esta serie8. La edad de los donadores varió entre 13–55 años (27,1±11,8 años), y todos con un peso corporal no inferior al 20% del receptor.
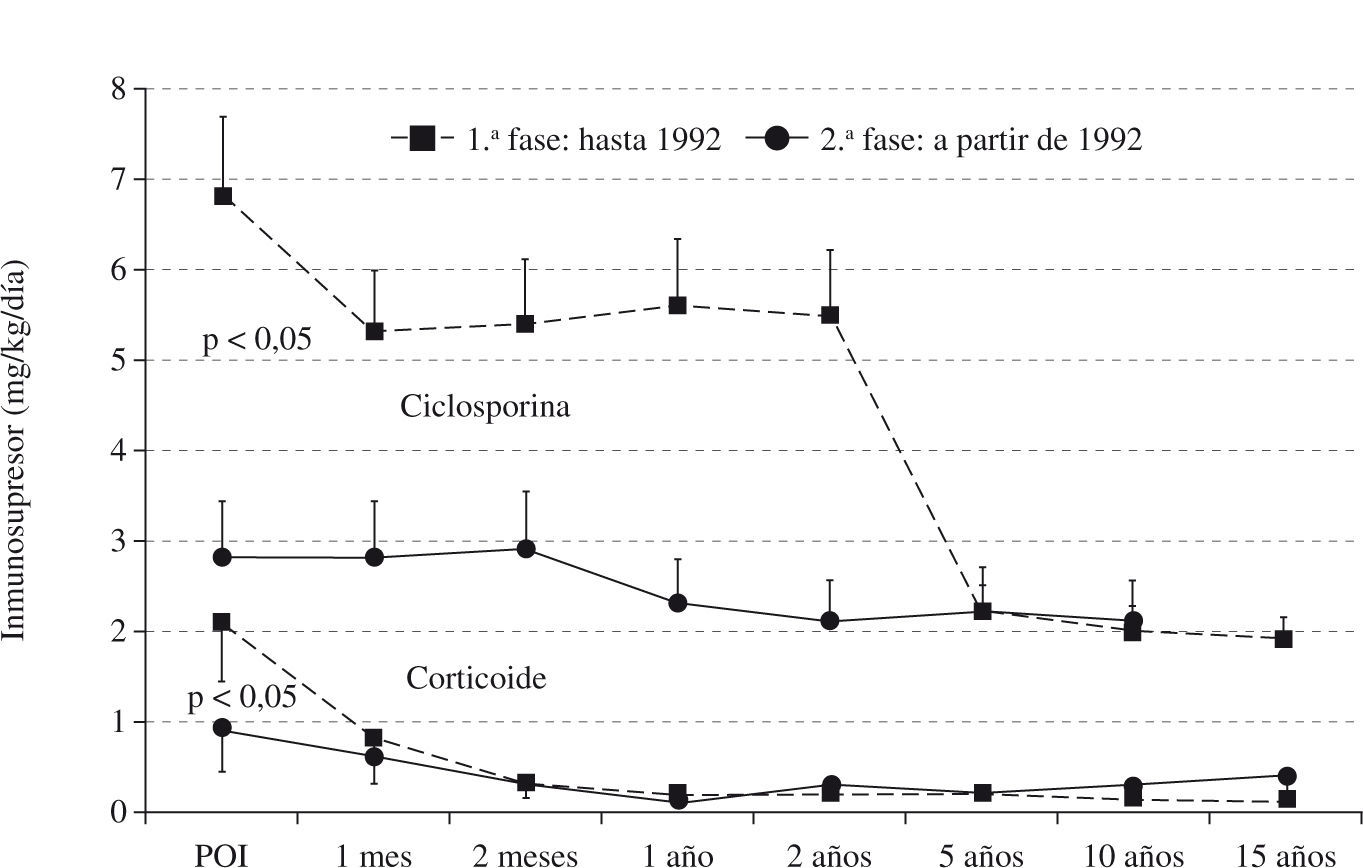
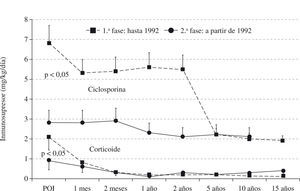
En un principio (hasta 1992 [1.a fase]), la inmunosupresión fue siempre apoyada en terapia triple compuesta por inhibidor de la calcineurina, antiproliferativos y corticoide. Los 10 (9,0%) primeros pacientes recibieron 1g endovenoso de metilprednisolona hasta la introducción de la dieta oral y, posteriormente, 1mg/kg/día, con reducción gradual hasta 0,2mg/kg/día. La azatioprina fue administrada inicialmente entre 1,5-3,5mg/kg/día y ajustada en función del recuento de leucocitos o de la incidencia de rechazo, excepto en 1 (0,9%) paciente que no recibió azatioprina. La ciclosporina fue administrada, por vía endovenosa durante la cirugía, en una dosis de 1–2mg/kg/día hasta la realimentación, procurándose mantener valores en sangre entre 700-1.200ng/ml y reducción para 500 y 700ng/ml, después del primer trimestre.
Posteriormente, a partir de 1992 (2.a fase), las dosis iniciales de corticoides fueron reducidas de forma más acentuada y precoz en función de la evolución del paciente. La dosis de azatioprina fue elevada a 3mg/kg/día y hubo una reducción de la ciclosporina, manteniendo los valores en sangre con hemólisis entre 200–300ng/ml en la fase inmediata al trasplante y para valores entre 100–150ng/ml, en la fase tardía.
A partir de 2001, un grupo de 15 (13,5%) pacientes recibió 2g de micofenolato mofetil (MMF) en sustitución de la azatioprina.
Apenas 2 (1,8%) pacientes recibieron tacrolimus por intolerancia a la ciclosporina. La globulina antitimocitaria fue administrada por vía endovenosa en 13 (11,7%) pacientes en la dosis de 10–15mg/kg/día durante 5-10 días; el control de rechazo fue realizado inicialmente por biopsia endomiocárdica y posteriormente con el auxilio de gammagrafía del corazón con galio, conforme al protocolo previamente publicado9. La pulsoterapia con corticoide fue considerada en los rechazos de grado superior a II por la clasificación de la International Society for Heart Lung Transplantation10.
El diagnóstico de la reactivación de la enfermedad fue realizado por la identificación del parásito en el miocardio, en nódulos cutáneos, en la sangre o por tests serológicos. El xenodiagnóstico y el cultivo de sangre no fueron considerados para el diagnóstico de reactivación de la enfermedad, por la posibilidad de falso positivo. Los episodios de parasitemia o reactivación de la enfermedad de Chagas fueron tratados con benzonidazol en la dosis de 10mg/kg/día durante 60 días. Apenas 4 (3,6%) recibieron empíricamente benzonidazol en la dosis de 10mg/kg/día como profilaxis en la reactivación de la enfermedad en el preoperatorio del trasplante en el inicio de la experiencia, sin que se observase cualquier beneficio.
Análisis estadísticoEl método de Kaplan-Meier fue utilizado en la construcción de las curvas de sobrevida y curvas libres, en la presencia de eventos para rechazo, neoplasias y reactivación de la enfermedad de Chagas. En el análisis comparativo de los inmunosupresores se utilizó el test t-Student, y los valores medios de las variables fueron expresados con los respectivos desvíos patrón y nivel de significancia, considerado de 5%.
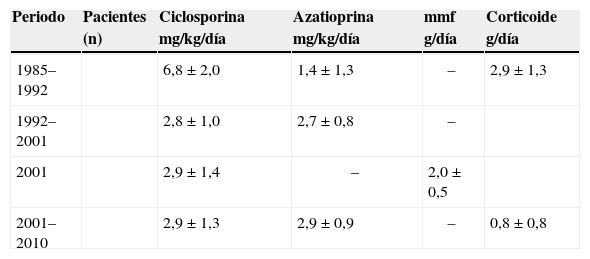
ResultadosLa distribución de los inmunosupresores utilizados en el postoperatorio inmediato del trasplante se encuentra descrita en la tabla I. Se puede observar que con el correr del tiempo hubo una reducción significativa de ciclosporina y del corticoide. A partir de 1992 se intensificó la reducción del corticoide en la fase tardía del trasplante, que en algunos pacientes fue totalmente suspendido. Por otro lado, hubo un aumento significativo de la azatioprina. La figura 1 muestra la evolución secuencial de las concentraciones de ciclosporina y corticoides utilizadas en las diferentes fases del trasplante cardíaco en la enfermedad de Chagas.
Distribución de las dosis iniciales de los inmunosupresores empleados en el trasplante cardíaco con enfermedad de chagas en las diferentes épocas
| Periodo | Pacientes (n) | Ciclosporina mg/kg/día | Azatioprina mg/kg/día | mmf g/día | Corticoide g/día |
| 1985–1992 | 6,8±2,0 | 1,4±1,3 | – | 2,9±1,3 | |
| 1992–2001 | 2,8±1,0 | 2,7±0,8 | – | ||
| 2001 | 2,9±1,4 | – | 2,0±0,5 | ||
| 2001–2010 | 2,9±1,3 | 2,9±0,9 | – | 0,8±0,8 |
MMF: micofenolato mofetil.
La mortalidad inmediata fue de 17,7% (19 casos), y las causas de las muertes fueron: infección en 6 (31,5%); disfunción del injerto en 6 (31,5%), rechazo en 4 (21,1%), paro cardiorrespiratorio súbito en 2 (10,5%) casos, por incompatibilidad ABO en 1 (5,3%) caso. De los tres pacientes que estaban en uso de asistencia circulatoria mecánica, dos de ellos están vivos y bien, y uno murió en postoperatorio inmediato como consecuencia de hemorragia.
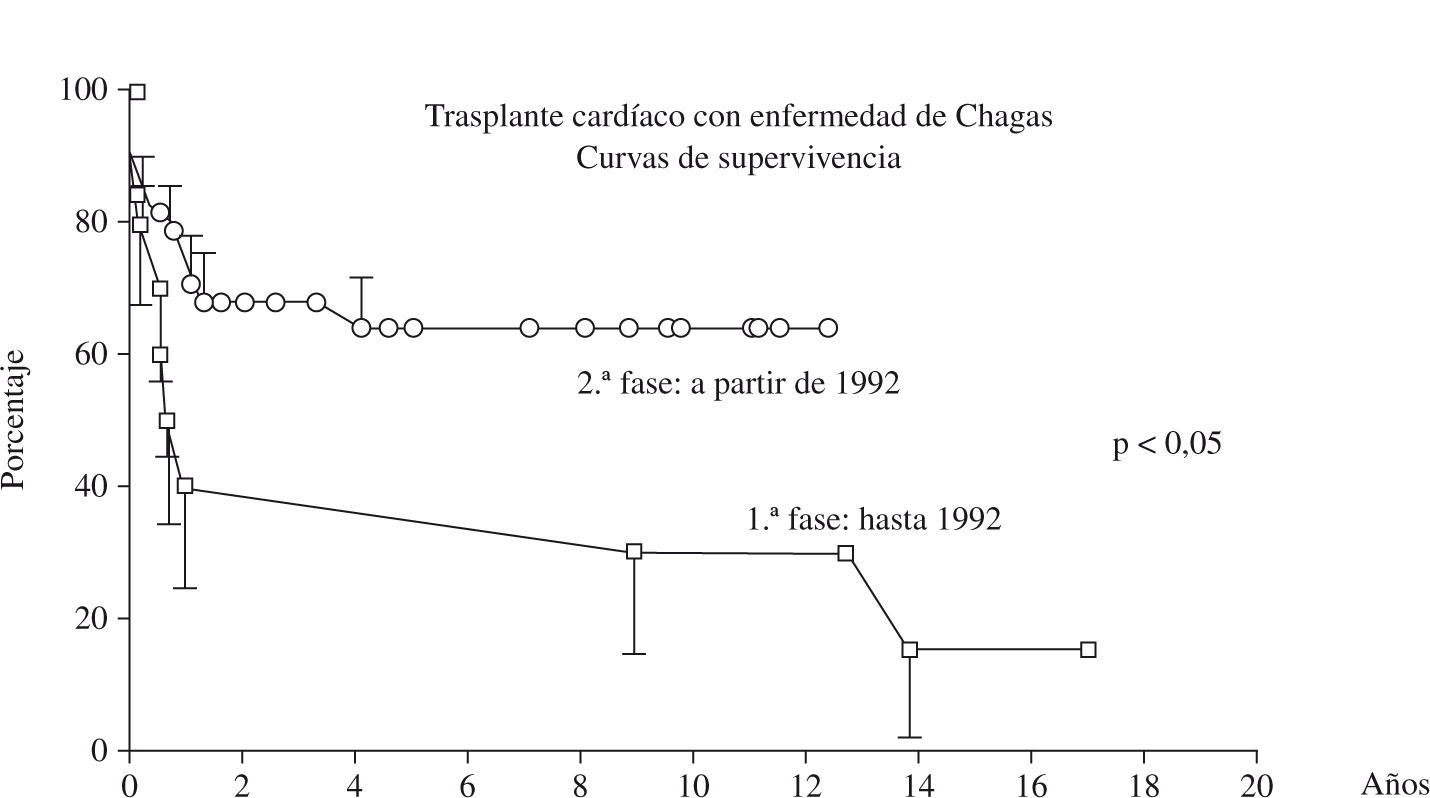
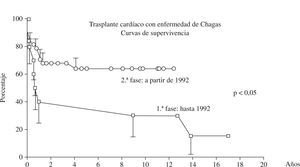
En la fase tardía, 27 (24,3%) pacientes murieron durante el periodo del estudio, y las principales causas de muerte fueron: rechazo en 6 (22,1%) casos, infección en 6 (22,2%), linfoma en 4 (14,8%), Kaposi en 2 (7,4%), pericarditis constrictiva en 2 (7,4%), y reactivación de la enfermedad de Chagas en el sistema nervioso central en 1 (3,7%) caso. El análisis de los pacientes por etapas antes y después de 1992, cuando hubo una mudanza drástica en la inmunosupresión, se nota que en la segunda etapa hubo una mejora significativa en la sobrevida (Fig. 2).
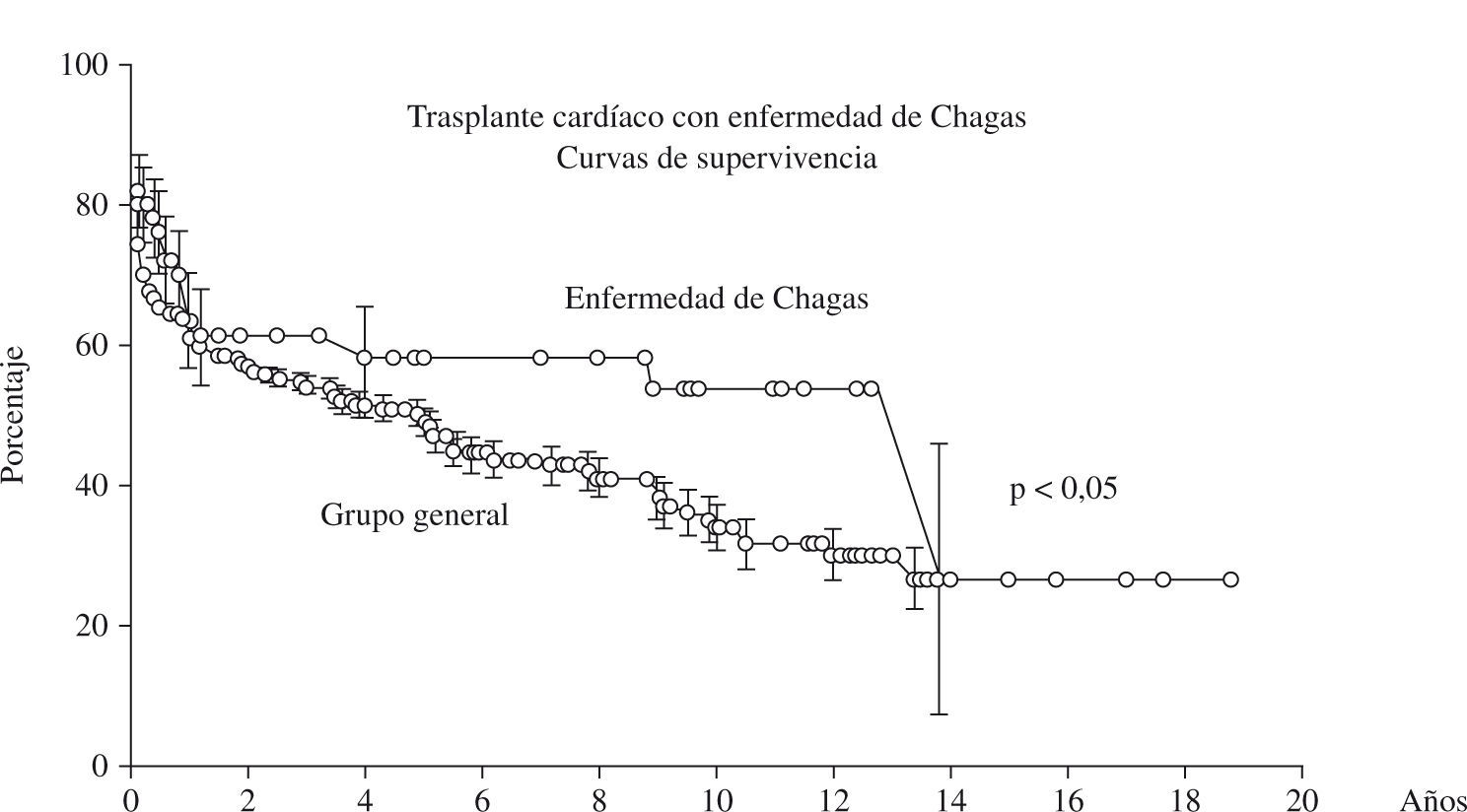
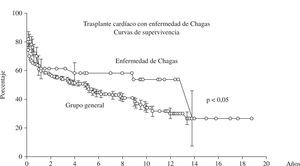
En la figura 3 está representado un análisis comparativo de las curvas de sobrevida de los pacientes sometidos a trasplante cardíaco con enfermedad de Chagas en relación con el grupo general, y se nota la tendencia no significativa de la mejora de los resultados.
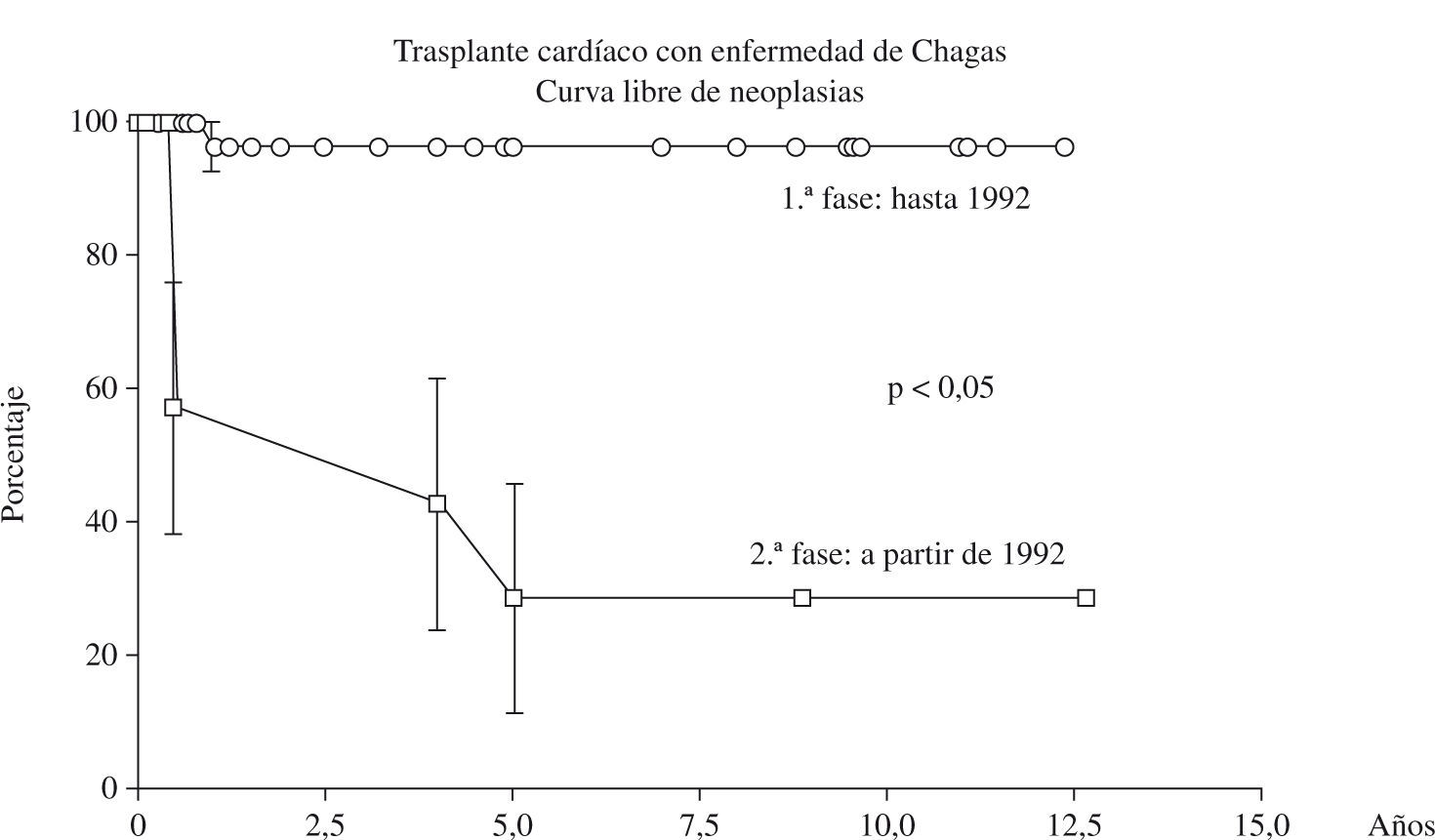
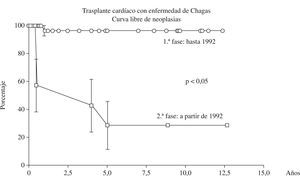
La enfermedad linfoproliferativa y el Kaposi fueron las neoplasias más frecuentes después en el trasplante con enfermedad de Chagas (Fig. 4), y ambos se comportaron de forma extremamente agresiva, con muerte precoz de todos los pacientes afectados. El linfoma ocurrió en 4 (14,8%) pacientes, el Kaposi en 2 (7,4%), y el carcinoma espinocelular en 1 (7,1%). El tiempo medio de aparición de estas neoplasias fue de apenas 6,5±2,1 meses después del trasplante.
La reactivación de la enfermedad ocurrió en 22 (19,8%) pacientes de esta serie durante el periodo de estudio, totalizando 32 episodios, con variación entre 1–8 episodios/ paciente, en la primera fase. En la primera fase del estudio la media de reactivación fue de 2,3 episodios/paciente, siendo reducida en la segunda fase (0,28 eventos/ paciente). El diagnóstico de reactivación de la enfermedad de Chagas fue determinada por biopsia endomiocárdica en 23 (71,8%) episodios, por el xenodiagnóstico en 11 (34,3%), por biopsia de nódulos subcutáneos en 8 (25,0%), y por biopsia del sistema nervioso central en 1 (3,1%) paciente.
La evolución del laboratorio seriada de las reacciones de fijación del complemento, del antígeno proteico y de la IgG se mostraron totalmente ineficaces en el diagnóstico de la reactivación de la enfermedad, pues sus valores no guardaban relación con los episodios de dicha reactivación, no siendo posible identificar un factor predictivo de diagnóstico precoz del evento.
El examen anatomopatológico de los corazones nativos extraídos evidenció miocarditis en 103 (92,7%) de los casos, presencia de afinamiento de la punta del ventrículo en 70 (63,0%), trombos intracavitarios en 36 (32,4%), y detección de formas amastigotes del parásito Trypanosoma cruzi en 21 (18,9%) casos.
DiscusiónEl agente etiológico de la enfermedad de Chagas es un protozoo parásito hemoflagelado denominado Trypanosoma cruzi, y el insecto vector pertenece a la subfamilia Triatominae1. En Brasil fueron aplicados esfuerzos notables para eliminar la transmisión de la enfermedad por el Triatoma infestans. Además, en función de diferencia regional existen otros importantes vectores que dificultan el control de la enfermedad.
Las discusiones que antecedieron al trasplante fueron intensas y controvertidas debido a que la enfermedad de Chagas es una enfermedad infecciosa con compromiso sistémico, donde es posible eliminar totalmente el agente etiológico. Estas discusiones persistieron durante años antes que Zerbini, en 1985, realizara pioneramente el trasplante en un paciente con cardiomiopatía chagásica, y el éxito obtenido motivó la expansión de la indicación11.
La enfermedad de Chagas es multifactorial, destacándose la acción directa y persistente del parásito sobre el cardiomiocito; factores inmunológicos; reacción inflamatoria con liberación de citocinas; anormalidades microvasculares y alteraciones en las uniones de los cardiomiocitos, que son responsables de los disturbios eléctricos frecuentemente encontrados en los pacientes. Esta enfermedad es la tercera causa de indicación de trasplante en diferentes instituciones en nuestro país, con tasas entre 15–20%, siendo precedida por la cardiomiopatía idiopática y la isquémica, respectivamente11–16. Se debe resaltar que la enfermedad de Chagas es factor de riesgo para el paciente que está en lista de espera17,18.
El manejo del paciente con enfermedad de Chagas todavía ofrece grandes desafíos a los investigadores, especialmente por la posibilidad del reaparición de manifestaciones de la parasitemia, que ocurre en su fase aguda. Además de los trasplantes de órganos, la reactivación de la infección crónica por el Trypanosoma cruzi ha sido descrita también en el SIDA, en los tratamientos con corticoides y quimioterápicos12,13,19–21. La inmunosupresión necesaria para los trasplantes de órganos predispone a la reactivación de la enfermedad. El benzonidazol ha sido el fármaco de elección para erradicar temporalmente el Tripanosoma cruzi durante las reactivaciones de la enfermedad; sin embargo, como no es posible la esterilización completa del agente, el paciente permanece siempre vulnerable a nuevos episodios. Estas observaciones sustentan la posición de la ineficacia del uso profiláctico de benzonidazol, tanto en el pre como en el postrasplante inmediato, apoyadas en la experiencia clínica acumulada hasta hoy. De esta forma, la cardiomiopatía chagásica continúa siendo una enfermedad crónica sin posibilidades de cura hasta el momento.
Almeida, et al., en 1996, presentaron la experiencia favorable con el uso de alopurinol para controlar la parasitemia sanguínea en sustitución de benzonidazol13. El nifurtimox es otro agente tripanomicida semejante al benzonidazol, pero no está dotado de eficacia deseada22,23. En estudios in vitro se demostró que la ciclosporina tiene efectos antiparasitarios que no se confirmaron en relación con el Tripanosoma cruzi24,25. Al contrario, la administración de ciclosporina en animales infectados produjo un aumento de la parasitemia y muerte. Sólo las formas epimastigotes presentan inhibición del crecimiento por adición de ciclosporina y no las amastigotes, que están presentes en el suero de pacientes contaminados, mostrando que el parásito puede presentar diferentes caminos de sensibilidad al inmunosupresor.
En el trasplante cardíaco los episodios de rechazo agudo que exigen tratamiento con pulsoterapia de corticoides son considerados factores de riesgo para el crecimiento del Tripanosoma cruzi en cualquier parte del cuerpo, y, consecuentemente, las manifestaciones clínicas de reactivación de la enfermedad. En la práctica clínica el diagnóstico más efectivo de reactivación de la enfermedad es por la identificación de parásitos en el miocardio, sangre u otros tejidos, y los demás exámenes de laboratorio se muestran inespecíficos. En los casos confirmados de reactivación de la enfermedad se debe iniciar precozmente el tratamiento con benzonidazol, que es capaz de eliminar el parásito circulante en torno de 2 semanas y no permitir que la miocarditis determine secuelas en el corazón. Los efectos colaterales de benzonidazol son probablemente atenuados por la inmunosupresión, aumentado así la tolerancia al uso de este fármaco.
En los primeros meses la exigencia de la inmunosupresión es mayor por la mayor incidencia de rechazo agudo, y, por lo tanto, predispone a la reactivación de la enfermedad de Chagas, que disminuye en los meses subsecuentes. La reducción precoz de la inmunosupresión y, principalmente, la supresión del corticoide son actitudes bien aceptadas actualmente por diferentes servicios con el fin de reducir la incidencia de reactivación de la enfermedad y el aparecimiento de neoplasias26–28, así como se puede observar en la evolución de los pacientes de la presente serie.
En la presente serie los pacientes que presentaron reactivación de la enfermedad tuvieron manifestaciones clínicas poco específicas, tales como malestar, fiebre y arritmias. En la fase inicial de la reactivación la miocarditis es silenciosa; posteriormente, el paciente puede exhibir disfunción ventricular o arritmias más graves, y el diagnóstico es confirmado generalmente por la presencia del Tripanosoma cruzi en la biopsia endomiocárdica de rutina. La aparición de tumoraciones por el cuerpo indica obligatoriamente la realización de biopsia, ya que puede representar una reacción inflamatoria con la presencia del parásito en su interior.
Estudios multicéntricos de trasplante en portadores de cardiomiopatías chagásicas muestran paradójicamente mejores resultados de sobrevida en relación con las demás cardiopatías15. Se cree que la baja reactividad vascular pulmonar propia de ese grupo de pacientes y la mayor atención prestada a ellos en función de la posibilidad de reactivación de la enfermedad puedan desempeñar un papel importante en la mayor vigilancia sobre esa población. Después del trasplante la mejora en la calidad de vida puede ser igualmente observada en diferentes centros que practican el trasplante en la enfermedad de Chagas14–18.
La aparición de neoplasias en esta serie no guardó relación estrecha con la infección por citomegalovirus, posiblemente, porque los pacientes estudiados presentan previamente alta incidencia de IgG positivo para el virus, al contrario de lo que se observa en la población de otros continentes. La mayor incidencia de neoplasias del tipo de los linfomas observadas en esta población de pacientes tal vez pueda encontrar explicaciones apoyadas en estudios experimentales y clínicos19,20. El benzonidazol es capaz de alterar la respuesta inmunológica, probablemente, por su efecto citotóxico sobre los linfocitos T, actuando de forma sinérgica con la ciclosporina y la propia enfermedad de Chagas, que también tiene un comportamiento inmunodepresivo.
Con la introducción del MMF en sustitución de la azatioprina por sus ventajas ya conocidas, se observó en la presente serie nuevamente aumento de la reactivación de la enfermedad. Estas observaciones fueron confirmadas por otros grupos que pasaron a utilizar la mitad de la dosis preconizada del fármaco para los trasplantes cardíacos en general19. De cualquier forma, estas constataciones motivaron a nuestro grupo a retomar el protocolo con azatioprina para los pacientes con enfermedad de Chagas.
La enfermedad de Chagas presenta características arritmogénicas propias que hacen que este grupo de pacientes tenga mayor propensión al uso de estimulación cardíaca artificial con marcapasos o desfibriladores implantables antes del trasplante. Además, después del trasplante, la necesidad de terapia electrica no difirió de los demás receptores. No se observó tampoco diferencias significativas en el desarrollo de la enfermedad vascular del injerto en estos pacientes, como ya fue discutido en publicaciones previas.
Limitaciones del estudioSe trata de un estudio observacional de una serie de casos que presenta la experiencia clínica de una única institución, donde los datos fueron recogidos prospectivamente y analizados retrospectivamente. Además, la eficacia del método puede ser fácilmente comprobada con los pacientes portadores de cardiomiopatía chagásica y que consiguen llegar al trasplante porque tienen una sobrevida inferior a los demás que están en lista de espera15,16,26,29.
ConclusionesEl trasplante cardíaco es la única forma existente en el momento capaz de modificar la evolución natural de la enfermedad de Chagas en su fase terminal. La reactivación de la enfermedad es un problema real que revierte fácilmente con la introducción de tratamiento farmacológico específico, restaurando los patrones histológicos del miocardio sin dejar secuelas. La inmunosupresión, en especial el corticoide, predispone a la aparición de neoplasias y reactivación de la enfermedad, exigiendo, por lo tanto, atención especial en cuanto a su no utilización o a su reducción precoz.