La alcaptonuria es una enfermedad rara autosómica recesiva del metabolismo de la tirosina que provoca el acúmulo de ácido homogentísico en determinados tejidos del cuerpo humano, como el tejido cartilaginoso, causando calcificación, degeneración y fibrosis. Las manifestaciones cardiovasculares son poco frecuentes, habiendo pocos casos descritos en la literatura en los que se produce afectación valvular cardíaca. Presentamos el caso de una mujer de 76 años con historia de alcaptonuria que fue diagnosticada de doble lesión aórtica severa e insuficiencia mitral moderada, requiriendo intervención quirúrgica para recambio valvular aórtico y mitral. Revisamos la etiología, la patogénesis, las manifestaciones clínicas, el diagnóstico y el tratamiento de esta patología.
Alkaptonuria is a rare autosomal recessive disease that affects the tyrosine metabolism causing an accumulation of homogentisic acid in certain tissues of the human body as the cartilaginous tissue, causing degeneration, calcification and fibrosis. Cardiovascular manifestations are rare, having few cases in the literature in which cardiac valvular involvement occurs. We present the case of a 76 year-old woman with history of alkaptonuria who was diagnosed with double aortic severe injury and moderate mitral insufficiency requiring surgery for aortic and mitral valve replacement. We reviewed the etiology, pathogenesis, clinical manifestations, diagnosis and treatment of this pathology.
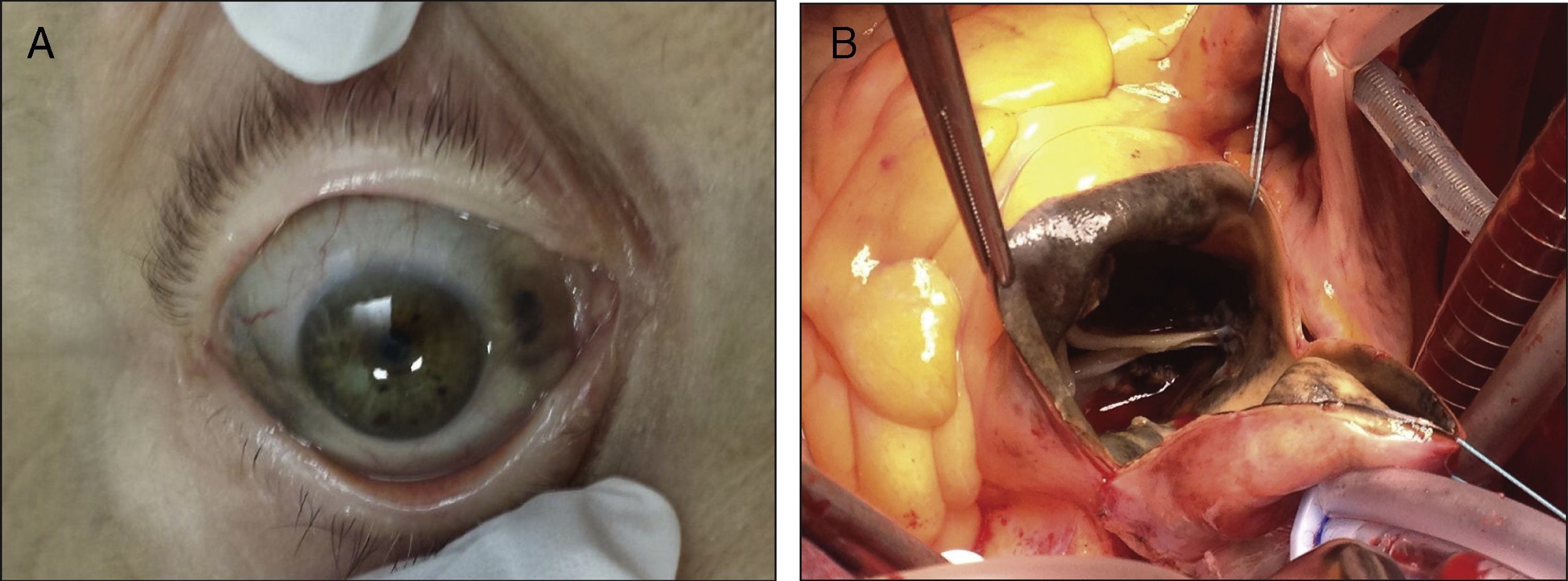
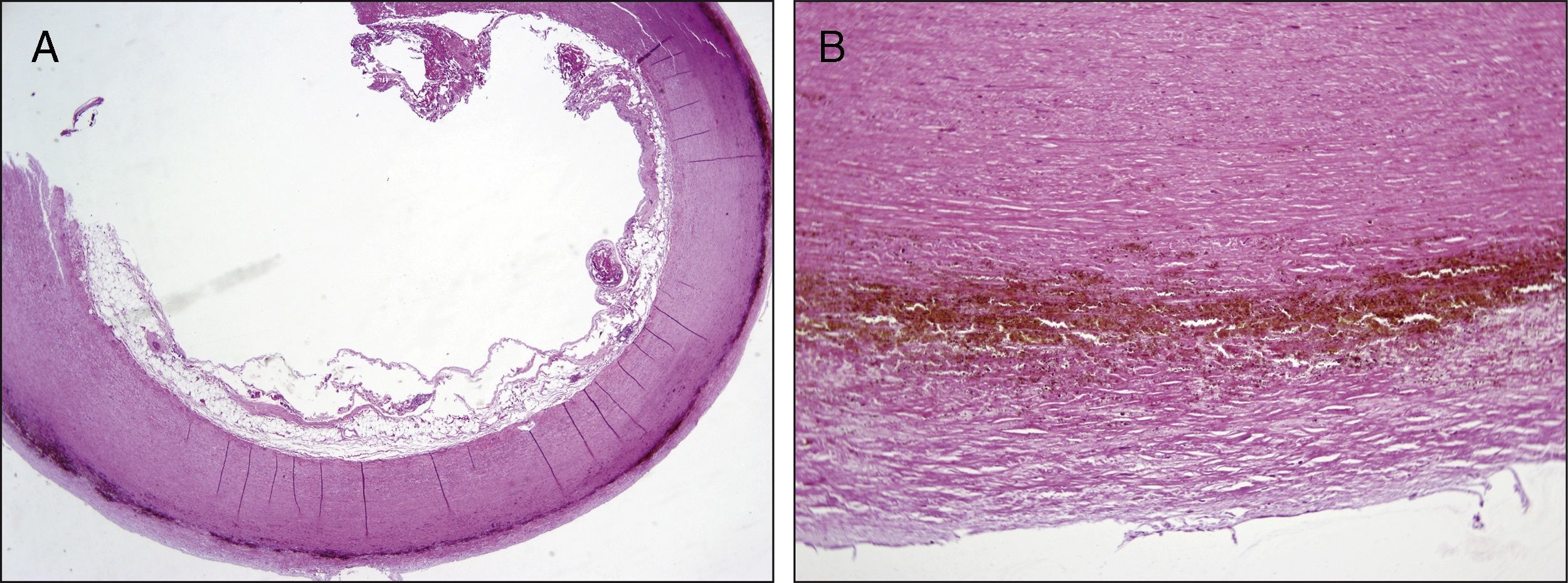
Presentamos el caso de una mujer de 76 años diagnosticada de alcaptonuria en el año 2006 sobre la base de la clínica que mostraba, con historia de osteoartrosis degenerativa progresiva con afectación articular múltiple que requirió por ello cirugía de prótesis de cadera bilateral y de rodilla izquierda. En la exploración física se evidenciaba pigmentación ocronótica a nivel de la esclera del ojo derecho (fig. 1 A). La bioquímica era anodina, así como las pruebas de función tiroidea, vitamina D y calcio. Los niveles de ácido homogentísico (HGA) en orina de 24 h eran prácticamente normales de 15mg/24h (normal<10mg/24h). No tenía antecedentes familiares de alcaptonuria. La paciente presentaba una cardiopatía valvular degenerativa consistente en una doble lesión aórtica severa (gradiente máximo 83mmHg y medio 53mmHg) e insuficiencia mitral moderada, con función ventricular conservada y dilatación de aorta ascendente (diámetro de 44mm). La coronariografía no objetivó patología coronaria. Ingresó de forma programada para intervención quirúrgica. Se llevó a cabo sustitución valvular por prótesis aórtica biológica Trifecta St. Jude Medical número 21 (St. Paul, Minnesota, EE. UU.), implante de tubo Hemashield número 30 en aorta ascendente y sustitución valvular mitral por prótesis biológica Carpentier-Edwards Perimount número 25 (Edwards Lifesciences Inc, Irvine, California, Estados Unidos). Como hallazgos intraoperatorios significativos, se observó una válvula aórtica trivalva severamente fibrocalcificada, con un tinte negruzco muy marcado e importante ateromatosis de la aorta ascendente (fig. 1 B). Tuvo como complicación significativa en el postoperatorio inmediato un episodio de inestabilidad hemodinámica y fibrilación auricular, con respuesta ventricular rápida secundaria a taponamiento cardíaco que precisó reintervención quirúrgica emergente para evacuación del derrame pericárdico. Posteriormente, continuó los cuidados de postoperatorio habituales, siendo finalmente alta a su domicilio. Para el estudio anatomopatológico se recibieron 3 muestras, correspondientes a fragmentos de arteria aorta, de válvula mitral y de válvula aórtica. Macroscópicamente, la válvula mitral presentaba un aspecto blanquecino habitual, mientras que en el espesor de los fragmentos de la pared arterial y de la válvula aórtica se identificaban áreas de coloración negruzca y focos de induración compatibles con áreas calcificadas. El estudio microscópico reveló, en ambas muestras, acúmulos extracelulares granulares finos dispersos y entremezclados con focos de fibrosis y calcificación. Estos acúmulos, por sus características y su localización, fueron compatibles con depósitos de HGA (fig. 2 A y B).
La alcaptonuria es una enfermedad rara autosómica recesiva del metabolismo de la tirosina, que provoca la ausencia del enzima homogentísico-1,2-dioxigenasa (HGD). Esta enzima fue identificada por primera vez en 1891 por Wolkow y Baumann1, siendo producida mayoritariamente en los hepatocitos y en el riñón. Es responsable del metabolismo del HGA, siendo este un intermediario en la vía de degradación de la tirosina2. El gen responsable se encuentra en el cromosoma 3q21-q23 y se han identificado más de 80 mutaciones diferentes, lo cual explica la gran variabilidad clínica. La prevalencia mundial de alcaptonuria es de 1 caso por cada 250.000-1.000.000 de nacimientos, siendo la mayor incidencia en Eslovaquia, en la República Checa y en la República Dominicana2. La distribución de esta enfermedad es igual en hombres que en mujeres y las manifestaciones clínicas aparecen habitualmente en la quinta década de la vida, siendo esencialmente asintomática durante la infancia3.
El déficit de actividad de HGD provoca aumento de los niveles plasmáticos de HGA que, con el paso del tiempo, se deposita en el tejido conectivo provocando alteración en las células del músculo liso, los macrófagos y los fibroblastos a nivel cutáneo, articular, renal, glandular, etc., causando una pigmentación patológica denominada ocronosis. Esto da lugar a las 3 características clínicas que incluyen la aciduria homogentísica, que produce el característico oscurecimiento de la orina en reposo, la ocronosis y la osteopatía, esta última resultando del depósito del polímero de HGA en el cartílago articular hialino, desarrollando cristales de calcio, de tal manera que la articulación se vuelve frágil, propensa a fracturarse y a degenerarse. El pigmento puede apreciarse a nivel de los pabellones auriculares, las regiones malares y las escleróticas.
Las manifestaciones cardíacas son menos frecuentes, siendo la válvula aórtica la más afectada, probablemente debido al elevado estrés mecánico en comparación con las otras válvulas. Gaines y Pai4 indicaron que la disfunción valvular aórtica está causada por la degeneración de los fibrocitos ocronóticos que llevan a una calcificación progresiva y fibrosis de la misma. El pigmento se observa sobre todo en la base de la valva, extendiéndose hacia el anillo (fig. 1 B). También se ha indicado que el depósito de dicho pigmento en el endotelio vascular conduce a la génesis de placas de ateroma responsables de la patología arterial coronaria, así como en las células del músculo liso de la capa media aórtica, las cicatrices de infartos antiguos y los músculos papilares5. Esto explica que no exista relación entre esta patología y los factores de riesgo cardiovascular convencionales6.
Con respecto al caso que nos concierne, la durabilidad de las prótesis biológicas en este tipo de pacientes es todavía desconocida y son necesarios estudios prospectivos a largo plazo para determinar la mejor opción de recambio valvular.
Actualmente, no existe ninguna terapia efectiva para el manejo de esta patología. Se recomienda una dieta baja en proteínas (principalmente, fenilalanina y tirosina) ya que aproximadamente un 6% de las proteínas de la dieta se degradan a través de la vía del HGA. Entre las alternativas terapéuticas se ha utilizado la nitisinona, puesto que reduce la excreción urinaria de HGA; sin embargo, el perfil de seguridad y la eficacia de su uso como terapia crónica son desconocidos1. El ácido ascórbico reduce la oxidación de HGA pero contribuye a la formación de cálculos de oxalato a nivel renal. Un estudio adicional reveló que la vitamina C es un cofactor del 4-hidroxifenilpiruvato-dioxigenasa, el cual provoca aumento de la producción de HGA.
En definitiva, la alcaptonuria es una patología rara, de manejo complicado, que requiere un abordaje multidisciplinar. En aquellos pacientes con sospecha, el diagnóstico precoz es fundamental y la evaluación de las posibles consecuencias que pueden aparecer a largo plazo implica la realización de diferentes pruebas diagnósticas con métodos no invasivos y de bajo coste, como la detección del HGA en orina, así como pruebas de imagen en las articulaciones más propensas y ecocardiograma transtorácico que descarte patología cardiovascular secundaria.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.