El pseudotumor inflamatorio es una entidad poco frecuente, considerada como benigna, caracterizada por la proliferación mesenquimal de células inflamatorias.
Caso clínicoPresentamos el caso clínico de un varón de 70 años con síndrome febril de origen desconocido, diagnosticado de abscesos hepáticos, que tras tratamiento antibiótico no mejoró. Se decidió realizar intervención quirúrgica ante la sospecha de cáncer de vesícula por imágenes de tomografía computada abdominal, reseñando la anatomía patológica intraoperatoria la existencia de un pseudotumor inflamatorio.
ConclusiónEl pseudotumor inflamatorio está clínicamente clasificado en varios tipos según su etiología, variando las opciones de tratamiento en función de la misma. Es muy difícil su diagnóstico debido a la ausencia de síntomas o alteraciones hematológicas o radiológicas específicos. El diagnóstico definitivo requiere a menudo una confirmación histopatológica, en la mayoría de los casos mediante punción percutánea hepática, pero a veces es necesaria una laparotomía exploradora o incluso la realización de una hepatectomía para su confirmación. La historia natural del pseudotumor inflamatorio es su remisión, por lo que se puede llevar a cabo una actitud conservadora mediante controles periódicos hasta su resolución o se puede tratar con antibióticos, antiinflamatorios e incluso corticoides. La resección quirúrgica queda para la persistencia de síntomas sistémicos no resueltos a pesar del tratamiento médico, en aquellas situaciones en las que se evidencia crecimiento, con o sin síntomas, cuando está implicado el hilio hepático y, por último, en caso de no poder descartar la posibilidad de malignidad.
Inflammatory pseudotumour is a rare entity, considered benign, and characterised by inflammatory cell mesenchymal proliferation.
Clinical caseThe case is presented 70 year-old man with fever of unknown origin syndrome. He was diagnosed with liver abscesses (one segment IV, adjacent to gallbladder fundus and segment VI), who progressed slowly after antibiotic treatment. In the absence of a diagnosis, although fine needle puncture-aspiration and different imaging tests were performed, elective surgery was decided. The intra-operative histopathology reported the existence of an inflammatory pseudotumour.
ConclusionsInflammatory pseudotumours are clinically classified into different types according to their aetiology, varying therapeutic management based on the same. It is very difficult to diagnose because of the absence of symptoms, blood disorders, or specific radiological findings. Definitive diagnosis often requires histopathological confirmation, in most cases by percutaneous liver puncture, but sometimes exploratory laparotomy or even performing a hepatectomy for confirmation is necessary. The natural history of inflammatory pseudotumour is its regression; thus conservative management may be used through regular checks until resolution, or can be treated with antibiotics, anti-inflammatories and even corticosteroids. Surgical resection is indicated for persistent unresolved systemic symptoms despite medical treatment, in those situations where growth is evident, with or without symptoms, when involving the hepatic hilum, and finally, in case where the possibility of malignancy cannot be ruled out.
El pseudotumor inflamatorio es una entidad poco frecuente, considerada como benigna, caracterizada por la proliferación mesenquimal de células inflamatorias, principalmente de linfocitos, células plasmáticas y, ocasionalmente, histiocitos1. Fue descrita por primera vez en el hígado en 1953 por Pack y Baker2. Radiológicamente, en algunas ocasiones, esta entidad puede imitar a tumoraciones malignas, por lo que su diagnóstico diferencial es muy importante3. Puede asentar en cualquier parte del organismo, siendo el pulmón la más frecuente, habiéndose descrito casos en el sistema nervioso central, los ojos, el hígado o el bazo.
Presentamos el caso clínico de un varón de 70 años que muestra cuadro de febrícula y síndrome constitucional, en el que se hallan, en una tomografía computada de abdomen, 2 lesiones hepáticas indicativas de abscesos hepáticos.
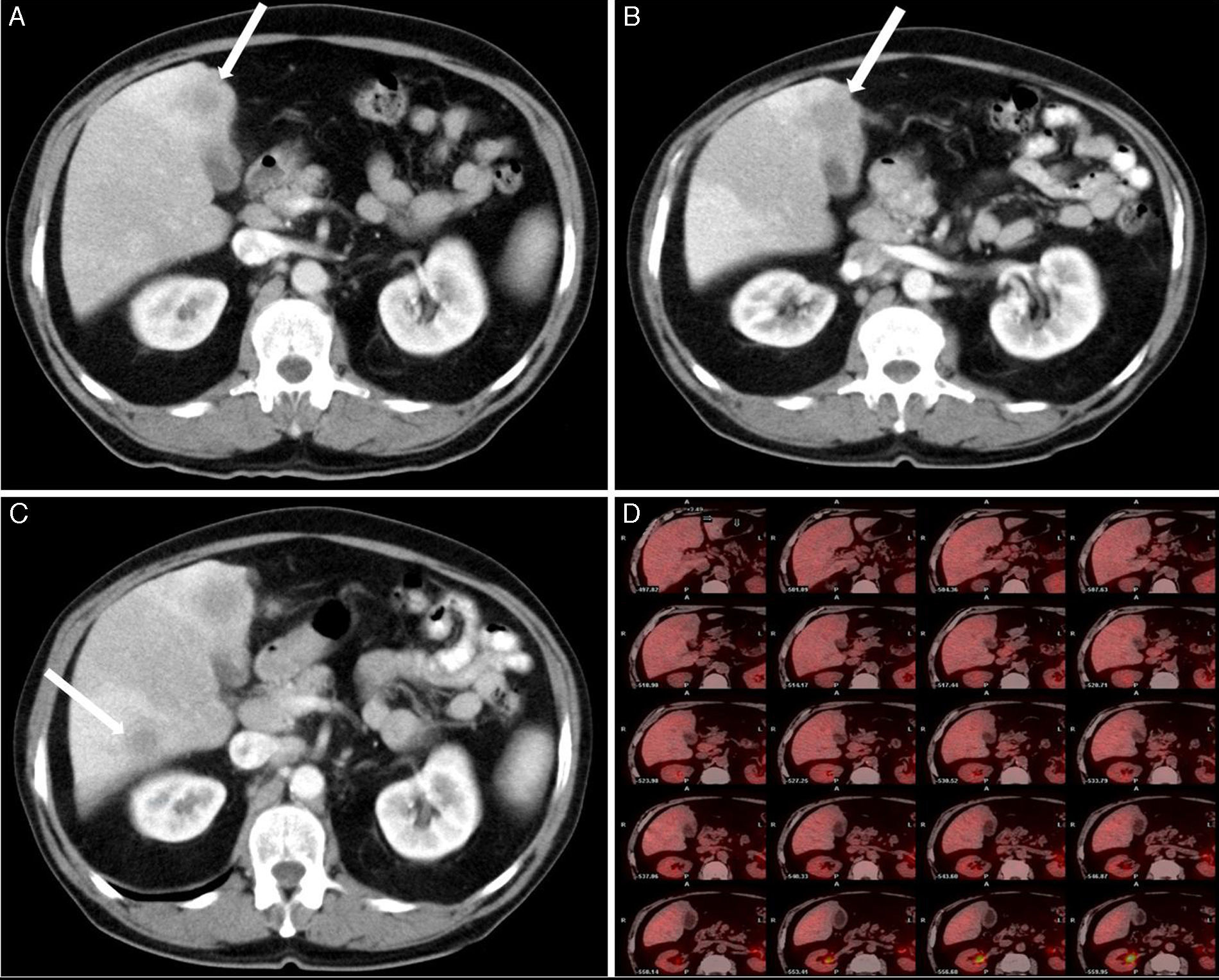
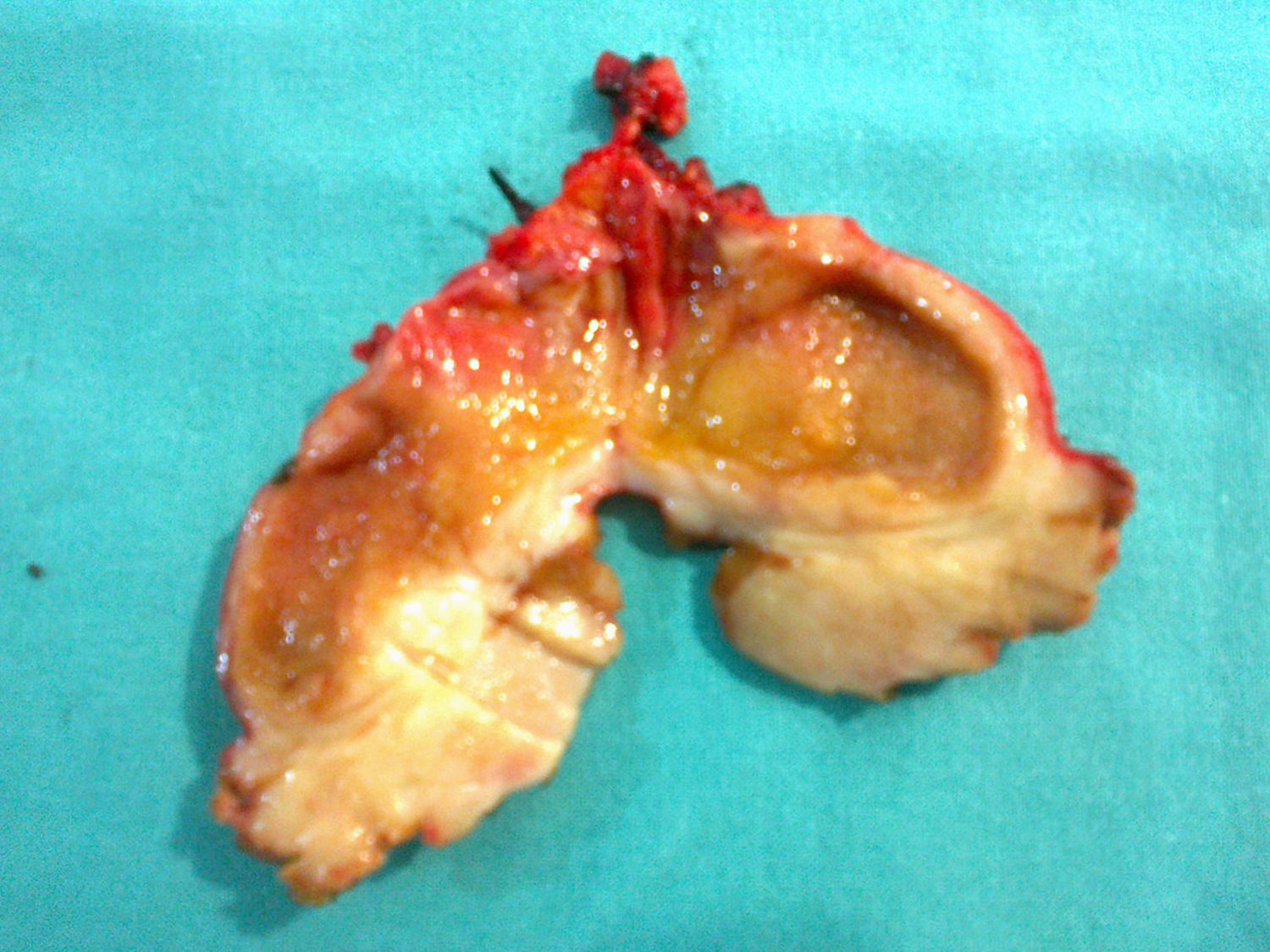
Caso clínicoSe trata de un varón de 70 años con antecedentes personales de alergia a penicilina, hipertensión, tuberculosis pulmonar, diabetes, artritis gotosa, litiasis renal y diverticulosis colónica. El paciente es ingresado para estudio en su hospital de referencia por cuadro clínico de al menos 3 semanas de evolución de febrícula, astenia, anorexia, pérdida de peso y oligoartritis (en rodillas e interfalángicas). El paciente presenta buen estado general, con exploración física dentro de la normalidad. Los exámenes de laboratorio destacan la presencia de gamma-glutamil-transpeptidasa 153UI/l (8-61), fosfatasa alcalina 142UI/l (40-129) y bilirrubina total 0.41UI/l (0.05-1.1), estando las enzimas de lisis hepática dentro de los rangos de normalidad. Se llevó a cabo un estudio para descartar enfermedad infecciosa (virus de la inmunodeficiencia humana, virus de las hepatitis B y C, citomegalovirus, Coxiella burnetii, lúes, fiebre Q, rosa de bengala e hidatidosis), que fue negativo, y de enfermedad inmunológica (anticuerpos antinucleares, anticuerpos extraíbles del núcleo, anticuerpos anti-ADN, anticuerpo anticélula endotelial), que resultó, del mismo modo, negativo. Todos los marcadores tumorales (alfa-fetoproteína, CEA, CA 19-9 y antígeno prostático) fueron negativos. La ecocardiografía no mostró signos de endocarditis. Se llevó a cabo una baciloscopia y un cultivo de esputo, obteniendo el mismo resultado, al igual que en el urocultivo y la colonoscopia. Se realiza una tomografía computada de cuello-tórax-abdomen, y como único hallazgo se comprueba un engrosamiento de las paredes de la vesícula biliar, con imagen de lesión hipodensa mal definida de unos 17mm de diámetro en segmento iv a nivel del lecho vesicular, pudiendo estar en relación con cambios inflamatorios, sin poder descartar absceso hepático (fig. 1A). En una ecografía de abdomen lo que se encuentra es el nódulo en segmento iv, sin engrosamiento de la pared vesicular. Ante estos resultados, el cuadro es tratado como absceso hepático y se instaura antibiótico con metronidazol, levofloxacino y aztreonam. Tras una leve mejoría, vuelven a aparecer los síntomas, realizándose de nuevo una tomografía computada toracoabdominal de control a los 4 meses del diagnóstico, y se observa un leve crecimiento de la lesión en segmento iv, 25mm, y la aparición de una nueva en segmento vi, 16mm, con persistencia de engrosamiento difuso e inespecífico de las paredes de la vesícula biliar (fig. 1B y C). En la resonancia magnética nuclear se observa una lesión focal hepática de aproximadamente 2cm localizada en el segmento iv, hipointensa en secuencias T2; adyacente a esta lesión se aprecian otros 2 nódulos de menor tamaño y similar aspecto (nódulos satélites). Tras la administración de contraste dichas lesiones presentan un discreto realce tardío; rodeando a estas lesiones existe una alteración en el parénquima hepático que muestra un aumento difuso en la intensidad de la señal en secuencias T2. En segmento vi, existe otro nódulo de 14mm y similares características, también rodeado por parénquima hepático de señal aumentada difusamente. En secuencias de difusión, los nódulos no muestran restricción (no se trata de abscesos y sí son indicativas de metástasis). La vesícula biliar no muestra litiasis y sí engrosamiento de la pared, principalmente en el fundus, adyacente a la lesión del segmento iv, a descartar neoformación. Ante tales hallazgos, se solicita punción-aspiración con aguja fina de dichas lesiones, obteniendo un resultado no concluyente. Se realiza una tomografía por emisión de positrones usando como trazador la 18-fluorodesoxiglucosa, sin que se demuestren focos hipermetabólicos a nivel hepático (fig. 1D) ni en otra localización que indicaran malignidad. El paciente es trasladado a nuestro hospital con diagnóstico de lesiones hepáticas compatibles con absceso hepático de mala evolución, sin poder descartar origen tumoral, con punción-aspiración con aguja fina no concluyente. Se decide intervención quirúrgica programada, hallándose una vesícula biliar con signos inflamatorios crónicos con pared engrosada, y tumor en el lecho adyacente a nivel del fundus. Lesión ocupante de espacio hepática dura en segmento vi de 11mm de diámetro y punteado en superficie hepática (en los segmentos iii, iv y v), que simula siembra miliar metastásica, así como en epiplón. Se realiza ecografía intraoperatoria, descartándose otras lesiones intraparenquimatosas. Tras enviar varias biopsias intraoperatorias de las lesiones hepáticas y de las de epiplón, se informan todas ellas como infiltrado linfoide sin signos de malignidad, compatible con pseudotumor inflamatorio. Se lleva a cabo una colecistectomía ampliada al lecho vesicular, incluyendo la tumoración (fig. 2).
A. Tomografía computada de abdomen: engrosamiento de las paredes de la vesícula biliar, con imagen de lesión hipodensa mal definida de 17mm de diámetro en el segmento iv a nivel del lecho vesicular. B. Tomografía computada de abdomen: persistencia de engrosamiento difuso e inespecífico de las paredes de la vesícula biliar, y crecimiento de la lesión en el segmento iv, 25mm. C. Tomografía computada de abdomen: aparición de una nueva lesión en el segmento vi, 16mm. D. En la tomografía por emisión de positrones no se observan focos hipermetabólicos a nivel hepático que evidencien malignidad.
El paciente presenta buena evolución postoperatoria, siendo dado de alta el quinto día tras la intervención. Los resultados definitivos de anatomía patológica vienen informados como, macroscópicamente, vesícula biliar con paredes engrosadas y lesión que emerge del fundus, sin que afecte a la mucosa. Tras el estudio microscópico, se obtuvieron hallazgos histológicos indicativos de tumor miofibroblástico inflamatorio o pseudotumor inflamatorio. El resto de las muestras mandadas se informó como tejido hepático con arquitectura distorsionada a expensas de fibrosis difusa que afecta a parénquima hepático y espacios porta, acompañado por intenso exudado inflamatorio linfoplasmocitoide maduro. Así mismo, en la muestra de epiplón se obtuvo un tejido fibroso con infiltrado linfoplasmocitoide maduro. En la inmunohistoquímica no se evidenció reordenamiento clonal para el gen de las cadenas pesadas de las inmunoglobulinas (IgH).
DiscusiónEl pseudotumor inflamatorio o tumor miofibroblástico inflamatorio o granuloma de células plasmáticas es una lesión formadora de tumor de tipo reparativo inflamatorio o reactivo de comportamiento benigno, poco frecuente, que fue descrita por primera vez en el hígado por Pack y Baker2 en 1953. Está caracterizado por la proliferación mesenquimal de células inflamatorias, especialmente de linfocitos, células plasmáticas y, ocasionalmente, histiocitos1. La fisiopatología del pseudotumor inflamatorio aún no es bien conocida, pero el patrón patológico inflamatorio y los síntomas sistémicos, como fiebre y malestar, demuestran la existencia de un agente infeccioso subyacente, aunque no siempre se confirma. Suele afectar a niños o adultos jóvenes, sobre todo varones4, y parece haber una mayor incidencia en razas no caucásicas5,6.
El pseudotumor inflamatorio se clasifica clínicamente en diferentes tipos según su etiología, variando las opciones de tratamiento en función de la misma. Las infecciones y los trastornos autoinmunes representan las causas originalmente descritas para esta entidad. El pseudotumor inflamatorio de origen infeccioso puede ser causado por Mycobacterium tuberculosis, micobacterias no tuberculosas, Escherichia coli, cocos grampositivos y Klebsiella pneumoniae. La detección de estos microorganismos puede confirmar la existencia en tales casos de pseudotumor inflamatorio, pudiéndose validar el diagnóstico, aún más, por la respuesta del paciente a los agentes antibacterianos específicos.
Es muy difícil para un médico diagnosticar esta afección debido a la ausencia de síntomas, anomalías hematológicas o hallazgos radiológicos específicos. Clínicamente, puede presentarse con fiebre, síndrome constitucional, dolor abdominal o malestar general. En el reporte de laboratorio, es frecuente encontrar un incremento en la velocidad de sedimentación globular, y de proteína C reactiva, leucocitosis, anemia, hipertransaminasemia o hipoalbuminemia.
Histopatológicamente, se caracteriza por la presencia de miofibroblastos envueltos en tejido colágeno densamente hialinizado, con infiltrado inflamatorio con predominio de linfocitos y células plasmáticas policlonales, los cambios de tipo reparativo con fibrosis, las áreas de necrosis celular y, a veces, una reacción granulomatosa4.
Los resultados radiológicos para el pseudotumor inflamatorio también son inespecíficos, debido a que la proporción o la distribución de las células inflamatorias y fibrosis van a depender tanto de la causa como de la fase inflamatoria en que se encuentre, de forma que, en ocasiones, incluso puede imitar tumores malignos3. Así, un realce tardío en la tomografía computada con contraste, especialmente en la periferia de las lesiones, se considera que es característico de pseudotumor inflamatorio7, pero también puede ser compatible con colangiocarcinoma o lesiones metastásicas. En su estudio, Akatsu et al.8 publican que en ocasiones puede mostrar un patrón de captación temprana seguido de un lavado en la fase retardada de la tomografía computada con contraste, típico del hepatocarcinoma; sin embargo, según Fukuya et al.7, la mayoría de las veces muestra una captación variable en la fase portal, con mayor realce en las fases tardías, lo que lo diferencia del hepatocarcinoma. En la resonancia magnética nuclear, la lesión demuestra un aumento de la intensidad de la señal tanto en T1 como en T2 en relación con un hígado normal9, si bien puede, igualmente, simular otras afecciones malignas. La tomografía por emisión de positrones usa como radiotrazador la 18-fluorodesoxiglucosa y podría ser de ayuda, ya que en procesos malignos la captación de este radiotrazador es mayor que en los inflamatorios. Un ejemplo de ello es que identifica con precisión los hepatocarcinomas menos diferenciados, sobre los que debe establecerse el diagnóstico diferencial con el pseudotumor inflamatorio10. Sin embargo, este método de diferenciación es de valor limitado para el pseudotumor inflamatorio porque la captación de 18-fluorodesoxiglucosa varía con la proporción de la fibrosis e infiltración de células inflamatorias. De hecho, ha habido algunos estudios con tomografía por emisión de positrones-fluorodesoxiglucosa en pseudotumor inflamatorio que nos informan de una alta captación de 18-fluorodesoxiglucosa11, comparable a malignidad.
El diagnóstico definitivo requiere a menudo una confirmación histopatológica en la mayoría de los casos mediante punción percutánea hepática, aunque a veces puede conducir a un diagnóstico erróneo12; por ello, en algunas ocasiones, sobre todo cuando no se puede descartar malignidad, es necesaria una laparotomía exploradora, e incluso la realización de una hepatectomía para su confirmación.
Numerosos estudios han demostrado que la historia natural del pseudotumor inflamatorio es su remisión. Una vez confirmado el diagnóstico con la biopsia, se puede llevar a cabo una actitud conservadora mediante controles periódicos hasta su resolución, o se puede tratar con antibióticos, antiinflamatorios e, incluso, corticoides4.
La resección quirúrgica, que en un principio era considerada como tratamiento de elección en estos enfermos, debe ser reservada para algunas situaciones, tales como persistencia de síntomas sistémicos no resueltos a pesar del tratamiento médico13, en aquellas situaciones en las que se evidencia crecimiento del pseudotumor inflamatorio, con o sin síntomas14, cuando está implicado el hilio hepático, pudiendo ser causa de obstrucción biliar y/o de hipertensión portal15 y, por último, en caso de no poder descartar la posibilidad de malignidad a pesar de las diferentes pruebas complementarias16.
En la actualidad, no hay estudios clínicos que comparen los resultados de los pacientes tratados de forma conservadora y los tratados con cirugía. Además, no hay datos sobre la duración del seguimiento en pacientes tratados de forma conservadora. Más recientemente, la recurrencia local y las metástasis a distancia se han atribuido a la ploidía de la lesión, teniendo las lesiones aneuploides más probabilidad de presentar recurrencias y tener metástasis que las diploides17. Por lo tanto, el análisis de ADN por citometría de flujo ha sido recomendado para proporcionar al clínico información tanto diagnóstica como pronóstica, para individualizar un enfoque terapéutico más factible.
ConclusionesEn nuestro caso, se trata de un paciente en el que tras un estudio intenso del posible origen del cuadro clínico que presentaba, se decide intervención quirúrgica al no poder filiar las lesiones hepáticas mediante punción-aspiración con aguja fina. En la misma, se halló una lesión en el lecho vesicular, íntimamente adherida al fundus de la vesícula, con lesiones compatibles con siembra miliar en la superficie hepática, así como en epiplón. Se optó por la toma de biopsia intraoperatoria, colecistectomía y extirpación de la lesión del lecho en bloque, sin resecar las demás lesiones, al obtener el diagnóstico de pseudotumor inflamatorio. En la actualidad, el paciente se encuentra asintomático.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.