Analizar si la autoevaluación de una vía clínica mejora los resultados del tratamiento del cáncer de recto (CR).
Pacientes y métodoPacientes intervenidos de CR divididos en 3 grupos según modificaciones bianuales de una vía clínica analizando diversos indicadores.
ResultadosCiento sesenta y seis pacientes: grupo A: 2002–2003, n=50; B: 2004–2005, n=53 y C: 2006–2007, n=63; sin diferencias en edad, sexo o comorbilidad. El estudio preoperatorio mejoró con la introducción de TC toracoabdominopélvico: un 76% en el grupo C frente a un 6% del A (p<0,001). Todos los tumores del grupo C fueron estadificados mediante RM, ECO rectal o ambas, frente a un 84% del A (p<0,001). La tasa de amputaciones de recto pasó del 42% en el grupo A, al 17% en el C (p=0,007). Un 48% de cirujanos del grupo A frente al 94% en el C (p<0,001) tenían dedicación específica a la coloproctología. La media de adenopatías analizadas fue: grupo A: 6,2±4,5 frente a 13±6,5 en el C (p<0,001) y se informó del margen circunferencial en un 24% del grupo A frente al 76% en el C (p<0,001). Parámetros como la transfusión perioperatoria de hemoderivados, ingreso en UCI, uso de sonda nasogástrica, tolerancia precoz o analgesia epidural también mejoraron progresivamente. La mortalidad operatoria descendió de forma no significativa hasta el 4,7% y las dehiscencias anastomóticas del 24% al 9,5%, reduciéndose la estancia postoperatoria de 15–11 días (p=0,029).
ConclusionesSe han mejorado múltiples indicadores de forma significativa en un período relativamente corto al efectuar autoevaluaciones del proceso.
To analyse whether the self-evaluation of a clinical pathway improves the results of rectal cancer (RC) treatment.
Patients and methodPatients operated on for RC were divided into 3 groups according to biannual modifications of a clinical pathway analysing several indicators.
Results166 patients: Group A: 2002–3 n=50, B: 2004–5 n=53 and C: 2006–7 n=63, without any differences in age, gender or comorbidity. Preoperative study improved with the introduction of CT scan: 76% in Group C vs. 6% in Group A (P<0.001). All Group C tumours were staged using MR, rectal ultrasound or both, compared to 84% in Group A (P<0.001). The rate of abdominal-perineal resections was reduced from 42% (Group A) to 17% (Group C); (P=0.007) and about 48% of surgeons in Group A vs. 94% in the C had a specific activity in coloproctology (P<0.001). The average lymph node count was: Group A=6.2±4.5 vs. 13±6.5 in the C and circumferential margin analysis was reported in 24% of Group A vs. 76% in Group C (P<0.001). Parameters such as perioperative blood transfusion, ICU admission, use of nasogastric tube, early feeding or epidural analgesia also improved progressively. Operative mortality decreased non-significantly to 4.7% and anastomotic leaks from 24% to 9.5% with a reduction in postoperative stay from 15 to 11 days during the period analysed (P=0.029).
ConclusionsSeveral indicators have significantly improved in a relatively short period of time due to self-evaluations of the process.
En las últimas décadas se ha ido extendiendo la cultura de la autoevaluación de los resultados de la cirugía, así como la necesidad de establecer mínimos de calidad exigibles1. Las vías clínicas constituyen herramientas muy útiles para analizar la calidad asistencial de procesos frecuentes, relevantes y que tengan un curso clínico predecible, como el cáncer de recto (CR), cuyo tratamiento quirúrgico ha sido clásicamente medido mediante indicadores tales como la morbilidad y la mortalidad, estancia hospitalaria o tasa de recidivas, a los que más recientemente se han añadido la calidad de la pieza quirúrgica, consumo de recursos, calidad de vida o el coste del proceso asistencial, entre otros2.
En las guías de práctica clínica se recogen los indicadores y estándares recomendados para el CR3–8. Hace años, diseñamos una vía clínica adaptada a nuestro medio hospitalario, que ha sido discutida y evaluada por un grupo multidisciplinar. El objetivo del presente trabajo es analizar si la autoevaluación basada en la evidencia científica de sus sucesivas actualizaciones, mejora la calidad asistencial del proceso carcinoma de recto.
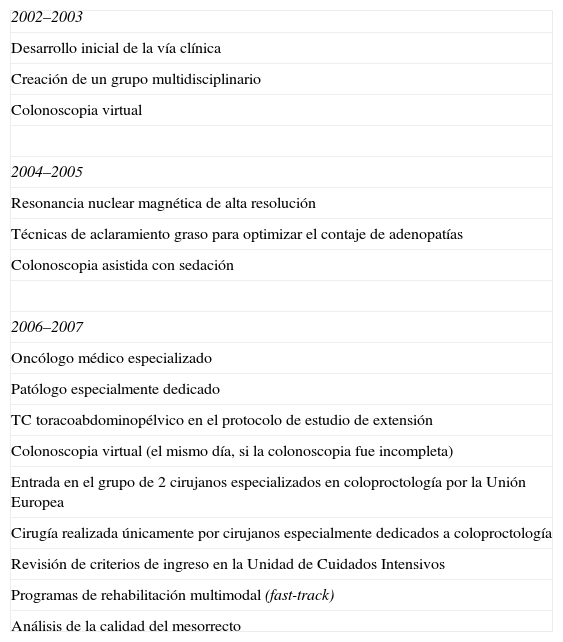
Pacientes y métodoSe han analizado los pacientes intervenidos de forma consecutiva de CR en nuestro hospital entre enero de 2002 y diciembre de 2007, siguiendo una vía clínica instaurada en el año 2002, con sucesivas modificaciones bianuales, efectuadas por el equipo multidisciplinar, para optimizar el empleo de recursos y mejorar los resultados, según la evidencia disponible (tabla 1). Dicho grupo fue ampliándose progresivamente y, desde 2005, está formado por cirujanos, endoscopista, radiólogo, anatomo patólogo, oncólogos médicos y radioterapeuta, especialmente dedicados, y se reúne con periodicidad semanal.
Programas de mejora de la vía clínica del carcinoma colorrectal
| 2002–2003 |
| Desarrollo inicial de la vía clínica |
| Creación de un grupo multidisciplinario |
| Colonoscopia virtual |
| 2004–2005 |
| Resonancia nuclear magnética de alta resolución |
| Técnicas de aclaramiento graso para optimizar el contaje de adenopatías |
| Colonoscopia asistida con sedación |
| 2006–2007 |
| Oncólogo médico especializado |
| Patólogo especialmente dedicado |
| TC toracoabdominopélvico en el protocolo de estudio de extensión |
| Colonoscopia virtual (el mismo día, si la colonoscopia fue incompleta) |
| Entrada en el grupo de 2 cirujanos especializados en coloproctología por la Unión Europea |
| Cirugía realizada únicamente por cirujanos especialmente dedicados a coloproctología |
| Revisión de criterios de ingreso en la Unidad de Cuidados Intensivos |
| Programas de rehabilitación multimodal (fast-track) |
| Análisis de la calidad del mesorrecto |
Los pacientes fueron distribuidos según la fecha de intervención en 3 grupos, aproximadamente correspondientes a la fechas de actualización de la vía clínica: grupo A: 2002–2003; grupo B: 2004–2005; grupo C: 2006–2007.
Se incluyeron los casos de cirugía programada por CR, considerando tumores rectales aquellos situados dentro de los 15cm, medidos desde margen anal con rectosigmoidoscopia rígida. Se excluyeron las colostomías paliativas y carcinomatosis peritonal difusa. El seguimiento postoperatorio mínimo fue de 18 meses.
Las variables analizadas fueron, aparte de las características clínicas de los pacientes y comorbilidad, indicadores de calidad asistencial tanto técnica, incluyendo métodos de imagen para estadificación, neoadyuvancia, tratamiento quirúrgico y anatomía patológica, como de consumo de recursos. Los datos se recogieron prospectivamente en una base clinicoadministrativa (Microsoft® Office Access 2003), siendo procesados con el paquete estadístico SPSS versión 15 para Windows (SPSS Inc., Chicago IL, EE.UU.). Se utilizaron las pruebas de chi cuadrado y test exacto de Fisher para las variables cualitativas, o las de t de Student o la U de Mann Whitney para las cuantitativas, según siguiesen o no los datos una distribución normal tras evaluarlo con el test de Kolmogorov-Smirnov. Se consideró estadísticamente significativo un valor de p<0,05.
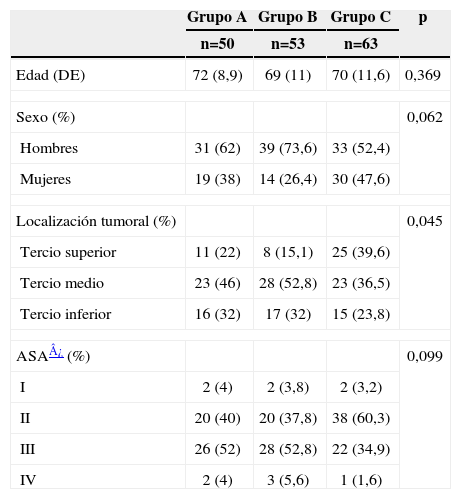
ResultadosSe han estudiado 166 pacientes (103 hombres y 63 mujeres) de edad media de 71±11 años. El grupo A estuvo formado por 50 pacientes, el B por 53 y el C por 63, sin diferencias en edad, sexo o gravedad de los pacientes según la clasificación de la Asociación Americana de Anestesistas (ASA) (tabla 2).
Características de los paciente
| Grupo A | Grupo B | Grupo C | p | |
| n=50 | n=53 | n=63 | ||
| Edad (DE) | 72 (8,9) | 69 (11) | 70 (11,6) | 0,369 |
| Sexo (%) | 0,062 | |||
| Hombres | 31 (62) | 39 (73,6) | 33 (52,4) | |
| Mujeres | 19 (38) | 14 (26,4) | 30 (47,6) | |
| Localización tumoral (%) | 0,045 | |||
| Tercio superior | 11 (22) | 8 (15,1) | 25 (39,6) | |
| Tercio medio | 23 (46) | 28 (52,8) | 23 (36,5) | |
| Tercio inferior | 16 (32) | 17 (32) | 15 (23,8) | |
| ASA¿ (%) | 0,099 | |||
| I | 2 (4) | 2 (3,8) | 2 (3,2) | |
| II | 20 (40) | 20 (37,8) | 38 (60,3) | |
| III | 26 (52) | 28 (52,8) | 22 (34,9) | |
| IV | 2 (4) | 3 (5,6) | 1 (1,6) | |
ASA: Asociación Americana de Anestesistas; DE: desviación estándar.
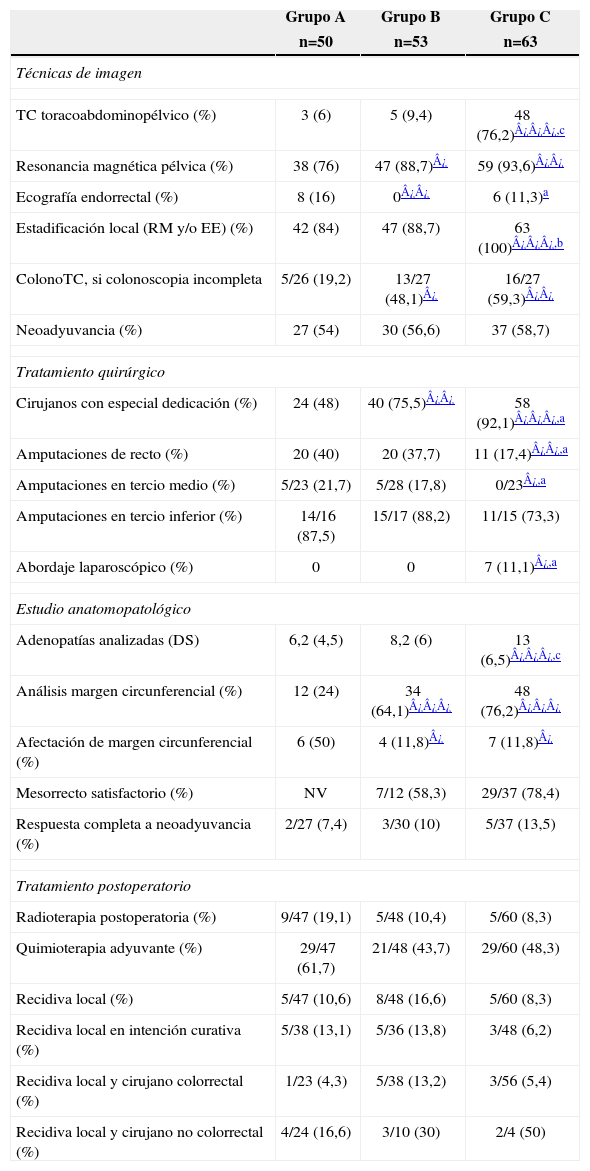
Respecto a las técnicas de imagen, el estudio de extensión fue variando desde el empleo de ecografía abdominal y radiología simple de tórax, a la de TC toracoabdominopélvico, que aumentó hasta el 76,2% en el grupo C (tabla 3). La estadificación local mediante RM y ecografía endorrectal (EE) fue, asimismo, aumentando y en el grupo C se efectuó una u otra en el 100% de pacientes. A todos se les realizó colonoscopia preoperatoria, incompleta en 80 (48,2%), sin diferencias entre grupos. Para completarla, se solicitaron en cada período más colonoscopias virtuales (colonoTC) protocolizadas en el grupo C para el mismo día o siguiente de una colonoscopia fallida. La tasa total de evaluación cólica completa entre el preoperatorio y los 3 primeros meses postoperatorios fue del 95,8%, sin diferencias entre grupos.
Calidad técnica
| Grupo A | Grupo B | Grupo C | |
| n=50 | n=53 | n=63 | |
| Técnicas de imagen | |||
| TC toracoabdominopélvico (%) | 3 (6) | 5 (9,4) | 48 (76,2)¿¿¿,c |
| Resonancia magnética pélvica (%) | 38 (76) | 47 (88,7)¿ | 59 (93,6)¿¿ |
| Ecografía endorrectal (%) | 8 (16) | 0¿¿ | 6 (11,3)a |
| Estadificación local (RM y/o EE) (%) | 42 (84) | 47 (88,7) | 63 (100)¿¿¿,b |
| ColonoTC, si colonoscopia incompleta | 5/26 (19,2) | 13/27 (48,1)¿ | 16/27 (59,3)¿¿ |
| Neoadyuvancia (%) | 27 (54) | 30 (56,6) | 37 (58,7) |
| Tratamiento quirúrgico | |||
| Cirujanos con especial dedicación (%) | 24 (48) | 40 (75,5)¿¿ | 58 (92,1)¿¿¿,a |
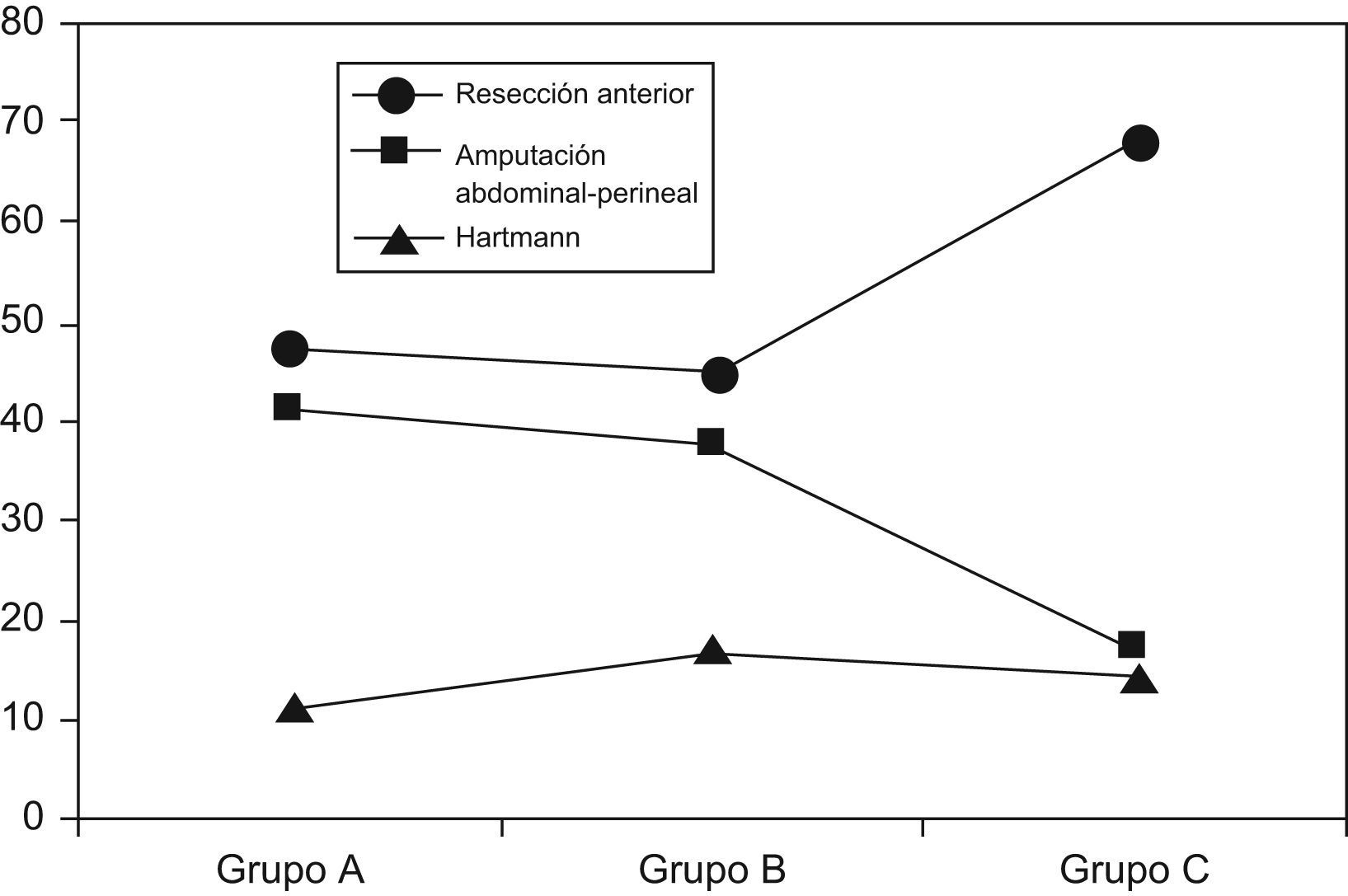
| Amputaciones de recto (%) | 20 (40) | 20 (37,7) | 11 (17,4)¿¿,a |
| Amputaciones en tercio medio (%) | 5/23 (21,7) | 5/28 (17,8) | 0/23¿,a |
| Amputaciones en tercio inferior (%) | 14/16 (87,5) | 15/17 (88,2) | 11/15 (73,3) |
| Abordaje laparoscópico (%) | 0 | 0 | 7 (11,1)¿,a |
| Estudio anatomopatológico | |||
| Adenopatías analizadas (DS) | 6,2 (4,5) | 8,2 (6) | 13 (6,5)¿¿¿,c |
| Análisis margen circunferencial (%) | 12 (24) | 34 (64,1)¿¿¿ | 48 (76,2)¿¿¿ |
| Afectación de margen circunferencial (%) | 6 (50) | 4 (11,8)¿ | 7 (11,8)¿ |
| Mesorrecto satisfactorio (%) | NV | 7/12 (58,3) | 29/37 (78,4) |
| Respuesta completa a neoadyuvancia (%) | 2/27 (7,4) | 3/30 (10) | 5/37 (13,5) |
| Tratamiento postoperatorio | |||
| Radioterapia postoperatoria (%) | 9/47 (19,1) | 5/48 (10,4) | 5/60 (8,3) |
| Quimioterapia adyuvante (%) | 29/47 (61,7) | 21/48 (43,7) | 29/60 (48,3) |
| Recidiva local (%) | 5/47 (10,6) | 8/48 (16,6) | 5/60 (8,3) |
| Recidiva local en intención curativa (%) | 5/38 (13,1) | 5/36 (13,8) | 3/48 (6,2) |
| Recidiva local y cirujano colorrectal (%) | 1/23 (4,3) | 5/38 (13,2) | 3/56 (5,4) |
| Recidiva local y cirujano no colorrectal (%) | 4/24 (16,6) | 3/10 (30) | 2/4 (50) |
EE: ecografía endorrectal; MC: Margen circunferencial; NV: no valorado; RM: resonancia magnética.
No hubo tampoco diferencias en el empleo de tratamiento neoadyuvante (quimioradioterapia), siendo de ciclo largo en 84 y corto, en 10 pacientes. Se aplicó profilaxis tromboembólica y antibiótica en todos los casos. La preparación mecánica de colon (PMC) se realizó en 158 pacientes (95,2%). En los grupos B y C no se preparó el colon en 2 y 6 casos, respectivamente, de neoplasias de recto superior debido al cambio en el protocolo de manejo, que incluía la PMC solo en los propuestos para una exéresis mesorrectal completa con ileostomía derivativa.
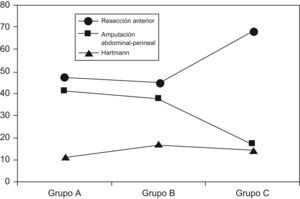
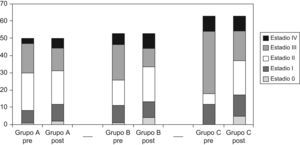
En lo que atañe al tratamiento quirúrgico, el porcentaje de cirujanos con especial dedicación a la coloproctología (al menos el 80% de su actividad cotidiana), fue progresivamente mayor, alcanzándose en el grupo C un 92%. La cirugía fue con intención curativa en el 77,7% de casos, sin diferencias entre grupos. La tasa de amputaciones abdominoperineales (AAP) fue del (17,4%) en el grupo C, significativamente menor que en los grupos A y B (tabla 3, fig. 1). El porcentaje de ileostomías de protección en resecciones anteriores fue del 35,2%, sin diferencias entre grupos. El abordaje laparoscópico comenzó a emplearse en el grupo C.
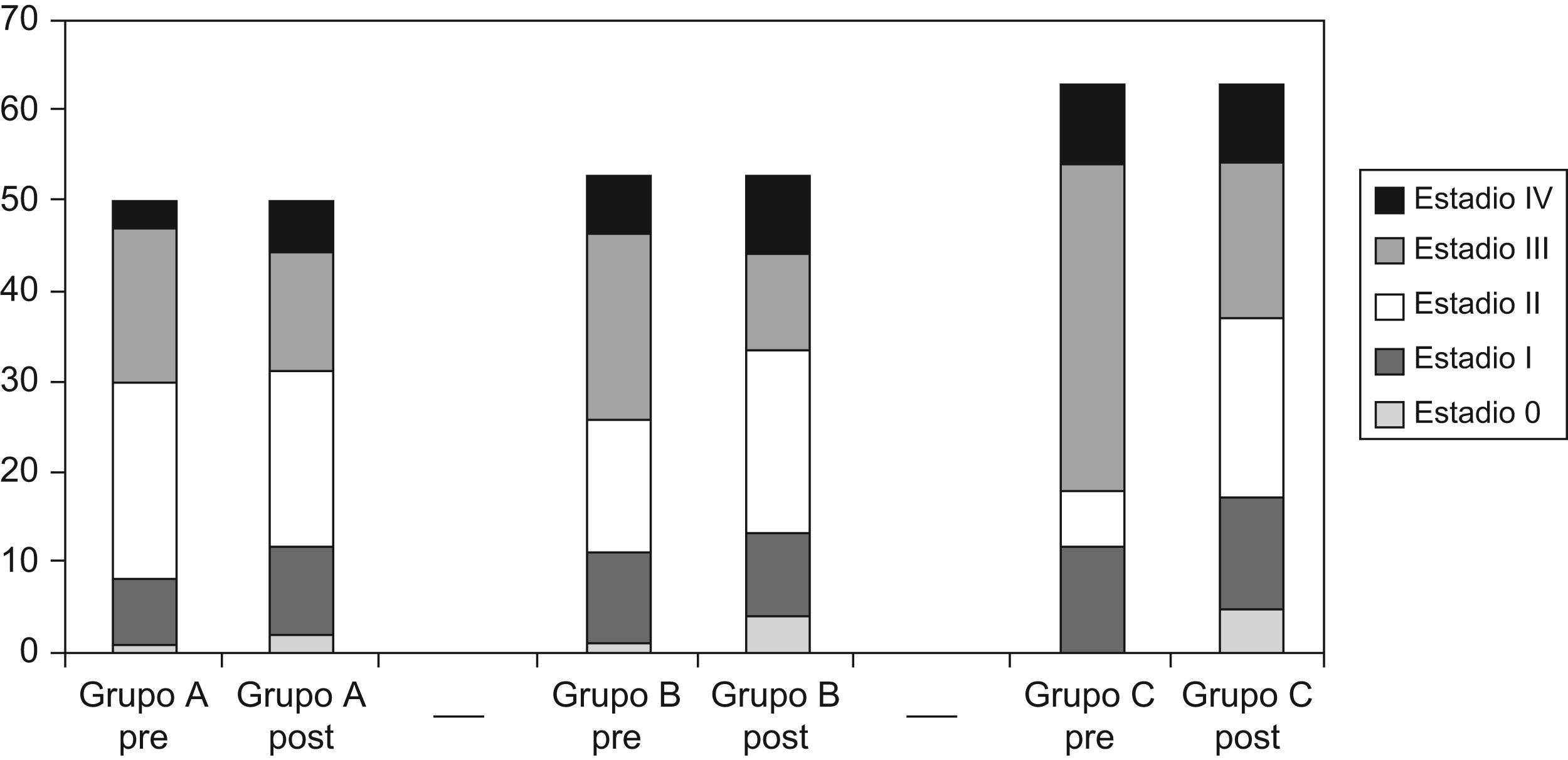
Tanto el número de adenopatías como el análisis del margen circunferencial, mejoraron de forma estadísticamente significativa (tabla 3) y el patólogo calificó el mesorrecto de satisfactorio en el 78,4% de pacientes del grupo C. La estadificación preoperatoria se modificó tras la intervención quirúrgica (fig. 2), mejorando el downstaging tumoral, con incremento no significativo de las respuestas completas en el grupo C. Se empleó radioterapia postoperatoria en un menor porcentaje en el grupo C, sin ser estadísticamente significativo. No hubo diferencias entre grupos respecto a la quimioterapia adyuvante.
Con una mediana de seguimiento de 70, 45 y 30 meses, respectivamente, la recidiva local se produjo en 18/155 pacientes (11,6%). En cirugía con intención curativa fue de 10,6%, mejorando progresivamente aún sin alcanzar la significación estadística y los cirujanos colorrectales obtuvieron una tasa en el global de la serie del 7,7%, sin diferencias entre grupos, pero significativamente inferior al 23,7% obtenido por los cirujanos sin dedicación específica; p=0,021 (OR=3,1; IC95%=1,1–8,3).
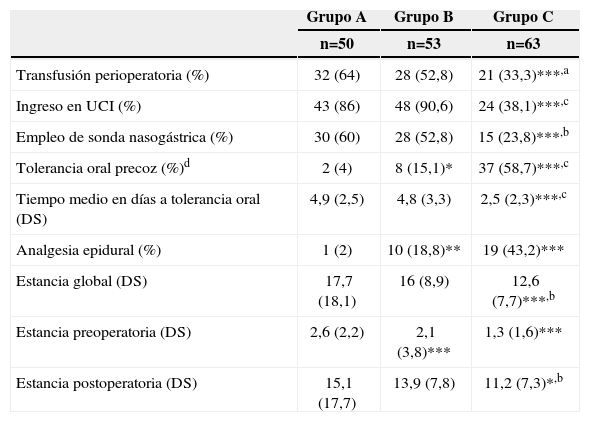
Consumo de recursos y efectividad clínicaHubo una progresiva reducción en la transfusión perioperatoria de hemoderivados (tabla 4). Solo el 38% de pacientes del grupo C ingresó en la Unidad de Cuidados Intensivos, significativamente menos que en los A y B, debido a la creación de una Unidad de Reanimación Postanestésica (URPA) para estancias menores a 24h. Se colocó sonda nasogástrica (SNG) de forma significativamente menor en el grupo C. Únicamente a 10 de los 93 pacientes a los que no se puso, hubo necesidad de colocarla durante el postoperatorio. La tolerancia oral precoz (días 0 a 2) fue cada vez mayor, hasta alcanzar casi el 60% en el grupo C y su tiempo medio de inicio en este grupo fue inferior a los otros. La analgesia epidural aumentó significativamente su empleo en cada período evaluado.
Consumo de recursos. Cirugía
| Grupo A | Grupo B | Grupo C | |
| n=50 | n=53 | n=63 | |
| Transfusión perioperatoria (%) | 32 (64) | 28 (52,8) | 21 (33,3)***,a |
| Ingreso en UCI (%) | 43 (86) | 48 (90,6) | 24 (38,1)***,c |
| Empleo de sonda nasogástrica (%) | 30 (60) | 28 (52,8) | 15 (23,8)***,b |
| Tolerancia oral precoz (%)d | 2 (4) | 8 (15,1)* | 37 (58,7)***,c |
| Tiempo medio en días a tolerancia oral (DS) | 4,9 (2,5) | 4,8 (3,3) | 2,5 (2,3)***,c |
| Analgesia epidural (%) | 1 (2) | 10 (18,8)** | 19 (43,2)*** |
| Estancia global (DS) | 17,7 (18,1) | 16 (8,9) | 12,6 (7,7)***,b |
| Estancia preoperatoria (DS) | 2,6 (2,2) | 2,1 (3,8)*** | 1,3 (1,6)*** |
| Estancia postoperatoria (DS) | 15,1 (17,7) | 13,9 (7,8) | 11,2 (7,3)*,b |
DS: desviación estándar; UCI: Unidad de Cuidados Intensivos.
*p< 0,05.
**p<0,01.
*** p<0,001 frente a grupo A.
ap<0,05.
bp<0,01.
cp<0,001 frente a grupo B.
dTolerancia a ingesta oral al 2.° día.
La estancia hospitalaria total fue significativamente inferior en el grupo C que en los A y B, lo que se debió tanto a la reducción de la estancia preoperatoria, ya mejorada en el grupo B, como de la postoperatoria.
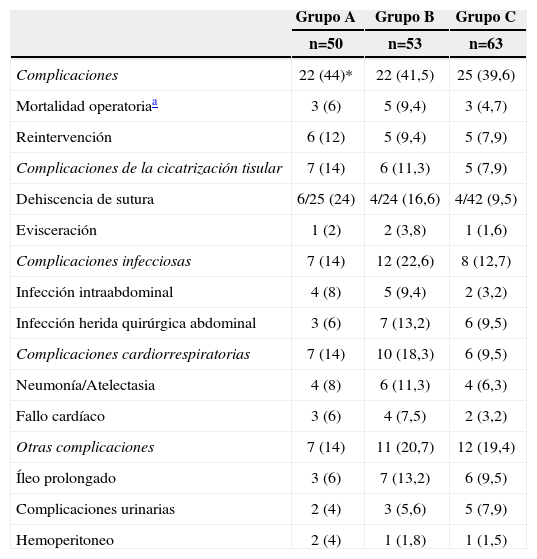
Un total de 69 pacientes (41,5%) se complicaron en el postoperatorio inmediato y la mortalidad en los 30 días de postoperatorio fue del 6,6%, en ambos casos sin diferencias entre grupos (tabla 5). La tasa de dehiscencias de sutura se redujo de modo no significativo hasta un 9,5% en el grupo C.
Complicaciones postoperatorias
| Grupo A | Grupo B | Grupo C | |
| n=50 | n=53 | n=63 | |
| Complicaciones | 22 (44)* | 22 (41,5) | 25 (39,6) |
| Mortalidad operatoriaa | 3 (6) | 5 (9,4) | 3 (4,7) |
| Reintervención | 6 (12) | 5 (9,4) | 5 (7,9) |
| Complicaciones de la cicatrización tisular | 7 (14) | 6 (11,3) | 5 (7,9) |
| Dehiscencia de sutura | 6/25 (24) | 4/24 (16,6) | 4/42 (9,5) |
| Evisceración | 1 (2) | 2 (3,8) | 1 (1,6) |
| Complicaciones infecciosas | 7 (14) | 12 (22,6) | 8 (12,7) |
| Infección intraabdominal | 4 (8) | 5 (9,4) | 2 (3,2) |
| Infección herida quirúrgica abdominal | 3 (6) | 7 (13,2) | 6 (9,5) |
| Complicaciones cardiorrespiratorias | 7 (14) | 10 (18,3) | 6 (9,5) |
| Neumonía/Atelectasia | 4 (8) | 6 (11,3) | 4 (6,3) |
| Fallo cardíaco | 3 (6) | 4 (7,5) | 2 (3,2) |
| Otras complicaciones | 7 (14) | 11 (20,7) | 12 (19,4) |
| Íleo prolongado | 3 (6) | 7 (13,2) | 6 (9,5) |
| Complicaciones urinarias | 2 (4) | 3 (5,6) | 5 (7,9) |
| Hemoperitoneo | 2 (4) | 1 (1,8) | 1 (1,5) |
*Los datos son números con porcentajes entre paréntesis.
El estudio intenta mostrar cómo pueden mejorarse los resultados de una patología relevante. La situación de partida era similar a la de muchos centros de la geografía nacional9. Si bien el Comité Multidisciplinar adoptó modificaciones sucesivas de la vía clínica, no todos los cambios fueron tan estáticos en el tiempo como se muestra al separarlos en 3 grupos, ya que algunos fueron progresivos, fruto de las reuniones y puestas en común semanales.
De las pruebas diagnósticas preoperatorias, la colonoscopia es de elección, pero solo pudo realizarse de forma completa en la mitad de los casos. Para obviarlo, se introdujo la práctica de una colonoTC el mismo día o al siguiente de una exploración fallida, lo que fue factible en casi el 60% de casos del grupo C. Ello supone una mejora en la detección de lesiones ocultas, con una sensibilidad de 88% para pólipos de más de 9mm10, pero también en la comodidad para el paciente que solo precisa una preparación de colon. Como método de estadificación locorregional, la RM pélvica de alta resolución ofrece, independientemente de una fiable estadificación T y N, la valoración del margen circunferencial del mesorrecto, variable pronóstica de primera magnitud11, y se efectuó significativamente más en los grupos B y C, aunque 4 pacientes del Grupo C no tuvieron RM: en 2 por biopsia de benignidad y ausencia de invasión en la EE y en otros 2 metastásicos. No es preciso remarcar la importancia del tratamiento neoadyuvante en el CR, y del interés de que el empleo de la radioterapia sea preoperatorio. Nuestras tasas de neoadyuvancia no difirieron en los períodos analizados, pero la indicación de radioterapia postoperatoria disminuyó notablemente.
La necesidad de la PMC nunca ha sido demostrada y recientes metaanálisis evidencian que incrementa el riesgo de dehiscencia e infecciones. Sin embargo, todavía no está claro que específicamente sea más segura la cirugía rectal con anastomosis en ausencia de preparación intestinal12 y el concepto está tan arraigado que es muy difícil cambiarlo13. Nuestra política es efectuarla cuando se espera hacer una ileostomía de protección (anastomosis bajas) y sustituirla por un enema salino en tumores de tercio superior o amputaciones de recto. Así, los casos en los que no se realizó PMC en el grupo B y C fue debido al cambio en el protocolo de manejo, que incluía solo en los propuestos para una exéresis mesorrectal completa con ileostomía derivativa.
La tendencia actual es de preservación de esfínteres, salvo que estén infiltrados. Se recomienda que el porcentaje de tumores rectales tratados por AAP sea inferior al 30–40%3–5,14. La AAP ofrece peores resultados en cuanto a recidivas locales por diversos factores, tales como la posible filtración transanal de células tumorales, la perforación o el efecto «cono» al efectuar la disección15,16. Nuestra tasa de AAP ha disminuido significativamente con el tiempo, no solo en general, sino también en tumores del tercio medio. Esta y otras mejoras, han sido reflejo de la adopción multidisciplinar de decisiones y realizar esta cirugía aquellos profesionales con especial dedicación17. Indudablemente ambos hechos son los que han contribuido más positivamente a la mejora de los resultados.
Existe en la actualidad bastante consenso en la realización de estoma de protección en las anastomosis bajas y, fundamentalmente, si hay factores de riesgo de dehiscencia18, y se realizó en la práctica totalidad de excisiones mesorrectales completas con anastomosis en el grupo C.
Para afirmar con una precisión mayor del 90% que no hay afectación linfática del tumor, se recomienda aislar un mínimo de 12 ganglios negativos19. Aunque la media de adenopatías aisladas en nuestra serie ha sido de 13 en el grupo C, significativamente superior a los previos, solo en el 71% de pacientes se obtuvo el mínimo de 12, por lo que aún debemos mejorar20. Además de ello, hay que extirpar correctamente el mesorrecto con unos márgenes distal y circunferencial adecuados. Así, en los últimos años ha aumentado el número de análisis del margen circunferencial (MC), cuya tasa de afectación varía ampliamente en los trabajos publicados, con cifras entre el 2 y el 28%21. En nuestro caso, ha sido del 11,8% en los Grupos B y C con un mesorrecto satisfactorio para el patólogo del 78,4%, en este último. Finalmente, la tasa recomendable de resecciones curativas debe ser superior al 60%14,21 y, por tanto, nuestro 77,7% estaría en un rango aceptable.
Las evidencias actuales sugieren que con el uso de técnicas quirúrgicas óptimas y la radioterapia preoperatoria para los tumores fijos o dudosos puede conseguirse una recidiva local global inferior al 10%2–5,9,14. Según esto, nuestros resultados globales (11,6%) no son buenos, aunque se han reducido al 8,3% en el último período, en el que, sí se analiza la cirugía efectuada por cirujanos con dedicación específica, la cifra se reduce hasta el 5,4%. Afectación del borde circunferencial del mesorrecto y tasa de recidivas locales son de gran utilidad en la evaluación de los resultados21 en los que la experiencia del cirujano es un factor pronóstico independiente22, lo mismo que para la preservación esfinteriana23. En este sentido, en el grupo C se incorporaron 2 cirujanos con acreditación específica en coloproctología (EBSQC) que contribuyeron a depurar y estandarizar la técnica quirúrgica y varios cirujanos implicados asistieron a cursos de formación, con el fin de crear una unidad de cirujanos colorrectales. Se puede deducir que en los resultados del tratamiento quirúrgico del CR influyen las características anatomopatológicas del tumor, la terapia neoadyuvante, la meticulosisdad de la cirugía, así como la experiencia del cirujano colorrectal17.
Uno de los avances que más ha contribuido a mejorar el manejo perioperatorio tras cirugía colorrectal es la rehabilitación multimodal, que pretende acelerar la recuperación, reduciendo morbilidad y acortando estancias24. Aplicando estas medidas hemos modificado significativamente el empleo de sonda nasogástrica, analgesia epidural, o ingesta oral precoz, si bien es posiblemente la medida más difícil de implantar. Se han reducido también los ingresos en UCI, lo que deriva de un cambio de actitud del equipo de anestesia25 y la tasa de transfusión perioperatoria.
La mortalidad postoperatoria global (6,6%) ha sido superior al máximo del 5% recomendado en la literatura, en la que se hallan cifras que oscilan entre el 0–8,6%2,3,9, siendo durante el último período del 4,7%. La dehiscencia de sutura constituye una importante causa de morbimortalidad. Las recomendaciones actuales3,5,26 son que el índice global de fugas clínicamente manifiestas sea inferior al 8% para las resecciones anteriores, y nuestras cifras son todavía del 9,5% en el Grupo C, si bien con una notable reducción. Respecto a otras complicaciones, los resultados de infección de las herida quirúrgica en el grupo C son del 16,3% incluyendo la herida perineal y del 9,6%, sin incluirla. Son datos que están cercanos a los recomendados por el Proyecto de Gestión Clínica de Procesos Asistenciales5. Las complicaciones cardiorrespiratorias han sido menores en el último período, analizado sin alcanzar la significación estadística, reduciéndose a la mitad posiblemente por el uso más racional de la fluidoterapia perioperatoria, que ha disminuido en un 40% el volumen administrado. Finalmente, la estancia global se redujo hasta 11,2 días en el Grupo C, en un rango similar a lo publicado para nuestro país26,27.
En conclusión, según el análisis realizado en determinadas dimensiones de la calidad asistencial, aún estamos lejos de alcanzar el 100% de los estándares publicados, aunque algunos ya pueden considerarse aceptables y se van aproximando a los primeros obtenidos del programa docente y auditado de la Asociación Española de Cirujanos sobre la escisión total del mesorrecto8, que pretende dar un giro nacional a los resultados de este importante proceso. En un período relativamente corto de tiempo han mejorado muchos indicadores de forma significativa y creemos que el estudio remarca la importancia de someter a una crítica constructiva permanente los resultados obtenidos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.