El cistoadenocarcinoma biliar (CACB) es un tumor extraordinariamente infrecuente1–6. Descrito inicialmente por Willes en 1943, solo unos 150 casos han sido publicados en la literatura médica2. Su diagnóstico correcto preoperatorio es difícil, especialmente diferenciarlo de su variante benigna, el cistoadenoma biliar (CAB). Presentamos un caso de CACB y realizamos una breve puesta al día.
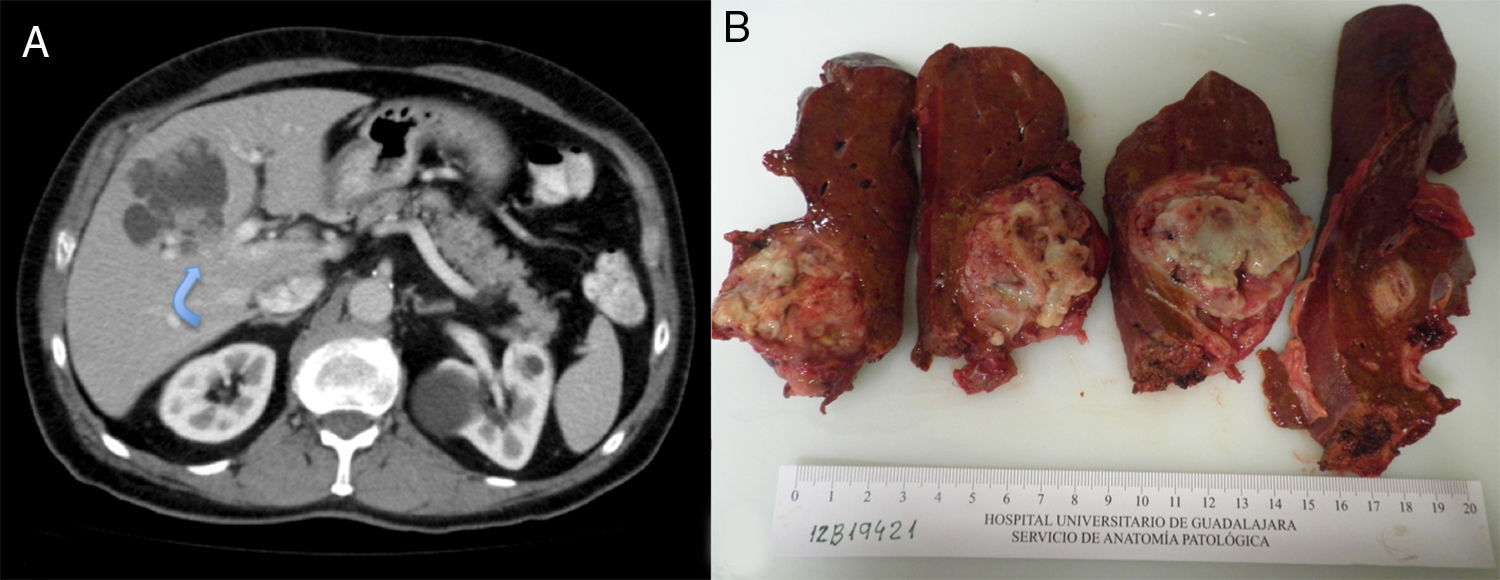
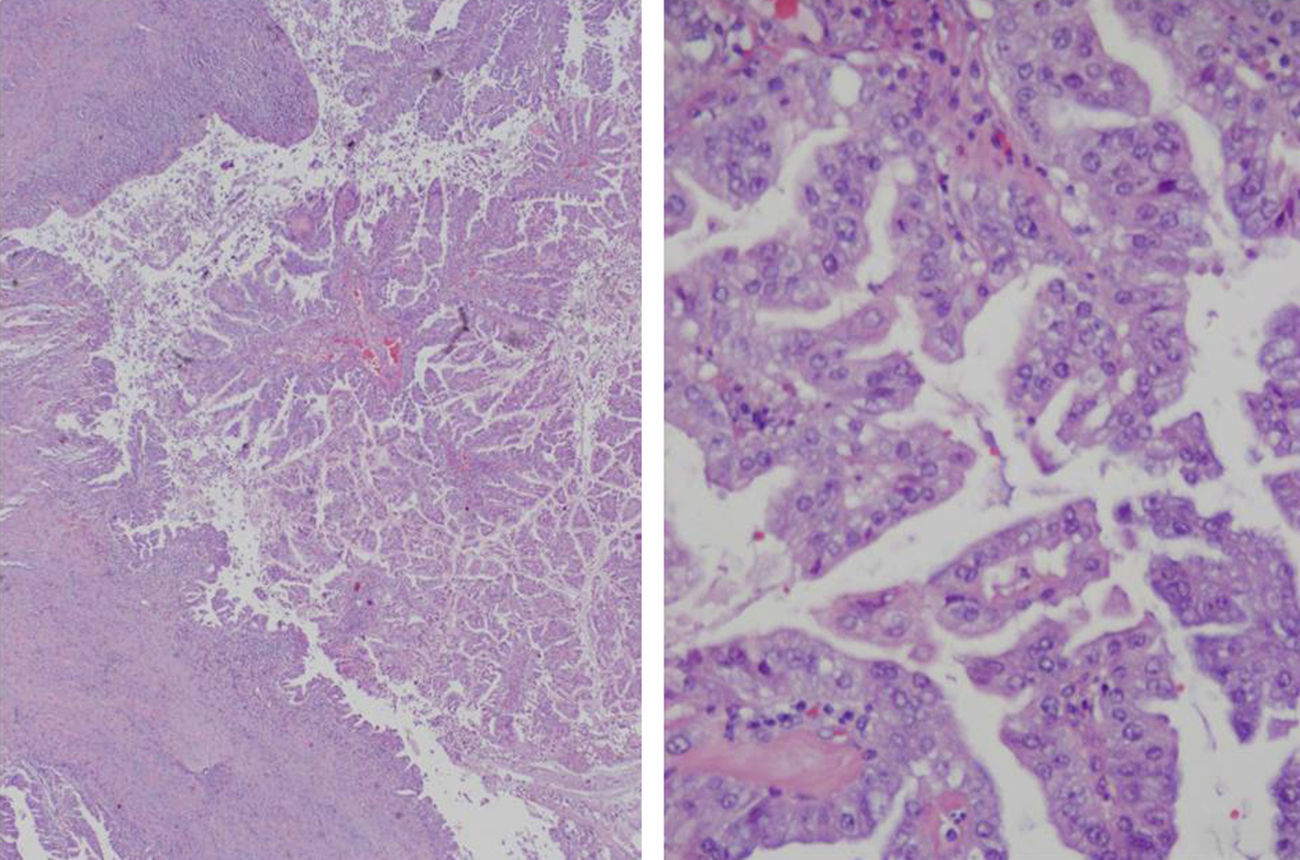
Varón, 75 años, con los siguientes antecedentes médicos: cáncer de próstata (Gleason 6) en tratamiento con radioterapia y hormonoterapia, hipertensión arterial, hipercolesterolemia. Sin antecedentes tóxicos. En la ecografía abdominal de control realizada se observa una lesión quística hepática compleja de contornos lobulados predominantemente anecogénica con refuerzo posterior y, en su interior, múltiples nódulos sólidos. El paciente no presentaba ninguna sintomatología abdominal. Los estudios analíticos fueron normales, exceptuando el CA19-9 (53 UI/l). La serología de hidatidosis fue negativa. La TAC abdominal aprecia una lesión quística de 65×55×45mm, localizada primordialmente en el segmento iv, y parcialmente en el v y viii, con nódulos murales hipercaptantes intraquísticos, leve dilatación de la vía biliar intrahepática por compresión directa y contacto con la vena porta izquierda (fig. 1A). La colangio-RM con gadolinio mostró una lesión quística de contornos lobulados y bordes bien definidos, de 69×57×56mm, que presentaba una intensidad de señal heterogénea, predominantemente hipointensa en T1 e hiperintensa en T2 (áreas quísticas) y, en su interior, varios focos hipointensos en T1 y T2 (nódulos sólidos murales intraquísticos) (fig. 1B). Se practica hepatectomía izquierda extendida a parte de los segmentos v y viii, ya que la infiltración portal izquierda impedía realizar una mesohepatectomía. Durante la sección del parénquima, se comprueba que la lesión infiltra la vía biliar intrahepática derecha en la bifurcación de los sectores anterior y posterior derechos, por lo que se efectúa una resección de la vía biliar y una hepaticoyeyunostomía en Y de Roux. El postoperatorio transcurre sin complicaciones y es dado de alta a los 12 días. Macroscópicamente se trataba de una tumoración quística blanquecina con zonas necróticas de 6,4×5,3cm. El estudio histológico mostró una formación quística con crecimientos papilares intraquísticos e infiltración del parénquima hepático subyacente, grado histológico G1 (> 95% de formación glandular) (fig. 2). No hay invasión perineural o vascular. La neoformación es positiva a CK7 y negativa para CK20. El diagnóstico final fue CACB pT1pN0M0, estadio i (TNM 7.ª ed). Se decidió tratamiento con capecitabina oral y radioterapia. A los 6 meses se encuentra asintomático.
EL CACB es una neoplasia hepática cuya etiología no está aclarada1,2,5–8, no presenta clara predilección por sexo ya que el 25-72% de los CACB ocurren en varones1,2,5,6,8. La edad media es de 60 años (26-82 años)1,2,4–10. Su incidencia es mayor en Asia1,2,4,6–10. No se conoce si el CACB es una evolución desde un CAB previo o es un tumor inicialmente maligno, y se postula que pudieran existir 2 subtipos de CACB: transformación maligna desde un CAB con o sin estroma ovárico, tipo más frecuente en mujeres, y otra variante inicialmente maligna que se origina de la vía biliar intrahepática o de una malformación biliar, más frecuente en varones1–3,6.
El CACB se caracteriza por ser un quiste único, grande, habitualmente multilocular con septos internos y proyecciones papilares o nódulos murales1,5,8. Aunque es infrecuente, puede estar comunicado con la vía biliar o presentar hemorragias intraquísticas2,4,10. La localización del CACB es habitualmente intrahepática1,5. Wang et al. afirman que las lesiones no localizadas en el hígado izquierdo suelen ser benignas1,3. El tamaño del CACB es variable entre 3,5 y 22cm1,2,5,6,8.
El síntoma más habitual del CACB es el dolor abdominal (90-100%)1,2,5. Otros síntomas son: masa palpable, náuseas, plenitud, fiebre y ocasionalmente ictericia o colangitis1,2,5,6. El CA19-9 está elevado en un 60% de los pacientes con CAB y CACB, y no sirve para diferenciar entre ambas entidades1,6,7. El CA19-9 también está elevado en el líquido intraquístico2,6,8. El resto de los marcadores (CEA, CA242, CA50) suelen ser normales1,6.
Los métodos diagnósticos empleados habitualmente en el CACB son la ecografía, la TAC y la RMN1,3,5,10. El PET se ha empleado poco pero parece presentar una elevada sensibilidad. El diagnóstico diferencial del CACB se plantea con: hidatidosis hepática, absceso hepático, metástasis con degeneración quística, tumores papilares intraductales de la vía biliar, complejos de von Meyenburg e, incluso, con el quiste simple2,7,8. Pero la verdadera dificultad diagnóstica es poder distinguir entre el CAB y el CACB, fundamental para la estrategia terapéutica1. La presencia de nódulos murales hipercaptantes en la TAC, las calcificaciones groseras y las proyecciones papilares son sugestivas de CACB2,6–8. Algunos pacientes se diagnostican tras años de seguimiento como CAB, o al fracasar medidas terapéuticas incorrectas como punción o fenestración6. La PAAF tiene un valor diagnóstico limitado, y se corre el riesgo de diseminación a través de la aguja1,3,8,10.
Wang et al. en su serie de 30 casos de CAB y CACB observan que son factores predictivos de CACB: edad > 60 años, sexo masculino y síntomatología de corta evolución (menos de 4 meses), y diseñaron un sistema de puntuación para diferenciar entre ambas lesiones. Aunque clásicamente se había valorado el tamaño como factor predictivo de CACB, no alcanzó significación estadística1.
El tratamiento del CACB es la resección quirúrgica con margen libre1,2,5,6,8. Debido al tamaño de las lesiones, frecuentemente se realizan hepatectomías mayores9. Otros procedimientos terapéuticos (fenestración, esclerosis) deben evitarse2. La enucleación válida para el CAB no debe realizarse en el CACB, por la necesidad de obtener margen libre8.
Los datos sobre supervivencia del CACB son escasos y confusos, y oscilan del 25 al 100% a los 5 años. Parece que existe una relación entre supervivencia, subtipo histológico y sexo del paciente. Así, las mujeres con un CABC que se desarrolla sobre un CAB con estroma mesenquimal parecen presentar mejor pronóstico, y los varones con un tumor inicialmente maligno, un peor pronóstico4,5. La resección radical se relaciona con menor recurrencia y mayor supervivencia1. La positividad a MUC2 se considera un factor pronóstico favorable9. No hay información válida de cuál es el régimen de quimioterapia más aconsejable.