Introducción
Los traumatismos son la principal causa de muerte en las primeras cuatro décadas de la vida. La mortalidad por trauma tiene una distribución trimodal. La primera elevación representa casi el 25% de las muertes, son las ocasionadas en el lugar del accidente y suelen ser consecuencia de lesiones graves en el cerebro, médula espinal, corazón y grandes vasos y poco se puede hacer para salvar la vida de estos enfermos. La segunda elevación representa las muertes tempranas que ocurren dentro de las primeras horas de ocurrido el accidente y éstas sí se pueden reducir si se trata correctamente al enfermo politraumatizado desde su inicio, suponen el 50% de las muertes. La tercera elevación corresponde a las muertes tardías y tiene lugar días o semanas después del accidente y su causa principal es el fallo multisistémico y sepsis.
En los traumatismos abdominales graves existen muchas razones que condicionan la aparición de complicaciones durante todas sus fases, valoración inicial, tratamiento o seguimiento. Diagnosticar y tratar adecuadamente las complicaciones que aparezcan durante la segunda y tercera elevación de la mortalidad repercutirá en su reducción.
Etiología de las complicaciones en los traumatismos abdominales
Las complicaciones pueden estar originadas en primer lugar por la agresión del propio traumatismo abdominal que condiciona alteraciones sistémicas, pero además, el shock hemorrágico, las transfusiones masivas y la contaminación peritoneal difusa con heces u orina provocan una serie de efectos perjudiciales que pueden ser causa de mortalidad y de complicaciones en el quirófano o durante el postoperatorio inmediato en la UCI.
En segundo lugar, somos también los médicos que atendemos a los enfermos politraumatizados los que provocamos las complicaciones debido a una exploración insuficiente, toma de decisiones erróneas, técnicas imperfectas o cuidados postoperatorios inadecuados. La incidencia de complicaciones después de un traumatismo abdominal se pueden disminuir si:
Realizamos una valoración inicial protocolizada con una reanimación eficaz.
Se ingresa y se mantiene una vigilancia a todo enfermo politraumatizado durante un mínimo de 24 h.
Se emplean los métodos diagnósticos y terapéuticos estableciendo prioridades.
Ante la duda diagnóstica no se escatiman los diferentes métodos diagnósticos por agresivos que sean.
Se efectúa una operación adecuada en la técnica y en el tiempo de intervención, con exploración meticulosa de todos los órganos y vísceras. Las laparotomías innecesarias conllevan una morbilidad asociada1, pero dejar sin diagnosticar y tratar una lesión de víscera hueca tiene consecuencias todavía mayores.
La exploración insuficiente o la toma de decisiones errónea provoca un retraso diagnóstico y estas lesiones olvidadas elevan la morbimortalidad y la estancia hospitalaria, y puede ser origen de problemas legales2. En el estudio de Hirshberg la mortalidad de estos enfermos fue del 26%. Este estudio divide las lesiones olvidadas en tres tipos:
Tipo I: lesiones olvidadas durante el examen inicial. Por ejemplo, una lesión cervical olvidada en un enfermo con traumatismo abdominal.
Tipo II: la lesión se olvida por una evaluación diagnóstica mal interpretada o durante la exploración quirúrgica. Es la causa más frecuente.
Tipo III: es la menos frecuente y es consecuencia del olvido de una lesión por parte del cirujano por realizar una intervención muy rápida para salvar la vida del enfermo. Puede ser frecuente en la cirugía del control de daños. Esto realmente no es un error en el tratamiento.
La laparotomía después de un traumatismo abdominal requiere una sistemática en la exploración completa de la cavidad abdominal. Después de diagnosticar y tratar las lesiones se debe realizar una última exploración sistemática para evitar el peligro de dejar una lesión inadvertida. Es necesario explorar la unión gastroesofágica y la pared posterior del estómago, lo que requerirá la apertura del ligamento gastrocólico. La rotura diafragmática también puede pasar inadvertida. Las lesiones del árbol biliar extrahepático se deben diagnosticar mediante exploración cuidadosa del hilio hepático. La maniobra de Kocher completa permitirá visualizar las perforaciones duodenales. La prevención de una lesión pancreática requiere la exploración completa de este órgano a través de la transcavidad. La lesión del conducto pancreático principal en ocasiones es difícil de diagnosticar. La lesión inadvertida de colon o recto suele tener consecuencias catastróficas; para evitarlo hay que realizar una movilización completa del colon para valorar adecuadamente su porción retroperitoneal. Las lesiones ureterales también pueden olvidarse si no se valora bien el trayecto de una lesión penetrante.
En los pacientes con lesiones múltiples las complicaciones abdominales pueden ser difíciles de diagnosticar. El dolor abdominal, la fiebre, la leucocitosis o la distensión abdominal pueden ser secundarias a una complicación abdominal o extraabdominal. También la disfunción de otros sistemas puede ser debida a una complicación abdominal o no. Serán, en definitiva, la TC y la experiencia del cirujano los que determinarán la necesidad o no de una intervención quirúrgica.
Tipos de complicaciones
Las complicaciones de los traumatismos abdominales podemos dividirlas en dos grandes grupos: las que afectan de forma general a todo el organismo, que finalizan en el llamado fracaso multiorgánico (FMO), y las que afectan exclusivamente al abdomen, aunque también puedan repercutir sobre otros órganos o sistemas.
Complicaciones generales
Las complicaciones generales están en relación con la respuesta del organismo a la agresión, y pueden producirse alteraciones metabólicas, endocrinas e inmunológicas.
Las alteraciones hormonales más importantes son un aumento de las catecolaminas, más acusado de noradrenalina que, además de sus efectos vasomotor y cardíaco, tienen una acción glucogenolítica, antiinsulínica y lipolítica. También se produce aumento de la ACTH, hormona del crecimiento que contribuyen igualmente a la obtención de energía. Por otro lado, para conservar agua y sal existe una disminución transitoria de la capacidad de concentración renal y un déficit de reabsorción tubular, lo que produce cambios importantes en la regulación secretora de la aldosterona y la ADH.
Se producen cambios inmunológicos tras los traumatismos tanto en los sistemas de inmunidad específica como de inflamación no específica, cuyas consecuencias se correlacionan directamente con la aparición de sepsis. Se producen alteraciones de los neutrófilos reduciéndose la quimiotaxis, y alterándose la actividad bacteriana intracelular. También se producen alteraciones del complemento con disminución de los valores de C3 y properdina3, del sistema reticuloendotelial con disminución de la alfa-2-glucoproteína y la fibronectina4 y de la función macrófago/monocito. Existe una respuesta inmunológica específica con disminución de los linfocitos T, sobre todo CD4, así como de interleucina 2.
Como consecuencia de la respuesta del organismo a la agresión, se producen alteraciones en la coagulación, respiratorias, renales y cardiovasculares que desembocan, finalmente, en complicaciones sépticas y en el denominado FMO.
Fracaso multiorgánico
Se ha aplicado el término de síndrome de disfunción orgánica múltiple a los que manifiestan disfunción de varios sistemas orgánicos a causa de los diversos tipos de lesión (hipoxia, traumatismo, etc.) o de manera indirecta a los efectos de la sepsis. En los traumatismos abdominales se suman los efectos de ser un traumatismo grave más la posible sepsis secundaria a una complicación intraabdominal.
Hasta principios de 1980 se consideraba que el FMO era la consecuencia de una infección con sepsis generalizada, y que la tasa de infecciones podría reducirse con la administración profiláctica de antibióticos. Esta teoría consideraba también que en la mayor parte de los casos el origen de la infección era un absceso abdominal, y por consiguiente, se debía practicar una laparotomía en todos estos enfermos. Sin embargo, en 1985 Morton5 demuestra que el drenaje de los abscesos abdominales no revertía el FMO. Posteriores estudios demostraron que la infección podía ser causa del FMO, pero que también podía existir FMO sin infección6.
En los pacientes con traumatismo abdominal grave lo que se produce es una hiperinflamación general temprana que se conoce con las siglas SIRS del término síndrome de reacción inflamatoria generalizada. Esta reacción en principio es beneficiosa y muchos pacientes la superan tras la reanimación inicial. Sin embargo, otros pueden terminar desarrollando un FMO, con o sin infección.
Varios factores patogénicos se han propuesto para explicar el FMO, el consumo no reconocido de oxígeno dependiente del flujo7, la isquemia tisular y la reperfusión8, la lesión del intestino delgado9, o la adherencia entre leucocitos polimorfonucleares y células endoteliales10.
La hiperactividad como respuesta a un agresión se basa, sobre todo, en tres hipótesis:
Hipótesis de los mediadores.
Isquemia-reperfusión.
Intestino.
Cada una de estas hipótesis parece tener un papel en la iniciación y perpetuación del FMO. Cada una puede contribuir por algún camino a la pérdida de la función de la barrera intestinal.
Según se ha ido profundizando en el estudio de los mediadores, la atención se ha centrado en las citocinas, de influencia decisiva en todos los mecanismos de respuesta inmunitaria e inflamatoria. Diversos estudios experimentales han confirmado que la producción de TNF alfa, interleucina 1 y otra citocinas por parte de macrófagos y otras células de la serie blanca del huésped en respuesta a endotoxina (lipopolisacárido [LPS]) es responsable del síndrome de alto gasto, hipertriglicemia, fiebre, vasodilatación, disfunción cardíaca, insuficiencia renal y otras secuelas letales de la infección, habiéndose encontrado correlación entre algunas citocinas o sus derivados (óxido nítrico, fosfolipasa A) y el pronóstico de los pacientes sépticos, politraumatizados o sometidos a cirugía mayor. Una producción aumentada de citocinas contribuye al síndrome de distrés respiratorio del adulto (SDRA). Es tanta la importancia fisiopatológica de los mediadores, que el FMO se ha llegado a denominar "enfermedad de los mediadores".
En realidad las citocinas representan mecanismos de defensa contra la infección, como puede ser el aumento de la fagocitosis de células infectadas, mediante un efecto citotóxico, pero su acción puede llevar a convertirlas en perjudiciales, siendo finalmente las responsables bioquímicas del síndrome de FMO.
Se ha puesto especial atención en el TNF alfa, IL1 e IL6 porque su liberación se ha relacionado de una manera muy estrecha con la morbilidad y la mortalidad, aunque se produce también descarga de estas citocinas también en las infecciones por microorganismos grampositivos y hongos.
Las citocinas pueden modificar directamente las células diana o bien pueden inducir la producción de mediadores secundarios tales como otras citocinas, metabolitos del ácido araquidónico, nucleótidos cíclicos o radicales libres de oxígeno.
El factor de necrosis tumoral (TNF alfa), o caquectina, reproduce los efectos fisiopatológicos cuando se administra exógenamente. Se produce en los macrófagos, sobre todo en el pulmón y el peritoneo, aunque también se ha demostrado su origen en los monocitos. En condiciones normales no se produce TNF alfa ni existen células de almacenamiento. Su producción es inducida por el macrófago mediante la estimulación por los LPS de la síntesis de ARNm específico. En estudios experimentales se han demostrado cuatro receptores distintos. Su mayor cuantía se encuentra en el hígado, riñón, pulmón y bazo. La administración experimental de TNF alfa produce los efectos sistémicos que se observan en el shock séptico. El TNF alfa induce la síntesis de IL1 e IL6, pero es el estímulo inicial durante el síndrome séptico.
Los pacientes están con frecuencia inmunodeprimidos y reciben múltiples antibióticos de amplio espectro que transforma la flora normal gastrointestinal. Los antiácidos anti-H2 pueden contribuir a la colonización bacteriana del estómago y de las vías aéreas superiores, lo que aumenta el riesgo de neumonía. El íleo contribuye a la estasis intestinal que incrementa la translocación bacteriana. La nutrición parenteral y la enteral hiperosmolar cambian la ecología normal de la flora bacteriana y empeoran los mecanismos de defensa del intestino. Los períodos de hipotensión y la administración de sustancias vasoactivas disminuyen la perfusión esplácnica, producen isquemia en la mucosa y atraviesan la barrera intestinal. La hipoalbuminemia favorece el edema intestinal empeorando el peristaltismo y aumenta la permeabilidad. Finalmente, el fallo hepático puede disminuir el aclaramiento de las endotoxinas y favorecer el estado séptico. Todos estos factores observados en el paciente muy enfermo pueden contribuir a la disfunción de la barrera intestinal.
Se han desarrollado diferentes sistemas para determinar la probabilidad de muerte tras el FMO11,12 y la magnitud de la respuesta inflamatoria13, lo que ha permitido poder comparar los resultados entre los diferentes grupos.
El principal sistema que se deteriora durante el FMO es el respiratorio. El pulmón es el órgano que suele fallar primero. Existen varias razones para que el pulmón sea el órgano afectando predominantemente. En primer lugar, el aparato respiratorio se afecta también en muchas ocasiones por el traumatismo. La segunda explicación es la teoría del primer filtro, es decir, el sistema capilar pulmonar recibe toxinas, células sanguíneas activadas y citocinas que alteran la permeabilidad capilar de los pulmones y desarrollan edema intersticial. Cambios en la permeabilidad capilar y extravasación de albúmina se han descrito 48 h después del trauma14. El predominio del papel del pulmón se explica también por la sensibilidad de este órgano a estos cambios y sus reducidos mecanismos de compensación15.
El segundo sistema que falla con más frecuencia es el hígado, pero se asocia con menos mortalidad que el sistema respiratorio o el cardiovascular.
El fallo del aparato cardiovascular se asocia de forma importante con la mortalidad.
El riñón se afecta menos veces después de un traumatismo debido a los tratamientos actuales. El mecanismo inicial del fallo es la isquemia, que disminuye el aclaramiento de creatinina y produce alteraciones en la integridad capilar; posteriormente se produce edema intersticial y fallo en las funciones de excreción y reabsorción.
La mortalidad aumenta con el número de órganos que fallan. Algunos autores publican un 100% de mortalidad con tres órganos afectados16.
Los factores de riesgo más importantes para desarrollar FMO después de un traumatismo son la edad, la gravedad, el tipo y la localización del traumatismo. En los traumatismo torácicos, abdominales y pélvicos la probabilidad de FMO es más alta debido a la elevada incidencia de hemorragia masiva.
Complicaciones abdominales
Hemorragia postoperatoria. Es la complicación más frecuente durante las primeras 24 h después de un traumatismo abdominal, siendo normalmente las vísceras macizas el origen de la hemorragia, sobre todo el hígado. Clínicamente se caracteriza por hipotensión, taquicardia, distensión abdominal o salida de sangre por los drenajes y disminución de la hemoglobina en sangre.
La causa puede ser una hemostasia quirúrgica incompleta durante la primera intervención, es decir, una cirugía inadecuada, o una coagulopatía secundaria a la pérdida masiva de sangre y la politransfusión. En el primer caso, la solución es la reintervención, mientras que en el segundo es necesario corregir los trastornos de la coagulación mediante plasma congelado fresco, plaquetas y en ocasiones una nueva intervención de control de daños, practicándose pacaje con compresas.
Hay que tener en cuenta que la tasa de mortalidad de los traumatismos graves abdominales continúa siendo elevada, provocando muchas muertes intraoperatorias14. Los mayores esfuerzos en la reanimación y el procedimiento quirúrgico pueden producir una cascada mortal de acontecimientos que constituyen la llamada "cascada de la muerte": acidosis metabólica, hipotermia y coagulopatía.
La cirugía del control de daños intenta interrumpir la cascada mortal de acontecimientos. Si el enfermo tiene acidosis metabólica (pH de 7,25 o inferior), hipotermia (34 ºC o menos) y coagulopatía probablemente ya sea tarde, por ello es importante la experiencia del cirujano para decidir en qué enfermos se debe emplear esta técnica. En general, se debe utilizar esta técnica si es imposible obtener una hemostasia en un tiempo prudencial o existe un edema visceral importante.
La técnica del control de daños consta de tres fases. En una primera fase hay que realizar una intervención quirúrgica rápida que consiste en el control rápido de la hemorragia (taponamiento) y de la contaminación (ligaduras, grapas o suturas continuas simples) por las técnicas más simples. La segunda fase consiste en la reanimación en la unidad de cuidados intensivos para mejorar o corregir la coagulopatía, la hipotermia y los trastornos metabólicos. La tercera fase consiste en la reoperación para eliminar el taponamiento y el cierre definitivo para restaurar la continuidad del tubo digestivo.
Este tipo de cirugía se realiza fundamentalmente en lesiones graves hepáticas o hemorragia retroperitoneal a consecuencia de la fractura de pelvis. En el caso de los traumatismos hepáticos son importantes dos detalles:
Evitar seccionar los ligamentos hepáticos para conseguir una mejor compresión.
Las compresas se deben retirar una vez corregida la coagulopatía, acidosis e hipotermia y, en general, no debe sobrepasar las 24-36 h, si queremos evitar los problemas sépticos y el FMO.
Las embolizaciones selectivas pueden ayudar en casos seleccionados, sobre todo si se decide realizar un tratamiento conservador no quirúrgico.
Complicaciones de la herida: infección, fascitis necrosante y dehiscencia de la herida
La hemorragia (transfusión por encima de 8 unidades) con hipotensión, unida a la posible existencia de tejidos desvitalizados, la contaminación por perforaciones intestinales o de intestino grueso en pacientes no preparados y las intervenciones quirúrgicas prolongadas contribuyen a la infección de la herida después de un traumatismo abdominal. Por este motivo se recomienda evitar el cierre primario y efectuar un tratamiento antibiótico adecuado en todos los pacientes con traumatismo abdominal que tengan alguno de estos factores predisponentes y en todos los traumatismos abiertos y muy especialmente en los producidos por asta de toro. El cierre definitivo de la herida se puede realizar a partir del cuarto día si el paciente evoluciona favorablemente y la herida no tiene signos de infección.
La fascitis necrosante es consecuencia de una herida infectada que no ha sido tratada adecuadamente. Esta complicación casi siempre origina dehiscencia de la herida y evisceración. Se origina una necrosis de la aponeurosis. El tratamiento es la apertura de la herida y el desbridamiento amplio de toda la aponeurosis y el tejido muscular.
Síndrome del compartimiento abdominal
El concepto de que el aumento de la presión intraabdominal (PIA) puede deteriorar otros órganos y producir el conocido síndrome del compartimiento abdominal (SCA) es relativamente reciente.
El SCA tiene una gran importancia en la práctica quirúrgica y en el cuidado postoperatorio de los enfermos politraumatizados porque los efectos de mantener una presión elevada en el compartimiento abdominal repercutirán sobre otros órganos y sistemas.
Se considera SCA cuando la presión intraabdominal está por encima de 20 mmHg.
El SCA es más frecuente en los traumatizados en los que se ha realizado una cirugía de control de daños con pacaje para el control de la hemorragia. El traumatismo hepático es la principal fuente de hemorragia.
La mortalidad puede acercarse al 50% en muchos estudios17.
Medida de la presión intraabdominal. La medida normal de PIA es cero o menos. La PIA se puede medir directamente introduciendo un catéter en la cavidad abdominal y conectándolo a un manómetro o traductor. Los insufladores utilizados en cirugía laparoscópica miden automáticamente la PIA. Esta medida directa no es posible en la práctica por lo que se han usado otros métodos de estimación indirectos. Estos métodos alternativos son la medición de la presión en estómago, vena cava inferior, recto y vejiga.
El más utilizado es la medición en vejiga urinaria. La técnica fue descrita por primera vez por Kron18. Se introduce una sonda de Foley de tres vías y una vez vaciada la vejiga se introducen 50-100 ml de suero salino estéril y se pinza la sonda. Por otra de las vías se conecta a un manómetro o traductor de presión. Debido a su buena correlación con la PIA y que la técnica es poco invasiva se ha convertido en el método de elección para el diagnóstico de aumento de la PIA. Una vejiga neurógena, o pequeña, la existencia de adherencias intraabdominales, o la presencia de una PIA elevada de forma crónica por obesidad, ascitis o embarazo pueden originar presiones que no se correlacionen con la PIA verdadera19.
Etiología. Las causas que pueden originar aumento de la PIC quedan reflejadas en la tabla 1. Las formas agudas se deben separar de las formas crónicas porque el incremento de la presión es lento y progresivo. En el caso de los traumatismos abdominales graves, el aumento de la PIA está motivado por el edema importante que sigue a la resucitación con líquidos abundantes para mantener al enfermo con una hemodinámica estable, hematomas retroperitoneales o intraabdominales, y a los pacajes abdominales20.
En un enfermo politraumatizado los acontecimientos se inician en la sala de atención inicial en el servicio de urgencias. En este lugar el paciente recibe una gran cantidad de volumen de fluidos para su resucitación y poder mantener su presión arterial. Como consecuencia de ello se produce un edema en las vísceras abdominales y el espacio retroperitoneal. El edema se agrava por el shock, lo que produce isquemia visceral y edema tras la reperfusión, así como disminución del flujo del territorio mesentérico como consecuencia de la manipulación quirúrgica o de los pacajes abdominales. La pared abdominal se cierra a mucha tensión. Después de la operación se precisará ventilación controlada con presión positiva para mantener una oxigenación adecuada, lo que también aumentará la PIA17.
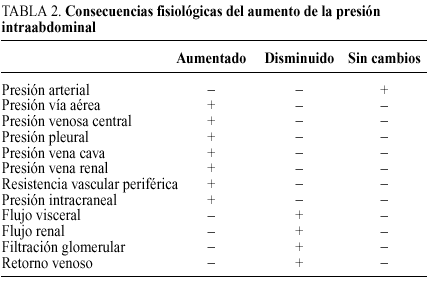
Consideraciones fisiológicas. Las principales consecuencias fisiológicas de la presión intraabdominal quedan reflejadas en la tabla 2.
Desde el punto de vista cardiovascular se produce una disminución del gasto cardíaco, sobre todo si la presión es superior a 20 mmHg, un aumento de las resistencias vasculares periféricas y una disminución del retorno venoso por la compresión de las venas cava y porta y el aumento de la presión intratorácica. El flujo hepático está disminuido afectándose toda la vascularización hepática21. En el abdomen el aumento de presión puede producir también isquemia intestinal y se ha descrito que contribuye a empeorar la sepsis, el FMO, la necesidad de reoperación y la mortalidad22. Además, la presión intraabdominal aumentada se transmite a todas las venas abdominales y retroperitoneales y al tejido linfático aumentando su presión. En el riñón una presión de 15 a 20 mmHg produce oliguria como consecuencia de la disminución del flujo renal, la filtración glomerular y alteraciones en la función tubular. Los diafragmas se elevan, por lo que disminuye el volumen torácico y se eleva la resistencia vascular pulmonar, aumentando la presión en la vía aérea y precisando ventilación con presión positiva para oxigenar adecuadamente al enfermo23. El resultado final es una hipoxia e hipercapnia a lo que puede contribuir también la asociación de un traumatismo torácico. En la pared abdominal se produce una reducción del flujo sanguíneo, las fascias y el músculo están isquémicos, lo que contribuye a las complicaciones infecciosas locales (deshiscencia y fascitis necrosante). También se eleva la presión intracraneal y reduce la perfusión cerebral, lo que puede ser importante en caso de que exista traumatismo craneoencefálico asociado.
Clínica. Kron fue el primero en correlacionar el aumento de la PIA (superior a 25 mmHg) con la oliguria que revertía con la descompresión18. La clínica del SCA consiste en la necesidad de incrementar la presión ventilatoria, aumento de la presión venosa central y disminución de la diuresis, asociado a distensión abdominal. La disfunción cardiocirculatoria, respiratoria y renal son difíciles de controlar si no se reduce la PIA. La descompresión abdominal revierte todos los efectos adversos del aumento de la PIA y produce hipotensión debido a la dilatación de los vasos periféricos. La hipótesis de que la descompresión puede conducir a una lesión por reperfusión al liberarse los metabolitos de las vísceras isquémicas reperfundidas no es aceptada por todos los autores24.
Tratamiento. El paciente de riesgo para cerrar el abdomen y desarrollar un SCA después de un traumatismo es el que ha presentado un estado de shock profundo que ha obligado a la reposición de grandes cantidades de volumen durante su resucitación, ha precisado una cirugía de control de daños con pacaje para resolver las hemorragias durante el acto quirúrgico y después de acabada la cirugía se comprueba un edema importante de todas las vísceras y del retroperitoneo. En estos enfermos el cierre primario de la fascia a veces no es posible o se consigue con desgarros sucesivos de la misma. Existen diferentes alternativas para cerrar a estos enfermos como la bolsa de Bogota, cierre sólo de la piel con clips, colocación de mallas (contraindicadas si existe contaminación o infección) o simplemente aplicar un plástico estéril sobre los dos lados de la piel, lo que permitirá observar la cavidad peritoneal sin lesionar la fascia. Todas estas técnicas de cierre lo que pretenden es prevenir el SCA. El cierre de la piel también puede producir aumento de la PIA, por ello la máxima reducción de la presión se obtiene no cerrando nada, ni la fascia ni la piel. La desventaja de estas técnicas es que el paciente está eviscerado con la consiguiente pérdida de líquidos y aumento del número de fístulas intestinales al dejar las vísceras abdominales expuestas y sin protección.
Se recomienda la reexploración si la presión está por encima de 20-25 mmHg con deterioro cardiovascular, pulmonar o renal19. Si la hipertensión intracraneal no responde a las medidas habituales también se recomienda la descompresión abdominal si ésta sobrepasa los 15-20 mmHg. Algunos autores han demostrado consecuencias catastróficas si se reduce la PIA de forma rápida23.
Antes de realizar el cierre definitivo del abdomen se recomienda la corrección de los trastornos de coagulación, la acidosis y la hipotermia. Éstos suelen ocurrir a los 3 o 4 días del traumatismo cuando se ha restaurado la diuresis y se ha realizado un correcto balance negativo que provoca una disminución del edema visceral y parietal. Normalmente, se recomienda el cierre de la facia durante la hospitalización inicial del enfermo21. En otros pacientes no es posible y se recomienda el cierre definitivo pasados 6 o 12 meses
Peritonitis y abscesos
Las peritonitis y los abscesos abdominales después de un traumatismo pueden ser consecuencia de un retraso diagnóstico de una perforación de víscera hueca, una mala exploración quirúrgica que pasa por alto una lesión, una mala técnica quirúrgica que deja mal drenada una secreción pancreática o biliar, las malas condiciones del enfermo por su enfermedad asociada o la presencia de lesiones múltiples que requieren transfusiones masivas y tiempos de intervención prolongados que provocan una dehiscencia en una anastomosis intestinal. Para prevenir la formación de abscesos también es importante no dejar sangre acumulada en la cavidad peritoneal, eliminar los tejidos necróticos, drenar adecuadamente las secreciones para evitar su acumulación y realizar un lavado exhaustivo de la cavidad abdominal.
La clínica aparece a partir del cuarto o quinto día de la intervención quirúrgica y consiste en fiebre, taquicardia, hiperventilación y leucocitosis. A la exploración se aprecia un abdomen distendido y doloroso.
Los abscesos se localizan en el hemiabdomen superior si el origen es el hígado, el páncreas o el bazo y en la pelvis si es el recto o colon sigmoide. En el diagnóstico son de gran utilidad, además de la clínica, la TC y la ecografía abdominal. Por este motivo todo paciente que durante el postoperatorio presente dudas de patología abdominal no resuelta, o fiebre de origen no explicable, se debe realizar una TC con contraste intravenoso y oral.
El tratamiento de los abscesos localizados es el drenaje percutáneo guiado por TC o ecografía y la inserción de una sonda de drenaje. Para las peritonitis difusas es imprescindible el tratamiento quirúrgico con lavado de la cavidad y drenaje de las colecciones.
Obstrucción intestinal
Suelen aparecer después de la primera semana. Se caracteriza clínicamente por la intolerancia a la alimentación oral, la distensión abdominal y la falta de emisión de heces y gases. El diagnóstico diferencial se debe realizar entre la obstrucción mecánica y el íleo adinámico. La causa puede ser una hernia interna por rotura de mesos que no haya sido correctamente tratada durante la primera intervención o bridas postoperatorias.
Colecistitis alitiásica
La colecistitis alitiásica se puede producir en todos los pacientes graves, sobre todo si están con respiración mecánica y nutrición parenteral. El diagnóstico de la enfermedad es difícil pero se debe establecer después de excluir otras causas de infección o deterioro del paciente. La fiebre, dolor en hipocondrio derecho y leve ictericia son los datos clínicos más característicos. La ecografía abdominal realizada en la misma sala de cuidados intensivos debe establecer el diagnóstico. Las opciones terapéuticas empleadas son la colecistectomía (abierta o laparoscópica), o la colecistostomía percutánea.
Correspondencia: Dr. J.M. Jover Navalón. Pinar de Doña Consuelo, 81. Urbanización "Huerta Vieja". 28220 Majadahonda. Madrid.