Introducción
En algunas ocasiones, y de forma preventiva de acuerdo con algunos autores1, el abdomen, después de un gran traumatismo, una obstrucción intestinal y/o una peritonitis no debe de ser herméticamente cerrado y el cirujano debe poner en práctica métodos de "cierre temporal". Con ello se evita la aparición de cuadros de síndrome compartimental abdominal. Este síndrome, caracterizado por un aumento no controlado y agudo de la presión intraabdominal, puede conducir a una disfunción orgánica que puede agravarse e incluso terminar con la vida del paciente.
Estos métodos de cierre temporal pueden plantear problemas al cirujano, ya que puede optar entre técnicas diversas. Una de ellas es el empleo de biomateriales.
Ante situaciones de hipertensión intraabdominal se producen alteraciones del flujo sanguíneo de la pared abdominal. Así, Diebel et al2, en un trabajo experimental realizado en cerdos demostraron que la elevación progresiva de la presión intraabdominal hasta 40 mmHg podía provocar disminuciones importantes del flujo sanguíneo en los vasos epigástricos. Ello explicaría la facilidad que tienen los pacientes con presión intraabdominal elevada para presentar dehiscencias, aumento del riesgo de infección y necrosis después del cierre a tensión de estas laparotomías.
Se han propuesto múltiples alternativas para el cierre temporal del abdomen. Una de ellas es el empleo de biomateriales. El polipropileno ha sido uno de los inicialmente utilizados. Este biomaterial tiene la importante ventaja de que puede ser utilizado en presencia de sepsis. Sin embargo, su comportamiento en la interfaz peritoneal no es el adecuado. Tras su empleo se ha descrito el desarrollo de fístulas intestinales hasta en un 33% de los casos3. Nuestro grupo4 ha estudiado este biomaterial en la interfaz peritoneal y su resistencia biomecánica tras la apertura y resutura frente a otros biomateriales5. En ambos estudios hemos podido comprobar la intensa formación adherencial generada tras su implante en contacto con las asas intestinales, así como la óptima resistencia biomecánica tras la apertura y posterior resutura. Esta última propiedad es importante, ya que en muchos casos de cierre temporal es necesaria la relaparotomía con el fin de reexplorar la cavidad peritoneal, sobre todo en casos de sepsis. Para este fin, se han empleado sistemas de cremalleras ubicadas en prótesis de polipropileno para facilitar estas reexploraciones6.
Con el fin de obtener una mejora en el comportamiento del polipropileno en la interfaz peritoneal hemos llevado a cabo un estudio experimental en el que hemos comparado el comportamiento de una prótesis compuesta de diseño propio (PL-PU99) y otra prótesis de tipo laminar derivada de submucosa porcina, Surgisis® (SIS). En la primera prótesis, además de polipropileno, se incluye una lámina de poliuretano, que es la que queda en contacto con las asas intestinales y que será la encargada de conseguir una óptima respuesta del peritoneo a través de una correcta mesotelización. La segunda prótesis, al ser de tipo laminar, creemos, tal como hemos podido demostrar en trabajos previos7, que generará un depósito mesotelial correcto. Este hecho es importante para evitar la formación de adherencias y la aparición de fístulas.
Por todo ello, el propósito de este trabajo ha sido evaluar de una forma experimental la validez de estos biomateriales para ser empleados en el cierre temporal abdominal.
Material y método
Animal de experimentación
Se emplearon 24 conejos blancos Nueva Zelanda, machos, de un peso aproximado de 2.000-2.500 g. Los animales fueron estabulados en condiciones de luz y temperatura constantes durante todo el tiempo del estudio (Normativa de la CEE 2871-22A9).
Material protésico
Las prótesis empleadas para los implantes han sido: a) una prótesis compuesta (PL-PU99) diseñada por nuestro grupo y formada por 3 componentes: una prótesis reticular de polipropileno (Marlex®, Bard, Inc. Murray Hill, New Jersey, Estados Unidos) de 1 mm de poro; una lámina de poliuretano de 26 µ de espesor, y un pegamento acrílico (cianoacrilato) como agente de unión entre los 2 biomateriales anteriores (OpSite®, Smith & Nephew Medical Limited, Hull HU3 2BN, Inglaterra), y b) una prótesis laminar derivada de submucosa porcina (SIS) absorbible a medio-largo plazo.
Técnica quirúrgica
Los animales fueron anestesiados con una mezcla de clorhidrato de ketamina (Ketolar®, Parke-Davis, Spain) (70 mg/kg), diazepam (Valium®, Roche, España), (1,5 mg/kg) y clorpromazina (Largactil®, Rhone-Poulenc, España) (1,5 mg/kg) administrada por vía intramuscular. En algunos casos se aplicó una dosis adicional del agente anestésico, administrada directamente en la cavidad abdominal durante el transcurso de la intervención.
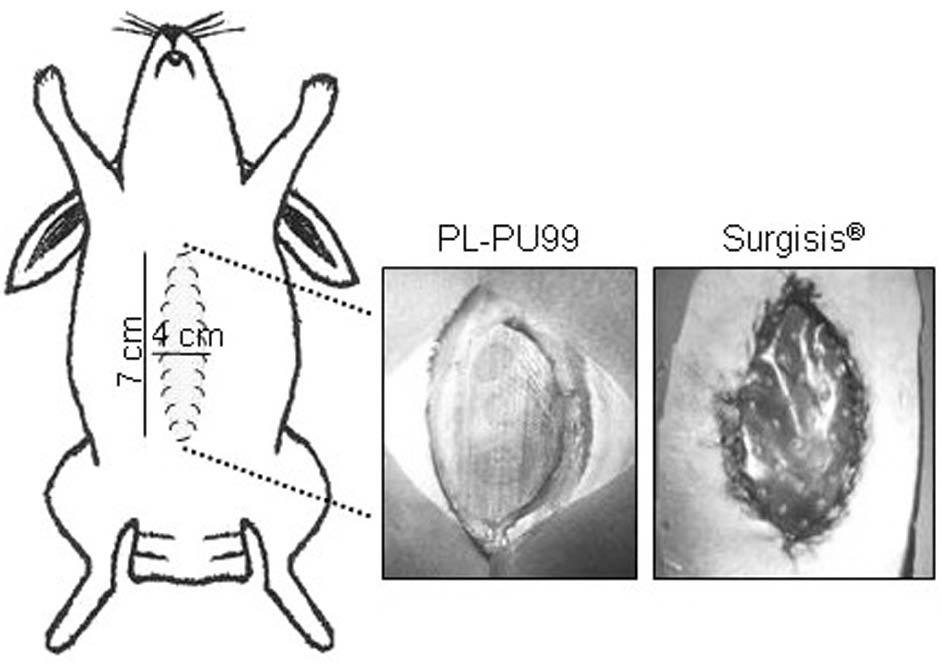
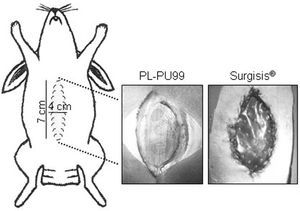
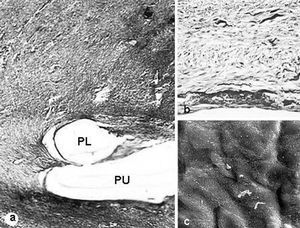
Mediante una técnica quirúrgica estéril se practicó a los animales una laparotomía media de unos 7 cm de longitud en la pared anterior del abdomen. Se colocó un fragmento del biomaterial en forma de huso (de 4 cm de anchura máxima en su porción medial y también de 7 cm de largo) en los bordes peritoneo-músculo-fasciales de la apertura. El anclaje se realizó con 2 suturas continuas de polipropileno 4/0 (Surgilene®, Tyco, España) interrumpidas sólo en los vértices superior e inferior del implante. A continuación, la piel fue suturada con hilo de polipropileno 3/0 (Surgilene®, Tyco, España) a los bordes de la prótesis, la cual quedaba en contacto con el exterior (fig. 1). Como mecanismo protector de las heridas se diseñaron unos apósitos que fueron fijados en una zona periférica del abdomen con grapas metálicas. Se realizó profilaxis antibiótica con una cefalosporina de primera generación.
Fig. 1. Representación esquemática del defecto realizado en la cavidad abdominal y aspecto de la prótesis de PL-PU99 y SIS una vez implantadas.
Diseño experimental
Se establecieron 2 grupos de estudio en función de la prótesis empleada: grupo I (n = 12) con implantes de PL-PU99 y grupo II (n = 12) con implantes de SIS. Los animales fueron sacrificados a los 14 días postimplante con el objeto de estudiar la integración y la formación neoperitoneal del implante.
Técnicas de estudio
Macroscópicamente se comprobó la presencia de infección y/o rechazo, y la formación de adherencias entre la prótesis y las asas intestinales.
Las adherencias fueron clasificadas en función de su consistencia en: a) laxas, de aspecto transparente y de fácil sección; b) firmes, de aspecto blanquecino y más difíciles a la sección, y c) integradas, en la interfaz prótesis/peritoneo visceral, con difícil plano de disección entre el biomaterial y la serosa intestinal.
La extensión y superficie de ocupación de las adherencias en las prótesis fueron evaluadas de acuerdo con un diseño previo de nuestro grupo de investigación8. Para ello se crearon unas plantillas de polietileno de las mismas dimensiones que las prótesis implantadas. Una vez extraída la prótesis, las zonas ocupadas por las adherencias eran marcadas sobre la plantilla y cuantificadas mediante un analizador de imágenes computarizado (MICRON). Posteriormente, los resultados fueron sometidos a un examen estadístico mediante el test de la U de Mann-Whitney.
Estudio morfológico
Se tomaron muestras de la interfaz prótesis-peritoneo visceral y prótesis-tejido receptor para su estudio histológico mediante microscopia óptica y electrónica de barrido.
Para la microscopia óptica, las piezas fueron fijadas en formol al 10%, incluidas en parafina, cortadas en secciones de 5 mm y teñidas con tricrómico de Masson (variedad Goldner-Gabe) y Rojo Sirio, una tinción específica para las fibras de colágeno. Por último, fueron observadas en un microscopio Zeiss Axiophot (Carl Zeiss, Oberkochen, Alemania).
Para la microscopia electrónica de barrido, las muestras se fijaron en glutaraldehído al 3% (2 h) y, después de mantenerlas al menos 2 h en tampón Milloning (pH 7,3), se deshidrataron en una serie gradual de acetonas. El punto crítico se llevó a cabo en un Polaron E-3000 (Polaron Ltd., Inglaterra). Por último, las piezas fueron metalizadas con oro-paladio y estudiadas en un microscopio Zeiss DSM-950 (Carl Zeiss, Oberkochen, Alemania).
Identificación de células macrofágicas
Las células macrofágicas se identificaron a partir de secciones de piezas fijadas en formol e incluidas en parafina. Las muestras fueron desparafinadas, hidratadas y equilibradas en tampón TBS (tampón tris salino). A continuación se incubaron con un anticuerpo monoclonal específico para macrófagos de conejo RAM-11 (DAKO M-633) diluido 1:50 en TBS, durante 1 h. Para amplificar la señal se empleó como anticuerpo secundario una IgG-biotinada (diluida 1:1.000 en TBS) 45 min, y se marcó con avidina (1:200 en TBS) durante 20 min. Para detectar la reacción antígeno-anticuerpo se utilizó la técnica de la fosfatasa alcalina-fast red. Los núcleos celulares fueron contrastados con hematoxilina.
Morfometría del peritoneo
El peritoneo neoformado en cada uno de los implantes se evaluó mediante un estudio morfométrico sobre 25 secciones histológicas (5 µm) por grupo, para lo que se utilizó un analizador de imagen computarizado (MICRON). De cada sección tisular se tomaron 2 medidas al azar del espesor del neoperitoneo, delimitado éste, en el caso del PL-PU99, por la lámina de poliuretano y la capa de células mesoteliales, y en el caso del SIS entre la propia prótesis y el mesotelio neoformado.
Análisis estadístico
Para determinar la presencia de diferencias significativas en el espesor del neoperitoneo y en el recuento de macrófagos entre las dos prótesis evaluadas en este estudio se aplicó, a los valores obtenidos en cada caso, el test de la U de Mann-Whitney. Se consideró que las diferencias eran significativas cuando p < 0,05.
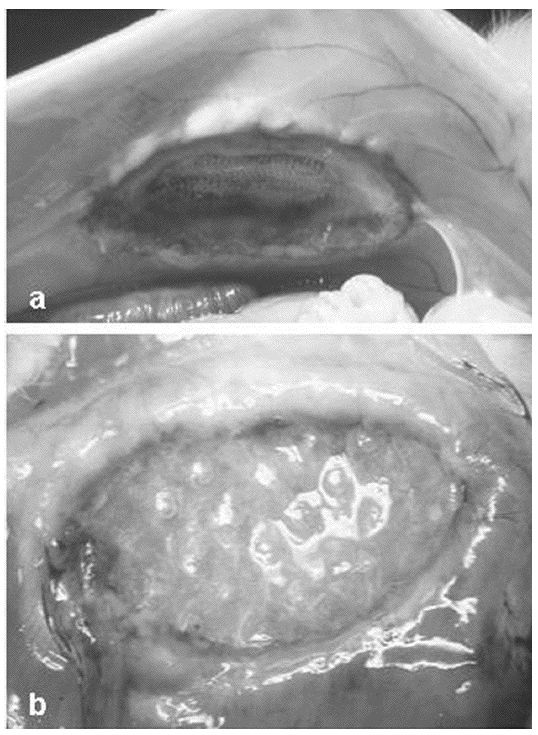
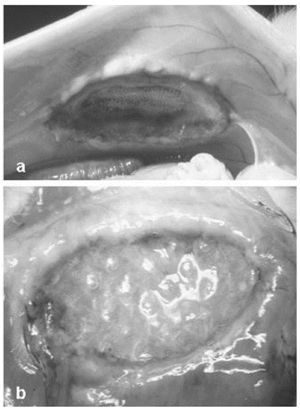
Fig. 2. a) Ausencia de adherencias en los implantes de PL-PU99 a los 14 días postimplante; b) adherencias de tipo laxo en las zonas de sutura del SIS al tejido receptor.
Resultados
No hubo mortalidad en los animales intervenidos. Las prótesis fueron siempre bien toleradas y no se detectaron signos de infección y/o rechazo de los implantes. No hubo presencia de exudados, manteniéndose la impermeabilidad en el implante. La formación adherencial fue mínima entre la prótesis compuesta y las asas intestinales. Sólo en algún caso, y principalmente en las zonas de anclaje de SIS, se formaron adherencias puntuales, de consistencia laxa (fig. 2). El porcentaje de adherencias en cada uno de los grupos fue estadísticamente significativo (p < 0,05): 0,31 ± 0,03% (PL-PU99) y 31,60 ± 7,35% (SIS).
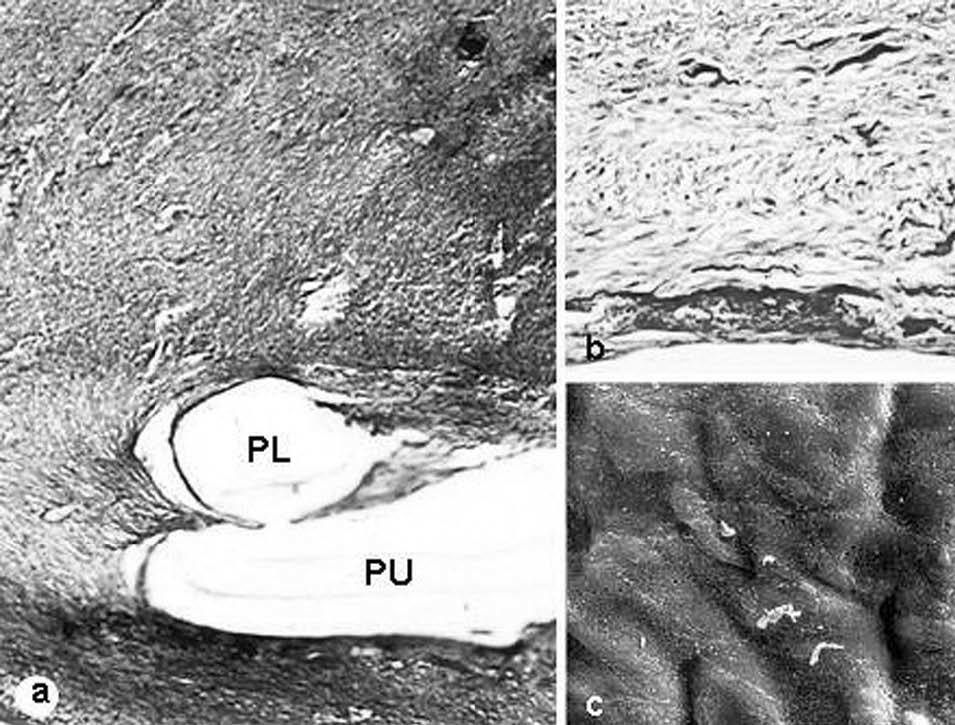
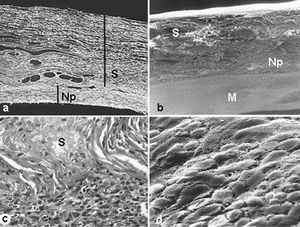
Fig. 3. PL-PU99. a) Zona de anclaje de la prótesis al tejido receptor (tricrómico de Masson, x100); b) neoperitoneo (tricrómico de Masson, *200); c) imagen de las células mesoteliales mediante microscopia electrónica de barrido (*1.000).PL: polipropileno; PU: poliuretano.
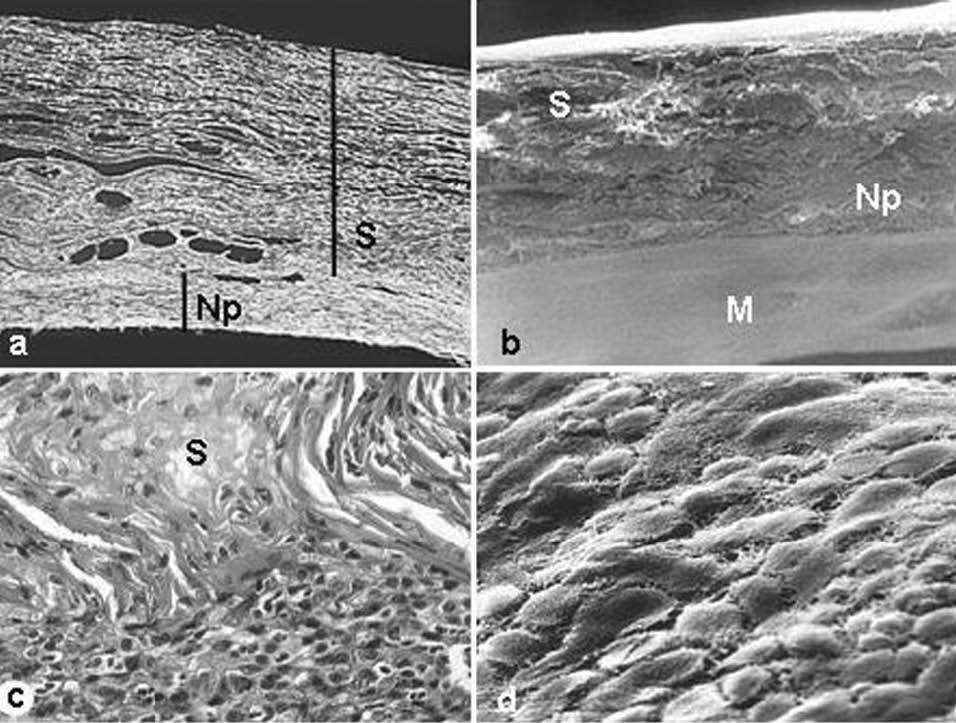
Fig. 4. SIS. a) Imagen panorámica del implante mediante microscopia óptica (rojo Sirio, *100) y b) mediante microscopia eléctronica de barrido (*100); c) zona de anclaje del SIS al tejido receptor en la que puede apreciarse un abundante infiltrado inflamatorio rodeando la prótesis y penetrando hacia el interior de ésta (tricrómico de Masson,*200); d) detalle de las células mesoteliales que tapizan el neoperitoneo (*1.000).S: SIS; Np: neoperitoneo; M: mesotelio.
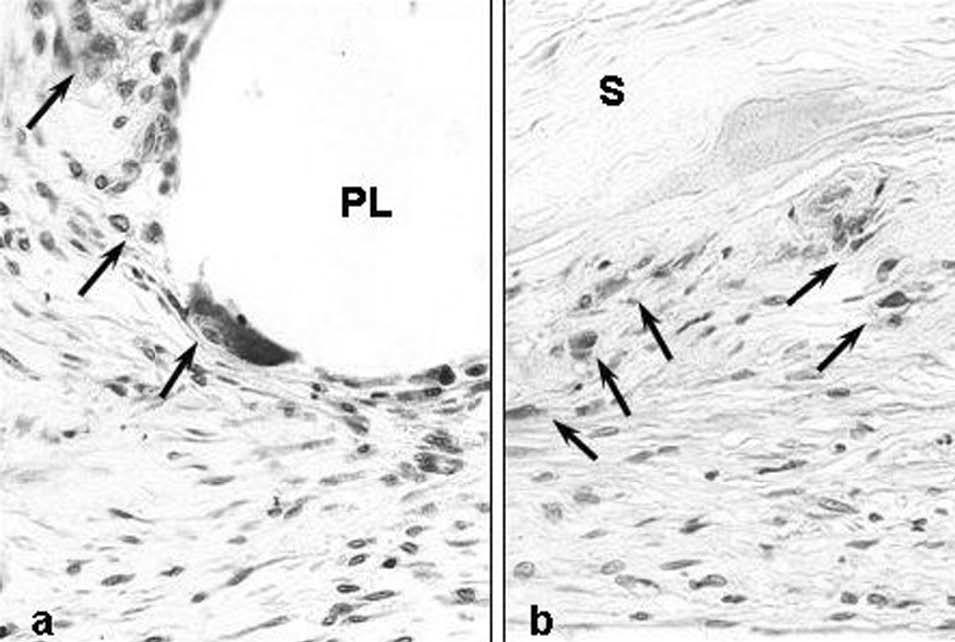
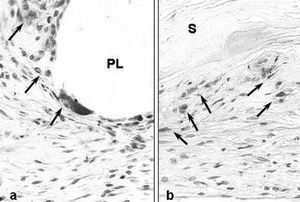
Fig. 5. a) Células marcadas con el anticuerpo monoclonal específico de macrófagos de conejo RAM11 (flechas) rodeando los filamentos de polipropileno de las prótesis de PL-PU99 (*400); b) en los implantes de SIS los macrófagos se depositaban bordeando la prótesis (*400).PL: polipropileno; S: SIS.
Implante de PL-PU99
En el grupo de animales en los que fue implantada una prótesis de PL-PU99 el estudio microscópico mostró, en la zona de anclaje de la prótesis al tejido receptor, la presencia de un tejido conectivo vascularizado con fibras de colágeno dispuestas de forma irregular, sin que se observara una dirección definida del crecimiento del tejido, con mayor concentración de fibras en torno a los filamentos de polipropileno. Alrededor de estos filamentos, y junto a la lámina de pegamento acrílico, se apreciaba un infiltrado celular compuesto por células blancas y células características de reacción a cuerpo extraño, principalmente macrófagos.
En la vertiente peritoneal se observó la formación de un neoperitoneo homogéneo conformado por tejido conectivo ordenado paralelamente al film de poliuretano y vascularizado, todo ello tapizado por un mesotelio perfectamente formado (fig. 3). Se observaba con claridad una barrera de macrófagos marcados entre la malla y la lámina de poliuretano.
Implante de SIS
En la interfaz prótesis-peritoneo visceral se observó la formación de un neoperitoneo homogéneo y bien organizado. Estaba constituido por tejido conectivo laxo, bien vascularizado y con presencia de fibras de colágeno dispuestas de forma paralela a la superficie de la prótesis. Entre las fibras se observó la presencia de fibroblastos, y en la zona en contacto con la prótesis se apreció la formación de una barrera celular en la que se pudo constatar, mediante técnicas inmunohistoquímicas, la presencia de células blancas, macrófagos y células gigantes de cuerpo extraño. El peritoneo neoformado estaba delimitado en su vertiente peritoneal por células mesoteliales de morfología poligonal.
En la zona del anclaje, la prótesis quedó infiltrada por un tejido conectivo muy celular y bien vascularizado formado por una trama de haces de fibras de colágeno, menos compactos que los haces de fibras que formaban la prótesis y con abundantes células libres en los intersticios fibrilares: fibroblastos, eosinófilos, monocitos, macrófagos y algunas células gigantes de cuerpo extraño, más numerosas en las zonas cercanas a la sutura. También se observó cómo la prótesis era colonizada por células procedentes del tejido huésped, que invadían rápidamente el implante, aunque en el tiempo de estudio establecido no se apreció aún el comienzo de la absorción de la prótesis (fig. 4).
Cuantificación de las células macrofágicas
El recuento de macrófagos marcados con el anticuerpo RAM-11 mostró una respuesta similar en el caso de la prótesis SIS (21,07 ± 8,93%) en comparación con los implantes de PL-PU99 (19,76 ± 1,59%). No se encontraron diferencias significativas entre los 2 grupos de estudio (fig. 5).
Morfometría del peritoneo
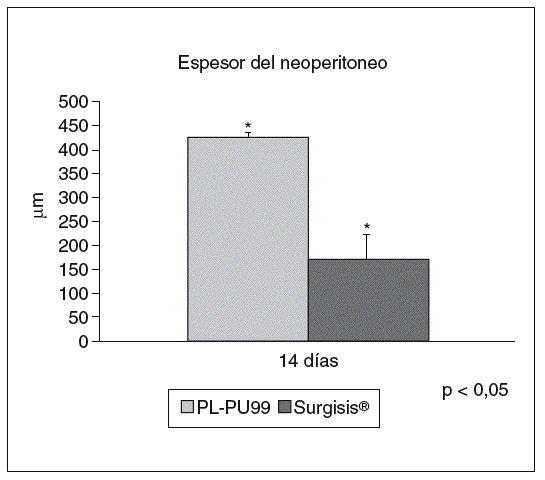
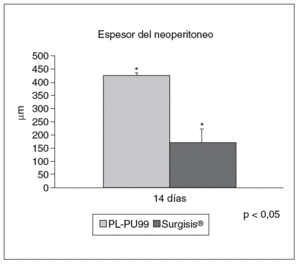
El grosor del neoperitoneo fue significativamente superior en los implantes de PL-PU99 respecto al obtenido en los implantes de SIS (427,60 ± 8,38 frente a171,90 ± 18,70 µm; p < 0,05) (fig. 6).
Fig. 6. Porcentaje del espesor del neoperitoneo a los 14 días en los 2 tipos de implante. La formación del neoperitoneo fue claramente superior en las prótesis de PL-PU99*(p < 0,05).
Discusión
Se ha descrito distintos métodos de "cierre temporal" del abdomen en casos de síndrome compartimental, aunque todavía no se dispone de un método ideal.
Todos estos métodos deben de cumplir una serie de requisitos de orden sobre todo práctico, tales como: ser técnicamente de fácil realización; permitir una sencilla reexploración de la cavidad peritoneal; ser herméticos en cuanto a evitar la excesiva pérdida de líquidos al exterior; preservar los bordes cutáneos y de la fascia en buenas condiciones evitando la retracción y, por último, deben ser métodos de fácil cuidado por el personal de enfermería.
En 1940, Ogilvie9 fue el primer cirujano en proponer técnicas de cierre temporal de la pared abdominal cuando los bordes de la laparotomía no pueden ser aproximados debido a un aumento de la presión intraabdominal. Los cierres iniciales fueron llevados a cabo con prótesis metálicas. Posteriormente se han empleado diferentes biomateriales, bien solos o combinados con apósitos y drenajes diversos10,11,12.
Uno de los métodos más sencillos ha sido el de la "bolsa de Bogotá", que emplea los envases de sueros de polietileno los cuales, previa esterilización, son recortados y fijados a los bordes fasciales de la pared del abdomen. El polietileno como material de estructura laminar, al quedar en contacto con el intestino, no genera adherencias y, por ello, no ocasiona problemas secundarios de fístulas. Varios autores13,14 han comunicado buenos resultados con este método.
La experiencia más protocolizada con el empleo de biomateriales es la de Fabian et al15. Emplean polipropileno, politetrafluoroetileno expandido (PTFE), poliglactin 910 y polivinilo. En una serie de 88 pacientes refieren un 9% de fístulas intestinales y obtienen los mejores resultados con el empleo de PTFE.
Porter16 empleó el polipropileno en combinación con una prótesis absorbible de poliglactin 910 y obtuvo buenos resultados en 5 pacientes.
Nagy et al17 utilizaron 3 biomateriales: polipropileno, PTFE y dexón. Con el polipropileno observaron fístulas y con el dexón grandes hernias incisionales, dado que es una prótesis absorbible. Los mejores resultados los obtuvieron con el PTFE. Estos mismos autores, en un estudio complementario, también obtuvieron óptimos resultados con el empleo de una prótesis de PTFE en presencia de infección, comparándola con una prótesis absorbible de dexón. A la misma conclusión llegan Ciressi et al18 con el empleo de este mismo biomaterial.
En el presente estudio hemos utilizado una prótesis de origen biológico derivada de submucosa porcina (SIS) que nunca había sido empleada para este fin. Dada su estructura de prótesis laminar, creímos que su comportamiento podría ser óptimo en la interfaz peritoneal. Además, cumplía todos los requisitos para ser empleada como cierre temporal. Inicialmente, esta prótesis no era multiperforada, como se hace con las últimas modificaciones que se han realizado recientemente.
El comportamiento fue bueno, con una buena integración en los bordes receptores y una buena mesotelización.
La otra alternativa fue el empleo de una prótesis compuesta. Utilizamos PL-PU99, una prótesis de diseño propio19, de fácil realización y empleo. Puede ser "construida" ante situaciones de emergencia en el quirófano por el propio cirujano, ya que solamente consiste en adherir a una prótesis de polipropileno una lámina de poliuretano (OpSite®). Asimismo, la colocación es sencilla y la lámina de poliuretano debe quedar ubicada en la vertiente peritoneal del implante. El comportamiento en la interfaz peritoneal es óptimo, dada la rápida mesotelización que se produce sobre el poliuretano.
Aunque en nuestro modelo no hemos inducido una hiperpresión en el abdomen de los animales, nuestro objetivo inicial en este estudio experimental ha sido comprobar el comportamiento de la prótesis en la interfaz peritoneal.
En estudio previos in vitro20 realizados por nuestro grupo, en los que cultivamos células mesoteliales y las sembramos sobre diferentes biomateriales, pudimos comprobar que la mesotelización era muy precoz cuando la prótesis era de tipo laminar. Por el contrario, cuando era de tipo reticular, el depósito mesotelial no se realizaba de una forma homogénea, ya que las células sólo se depositaban sobre los filamentos de la malla y no llegaban a cubrir los huecos que estos dejan entre sí.
La precoz formación de mesotelio sobre las prótesis laminares, tipo PTFE, SIS y poliuretano, probablemente explique la casi ausencia de formación adherencial tras su implante. Posiblemente, el retraso en la formación de dicho mesotelio cuando se implantan prótesis tipo reticular pueda explicar que en la interfaz prótesis-peritoneo visceral sea más frecuente la aparición de adherencias. En el caso del SIS, esta formación adherencial fue mayor que en la del PL-PU99, hecho que probablemente sea debido a la rapidez con que se forma el neoperitoneo y al espesor de éste, que también fue significativamente mayor en la prótesis compuesta.
Por otro lado, la reacción de cuerpo extraño, detectada por el recuento de macrófagos, no mostró diferencias entre los 2 biomateriales, a pesar de ser la prótesis laminar derivada de submucosa porcina. Ello está en consonancia con trabajos previos sobre la respuesta inmunológica efectuados con esta prótesis21.
Por todo ello podemos concluir que: a) ambas prótesis tienen un buen comportamiento en la interfaz prótesis-peritoneo visceral, aunque con la prótesis compuesta se consigue una menor formación adherencial y un mayor espesor del neoperitoneo formado, y b) las 2 prótesis ensayadas de forma experimental podrían ser empleadas en clínica como biomateriales para el cierre temporal de la cavidad abdominal.