Introducción
La fístula pancreaticopleural (FPP) es una rara entidad que fue descrita por primera vez en 1973 por Tombroff; en la actualidad hay poco más de un centenar de casos descritos en 40 publicaciones.
Hay 2 formas diferentes de presentación, directamente desde el conducto pancreático principal a la cavidad pleural, o con más frecuencia, desde un seudoquiste.
Habitualmente ocurre en varones de alrededor de 45 años, con antecedentes de pancreatitis crónica de etiología enólica. El diagnóstico puede resultar confuso por su presentación atípica, ya que el síntoma más frecuente es la disnea progresiva. La radiología simple suele mostrar un derrame pleural masivo. Los datos analíticos revelan un aumento de amilasa, tanto sanguínea como pleural (aproximadamente 551 y 26.504 U/l, respectivamente). El diagnóstico se ha establecido clásicamente por colangiopancreatografía retrógrada endoscópica (CPRE). En la actualidad se puede diagnosticar correctamente mediante una pancreatografía por resonancia magnética (RM). Entre el 45 y el 50% de los casos responde al tratamiento médico1-6, pero se debe recurrir a la cirugía cuando la FPP es recidivante o rebelde a dicho tratamiento. Se estima una mortalidad global de esta enfermedad de alrededor del 5%4-6.
El objetivo de este trabajo es realizar un acercamiento en cuanto a la epidemiología, clínica, diagnóstico y tratamiento actual de esta enfermedad.
Caso clínico
Varón de 40 años, con antecedentes de diabetes mellitus tipo 2, fumador de un paquete y medio al día y bebedor de 120 g de alcohol al día. Había sido diagnosticado de pancreatitis crónica calcificante e intervenido en dos ocasiones, la primera por un seudoquiste pancreático, realizándose un drenaje percutáneo del seudoquiste, y la segunda por una ictericia obstructiva en 1997 que requirió una hepaticoyeyunostomía en "Y" de Roux con colecistectomía.
El paciente acude a nuestro servicio refiriendo sensación disneica de 3 días de evolución, que ha ido aumentando progresivamente hasta hacerse de mínimos esfuerzos (unos 10 pasos), y no refiere ortopnea, oliguria, ni edemas en extremidades inferiores. En las 24 h anteriores a su ingreso presenta dolor continuo en ambas regiones infraescapulares, que no irradia ni se acompaña de cortejo vegetativo. No refiere fiebre ni clínica respiratoria, y tampoco dolor abdominal.
En la exploración física el paciente presenta un buen estado general con ligera palidez cutaneomucosa, taquipnea y taquicardia de 24 respiraciones/min y 100 lat/min, respectivamente. La auscultación cardíaca resulta rítmica sin soplos, mientras que la auscultación pulmonar revela una hipoventilación en el tercio inferior del hemitórax derecho y en los 2 tercios inferiores del lado izquierdo. No se reproduce el dolor infraescapular en la palpación, pero sí en la lateralización del tronco. El abdomen es blando, depresible, no doloroso a la palpación con ruidos presentes. Presenta una hepatomegalia de 4-5 traveses y una esplenomegalia de 3-4 traveses, sin oleada ascítica.
Entre los datos analíticos en el momento del ingreso destaca una hemoglobina de 10,4 y un hematócrito de 30; una amilasemia de 858, glucosa-lisina (GL) 173, lactato deshidrogenasa (LDH) 337 y proteína C reactiva (PCR) 50. El calcio, la fórmula leucocitaria y las plaquetas resultan normales. Durante su ingreso, la hemoglobina desciende a 8,1, por lo que el paciente requirió la transfusión de 2 concentrados de hematíes, y la amilasa a 357, siendo la lipasa de 156, la fosfatasa alcalina (FA) de 164 y la gamma glutamiltransferasa (GGT) de 110. La determinación de GL, urea, creatinina (Cr), ácido úrico, iones, calcio, colesterol, triglicéridos, lipoproteínas de baja densidad (LDL), bilirrubina, transaminasa glutamicooxalacética (GOT), transaminasa glutamicopirúvica (GPT) y LDH era normal. El proteinograma, la coagulación y la alfafetoproteína eran normales.
En la radiografía de tórax se aprecia un importante derrame pleural bilateral con mayor componente izquierdo. Una toracocentesis muestra un líquido hemorrágico con 51.250 U de amilasa. En dicho líquido pleural, el ADA es normal y el cultivo y la citología resultan negativos.
Se le realiza una tomografía computarizada (TC) toracoabdominal que confirma la presencia de un derrame pleural bilateral con atelectasia secundaria del lóbulo inferior izquierdo y cambios secundarios a pancreatitis con obstrucción del eje esplenoportal. Se observaba importante circulación colateral con esteatosis parcheada de hígado. La ecografía Doppler abdominal muestra la presencia de un hígado con marcada alteración de su ecogenicidad y áreas múltiples de aspecto nodular compatible con cirrosis. Había esplenomegalia. No se identifica la vena porta en el hilio hepático y en su lugar se aprecian vasos múltiples tortuosos que corresponden a una cavernomatosis portal.
Se procede a la colocación de un drenaje pleural, extrayéndose 1.750 ml de líquido hemorrágico.
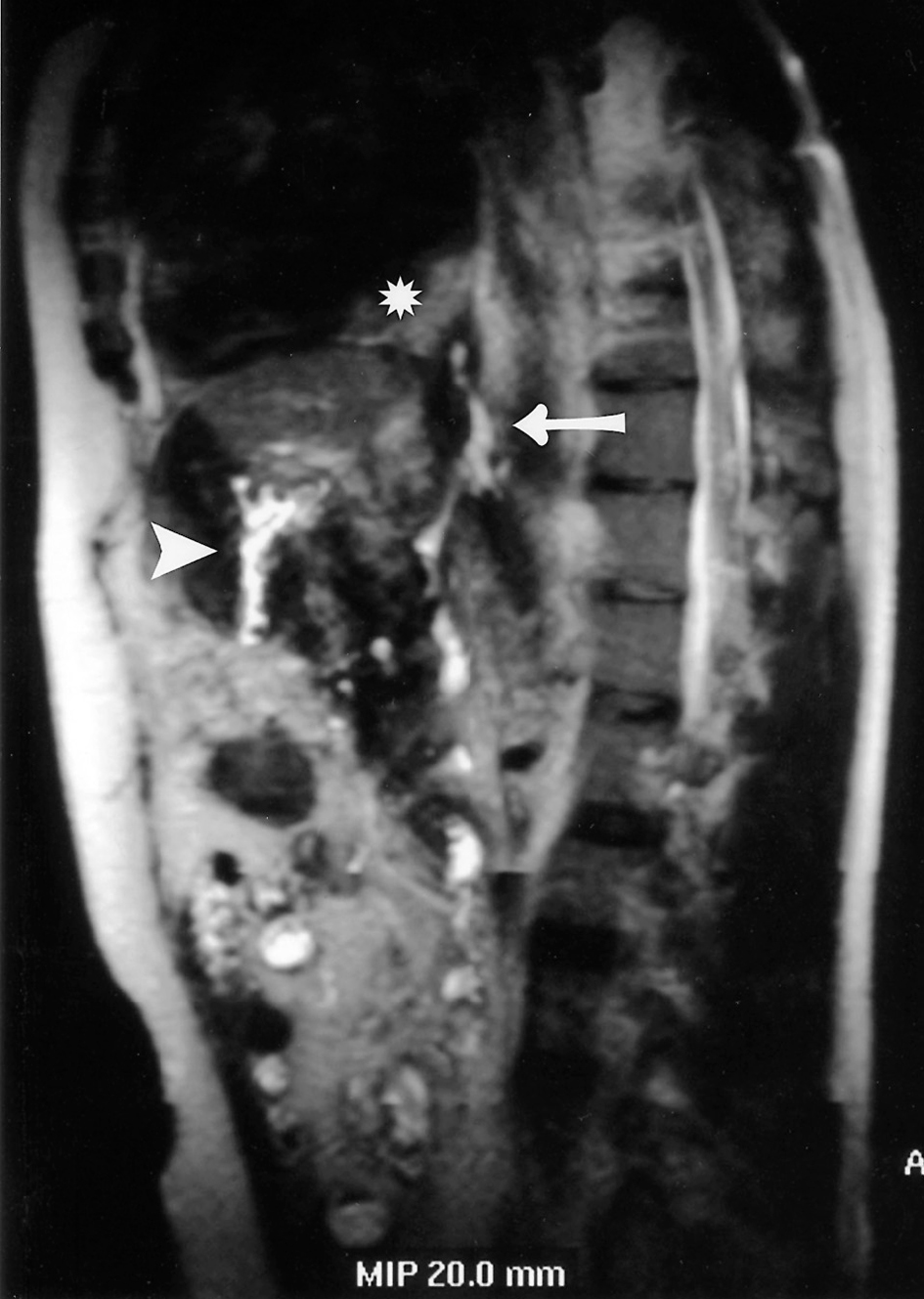
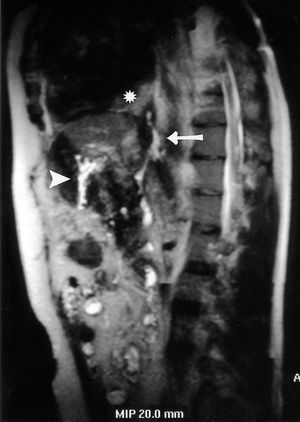
Ante la sospecha clínica de FPP se realiza una pancreatografía por RM, evidenciando una fístula directa que asciende desde el conducto pancreático por el hiato esofágico del diafragma a la cavidad pleural (fig. 1).
Fig. 1. En esta figura se objetiva la fístula directa que asciende a la cavidad pleural (flecha). *Derrame pleural. ý "Y" de Roux. þ: fístula pancreaticopleural.
El paciente es tratado mediante drenaje pleural, dieta absoluta y nutrición parenteral total, resolviéndose el cuadro clínico. Un control radiológico realizado un mes después no muestra signos de recidiva de la FPP.
Discusión
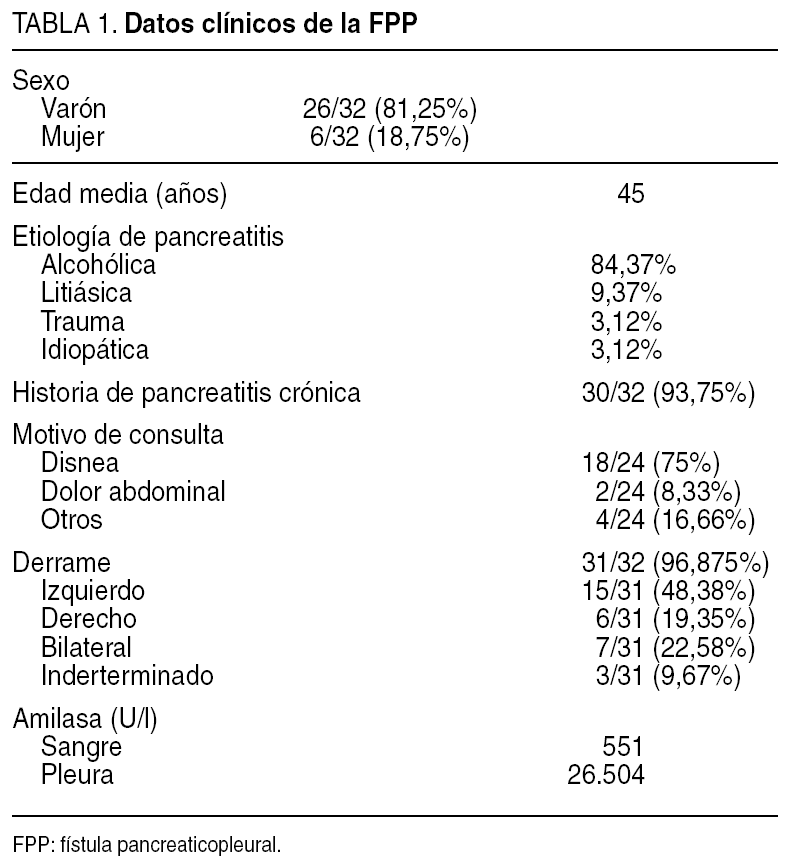
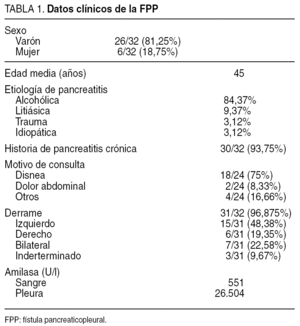
Hemos realizado una búsqueda en la base de datos Medline utilizando los términos Mesh pancreatic fistula, pleura y pancreaticopleural fistula. De los 40 artículos que se refieren a este tema se han excluido las publicaciones que no hablan de fístula, las de habla no inglesa, un artículo de pediatría y otro de urología. En total se dan datos de 32 pacientes a los que se les confirma la presencia de fístula, en unos casos mediante pruebas diagnósticas y en otros mediante intervención quirúrgica. Con estos datos hemos elaborado una tabla en la cual se reflejan los aspectos epidemiológicos, clínicos, etiológicos, analíticos y métodos de diagnósticos de esta entidad (tabla 1).
El perfil epidemiológico típico del paciente con fístula pleuropancreática es de una persona joven, varón en una pro-porción 4:1, con una media de edad de 45 años (rango, 17-84).
En cuanto a la etiología, el 93,75% corresponde a pacientes con historia de pancreatitis crónica; la etiología de ésta es enólica (84,37%), litiásica (9,37%), traumática (3,12%) o idiopática (3,12%).
Aunque la mayoría de los pacientes presentan una pancreatitis crónica, el dolor abdominal en la FPP sólo está presente en un 8,33%, siendo la disnea el síntoma inicial en el 75% de los casos. Pueden presentar también dolor torácico, anorexia, pérdida de peso, disfagia y tos.
Lógicamente, el derrame pleural masivo es una constante. Éste suele ser izquierdo en un 48,38%, y puede ser derecho en un 19,35% o bilateral en un 22,58%. Asimismo, en todos los casos se observa una amilasa pleural elevada con una media de 26.504 U/l (rango, 4.730-125.000) acompañada de una amilasemia con cifras de 140-1.580 U/l.
El diagnóstico de la FPP clásicamente se ha realizado mediante CPRE y en la actualidad es la RM el estudio diagnóstico de elección, dejando la CPRE para casos de duda diagnóstica o con fines terapéuticos.
La pancreatografía por RM permite visualizar el trayecto fistuloso, que se muestra como una estructura con señal intensa, además no es necesaria la inyección de material de contraste. La topografía de la fístula y sus relaciones anatómicas son definidas con precisión, sugiriendo que el papel que desempeña la CPRE para el diagnóstico queda relegado solamente a casos de duda7,8.
El tratamiento inicialmente debe ser médico y se deben tomar medidas que disminuyan la secreción pancreática. Estas medidas incluyen la combinación de dieta, nutrición parenteral total, tubo de drenaje pleural y somatostatina u octeótrido durante 3 semanas, consiguiendo una resolución del proceso en el 45-50% de los casos1-6.
Durante años se ha recurrido a la cirugía como única opción ante pacientes de difícil control por fístula persistente o recidivante. Dependiendo de la localización de la fístula se puede realizar una pancreatectomía distal (si la fístula se localiza en la cola pancreática), una anastomosis pancreaticoyeyunal en "Y" de Roux (si se localiza en el cuerpo pancreático) o una duodeno-pancreatectomía cefálica (si está en la cabeza pancreática). Estos procedimientos presentan un éxito a largo plazo del 80-95% con una mortalidad del 3%4,5.
En el último lustro hay 2 publicaciones que señalan otra alternativa terapéutica mediante la colocación-implantación transpapilar de un stent pancreático o de una sonda nasopancreática por CPRE1,3. No queda establecido el tiempo que debe permanecer alojado el stent o la sonda en el conducto pancreático, si bien parece ser que 1 o 2 meses serían suficientes.
Globalmente, el tratamiento médico, endoscópico y quirúrgico tienen una mortalidad de alrededor del 5%4-6.
En definitiva, nuestro caso coincide con la mayoría de los casos publicados en cuanto a la epidemiología, etiología, clínica y semiología.
Conclusiones
La FPP es una rara entidad que hay que considerar ante un paciente que presenta disnea con antecedentes de pancreatitis crónica enólica. En nuestro caso, el hallazgo de una amilasa muy elevada en el líquido obtenido en la toracocentesis nos hizo sospechar de esta enfermedad.
La epidemiología, la clínica y el tratamiento no han variado considerablemente en los últimos 20 años. Sin embargo, gracias a los avances en técnicas diagnósticas, la pancreatografía por RM parece ser la técnica diagnóstica de elección y ha ganado terreno a la CPRE, reservando esta última para casos de duda7,8. Ésta tiene el inconveniente de la utilización de contraste y de ser una prueba invasiva con un pequeño porcentaje de complicaciones7.
La pancreatografía por RM, por el contrario, es una prueba no invasiva que proporciona imágenes de alta resolución del páncreas y sus relaciones. Además, no utiliza material de contraste, con las ventajas que ello conlleva.