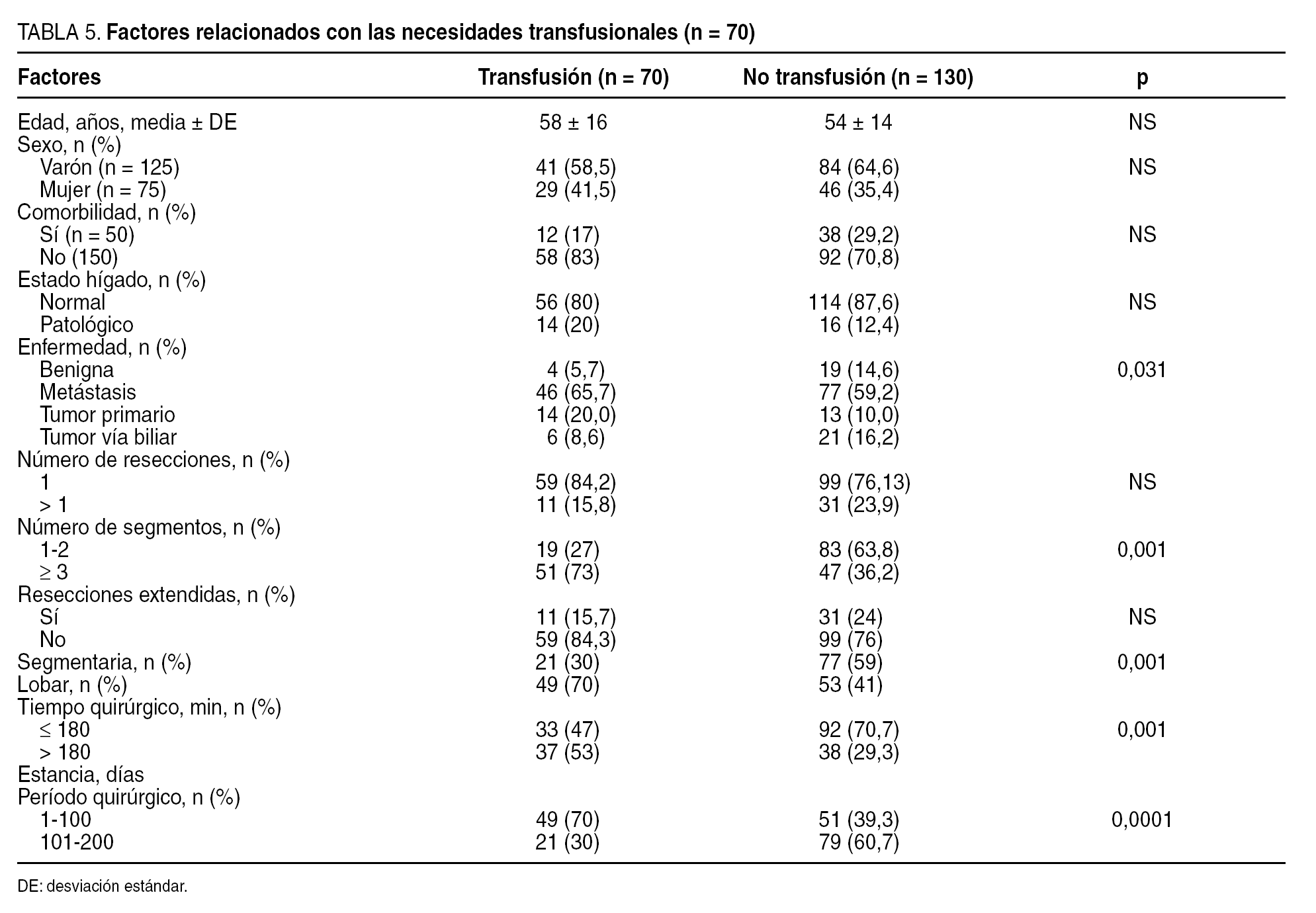Introducción
Hasta hace unas décadas, la mortalidad de las resecciones hepáticas (RH) superaba el 5% en la mayor parte de las series (la mayoría de ellas relacionadas con hemorragia perioperatoria, sepsis e insuficiencia hepática), con una morbilidad > 20-30%1-3.
En la pasada década se publicaron series con una mejoría de estos resultados (mortalidad < 5% con una morbilidad < 20%)4-12. Varios son los factores que han contribuido a la mejora de estos resultados: mejor selección de los pacientes, mejora de la técnica quirúrgica y de las técnicas anestésicas, mejor conocimiento de la anatomía quirúrgica del hígado13, mayor experiencia de los equipos gracias al trasplante hepático14,15, desarrollo de nuevos aspectos técnicos (maniobra de Pringle, exclusión vascular total, ligadura extrahepática de grandes vasos, embolización portal, etc.)16,20 y desarrollo de nuevo instrumental auxiliar (ecografía intraooperatoria, cavitrón, bisturí de argón, etc.)21-22.
Nuestro objetivo es presentar una serie de 200 RH, realizadas consecutivamente por el mismo equipo quirúrgico, sin mortalidad operatoria. Se analiza la morbilidad postoperatoria y los factores perioperatorios que pueden haberla condicionado y se discuten los aspectos que pueden haber influido en la ausencia de mortalidad.
Pacientes y método
Hemos incluido a los pacientes en los que se realizó una RH entre enero de 1996 y octubre de 2003. Todos los datos referentes al paciente, así como las exploraciones complementarias diagnósticas, los aspectos relacionados con la técnica quirúrgica y el seguimiento se obtuvieron mediante un protocolo diseñado de forma prospectiva. En este período se realizaron 200 RH en 177 pacientes: 158 pacientes recibieron 1 RH y 19 más de 1, en los que se realizaron las 42 RH restantes (en 15 pacientes se realizaron 2 RH y en 4 pacientes se realizaron 3 RH). De estos 19 pacientes, en 2 casos con metástasis bilaterales múltiples de carcinoma colorrectal realizamos resección de las metástasis en 2 intervenciones quirúrgicas: en la primera intervención resecamos las metástasis del lóbulo hepático izquierdo y ligamos la rama derecha de la vena porta, y en la segunda intervención, 4 semanas más tarde, llevamos a cabo una hepatectomía derecha. En 7 pacientes con metástasis hepáticas se realizó una resección de metástasis pulmonares (6 por metástasis de origen colorrectal y 1 por metástasis de hepatocarcinoma [HC]). La edad media de los 177 pacientes fue de 56 años (rango, 1-82) y 108 fueron varones (61%). De las 200 RH, 125 se realizaron en varones.
Las indicaciones de las 200 RH fueron (tabla 1), en 23 casos, por enfermedad benigna y en 177 por enfermedad maligna. La indicación de resección en el hemangioma se realizó según el crecimiento tumoral en 4 casos (en 1 de estos pacientes se había realizado unos meses antes una nefrectomía izquierda por la rotura de un hemangioma renal) y en 3 se efectuó la resección durante el transcurso de una laparotomía por otra indicación. En los 3 casos de hiperplasia nodular focal, la RH se indicó por una punción citológica compatible con adenoma hepático. Cuatro pacientes fueron intervenidos por litiasis intrahepática segmentaria no accesible mediante abordajes endoscópicos y radiológicos. En 2 pacientes se efectuó una hepatectomía derecha por isquemia secundaria a la ligadura de la arteria hepática derecha, realizada en ambos casos fuera de nuestro hospital (en 1 caso había una lesión sangrante en el lóbulo derecho y en 1 se debió a una fractura traumática del lóbulo derecho). En 1 paciente con lesión iatrogénica del conducto biliar posterior derecho y abscesos hepáticos secundarios se realizó una resección de los segmentos VI y VII. En el paciente restante se llevó a cabo una lobectomía izquierda por colangitis de repetición en el árbol biliar izquierdo.
La resección por enfermedad maligna (n = 177) se indicó en 123 casos por metástasis hepáticas: en 105 por tumores de origen colorrectal y en 18 por metástasis de tumores no colorrectales (las 6 RH por metástasis de cáncer gástrico se realizaron en 4 pacientes, 2 de los cuales recibieron 2 resecciones cada uno; las 2 RH por metástasis hepáticas de hipernefroma se realizaron en el mismo paciente). Un total de 27 RH se realizó por tumores hepáticos malignos primarios: 25 por HC, 15 por cirrosis (todos ellos en clase A de Child) y 10 en hígado sano (en 2 de ellos por HC fibrolamelar y en 1 por un HC que apareció en un paciente trasplantado de hígado, 4 años antes, por HC); asimismo, 2 RH se realizaron por otros tumores primarios (hemangiosarcoma y cistoadenocarcinoma). Por último, en 27 casos, la indicación de RH se realizó por tumores de vías biliares: en 15 por colangiocarcinoma (7 hiliares y 8 periféricos) y en 11 por adenocarcinoma de vesícula; asimismo, en 1 caso diagnosticado de tumor de Klastkin, éste fue irresecable, pero se realizó una lobectomía izquierda ante la presencia de microabscesos múltiples en el lóbulo izquierdo. La técnica quirúrgica se presenta en la tabla 2. En 102 casos realizamos la RH con control vascular hemihepático (con el control de los pedículos vasculares portales y suprahepáticos correspondientes), movilizando completamente el lóbulo a resecar y separando el lóbulo caudado de la vena cava inferior (VCI) (en el caso de las hepatectomías derecha e izquierda y de la hepatectomía derecha ampliada). En estos pacientes con control vascular hemihepático, en ningún caso se realizó la oclusión vascular del lóbulo sano y en 10 casos de hepatectomía derecha se realizó la bipartición del hígado por la línea de Cantlie con control vascular pero sin oclusión23, según la técnica de donante vivo.
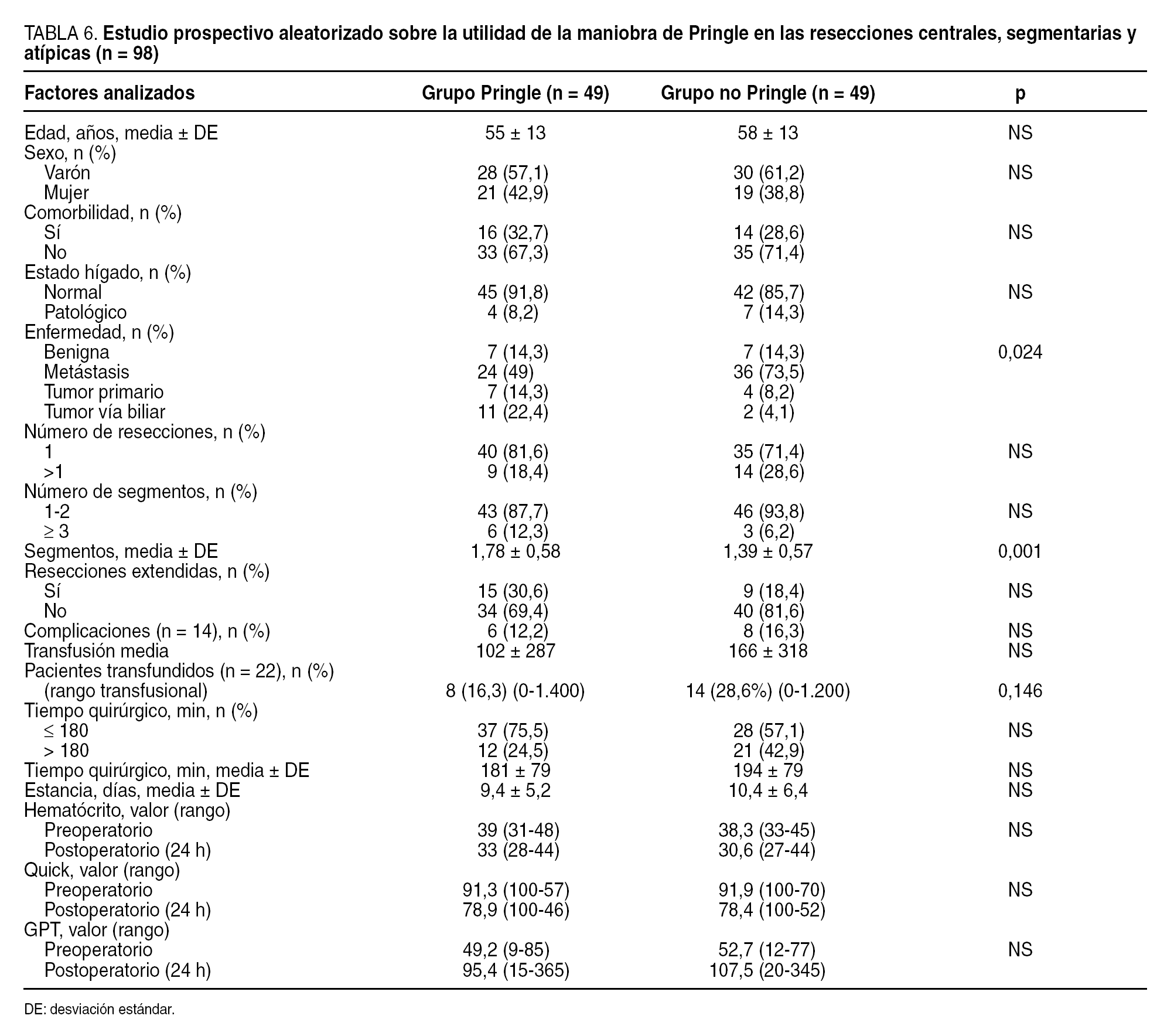
Las 98 RH restantes fueron resecciones segmentarias (tabla 2) (de las 28 RH de segmentos centrales hepáticos, en 2 casos se realizó la resección de los 3 segmentos IV, V y VIII, en 18 casos se resecaron 2 segmentos centrales y en 8 casos 1 solo segmento central). Estas 98 RH segmentarias fueron aleatorizadas de forma prospectiva desde el inicio del estudio en 2 grupos, según se realizase la RH con o sin maniobra de Pringle (de esta forma, en 49 casos se realizó la RH con maniobra de Pringle y en 49 sin esta maniobra). En todos los casos de maniobra de Pringle, ésta se empleó de forma continua, con un tiempo medio de 12,6 ± 4,2 min (rango, 8-24 min).
De las 200 RH, 98 fueron mayores y 102 menores. Recientemente, 2 de estas resecciones menores se han realizado por laparoscopia (1 resección del lóbulo izquierdo anatómico del hígado debido a una metástasis hepática de carcinoma y 1 resección atípica de una hiperplasia nodular focal (HNF) de 8 cm localizada en el segmento VI).
En la misma intervención se realizaron otros gestos quirúrgicos (resecciones extendidas) en 42 casos: resección sincrónica de metástasis hepáticas y pulmonares en 1 caso, resección sincrónica de colon en 4 casos, resección sincrónica de intestino delgado en 2 casos, linfadenectomía del hilio hepático en 19 casos, linfadenectomía retropancreática y retroperitoneal en 4 casos, resección de la vía biliar principal en 7 casos y hepatoyeyunostomía en "Y" de Roux en 1 caso; asimismo, en 1 paciente con metástasis hepáticas de adenocarcinoma de páncreas se asoció una pancreatectomía corporocaudal; en 1 paciente con metástasis de melanoma se asociaron una nefrectomía izquierda y una duodenopancreatectomía cefálica; en 1 paciente con metástasis de hipernefroma se asoció una nefrectomía izquierda y, por último, en 2 casos realizamos una resección amplia del diafragma por invasión tumoral.
Para disminuir las pérdidas hemáticas durante la sección del parénquima mantenemos una presión venosa central (PVC) < 4 mmHg24 y realizamos una perfusión de líquidos suficiente para mantener una diuresis adecuada (entre 0,5-1 ml/kg/hora), a la que asociamos una perfusión de nitroglicerina de 1 μg/kg/min para conseguir la vasodilatación esplácnica. La indicación de transfusión intraoperatoria se realizó cuando el hematócrito descendió por debajo del 30%.
Para realizar la técnica quirúrgica por laparotomía disponemos de ecografía intraoperatoria, cavitrón CUSA EXCEL y bisturí de argón, y para la vía laparoscópica disponemos de ecografía laparoscópica, cavitrón CUSA EXCEL, ligasure ATLAS y Tissuelink.
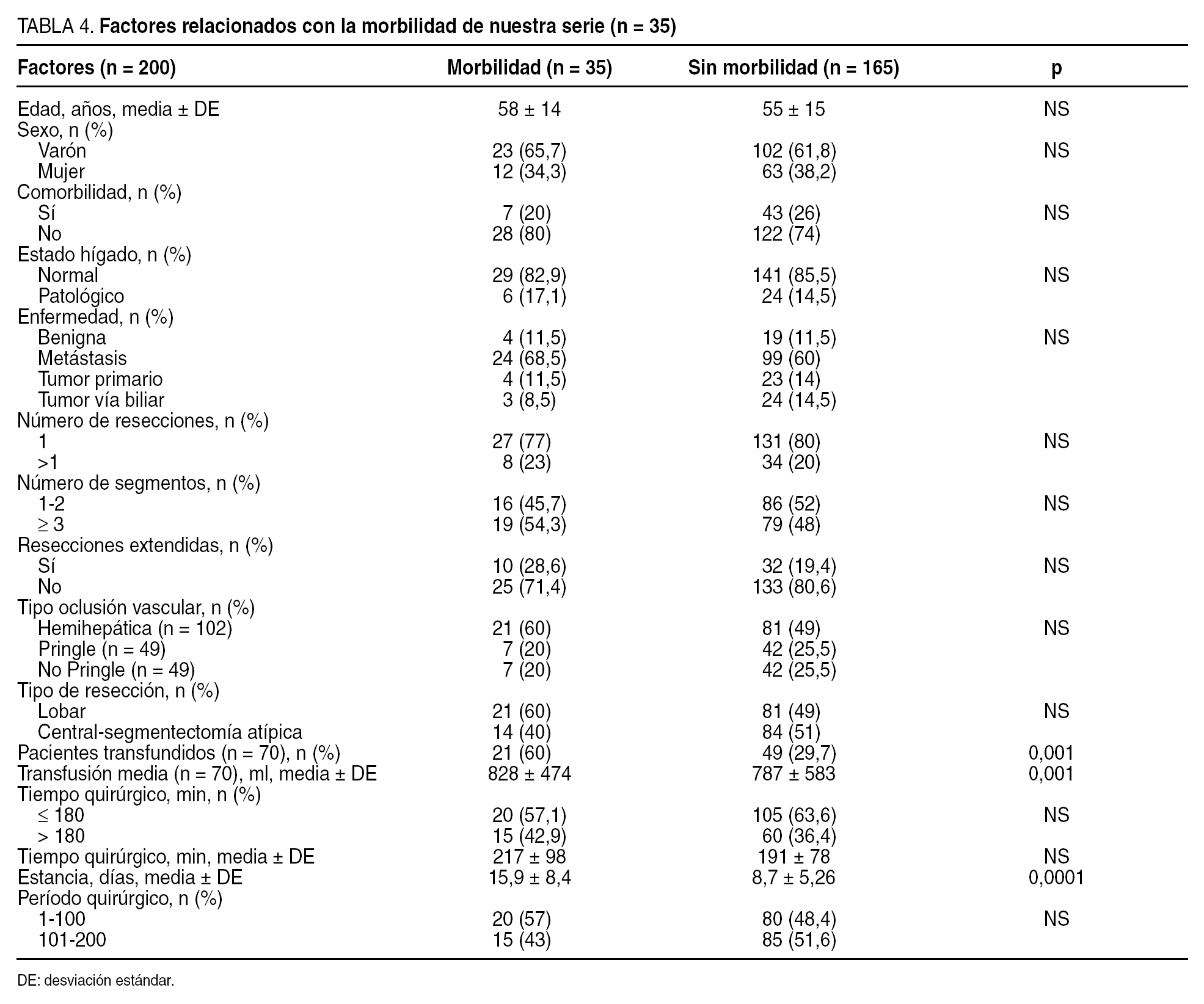
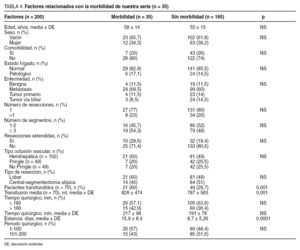
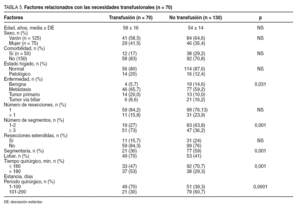
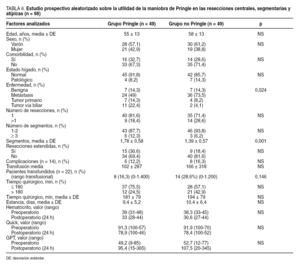
Definimos la mortalidad operatoria como la que ocurre como consecuencia de complicaciones relacionadas con la intervención quirúrgica. Hemos relacionado la morbilidad (tabla 3) con la edad, el sexo, la presencia de taras orgánicas previas a la RH (comorbilidad), el estado del hígado (cirrosis, colestasis, hígado graso y normal), la indicación quirúrgica (tumores benignos, metástasis, tumores malignos primarios, tumores de vías biliares), el número de resecciones (1 o > 1), la resección mayor (≥ 3 segmentos) o menor, la resección extendida (la que se asocia con otro gesto quirúrgico), el tipo de oclusión vascular (hepatectomía con control vascular hemihepático, RH con maniobra de Pringle, RH sin control vascular y sin maniobra de Pringle), el tipo de RH realizada (lobar frente a central, segmentaria y atípica), la necesidad de transfusión (sí o no), el tiempo quirúrgico (< 180 min y > 180 min), la estancia hospitalaria y la experiencia del equipo quirúrgico (para ello hemos dividido las 200 RH en 2 grupos cronológicos de 100 RH cada uno). Por otra parte, el consumo de hemoderivados se relacionó con los mismos factores descritos para la morbilidad (tabla 3).
En los pacientes que fueron aleatorizados de forma prospectiva desde el inicio del estudio y en los que se iba a realizar una resección hepática central, segmentaria o atípica (tabla 2), además de los factores comentados previamente se analizaron datos analíticos preoperatorios y postoperatorios (a las 24 h) (quick, transaminasas, bilirrubina total, hematócrito) con el objetivo de comprobar si la maniobra de Pringle puede condicionar un descenso de las necesidades transfusionales en nuestros pacientes sin ocasionar un incremento de las complicaciones.
El análisis estadístico de las tablas de doble entrada de la morbilidad se realizó mediante los tests de la t de Student y de la χ2, y para el consumo de hemoderivados se utilizaron test no paramétricos (Kruskal-Wallis y test de Mann-Whitney).
Resultados
El tiempo medio quirúrgico fue de 196 ± 82 min (rango, 120-420 min). La estancia media fue de 10,8 días (rango, 4-40).
No hubo mortalidad operatoria y ningún paciente falleció en el primer mes postoperatorio. Tres pacientes fallecieron entre los meses primero y tercero: 2 pacientes intervenidos por metástasis hepáticas (1 por accidente cerebrovascular en el segundo mes y 1 por carcinomatosis peritoneal en el tercer mes) y 1 con resección de hepatocarcinoma que reingresó en el segundo mes con ascitis y una peritonitis bacteriana de líquido ascítico, y que falleció como consecuencia de ésta.
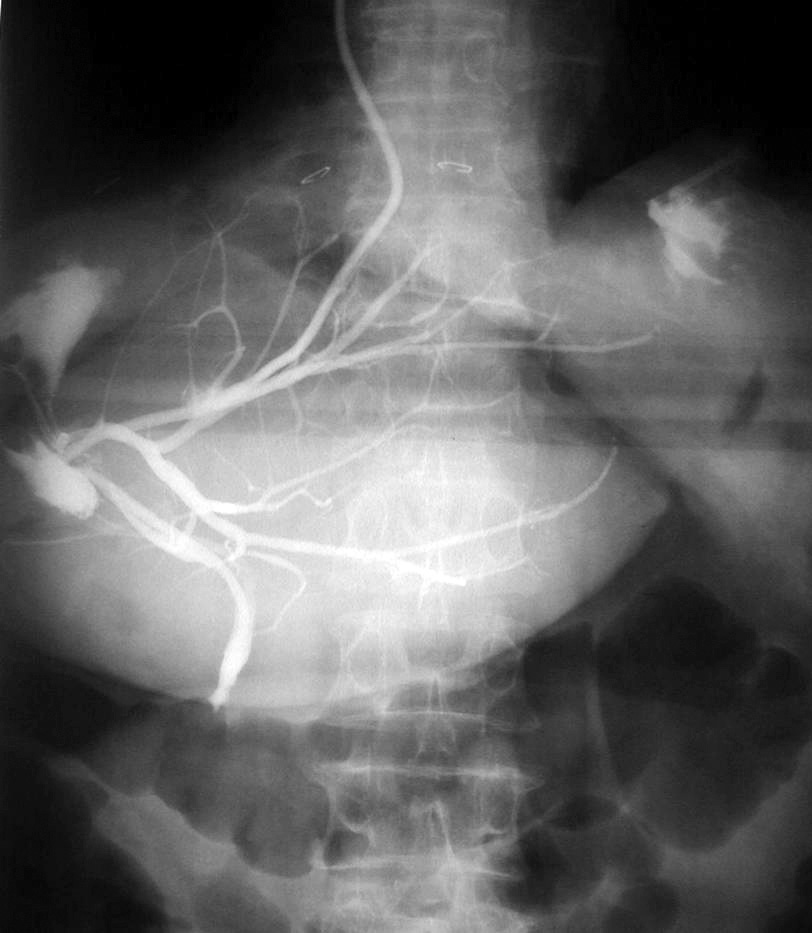
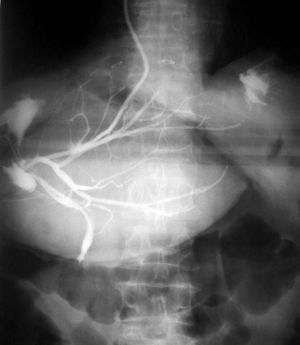
Hubo morbilidad en 35 RH (17,5%). En ningún caso se produjo insuficiencia hepática postoperatoria. Las complicaciones más frecuentes fueron las de origen biliar (n = 16; el 8% de la serie): 12 casos de biloma que se resolvieron con la colocación de un drenaje radiológico externo; 1 fístula biliar externa a través del drenaje que se resolvió espontáneamente a los 6 días; 1 caso de peritonitis biliar difusa que se resolvió con drenaje radiológico; 1 caso de bilioptisis tras hepatectomía derecha (hubo una fístula del conducto hepático derecho con colección biliar que drenó hacia el tórax en la que fue preciso realizar una reintervención, ya que no se solventó con prótesis endoscópica); y, por último, una lesión iatrogénica de la vía biliar principal en 1 paciente con hepatectomía derecha por metástasis que presentó recidiva en los segmentos IV y I; durante la reintervención se extirpó un segmento de colédoco medio y, ante la imposibilidad técnica de derivar el hepático izquierdo hacia un segmento digestivo próximo el paciente había presentado cuadros previos de peritonitis aguda difusa en relación con la resección de colon, se colocó un drenaje radiológico izquierdo, pasando el drenaje hacia el duodeno por el colédoco distal seccionado (fig. 1). El paciente llevó el drenaje durante 6 meses y falleció por enfermedad metastásica.
Fig. 1. Lesión iatrogénica de la vía biliar principal resuelta con drenaje radiológico.
En 10 casos hubo un absceso subfrénico por hematoma infectado que en todos los casos se resolvió también con drenaje radiológico; asimismo, hubo 6 casos de absceso de pared, 1 obstrucción intestinal que precisó reintervención y 2 hemorragias postoperatorias que precisaron de reintervención.
Análisis estadístico de la morbilidad
Como se expone en la tabla 4, la morbilidad se relacionó con la transfusión, de forma que los pacientes transfundidos presentaron más complicaciones que los no transfundidos (p < 0,001). En el análisis multivariable, la transfusión fue el único factor predictivo significativo respecto de la presencia de complicaciones, de forma que los pacientes transfundidos presentan un riesgo de presentar complicaciones 3,56 veces mayor que los no transfundidos (p < 0,001).
Análisis estadístico de la transfusión
La transfusión media global fue de 280 ml (rango, 0-3.600 ml) y no se requirió transfusión en 130 resecciones (65%). La media de sangre recibida por los pacientes transfundidos (n = 70) fue de 800 ± 550 ml. Como se observa en la tabla 5, la transfusión se relacionó con la indicación quirúrgica (p = 0,031), con el tipo de resección mayor (p < 0,001), con la realización de resecciones lobares (p < 0,001), con las primeras 100 resecciones hepáticas (p < 0,0001) y con el tiempo quirúrgico prolongado (p < 0,001). En el análisis multivariable, la transfusión fue superior cuando la resección se indicó por tumores primarios (p = 0,029) y en las metástasis (p = 0,064) respecto de los tumores benignos, en las resecciones mayores (p < 0,001), y en las primeras 100 resecciones (p < 0,001).
Análisis de la utilidad de la maniobra de Pringle
Se aleatorizó a 98 pacientes; en 49 se planificó la realización de la RH con maniobra de Pringle (CMP) y en los otros 49 sin dicha maniobra (SMP) (tabla 6). Se transfundió a 22 de los 98 pacientes del estudio. En el grupo CMP se transfundió a 8 de los 49 casos (16,3%), mientras que en el grupo SMP se hizo en 14 de los 49 pacientes (28,6%) (p = 0,146, próximo a significación estadística). En 3 pacientes del grupo SMP fue necesario recurrir a esta maniobra debido a que el equipo quirúrgico consideró que el sangrado y las necesidades transfusionales eran importantes. Cabe destacar que, a pesar de la aleatorización, la media de segmentos resecados fue superior en el grupo CMP (p < 0,001), a pesar de lo cual las necesidades transfusionales fueron menores. También en el grupo CMP hubo un mayor porcentaje de tumores de las vías biliares que en el otro grupo, mientras que en el grupo SMP hubo un mayor porcentaje en metástasis (p = 0,024). No hubo diferencias entre ambos grupos respecto al hematócrito, la actividad de la protrombina ni las transaminasas (GPT) preoperatorias y postoperatorias.
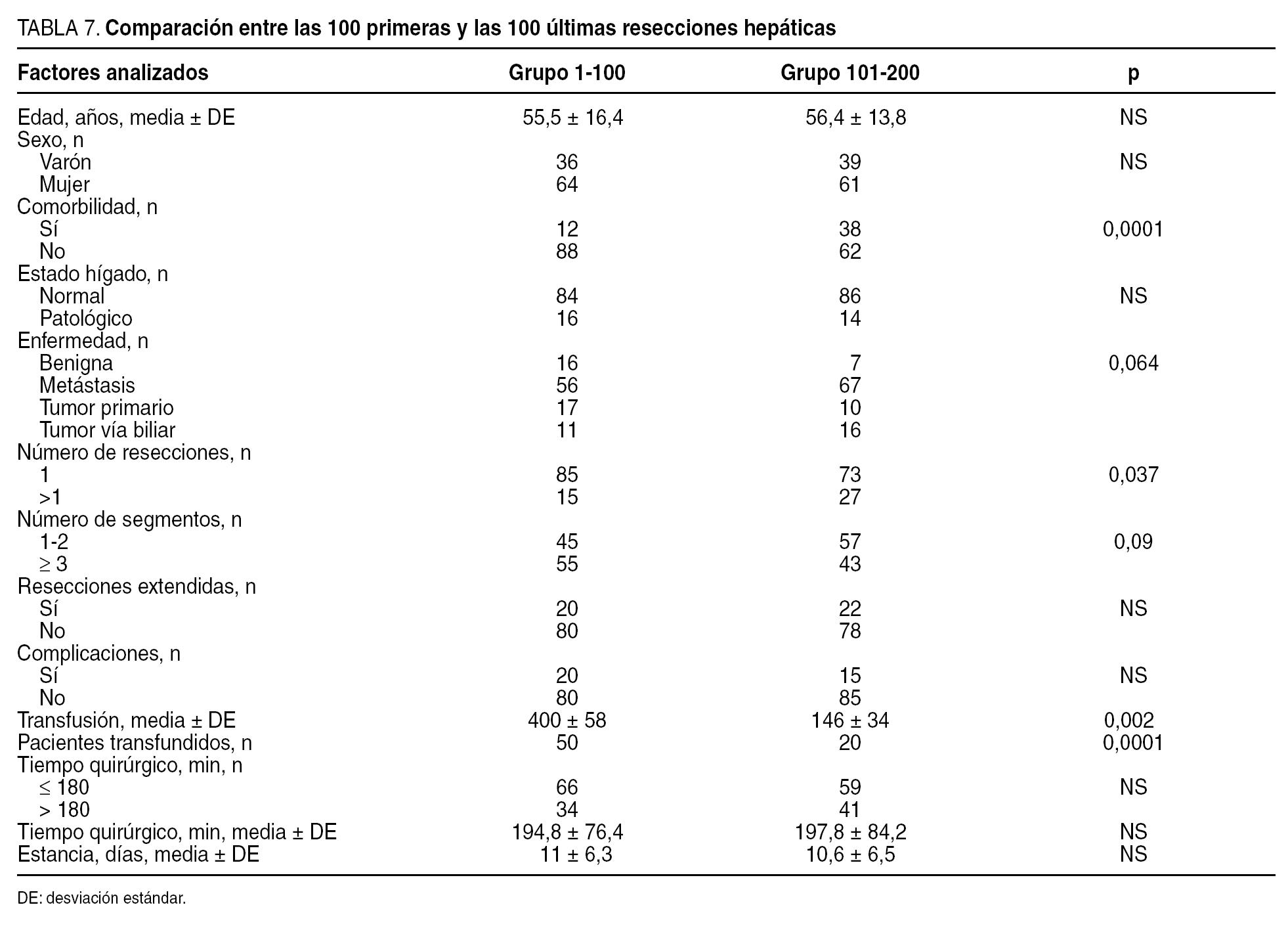
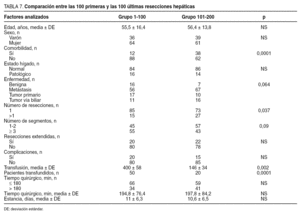
Comparación entre las 100 primeras y las 100 segundas resecciones hepáticas (tabla 7)
En las 100 segundas RH, la presencia de taras orgánicas fue superior (el 38 frente al 12%; p = 0,001), hubo un mayor porcentaje de metástasis (p < 0,05) y un mayor número de rerresecciones (el 27 frente al 15%; p < 0,05) que en las primeras 100 RH. El número de resecciones mayores (resección ≥ 3 segmentos) fue superior en los primeros 100 pacientes, y el de segmentectomías fue mayor en los últimos 100 pacientes. En las últimas 100 RH fueron menores las complicaciones (el 15 frente al 20%; sin diferencias estadísticas) y las necesidades transfusionales (p < 0,001).
Discusión
En la última década, la mortalidad de las RH ha descendido por debajo del 5% en la mayoría de las series y en series amplias la mortalidad ha sido nula4,5. Así, en la serie del Memorial4, sobre 1.083 resecciones hepáticas se obtuvo una mortalidad operatoria del 3,1%, con un descenso de la mortalidad desde el 4% en los 5 primeros años del estudio a 1,3% en los últimos 2 años y una mortalidad cero en las últimas 184 RH; estos últimos resultados coinciden con nuestra experiencia.
Varios son los factores que han contribuido al descenso de esta mortalidad. En primer lugar hay una mejor selección de los pacientes, sobre todo entre los cirróticos, ya que la mayoría de los grupos indican la RH en el HC con cirrosis en estadio A de Child, con una bilirrubina < 3 μmol/l, sin hipertensión portal y con buena reserva funcional hepática, reservando el trasplante para los pacientes en estadios B y C de Child sin contraindicaciones25-28. También influye el tamaño tumoral26, de forma que los tumores de gran tamaño que podrían requerir una RH mayor para su extirpación tienen un riesgo más elevado de insuficiencia hepática postoperatoria, en cuyo caso están indicados otros tratamientos ablativos del HC (quimioembolización, alcoholización, radiofrecuencia, etc.)29. En nuestra serie de HC resecados con cirrosis, todos en estadio A de Child, en 3 casos se realizó un trasplante hepático con posterioridad (todos con tamaño < 5 cm). En los tumores originados en la vía biliar (carcinoma de vesícula, colangiocarcinoma), la colestasis provoca una disfunción hepática e incluso una cirrosis biliar secundaria30-32. Nosotros, al igual que otros autores30-32, consideramos que los pacientes que van a recibir una RH mayor con un hígado colestásico presentan un riesgo elevado de insuficiencia hepática postoperatoria, por lo que las técnicas de drenaje biliar preoperatorio y de embolización portal o arterial pueden tener indicación en los que presenten colestasis severas y con un hígado residual de pequeño tamaño31,32, aunque algunos autores no lo consideran necesario y también obtienen buenos resultados33. Los 7 pacientes de nuestra serie resecados por colangiocarcinoma hiliar llevaron drenaje radiológico preoperatorio percutáneo y en todos ellos mejoraron las alteraciones preoperatorias de la coagulación. En los pacientes con hígado sano, tumores benignos y metástasis34-37 se han ampliado las indicaciones de resección debido a los buenos resultados de la cirugía, que permiten intervenir a pacientes en los que hace unos años la cirugía estaba contraindicada. Así, se indica cirugía de RH en pacientes con metástasis bilobares múltiples o metástasis irresecables que, gracias a las técnicas de embolización portal preoperatoria o de resección en 2 tiempos36,37, conseguimos hacer resecables. A esta ampliación de las indicaciones, sobre todo en las metástasis de carcinoma colorrectal, ha contribuido también la buena respuesta a los tratamientos quimioterápicos actuales38,39.
Consideramos que también ha contribuido al descenso de la mortalidad la mejor formación quirúrgica del cirujano (trasplante hepático) y la disponibilidd de mejores medios auxiliares de diagnóstico y tratamiento. Así, la planificación de la técnica quirúrgica que se va a realizar, en nuestra experiencia, comienza en el estudio preoperatorio, donde se da gran importancia al cálculo del volumen del hígado residual (VHR) calculado mediante tomografía computarizada (TC) helicoidal. Consideramos que un porcentaje > 25% de VHR en el hígado sano o > 35% en pacientes diabéticos o con hígado graso (que reciben numerosas sesiones de quimioterapia) conlleva un riesgo menor de insuficiencia hepática postoperatoria. Nosotros realizamos una volumetría en todos los pacientes con hígado no cirrótico que van a recibir una RH mayor, realizando embolización portal preoperatoria o ligadura portal intraoperatoria en los pacientes con un VHR inferior al porcentaje expresado.
También los medios técnicos auxiliares intraoperatorios han contribuido a disminuir las pérdidas hemáticas, factor muy relacionado, como indican nuestros resultados, con la presencia de complicaciones. Así, la ecografía intraoperatoria es fundamental para detectar el número de lesiones y estudiar las relaciones de éstas con los grandes vasos40. Consideramos que una buena liberación hepática, con control de los pedículos vasculares una vez disecados, contribuye a realizar una RH con mayor seguridad. En nuestra experiencia, como ya han demostrado otros autores20, el empleo de la maniobra de Pringle contribuye a minimizar las pérdidas y disminuir el número de pacientes transfundidos, sin incrementar las complicaciones. A pesar de estos resultados, consideramos que la oclusión del hilio hepático no se debe realizar de forma indiscriminada, ya que muchas resecciones se pueden realizar sin oclusión y sin transfusión y, además, tiene el riesgo de algunas complicaciones postoperatorias (rotura esplénica, insuficiencia hepática). En las resecciones con control vascular hemihepático no somos partidarios de realizar oclusión del hígado sano residual (de hecho, no lo hemos realizado en ningún paciente), ya que el riesgo de insuficiencia hepática postoperatoria es menor (primera causa de mortalidad de estos pacientes), aunque para ello tengamos un porcentaje de transfusión algo superior que en otras series. En el caso de tener que recurrir a la oclusión del hilio hepático, consideramos que el tiempo depende de la localización de la lesión, la cantidad de hígado residual y el estado del hígado, de forma que debe haber un equilibrio entre la cantidad que se va a transfundir y el riesgo de insuficiencia hepática. Así, en los pacientes con VHR < 35% y con hígado patológico (cirrosis, colestasis, hígado graso por poliquimioterapia), el tiempo de oclusión debe ser lo más corto posible y realizarse sólo en los momentos en que operemos en "zonas conflictivas" o con sangrado excesivo. Por ello, nosotros tratamos de minimizar las pérdidas hemáticas mediante una baja presión venosa central con la anestesia durante la sección del parénquima (PVC < 4 mmHg), la realización de una perfusión de líquidos suficiente para mantener una diuresis adecuada (0,5-1 ml/kg/hora) y la asociación de una perfusión de nitroglicerina (1 μg/kg/hora) que provoca vasodilatación esplácnica.
Para la sección del parénquima empleamos el bisturí ultrasónico (Cavitrón CUSA EXCEL) y el bisturí de argón, muy útiles para un menor sangrado. Durante la sección empleamos lentes de 2,5 aumentos y los vasos de mayor calibre son ligados o suturados en ambos extremos con prolene 3-4/0.
La mayor seguridad técnica ha conseguido que aumente el número de resecciones parciales (segmentectomías) descienda el de resecciones mayores. Así, en la serie del Memorial4, el porcentaje de segmentectomías aumentó y el número de resecciones mayores disminuyó con el fin de ahorrar parénquima hepático, factor trascendental para evitar la insuficiencia hepática postoperatoria si intervenimos en un hígado patológico. Esto ha permitido también aumentar el número de procedimientos mayores concomitantes ("resecciones extendidas") sin incrementar de forma significativa la morbimortalidad. Por ello, se produce un aumento del número de segmentos resecados que, junto con el incremento de la experiencia quirúrgica, condiciona una disminución de las complicaciones y de las necesidades transfusionales; estos hechos también se han comprobado en nuestra serie al comparar los 100 primeros pacientes con los 100 últimos.