Introducción. El CD44v6 es una isoforma de la molécula de adhesión CD44 cuyo principal ligando es el ácido hialurónico. Hemos querido estudiar la posible asociación entre las concentraciones de ácido hialurónico, citosólico y de membrana, y ciertas propiedades clinicobiológicas de los carcinomas ductales infiltrantes de mama (CDI) CD44v6 positivos.
Pacientes y métodos. Hemos estudiado, en 63 casos y con métodos inmunológicos, las concentraciones citosólicas de receptores de estrógenos, de progesterona, pS2, activador del plasminógeno tipo tisular (t-AP) y catepsina D, así como las del receptor del factor de crecimiento epidérmico y proteína erbB2/neu en las membranas celulares. Asimismo, tuvimos presente el estado menopáusico, tamaño, afectación ganglionar, ploidía, fase de síntesis celular y grado histológico.
Resultados. Los tumores de membrana negativos para ácido hialurónico (< 1.500 ng/mg de proteína) presentaron menores concentraciones (p = 0,005) y porcentaje de positividades (p = 0,000) para los receptores de estrógenos, no se asociaron al estado premenopáusico (p = 0,044), fueron más frecuentemente aneuploides (p = 0,022), proliferativos (p = 0,008) y cursaron con invasión axilar superior a 3 ganglios (p = 0,048). Los tumores citosólicos negativos para ácido hialurónico (< 4.800 ng/mg de proteína) mostraron menores concentraciones de t-AP (p = 0,005) y de los receptores del factor de crecimiento epidérmico (p = 0,028), y fueron más frecuentemente aneuploides (p = 0,028).
Conclusiones. Los resultados anteriores sugieren que la concentración de ácido hialurónico, tanto en membrana como en citosol, parece asociarse a ciertas propiedades clinicobiológicas de los CDI/CD44v6 positivos reflejando las menores concentraciones del proteoglicano, un fenotipo más indiferenciado y hormonoindependiente. Asimismo, resaltan el valor del ácido hialurónico y su receptor como una unidad funcional, y podrían explicar las discrepancias descritas en la bibliografía cuando se consideran aisladamente cada uno de ellos.
Introduction. CD44v6 is an isoform of the CD44 adhesion molecule, the major cell-surface receptor for hyaluronic acid. Our objective was to study the possible association between cytosolic and cell surface hyaluronic acid concentrations and certain clinical and biological properties of CD44v6-positive infiltrating ductal carcinomas of the breast.
Patients and methods. In a series of 63 patients, we employed immunological methods to study the cytosolic concentrations of estrogen receptors, progesterone receptors, pS2, cathepsin D and tissue-type plasminogen activator, as well as the cell surface levels of epidermal growth factor receptor and erbB2 oncoprotein. Menopausal status, tumor size axillary lymph node involvement, ploidy, S-phase cellular fraction and histological grade were also considered as variables in the study.
Results. Cell surface hyaluronic acid-negative tumors (< 1500 ng/mg protein) had lower concentrations (p = 0.005) and rate of positivity for progesterone receptors and were not associated with premenopausal status (p = 0.44). These tumors were also more often aneuploid (p = 0.022) and proliferative (p = 0.008) than cell surface hyaluronic acid-positive lesions. Moreover, they showed involvement of more than 3 axillary nodes (p = 0.048). Cytosolic hyaluronic acid-negative tumors (< 4800 ng/mg protein) showed lower levels of tissue-type plasminogen activator (p = 0.005) and epidermal growth factor receptor (p = 0.028) and were more frequently aneuploid (p = 0.028) than cytosolic hyaluronic acid-positive tumors.
Conclusions. Our results suggest the existence of an association between the hyaluronic acid level and certain clinical and biological properties of CD44v6-positive infiltrating ductal carcinomas of the breast, with the lowest proteoglycan levels reflecting a less differentiated and hormone-independent phenotype. Moreover, the levels of hyaluronic acid and its receptor act as a functional unit, a finding that may explain the discrepancies among those reports in the literature in which each of them is considered separately.
Introducción
El CD44 es una glucoproteína de la superficie celular que participa activamente en la adhesión y migración celular, conociéndose algunas de las vías bioquímicas a través de las cuales ejerce su efecto1,2. El gen que codifica esta molécula de adhesión se localiza en el cromosoma 11 y, merced a modificaciones postranscripcionales del ARN (splicing alternativos), diferentes glucosilaciones N y O, adición de condroitín sulfato y fosforilaciones del dominio citoplasmático, numerosas isoformas variantes (CD44v) son codificadas. Éstas difieren de la forma estándar por la adición de aminoácidos en la región extracelular de la molécula, lo que conlleva un mayor peso molecular, cambios en sus propiedades adhesivas, mecanismos de regulación y estado de activación celular, así como la posibilidad de conferir, algunas de ellas, un potencial metastático en modelos experimentales y de servir como base para futuras terapias3-6. Recientemente se ha demostrado que la expresión de muchas formas variantes puede ser también consecuencia de una respuesta normal de la célula a factores de crecimiento que estimulan la proliferación, y no un reflejo de transformación maligna7. La forma estándar (CD44s) tiene capacidad para unir ácido hialurónico, pero no todas las isoformas de elevado peso molecular lo hacen del mismo modo, siendo una de las mayores funciones de la familia CD44 degradar el citado proteoglicano8.
La isoforma variante v6 (CD44v6) tiene un peso molecular de 180-220 kD, se manifiesta de forma variable en diferentes células normales9 y está involucrada en la capacidad metastásica, motilidad e invasión de las células tumorales10,11. Asimismo, su expresión y valor clínico difiere según el tumor estudiado y puede ser utilizada como inmunógeno para la obtención de vacunas con finalidades terapéuticas12-23. En los carcinomas de mama, su comportamiento clínico difiere según los diferentes autores, y se acepta que no es un factor pronóstico independiente24-33. Charpin et al34 constatan que la positividad para esta isoforma es independiente de la edad, tamaño, histología, grado, afectación axilar, receptores de estrógenos, de progesterona, pS2 y glucoproteína p.
El ácido hialurónico (AH) es un componente de la matriz extracelular (MEC) y está involucrado en el crecimiento tumoral y las metástasis, siendo más abundante en los tejidos fetales o con un rápido crecimiento. Su acumulación es característica de las células tumorales mamarias y la cantidad se correlaciona con el grado de malignidad de las células productoras, lo que puede ser indicador de progresión tumoral en ciertas lesiones premalignas35-41. En los procesos benignos mamarios, el AH se localiza en la estroma, siendo negativas las células epiteliales ductales; por el contrario, en los tumores la intensidad estromal es mayor y se detecta en las membranas celulares o en el citoplasma. En los carcinomas ductales, la expresión intensa de AH en la estroma y en las células tumorales se correlaciona significativamente con una peor diferenciación, lo que sugiere que este proteoglicano está involucrado en la progresión de los mismos37.
En un trabajo previo42 estudiamos el comportamiento de la isoforma CD44v6 en 168 carcinomas ductales infiltrantes de mama, apreciando que los casos positivos cursaron con mayores concentraciones de receptores de estrógenos (p = 0,005), de progesterona (p = 0,002) y catepsina D (p = 0,016), así como menores del receptor del factor de crecimiento epidérmico (EGFR), que rozaron la significación estadística (p = 0,051), mientras que no se apreciaron diferencias con otros parámetros clínicos y biológicos analizados. Todo ello nos sugería que la expresión del CD44v6 se asociaba directamente con parámetros de diferenciación celular, lo que hace suponer una conexión con un mejor pronóstico.
Dada la discordancia descrita en los resultados acerca del comportamiento y utilidad clínica del CD44v6 en los carcinomas de mama, y que una de las funciones biológicas más importantes del CD44 es unir y degradar el ácido hialurónico, nos pareció de interés estudiar si este proteoglicano era capaz de modular algunas características clinicobiológicas de los carcinomas ductales infiltrantes de mama CD44v6 positivos, como ya habíamos demostrado previamente con la variante CD44v542, lo cual contribuiría a conocer mejor la fisiopatología de la isoforma y explicar los distintos resultados obtenidos con el estudio exclusivo de la molécula de adhesión.
Material y métodos
El grupo de estudio incluyó 63 casos de carcinomas ductales infiltrantes de mama (CDI) CD44v6 positivos. De ellos, 62 fueron clasificados en función de la positividad para el ácido hialurónico de membrana y 63 lo fueron en función de la positividad para el ácido hialurónico citosólico, tomando como umbrales las cifras de 1.500 y 4.800 ng/mg de proteína, que corresponden a las medianas obtenidas previamente en 252 CDI.
Las muestras tisulares fueron limpiadas de sus componentes grasos, congeladas y almacenadas en nitrógeno líquido hasta su homogenización. Ésta se realizó en un tampón (Tris 0,1 mol/l, EDTA Na2 0,015 mol/l, glicerol al 10%, monotioglicerol al 0,01%, pH 7,5) y en frío mediante un microhomogenizador (OMNI 1000, Waterbury, CT, EE.UU.), siendo después centrifugadas a 1.500 rpm durante 10 min y, posteriormente, el sobrenadante se sometió a una ultracentrifugación a 100.000 g durante 1 h a 4 ºC. El nuevo sobrenadante (citosol) fue utilizado para la determinación de los receptores de estrógenos (RE) (EIA, Abbott, EE.UU.), de progesterona (RP) (EIA, Abbott, EE.UU.), pS2 (IRMA, CIS Biointernacional, Francia), catepsina D (CAT-D) (IRMA, CIS Biointernacional, Francia) y activador del plasminógeno tipo tisular (t-AP) (EIA, Boehringer Mannheim, Alemania). El precipitado (pellet) fue empleado para determinar el receptor del factor de crecimiento epidérmico (EGFR) (RLG, Viennalab, Austria) y la proteína oncogénica
erbB2/neu (EIA, Oncogene, EE.UU.). La ploidía y la fase de síntesis (fase S) fueron medidas por citometría de flujo (Bencton Dickinson, Fascam) a partir de muestras en fresco. Asimismo, se tuvieron presentes el tamaño, la afectación ganglionar axilar, el grado histológico y el estado menopáusico. Los resultados fueron expresados en mg de proteína, determinados mediante el método de Bradford. Los umbrales de positividad para los diferentes parámetros fueron, según nuestra experiencia, los siguientes: 10 fmol/mg de proteína para los RE y RP; 5 ng/mg de proteína para la pS2; 50 pmol/mg de proteína para la catepsina D; 4,5 fmol/mg de proteína para el EGFR; 6.000 NHI/mg de proteína para la proteína oncogénica erbB2/neu de membrana y un 7 y un 14% para la fase de síntesis celular. El estudio estadístico fue realizado mediante el programa BMDP3; como los diferentes parámetros biológicos no siguieron una distribución normal, hemos empleado pruebas no paramétricas, así como la de la *2. Por ello, los resultados se han expresado mediante el intervalo y los percentiles 25, 50 y 75. Se consideró estadística una diferencia cuando el valor de p < 0,05.Resultados
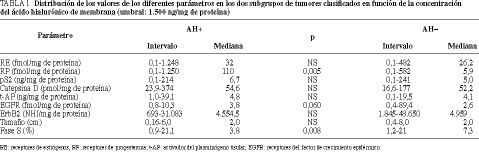
Como se observa en las tablas 1 y 2, los tumores de membrana positivos para ácido hialurónico presentaron mayores concentraciones de receptor de progesterona (p = 0,005), siendo con más frecuencia positivos para receptor de progesterona (p = 0,000) y asociándose al estado premenopáusico (p = 0,044). Por el contrario, los casos negativos para ácido hialurónico presentaron con más frecuencia invasión ganglionar axilar superior a 3 ganglios (p = 0,048), aneuploidía (p = 0,022) y mayores cifras globales de fase de síntesis celular (p = 0,008).
Cuando consideramos el ácido hialurónico citosólico (AHc), y como se aprecia en las tablas 3 y 4, los tumores positivos para AHc tuvieron mayores concentraciones de activador del plasminógeno tipo tisular (p = 0,005) y del receptor del factor de crecimiento epidérmico (p = 0,028). Por el contrario, los tumores negativos fueron más frecuentemente aneuploides (p = 0,028).
Discusión
La familia del CD44 es un nuevo grupo de moléculas de adhesión de la membrana celular que desempeñan un importante papel en la transformación tumoral y el comportamiento metastásico de numerosos tumores. En relación con la isoforma CD44v6 y los carcinomas mamarios, los resultados descritos en la bibliografía son discordantes. Así, Lyzak et al24 describen, en tumores T1a y T1b no palpables, un 97 y un 100% de positividades en los casos sin y con afectación ganglionar axilar, respectivamente, no correlacionándose, pues, su expresión con las metástasis ganglionares, cosa que sí hizo la forma estándar. Aceituno et al25 observan un 41,3% de positividades, que se relacionaban discretamente con la fase de síntesis y el grado histológico, pero no con la agresividad del tumor. Hefler et al26, estudiando la isoforma en el citosol, comprueban que su expresión es regulada positivamente con la transformación maligna, pero que no es necesaria para adquirir el fenotipo metastásico. Tempfer et al27 describen un 24% de positividades en los tumores primitivos y un 92% en los ganglios metastásicos, siendo la supervivencia a los 5 años mayor en los casos negativos (81%) que en los positivos (62%), lo que también ocurrió con el intervalo libre de enfermedad; sin embargo, la isoforma no logró ser un factor pronóstico independiente. Kaufmann et al28 observan un 84% de positividades en los tumores primitivos, teniendo los casos negativos un mejor pronóstico que los positivos y demostrándose la isoforma como un factor pronóstico independiente junto a los receptores de progesterona, invasión ganglionar, tamaño y grado histológico. Por el contrario, Guriec et al29 constatan que la expresión de variantes con exones v6 y v10 y
con exones del v6 al v10 se correlacionó con mayores porcentajes de intervalo libre de enfermedad y mejor evolución en los casos N0M0. Regidor et al30 no la relacionan con la capacidad metastásica; Jansen et al31 no la consideran un factor pronóstico, mientras que sí lo fue la isoforma v3 (CD44v2)32, y Bankfalvi et al33 demuestran que el descenso de la expresión de la cadherina E unida a la negatividad para la CD44v6 se asociaba con una peor supervivencia. En nuestra experiencia42, la positividad para esta isoforma se asoció con la hormonodependencia, hecho que, unido a su correlación inversa con la aneuploidía, nos sugería la posibilidad de que reflejara un posible mejor pronóstico. La mayoría de los estudios se refieren exclusivamente a la expresión de la isoforma, no prestando atención a su principal ligando: el ácido hialurónico (AH). Este proteoglicano de la matriz extracelular está asociado con la génesis y evolución de los tumores mamarios35-41 y, tras su unión al CD44, se internaliza celularmente y se degrada, fenómeno que se asocia con una mayor proliferación y agresividad8. Si el efecto biológico final parece ser consecuencia del balance AH/CD44 y no de cada uno de estos parámetros aisladamente, creímos que sería de interés estudiar si la concentración de AH era capaz de modular ciertas propiedades clinicobiológicas de los carcinomas ductales infiltrantes de mama positivos para ciertas isoformas del CD44. En un estudio previo43 comprobamos que los tumores CD44v5 positivos con poco ácido hialurónico de membrana presentaban más frecuentemente un grado histológico 3, aneuploidía y positividad para la catepsina D, lo cual sugería un posible peor comportamiento. Los mismos resultados observamos cuando consideramos la concentración del ácido hialurónico citosólico (datos no expuestos). Estos hallazgos concordaban con lo observado en ciertos tumores cerebrales44. Estos hechos nos indujeron a estudiar si el AH citosólico y de membrana también modulaba ciertas propiedades clinicobiológicas en los carcinomas ductales infiltrantes de mama CD44v6 positivos. Cuando consideramos el AH de membrana, pudimos comprobar que los casos negativos para AH presentaron menores concentraciones y porcentajes de positividades para el receptor de progesterona, siendo con más frecuencia aneuploides, proliferativos y con afectación axilar superior a 3 ganglios. Estos fenómenos que explican su menor asociación con el estado premenopáusico y reflejan un peor comportamiento clínico45-48. Cuando consideramos el AH citosólico, los tumores AH negativos presentaron menores concentraciones del activador del plasminógeno tipo tisular (t-AP) y del receptor del factor de crecimiento epidérmico (EGFR), siendo más frecuentemente aneuploides; asimismo, tampoco se asociaron con el estado premenopáusico. El t-AP se correlaciona a nivel citosólico con los receptores esteroides y es un indicador adicional del estado funcional de los mismos, pudiendo utilizarse para planificar el tratamiento hormonal49-51. En relación con el EGFR, se ha observado que su expresión se relaciona inversamente con los receptores de estrógenos y de progesterona, si bien es posible detectar positividades en el 30% de los carcinomas mamarios positivos para RE o para RP; asimismo, no se correlaciona con la edad, estado menopáusico, tipo histológico, tamaño tumoral, afectación axilar, ploidía, proliferación, receptores del factor de crecimiento insulínico (IGFR), de la prolactina, del factor liberador de la hormona luteínica (LH-RH-R) y el grado tumoral (sólo el 50% de las series publicadas)52. Recientemente53, se ha observado que este receptor no es necesario para mantener la diferenciación funcional, pero sí para el crecimiento y diferenciación de las células inmaduras y para la supervivencia de las células diferenciadas a término, lo cual nos induce a considerar que la mayor concentración y positividad observada en los tumores AH positivos es consecuencia de la supervivencia de las células tumorales diferenciadas, lo cual concuerda con los otros hallazgos descritos.Los resultados anteriores apoyan nuestros resultados obtenidos con la isoforma CD44v5 y resaltan el posible papel biológico del CD44v6 y su ligando (AH) como una unidad funcional. La positividad para el CD44v6 asociada a menores concentraciones de AH parece reflejar una mayor indiferenciación celular y una incrementada proliferación, lo cual puede asociarse a un peor comportamiento y evolución. Asimismo, podría ayudar a explicar las discrepancias descritas en la bibliografía cuando se analizan por separado cada uno de los dos factores.