Introducción
Los sarcomas son tumores poco frecuentes que se desarrollan a partir de células mesenquimales. Su incidencia es de 2 a 3 casos por cada 100.000 habitantes/año, lo que corresponde al 1% del total de las neoplasias. Su mortalidad se sitúa alrededor del 50%, por lo que son la causa del 2% del total de muertes debidas a cáncer. La mitad de los sarcomas se localiza en las extremidades, y el 30% crece en la zona intraabdominal. Su estudio es complejo debido a lo variado de su histopatología, localización y comportamiento1, lo que requiere de un equipo multidisciplinario para su tratamiento.
El sarcoma diagnosticado precozmente es potencialmente curable. Las tasas de supervivencia presentes en la literatura médica varían entre el 12 y el 70%2. Sin embargo, los resultados en sarcomas abdominales localmente avanzados son mucho peores, y muestran un tiempo de supervivencia medio de 8-12 meses1, con una tasa de supervivencia de prácticamente cero.
El pronóstico lo definen 3 factores: localización anatómica e invasión locorregional que determinan su resecabilidad, tamaño y grado histológico3.
Tradicionalmente, la cirugía ha sido el tratamiento de elección, con un éxito limitado por la tasa de recurrencia local cercana al 90% en algunas series. Esto ha hecho necesario la introducción de tratamientos complementarios a la cirugía con intención de mejorar el pronóstico4. Los tratamientos adyuvantes y neoadyuvantes han obtenido resultados de distinto impacto. El uso de la quimioterapia sistémica es controvertido, se utiliza en el tratamiento de la enfermedad metastática y como adyuvante para reducir la recidiva local, sin haber obtenido hasta el momento una mejoría de la supervivencia clara1. La radioterapia externa ha demostrado reducción de la recurrencia local en el sarcoma de extremidades, pero su uso en el abdomen está limitado por los efectos perniciosos que la radiación produce en las estructuras adyacentes al tumor5-7.
En la actualidad, se han desarrollado nuevas técnicas que aplicadas durante la cirugía potencian el tratamiento quirúrgico, con el fin de mejorar el control local de la enfermedad, disminuir la recurrencia y potencialmente mejorar la supervivencia. Las 2 que vamos a analizar son la radioterapia intraoperatoria (RIO), que consiste en la administración de altas dosis de radiación en el lecho quirúrgico una vez hecha la resección, y la quimioterapia intraperitoneal intraoperatoria hipertérmica (QIOH), que consiste en la administración de agentes quimioterapéuticos dentro del abdomen, una vez realizada la resección quirúrgica, con el fin de destruir los implantes peritoneales microscópicos. En este artículo, discutimos el papel que la RIO y la QIOH pueden desempeñar en el tratamiento de los sarcomas abdominales localmente avanzados y la sarcomatosis peritoneal, respectivamente, la factibilidad de los procedimientos y los resultados en los pacientes de nuestra serie.
Material y métodos
Definimos los sarcomas abdominales localmente avanzados como aquellos tumores que cumplen 2 o más de los siguientes criterios: tumor mayor de 5 cm (T2), invasión ganglionar (N1), recidiva y/o invasión de otras estructuras diferentes de su origen. La sarcomatosis peritoneal se considera siempre una enfermedad localmente avanzada.
Definimos la intensificación terapéutica intraoperatoria como las técnicas aplicadas durante la intervención quirúrgica y como complemento a ella, utilizadas para mejorar el resultado de la resección quirúrgica en enfermedad localmente avanzada, con el objetivo de mejorar el control local de ésta y, potencialmente, la supervivencia. Usamos 2 tipos distintos: la RIO y la QIOH.
La RIO consiste en la administración durante la cirugía de altas dosis de radiación de forma directa sobre el lecho tumoral. Una vez realizada la resección quirúrgica y con el abdomen abierto, el paciente es trasladado a un búnker donde se le administra, mediante un acelerador de electrones, una dosis de 1.000 a 1.250 cGy por campo, sobre uno o varios campos en función de la superficie del lecho tumoral con conos de entre 8 y 12 cm de diámetro. El efecto sobre las estructuras adyacentes es mínimo o nulo, y el objetivo es reducir la tasa de recurrencia local y disminuir los efectos secundarios de la radioterapia. Este tratamiento se ha aplicado en distintos tipos de enfermedad maligna. El tratamiento propuesto para los sarcomas abdominales avanzados fue resección en bloque del tumor y estructuras invadidas más RIO. Los detalles de nuestra técnica han sido previamente descritos8-10.
La citorreducción masiva sin residuo macroscópico unida a la QIOH es una opción de tratamiento de la sarcomatosis peritoneal, una enfermedad hasta hace poco considerada intratable. El procedimiento consiste en la realización de una citorreducción completa o máxima sin residuo macroscópico, con resección de la masa tumoral y electroevaporación con bisturí eléctrico de los implantes tumorales. Posteriormente se administra la QIOH utilizando como fármacos quimioterapéuticos la doxorrubicina a dosis de 15 mg/cm2 y el cisplatino a dosis de 50 mg/cm2 diluidos en 2 l de peritofundina. La mezcla se calienta a una temperatura de entre 41 y 43 °C, y se infunde a la cavidad abdominal donde recircula mediante un sistema cerrado de infusión y recogida durante 90 min. En este período, el abdomen permanece abierto y elevado con un plástico estéril según la técnica de "coliseo" descrita por Sugarbaker11. La utilización de la QIOH se basa en la acción directa de los agentes quimioterapéuticos a altas temperaturas (42 °C), lo que favorece su efecto sobre el residuo tumoral microscópico tras la citorreducción quirúrgica11. En el postoperatorio inmediato, se administra un ciclo de 5 sesiones de quimioterapia intraperitoneal no hipertérmica con 5-FU.
Analizamos de forma retrospectiva el impacto de la intensificación terapéutica intraoperatoria (RIO y QIOH) en un grupo de pacientes diagnosticados de sarcoma abdominal avanzado y sarcomatosis peritoneal. Analizamos tasas de recurrencia local, supervivencia global y supervivencia libre de enfermedad.
Desde diciembre de 1996 hasta octubre de 2005, se evaluó y trató en nuestro servicio a 20 pacientes con el diagnóstico de sarcoma abdominal avanzado (según definición previa) y 5 con el de sarcomatosis peritoneal.
La estadificación tumoral se realizó de acuerdo con el American Joint Commitee on Cancer (AJCC). En nuestra serie incluimos casos que presentaban invasión de grandes vasos y aquellos con sarcomatosis peritoneal que previamente se han excluido en otras series12,13.
El grado histológico ha sido motivo de controversia en múltiples publicaciones. Existen varias clasificaciones, pero nosotros usamos la del AJCC que los divide en alto, medio y bajo grado de malignidad14.
Usando esta clasificación y los criterios definidos previamente, todos los pacientes de la serie presentaban sarcomas abdominales localmente avanzados.
La cirugía realizada para el tratamiento de los sarcomas abdominales avanzados se clasificó en 3 categorías: a) R0, resección completa sin residuo microscópico en los márgenes; b) R1, resección macroscópicamente completa con invasión microscópica de márgenes, y c) R2, resección incompleta.
La radicalidad de la citorreducción llevada a cabo en los pacientes con sarcomatosis peritoneal se clasifica según la puntuación CC (Completeness of Cytorreduction Score). CC-0 implica que no hay residuo visible; CC-1, residuo menor de 2,5 mm de diámetro; CC-2 supone residuo tumoral con nódulos de entre 2,5 mm y 2,5 cm, y CC-3, masa residual superior a 2,5 cm. Se consideran citorreducciones óptimas las CC-0 y CC-1.
Usamos 2 tipos distintos de intensificación terapéutica intraoperatoria tras la resección quirúrgica: RIO para los sarcomas localmente avanzados y QIOH para la sarcomatosis peritoneal. Tras la resección, y en el mismo tiempo quirúrgico, 20 pacientes recibieron RIO, 4 QIOH, y en un paciente se combinaron ambos procedimientos (este paciente se incluye dentro del grupo de QIOH).
Las variables estudiadas fueron: sexo, edad, diagnóstico anatomopatológico, grado de malignidad, presentación (primario/recidiva), radicalidad de la cirugía, RIO, QIOH, radioterapia externa, quimioterapia sistémica y resección visceral y vascular mayor.
Los criterios para incluir a un paciente en el programa de RIO fueron la presencia de sarcoma abdominal localmente avanzado, según lo definido, sin criterios quirúrgicos de irresecabilidad. Y en el programa de QIOH, pacientes con sarcomatosis peritoneal. Excluimos a los pacientes que presentaban metástasis a distancia.
El seguimiento postoperatorio se realizó en consulta cada 3 meses el primer año, con tomografía computarizada (TC)/resonancia magnética (RM) cada 6 meses; y cada 6 meses en lo sucesivo con TC/RM cada año.
El análisis de supervivencia se realizó mediante el operador de Kaplan-Meier con el programa estadístico SPSS 12.5.
Resultados
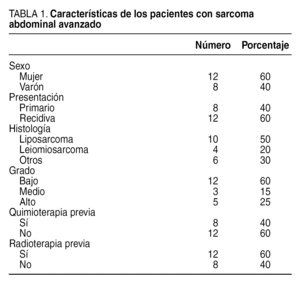
De los pacientes con sarcomas abdominales avanzados, el 60% (n = 12) eran mujeres y el 40% (n = 8) eran varones. La edad media fue de 45,5 años con un rango entre 18 y 74. El 40% de los pacientes presentaba tumores primarios, y el 60%, recidivas. Todos los pacientes presentaban tumores mayores de 5 cm (T2). El tipo histológico predominante fue el liposarcoma con el 50% de los casos (n = 10), seguido por el leiomiosarcoma con el 20% (n = 4), y otros tipos el 30% (hemangiopericitoma, condrosarcoma, rabdiomiosarcoma, fibrosarcoma). El grado de malignidad de los tumores fue bajo en 12 casos (60%), intermedio en 3 (15%) y alto en 5 (25%) (tabla 1).
El número de intervenciones quirúrgicas llevadas a cabo (incluyendo cirugías de recidiva) fue de 29. De ellas, 24 (83%) fueron resecciones R0, resección R1 (3%), 3 resecciones R2 (10%) y una biopsia sin resección por irresecabilidad del tumor (hallazgo intraoperatorio de metástasis hepáticas no conocidas). Todas las intervenciones R0 y R1, excepto una, requirieron resección parcial o completa de uno o más órganos invadidos (tabla 2). Se llevaron a cabo 3 sacrectomías y 8 resecciones vasculares mayores: 2 sustituciones de aorta infrarrenal, 2 sustituciones de vena cava infrarrenal y 4 resecciones de vena cava infrarrenal sin sustitución. El número total de procedimientos con RIO fue de 25.
La mortalidad peroperatoria fue del 10%, 2 casos: uno de ellos por hemorragia pélvica no controlada intraoperatoriamente y otro por trombosis de la arteria basilar en el postoperatorio inmediato. La morbilidad postoperatoria fue del 45%, generalmente infecciosa (neumonías, abscesos intrabdominales, infecciones de herida). Las complicaciones se solucionaron con tratamiento antibiótico intravenoso y ocasionalmente drenaje percutáneo de las colecciones intrabdominales. Fue necesaria una relaparotomía por síndrome compartimental.
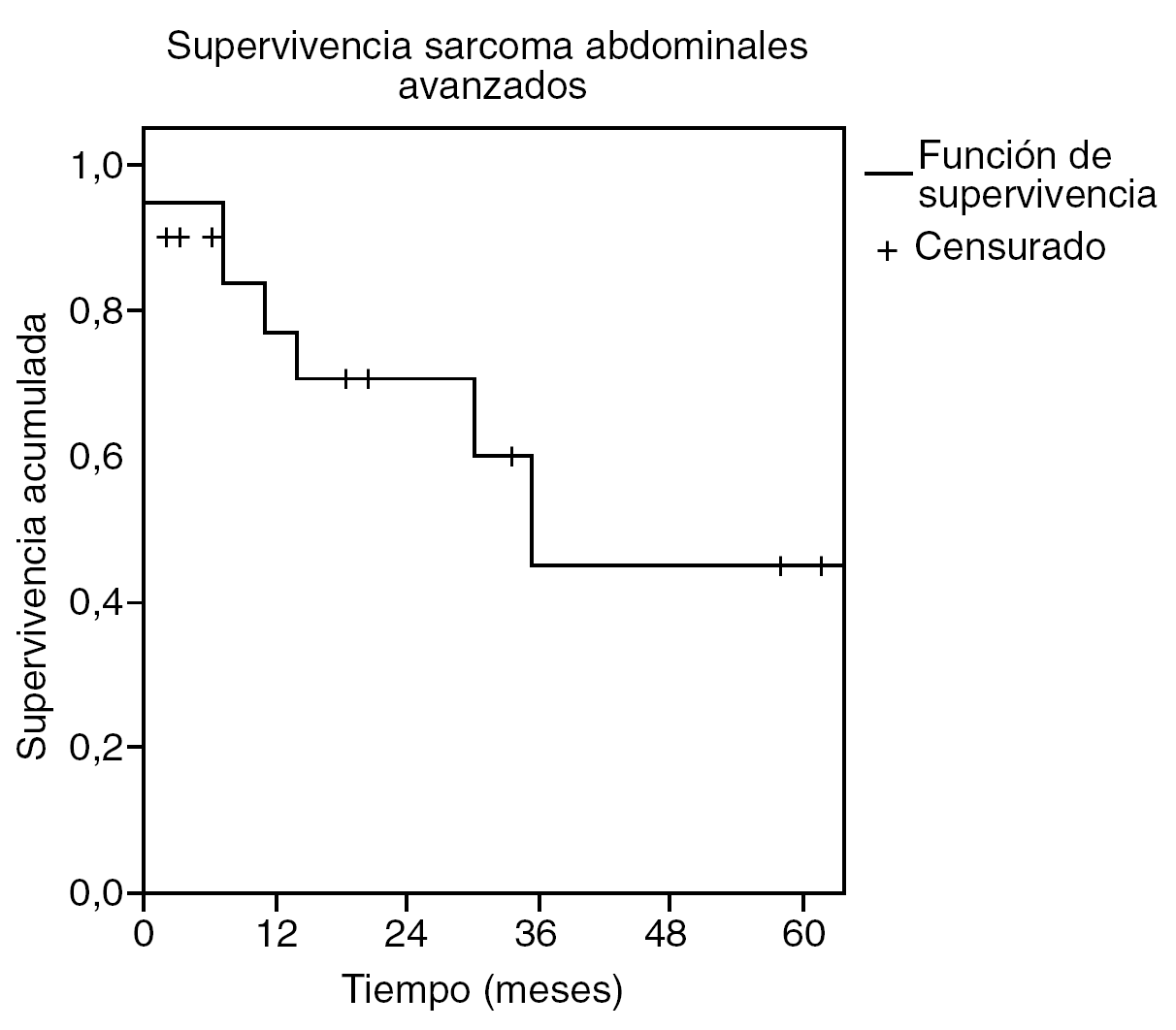
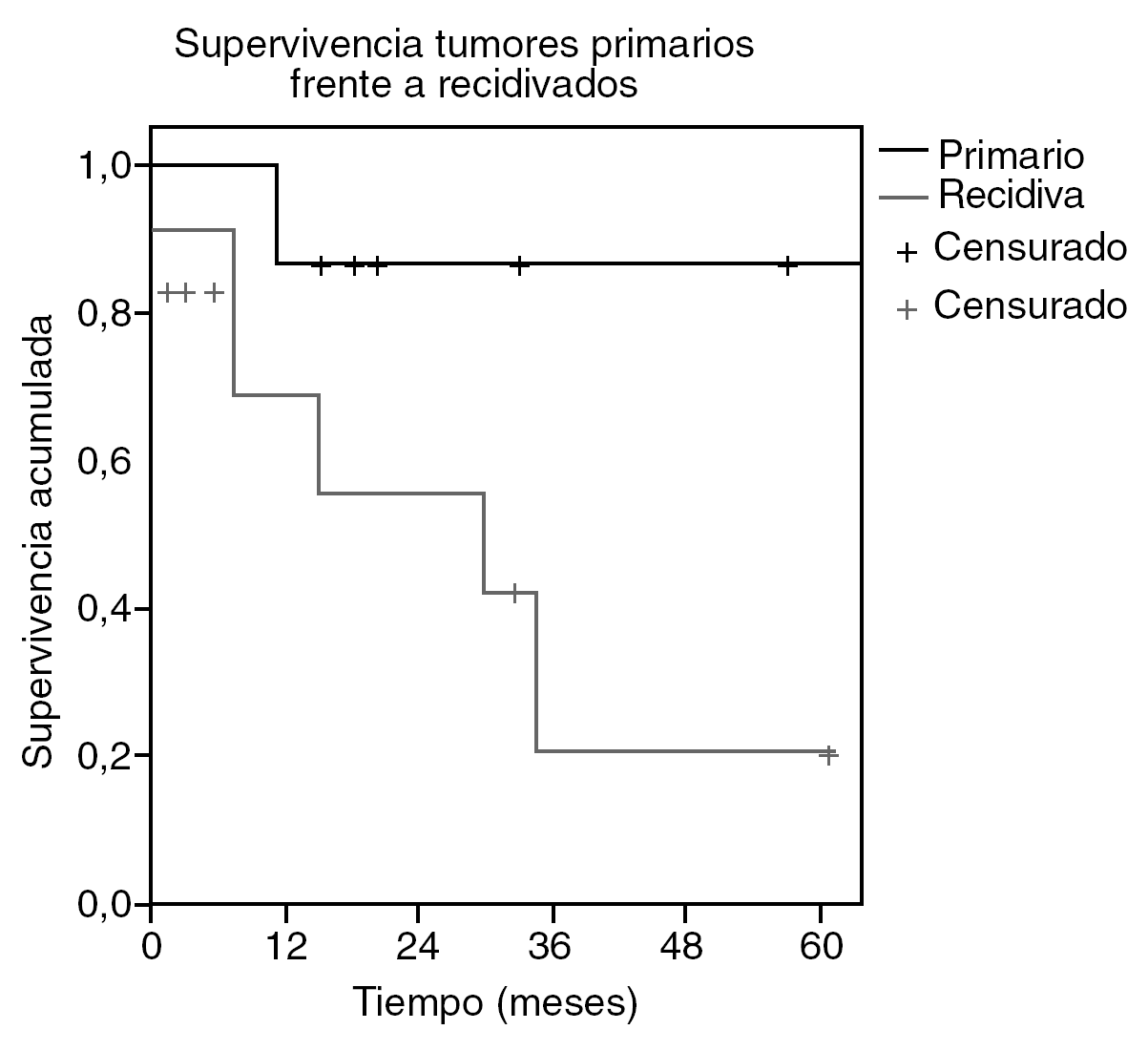
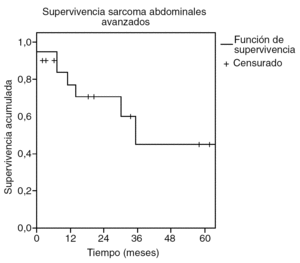
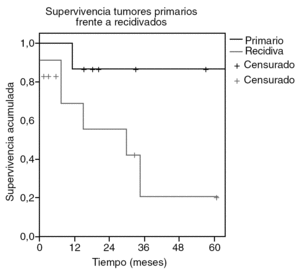
Los pacientes tratados de sarcoma abdominal sin sarcomatosis presentaron una tasa de supervivencia del 65% a los 26 meses (fig. 1), con un tiempo medio de supervivencia estimado de 59 meses (intervalo de confianza [IC] del 95%, 32-85). Por tanto la estimación de supervivencia a los 5 años se sitúa en el 50%. La supervivencia media de los tumores primarios se estima en 94 meses (IC del 95%, 72-116) y la de los recidivados en 27 meses (IC del 95%, 12-42) (fig. 2). La tasa de recurrencia local fue del 39%.
Fig. 1. Supervivencia de los sarcomas abdominales avanzados.
Fig. 2. Supervivencia de los sarcomas primarios frente a los recidivados.
Se evaluó a los 5 pacientes que presentaban sarcomatosis peritoneal como tumores recidivados con una o varias cirugías previas (rango de 1 a 5). De ellos, 3 eran mujeres y 2, varones. La edad media fue de 42,2 años con un rango entre 38 y 43. Los tipos histológicos fueron: liposarcomas (2 casos), leiomiosarcomas (2 casos) y adenosarcoma mülleriano (1 caso). Y los grados de malignidad: alto en 2 pacientes, medio en 1 y bajo en los otros 2.
Se llevó a cabo un total de 9 cirugías, de las cuales 6 fueron citorreducciones óptimas (CC-0 o CC-1) seguidas de QIOH. En un paciente ambas técnicas de intensificación terapéutica intraoperatoria (QIOH por sarcomatosis y RIO sobre el lecho tumoral de la masa dominante) se combinaron en la misma intervención quirúrgica. Al año de seguimiento se reintervino a 2 pacientes para la reconstrucción del tránsito: en uno se halló un implante único que fue resecado, y el otro estaba libre de enfermedad. Un paciente fue reintervenido por recidiva a los 14 meses y se llevó a cabo citorreducción CC-3 paliativa sin QIOH.
No hubo mortalidad peroperatoria. Todos los pacientes, excepto uno, presentaron complicaciones en el postoperatorio inmediato. Sólo en un caso fue grave, al presentar un síndrome de distrés respiratorio que requirió ingreso en la unidad de vigilancia intensiva e intubación orotraqueal. La administración de quimioterapia intraperitoneal produjo como complicación característica, 2 casos de neutropenia que obligaron a suspender de forma prematura el ciclo de quimioterapia postoperatoria. La tasa de reintervención fue de 0.
Tras 20 meses de seguimiento medio, el 60% de los pacientes (n = 3) está vivo, y 2 de ellos libres de enfermedad.
Las variables sexo, edad, diagnóstico anatomopatológico, grado y adyuvancia/neoadyuvancia no mostraron relevancia clínica para ninguno de los 2 tipos de pacientes, y no permiten sacar conclusiones probablemente debido a la escasa cantidad de casos.
Discusión
Actualmente, los sarcomas, en general, y los abdominales, en particular, representan un importante reto para el cirujano oncológico, y por el momento no existe un tratamiento definitivamente establecido.
La cirugía con resección en bloque es la base del tratamiento. Los avances en la técnica quirúrgica han supuesto importantes mejoras en las tasas de supervivencia. En el año 2001, Pirayesh et al2 realizaron un revisión en la que analizaron los resultados de la cirugía como único tratamiento para los sarcomas abdominales y compararon las tasas de supervivencia de las series históricas y la suya propia. La primera serie es de Pack y Tabah de 1954 en el Memorial Sloan Ketering Center (MSKCC), con una tasa de supervivencia del 2% a los 5 años. Las más recientes varían entre el 20% de Jenkins et al15 en 1996 hasta el 74% de Jaques et al4 en 1990, mientras que la propia de Pirayesh es del 22%16-28. Todo ello indica un importante avance gracias al perfeccionamiento de la técnica quirúrgica, así como una gran variabilidad de los resultados en las distintas series.
La serie más voluminosa de pacientes presentada hasta el momento, que analiza el impacto de la cirugía como único tratamiento en la supervivencia de los sarcomas abdominales, es la de Lewis et al13 del MSKCC de 1998. En ella se analizó un total de 500 casos, de los cuales 278 (56%) eran tumores primarios y 222 (44%), tumores recidivados. Excluyeron como variable para el análisis la adyuvancia y se centraron en los tumores primarios, también excluyeron las recidivas y consideraron como irresecables aquellos que presentaban invasión vascular mayor y/o diseminación peritoneal. Su tasa de supervivencia actuarial a los 5 años se situó en el 54%.
El gran problema de los sarcomas radica en la gran incidencia de recidiva local, que en algunas series alcanza al 90% de los pacientes. La cirugía, a pesar de ser el factor que más influye en la supervivencia, ha alcanzado su techo terapéutico y es incapaz de controlar la recurrencia local. Por ello es necesario buscar alternativas que la complementen.
La radioterapia externa ha obtenido importantes resultados en el tratamiento de los sarcomas de las extremidades. Su uso queda limitado en los sarcomas abdominales debido a la toxicidad que produce en las estructuras adyacentes5-7.
Actualmente, el desarrollo de nuevos tratamientos ha hecho posible llevar a cabo procedimientos de intensificación terapéutica durante el acto quirúrgico como complemento a la resección en bloque.
La RIO se está usando de forma cada vez más frecuente con buenos resultados. En 1993, Gunderson et al29 publicaron los resultados de una serie de 20 casos de sarcomas retroperitoneales avanzados tratados con cirugía y RIO, con una tasa de supervivencia del 70%. En 1995, Dubois et al30 presentaron a 31 pacientes, de los cuales 13 eran pacientes con sarcomas retroperitoneales y pélvicos, y 18 con sarcomas de tronco y extremidades. Tras el tratamiento, su tasa de supervivencia a los 5 años fue del 64% (69% en tumores primarios y 60% en recidivas). En el año 2000, Alektiar et al12 publicaron una serie de 49 pacientes de los cuales 23 fueron tratados con cirugía y RIO, con una tasa de supervivencia a los 5 años del 45%. Lehnert et al31, también en el 2000, presentaron una serie de 251 pacientes con sarcomas retroperitoneales, de tronco y de extremidades, de los cuales 92 fueron tratados con cirugía y RIO que dio como resultado una disminución del 40% en las tasas de recurrencia y mortalidad debida a la enfermedad. En el año 2002, Gilbeau et al32 presentaron 45 casos de sarcomas retroperitoneales con una supervivencia a los 5 años del 65%. En el año 2003 Bobin et al33 publicaron su serie de 24 casos con una supervivencia global y libre de enfermedad del 56 y 28%, respectivamente.
Solamente existe un estudio prospectivo aleatorizado que compara cirugía con RIO y cirugía sin RIO en el tratamiento de lo sarcomas. Este estudio lo realizaron Sindelar et al34 en 1993 y en él se incluyó a 35 pacientes. El tratamiento administrado en 15 de ellos fue cirugía, RIO y radioterapia externa, mientras que los otros 20 sólo recibieron cirugía y radioterapia externa. Aunque no demostró una diferencia en las tasas de supervivencia, sí demostró una mejoría estadísticamente significativa en el control local de la enfermedad con disminución de la recidiva local. Asimismo, las complicaciones locales derivadas de la radioterapia de los pacientes con RIO fueron menores, aunque presentaron mayor tasa de neuropatías.
Todo ello parece indicar que la RIO aporta un beneficio añadido a la cirugía con el objetivo de reducir la tasa de recurrencia local de los sarcomas abdominales.
En este artículo presentamos una serie de pacientes con sarcomas abdominales considerados como avanzados, que son tratados con cirugía radical y RIO. La tasa de supervivencia del 65% a los 26 meses, con una estimación a los 5 años del 50%, coincide con los resultados ofrecidos por otras series de la literatura médica que utilizan cirugía radical más RIO29-34 como tratamiento de los sarcomas avanzados, y parece superar los resultados de las series que utilizan la cirugía como único tratamiento16-28. En nuestro centro se realizó un estudio retrospectivo previo en el que se comparaba los resultados en pacientes diagnosticados de sarcomas abdominales tratados con cirugía con y sin RIO. La supervivencia a los 3 años era del 50% para los pacientes que recibieron RIO y del 35% para los que no la recibieron35. Asimismo, parece existir una reducción de la tasa de recurrencia local.
La sarcomatosis peritoneal es la forma localmente más avanzada de presentación de los sarcomas abdominales. Generalmente es consecuencia de la diseminación de la enfermedad dentro de la cavidad abdominal durante cirugías previas, aunque ocasionalmente puede ser producida por fisuración del tumor y vertido de células a la cavidad abdominal. No es usual, por tanto, que se presente como tumor primario y sí como recidiva. Hasta hace poco ha sido considerada como una enfermedad incurable y se incluye como criterio de exclusión en muchas series de sarcomas abdominales. La QIOH es actualmente el procedimiento a añadir a la cirugía con intención curativa. Su efectividad está aún por demostrar de forma definitiva mediante estudios prospectivos. Las series publicadas por Sugabaker11 con estudios en fase II, muestran unas tasas de supervivencia del 40%. Berthet et al36, en una revisión de 1999, presentaron una tasa de supervivencia del 75% para pacientes con diseminación peritoneal y un índice de sarcomatosis menor de 13 según el score diseñado por Sugarbaker. En el año 2004 se publicó un estudio prospectivo que incluía a 60 pacientes diagnosticados de sarcomatosis peritoneal y que tras cirugía radical y QIOH presentaron una tasa de supervivencia del 47% con una mediana de tiempo de seguimiento de 28 meses37.
Los sarcomas abdominales continúan siendo una enfermedad infrecuente de difícil tratamiento, y con una supervivencia limitada a pesar de tratamiento quirúrgico completo. Actualmente, la cirugía como único tratamiento ha alcanzado su techo terapéutico, y se muestra insuficiente para el tratamiento de los sarcomas abdominales avanzados y de la sarcomatosis peritoneal. Los tratamientos adyuvantes (quimioterapia sistémica y radioterapia externa) no suponen una solución definitiva. Las técnicas de intensificación terapéutica intraoperatoria aparecen como una nueva opción. La RIO puede ser una técnica a asociar a la cirugía radical con el objeto de disminuir la tasa de recurrencia local, mejorar el control local de la enfermedad y, en consecuencia, la supervivencia de estos pacientes. La citorreducción y la QIOH son en la actualidad una opción real de tratamiento con intención curativa para la sarcomatosis peritoneal. Serán necesarios estudios prospectivos que demuestren las razones para su uso y establezcan el beneficio que pueden proporcionar.
Correspondencia: Dr. E. Velasco Sánchez.
Campoamor, 9. Esc. dcha, 3.o 3.a. 28010 Madrid. España.
Correo electrónico: envelasco@hotmail.com
Manuscrito recibido el 7-12-2005 y aceptado el 15-6-2006.