La diferencia cada vez mayor entre el número de pacientes en espera para un trasplante hepático y el número de donantes disponibles ha generado un gran interés en la utilización de órganos «no ideales» como es el caso de los provenientes de donantes en asistolia. Sin embargo, la sensibilidad de estos hígados a la isquemia hace que su tasa de utilización sea baja y las tasas de complicaciones y retrasplante mayores que en el trasplante convencional. Las máquinas de perfusión normotérmica exvivo (MPN) surgen como una opción para intentar mantener la viabilidad de estos órganos e incluso mejorar su función. Esta revisión se centra en los resultados actuales obtenidos en el trasplante hepático con órganos provenientes de donantes en asistolia y el papel que puede tener la MPN en este campo.
The increasing difference between the number of patients in waiting lists for liver transplantation and the number of available donors has generated a great interest in the use of non-ideal organs, like grafts obtained from cardiac death donors (DCD). However, the extreme sensibility to ischemia of these livers results in a low utilization rate and a high percentage of post-transplant complications and re-transplantation. Normothermic perfusion machines (NMP) emerged as an alternative that tries to maintain the viability of the organ and even to improve its function. This review focuses on current results of DCD liver transplantation and on the role that NMP may have in this field.
El éxito del trasplante hepático (TH) ha tenido como efecto secundario un importante desequilibrio entre el número de pacientes que están en lista de espera (LE) para TH y la cantidad de órganos disponibles. Según los últimos datos de la UNOS, 15.290 pacientes se encontraban en LE para TH en EE. UU. al final del año 2012, mientras que en todo el año se habían realizado solo 6.256 trasplantes1. La situación es parecida en España, con 1.093 TH realizados en el año 2013, pero con 1.997 pacientes en LE2.
Una de las opciones disponibles para aumentar el número de injertos es la utilización de órganos provenientes de donantes en asistolia (DA). Sin embargo, debido al mayor tiempo de isquemia caliente (TIC) que generalmente se asocia a DA, el uso de este tipo de órganos está acompañado de mayores tasas de pérdida del injerto y otras complicaciones. La utilización de una máquina de perfusión normotérmica exvivo (MPN) sería muy interesante en el TH, donde la sensibilidad extrema del hígado a la isquemia hace que el índice de utilización de los órganos provenientes de DA sea muy bajo. Esta revisión se centra en la situación actual en la DA en el TH y el papel de las MPN en su futuro desarrollo.
Perspectiva histórica y situación legal actual en España de la donación en asistoliaA pesar de que los donantes utilizados al principio de los programas de trasplante eran DA, su uso no se ha generalizado después de la definición de la muerte encefálica de Harvard de 1967, debido a los malos resultados obtenidos3. Sin embargo, la poca disponibilidad de donantes considerados ideales y el éxito del trasplante renal de DA han hecho que esta tendencia se replanteara en los años 90.
En el año 1995, la reunión de consenso de Maastricht establece la clasificación de la DA (tabla 1)4.
La división de los DA en «controlados» y «no controlados» se añadió posteriormente y refleja la importancia del TIC en el pronóstico del respectivo órgano una vez trasplantado. En los donantes «controlados», el fallecimiento es esperado y, como consecuencia, el TIC es conocido (y, en la mayoría de los casos, menor). En cambio, el DA «no controlado» implica una parada cardiorrespiratoria no esperada. En estos casos el TIC suele resultar más difícil de calcular (y generalmente es mayor)5.
Tanto en EE. UU. como en Europa se han desarrollado guías clínicas para concretar los puntos claves de la DA (la definición de muerte cardiaca, TIC y tiempo de isquemia fría [TIF], niveles máximos de transaminasas, etc.)6,7. Aunque la utilización de estos criterios estrictos para seleccionar los donantes ha ayudado a bajar las tasas de complicaciones postrasplante, la proporción de TH con injertos provenientes de DA no ha aumentado en la última década6,8. A diferencia del trasplante renal de DA, un número importante de hígados queda descartado.
En España, la situación legal actual hace que la donación de DA sea todavía más interesante. Hasta hace poco, el único tipo de DA permitido en España era el no controlado9. Como consecuencia, nuestro grupo ha realizado un intenso trabajo experimental centrado en el DA tipo 2 para demostrar la utilidad de la oxigenación normotérmica por membrana extracorpórea10–15 y posteriormente ha realizado el protocolo de TH de DA tipo 2 con utilización sistemática de la perfusión regional normotérmica (PRN), cuyos resultados no son estadísticamente inferiores a los del TH de la donación de muerte encefálica (DME)7,16–18. La publicación del RD 1723/201219, que incluye la donación de tipo 3, supone un cambio importante de las perspectivas de la donación, sobre todo para centros con experiencia en DA.
Resultados actuales en la donación en asistoliaLos resultados del TH de DA a nivel mundial siguen siendo inferiores a los obtenidos en el TH con DME. Aunque en la mayoría de los estudios no hay una diferencia estadísticamente significativa en cuanto a la supervivencia de los pacientes (supervivencia a los 3 años 66,9-77% en DA vs. 77-80% en DME)20–23, la supervivencia del injerto es claramente inferior en la DA (48,8-65 vs. 72-80% en DME con un OR de fallo de injerto de 1,59-1,87 para los DA)20,24–28.
Estas diferencias registradas en la supervivencia del injerto son resultado de las mayores tasas de fallo primario de injerto20,24,28, pero sobre todo del índice de colangiopatía isquémica (CI), mucho mayor en injertos de DA. La CI aparece como resultado de la sensibilidad del epitelio biliar a la lesión isquémica y está descrita en el 15-37% de los receptores de DA24. Se traduce en la aparición de varias zonas de estenosis biliares a nivel intrahepático. Como consecuencia clínica, los pacientes con CI presentan cuadros de colangitis y abscesos hepáticos recurrentes. Cuando se analizan las causas de retrasplante en los receptores de hígados de DA, la CI es la causa más frecuente28.
En cuanto a los factores relacionados con la tasa mayor de fallo de injerto, el TIC y el TIF son unos de los factores más importantes relacionadas con la mala evolución postrasplante. La mayoría de los centros abogan por un TIC menor a 20 min22. Un TIF mayor a 8 h de asocia con un 30,4% de fallo de injerto, mientras que para un TIF de más de 10 h, el fallo del injerto se produce en un 58,3% de los casos20.
Estos resultados han tenido como efecto secundario una cierta cautela a la hora de decidir si un hígado de DA es válido para TH. En el análisis de los datos de UNOS, Orman observa que la proporción de injertos hepáticos descartados para el TH por ser provenientes de DA aumentó de el 9% en 2004 hasta el 28% en 201029.
Todos estos datos indican una extrema sensibilidad de los hígados provenientes de DA a isquemia (tanto fría como caliente). En este contexto, la utilización de la MPN, sobre todo en combinación con la PRN, mantendría en un mínimo la exposición de los injertos a isquemia.
Máquina de perfusión normotérmica en estudios experimentalesLa utilización de MPN no es una tecnología nueva. En la primera mitad del siglo XX se había intentado la perfusión de varios órganos con suero oxigenado normotérmico, demostrando su viabilidad durante varios días30. En el primer TH humano, realizado por Starzl, el injerto fue preparado previamente al trasplante en una máquina de perfusión con sangre diluida y oxigenada31. Después de la aparición de las soluciones de preservación y del éxito de la preservación de los injertos en frío, la utilización de la MPN se consideró como una herramiento muy compleja y poco útil, sobre todo en el contexto de la ausencia de una presión de la LE, como era el caso al principio del TH. Sin embargo, por la necesidad de utilizar órganos provenientes de donantes con criterios expandidos, la opción de la perfusión normotérmica como intento de mejorar la calidad de estos injertos se volvió a plantear a finales del siglo XX.
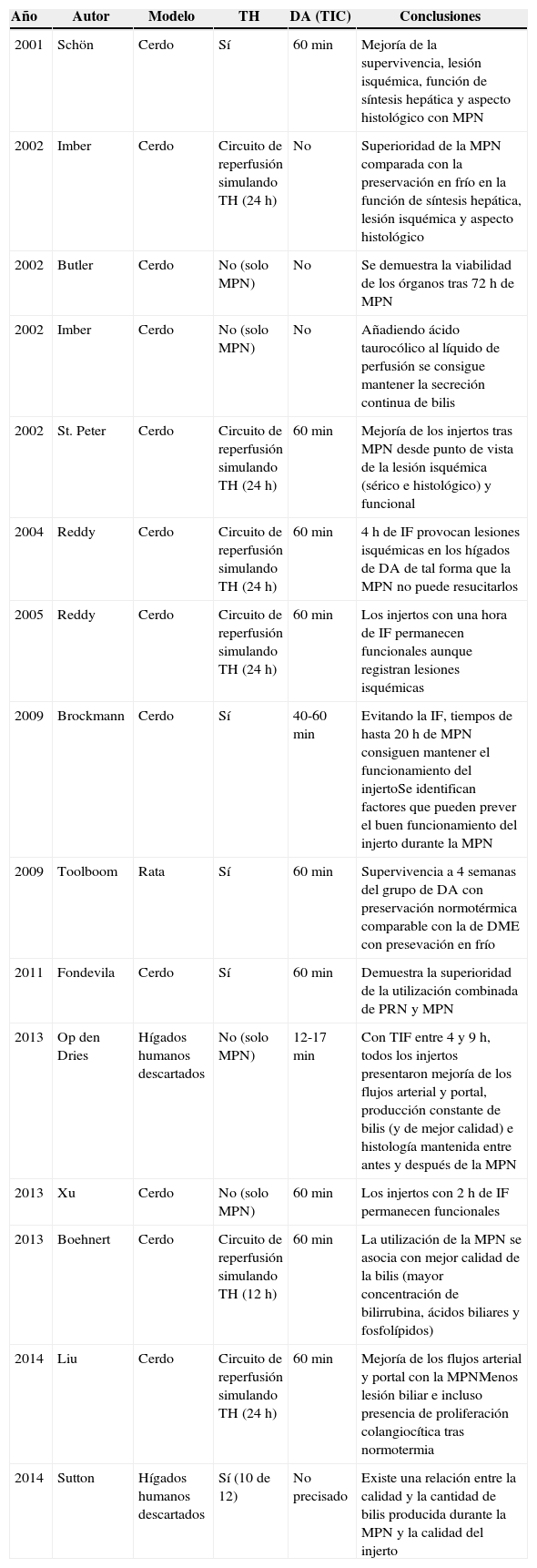
Desde los primeros trabajos se observó que la utilización de una MPN podría traer ventajas en el TH en general y sobre todo en el campo de DA. Aparte del beneficio evidente de poder analizar la viabilidad del hígado durante su perfusión normotérmica exvivo32, la MPN en ámbito experimental produce una mejoría de la calidad del injerto previo al TH (la tabla 2 resume estos estudios experimentales).
Trabajos experimentales sobre MPN
| Año | Autor | Modelo | TH | DA (TIC) | Conclusiones |
|---|---|---|---|---|---|
| 2001 | Schön | Cerdo | Sí | 60min | Mejoría de la supervivencia, lesión isquémica, función de síntesis hepática y aspecto histológico con MPN |
| 2002 | Imber | Cerdo | Circuito de reperfusión simulando TH (24h) | No | Superioridad de la MPN comparada con la preservación en frío en la función de síntesis hepática, lesión isquémica y aspecto histológico |
| 2002 | Butler | Cerdo | No (solo MPN) | No | Se demuestra la viabilidad de los órganos tras 72 h de MPN |
| 2002 | Imber | Cerdo | No (solo MPN) | No | Añadiendo ácido taurocólico al líquido de perfusión se consigue mantener la secreción continua de bilis |
| 2002 | St. Peter | Cerdo | Circuito de reperfusión simulando TH (24h) | 60min | Mejoría de los injertos tras MPN desde punto de vista de la lesión isquémica (sérico e histológico) y funcional |
| 2004 | Reddy | Cerdo | Circuito de reperfusión simulando TH (24h) | 60min | 4 h de IF provocan lesiones isquémicas en los hígados de DA de tal forma que la MPN no puede resucitarlos |
| 2005 | Reddy | Cerdo | Circuito de reperfusión simulando TH (24h) | 60min | Los injertos con una hora de IF permanecen funcionales aunque registran lesiones isquémicas |
| 2009 | Brockmann | Cerdo | Sí | 40-60min | Evitando la IF, tiempos de hasta 20 h de MPN consiguen mantener el funcionamiento del injertoSe identifican factores que pueden prever el buen funcionamiento del injerto durante la MPN |
| 2009 | Toolboom | Rata | Sí | 60min | Supervivencia a 4 semanas del grupo de DA con preservación normotérmica comparable con la de DME con presevación en frío |
| 2011 | Fondevila | Cerdo | Sí | 60min | Demuestra la superioridad de la utilización combinada de PRN y MPN |
| 2013 | Op den Dries | Hígados humanos descartados | No (solo MPN) | 12-17min | Con TIF entre 4 y 9 h, todos los injertos presentaron mejoría de los flujos arterial y portal, producción constante de bilis (y de mejor calidad) e histología mantenida entre antes y después de la MPN |
| 2013 | Xu | Cerdo | No (solo MPN) | 60min | Los injertos con 2 h de IF permanecen funcionales |
| 2013 | Boehnert | Cerdo | Circuito de reperfusión simulando TH (12h) | 60min | La utilización de la MPN se asocia con mejor calidad de la bilis (mayor concentración de bilirrubina, ácidos biliares y fosfolípidos) |
| 2014 | Liu | Cerdo | Circuito de reperfusión simulando TH (24h) | 60min | Mejoría de los flujos arterial y portal con la MPNMenos lesión biliar e incluso presencia de proliferación colangiocítica tras normotermia |
| 2014 | Sutton | Hígados humanos descartados | Sí (10 de 12) | No precisado | Existe una relación entre la calidad y la cantidad de bilis producida durante la MPN y la calidad del injerto |
CI: colangiopatía isquémica; DA: donación (donantes) en asistolia; DME: donación (donantes) en muerte encefálica; IC: isquemia caliente (ver TIC); IF: isquemia fría (ver TIF); LE: lista de espera; MPH: máquina de perfusión hipotérmica; MPN: máquina de perfusión normotérmica; PRN: perfusión regional normotérmica, método de preservación de los órganos provenientes de DA previo a su extracción mediante recirculación normotérmica; TH: trasplante hepático; TIC: tiempo de isquemia caliente, el tiempo que pasa desde la interrupción de la circulación del órgano donado hasta el momento en que es perfundido con la solución hipotérmica de preservación; TIF: tiempo de isquemia fría, período que transcurre desde que el órgano es preservado en un estado hipotérmico hasta su trasplante en el receptor; UNOS: United Network for Organ Sharing, la organización que administra la red de trasplante en EE. UU.
El grupo de Schön demostró en 2001 que la utilización de la normotermia durante solo 4 h antes del TH producía una mejoría de la función de síntesis hepática, cuando se comparaba con 4 h de preservación fría33. Los resultados fueron confirmados por el grupo de Oxford, que concluyó que la utilización de MPN es superior a la preservación fría en cuanto a la producción de bilis, síntesis proteica, lesión isquémica y aspecto histológico32.
En cuanto al tiempo que la MPN puede mantener en estado de funcionamiento los órganos, Butler consiguió mantener su viabilidad durante 72 h34. El único parámetro que tuvo una evolución desfavorable en la última parte del estudio fue la disminución de la secreción de bilis, pero Imber demostró que este efecto está relacionado con la imposibilidad de rellenar el depósito hepático de sales biliares. El hígado tiene la capacidad de absorción y utilización de los ácidos biliares exógenos. Una vez añadidos a la solución de perfusión, se puede restablecer la secreción normal de bilis35.
Efectos de la normotermia en modelos de DASi en modelos de DME la normotermia consigue mantener durante mucho tiempo la viabilidad del órgano, en el caso de DA la situación es diferente. Se trata de órganos que ya han sufrido una lesión isquémica importante, con las reservas de ATP disminuidas de forma significativa. Por este motivo, añadir isquemia fría (IF) en el momento de la preservación significa añadir todavía más lesión isquémica que muchos órganos no toleran bien36,37.
En su estudio de 2001, Schön estudió también el TH en un modelo de DA con una hora de isquemia caliente33. La perfusión mediante MPN se acompañaba de menos lesión isquémica, mejor aspecto histológico y una importante mejoría de la supervivencia (100% a los 7 días), cuando en el grupo de control (TIC de una hora+preservación en frío) todos los animales trasplantados fallecían menos de 18 h después por fallo primario del injerto. Cuando el experimento se repitió en un circuito de reperfusión que simula el TH, se observó además que los órganos preservados mediante MPN y «trasplantados» presentaban una secreción de bilis continua y de buena calidad, a diferencia de los órganos preservados en frío38.
La mejoría de la secreción biliar tras la perfusión normotérmica parece relacionada con los cambios a nivel del epitelio biliar. Liu demuestra que la utilización de la MPN se asocia con mejor aspecto del epitelio biliar e incluso observa signos indirectos de proliferación colangiocítica39. Estos cambios a nivel histológico se acompañan de una mejoría de la calidad de la bilis secretada por el injerto, con mayores concentraciones de bilirrubina, ácidos biliares y fosfolípidos40.
Sin embargo, todos estos estudios preliminares utilizaron modelos animales sin IF. Desde el punto de vista logístico, la mayoría de los TH no puede transcurrir sin preservación en frío, simplemente porque es el método de trasporte del injerto entre el centro del donante y el hospital del receptor. En el contexto de la utilización de la MPN en DA, solo existen 2 opciones lógicas: trasporte con preservación en frío para posterior colocación del órgano en normotermia o colocación inmediata en perfusión normotérmica (condicionada por el trasporte de la MPN hasta el hospital del donante).
El grupo de Oxford estudió extensamente la primera opción41,42. Cuando al TIC de una hora se añade un TIF de 4 h antes de iniciar la perfusión normotérmica, los órganos no consiguen preservar su función de síntesis. Sin embargo, si el TIF se reduce a una hora la secreción de bilis y los niveles de factor V son parecidos a los pacientes sin IF, aunque la lesión isquémica sigue siendo notable, tanto a nivel sérico como histológico. La viabilidad de los órganos se puede mantener incluso con 2 h de TIF, consiguiéndose una regeneración de las reservas de ATP hasta un 80% de los niveles previos al fallecimiento43. Es evidente que respetar tiempos de una hora de IF o incluso 2 h es imposible en muchos de los casos, por lo cual la opción más razonable es una MPN trasportable para poder reperfundir el injerto directamente después de la extracción.
Si la IF se consigue mantener al mínimo, incluso perfusiones normotérmicas prolongadas se asocian con altas tasas de funcionamiento del injerto, como demuestra Brockmann44. En el mismo estudio se realiza un modelo de algoritmo sobre los parámetros de perfusión que pueden indicar una buena evolución del injerto. Este modelo incluye el flujo biliar, el exceso de base, AST, ALT, ácido hialurónico, la presión y la resistencia portal en las primeras 4 h de perfusión.
En cuanto a los resultados a medio plazo tras la utilización de la MPN, Tolboom reporta una supervivencia a 4 semanas de 92% en un modelo de DA en ratas, con resultados postoperatorios comparables a los del grupo de DME con preservación en frío45. Sin embargo, estos resultados se tienen que analizar con precaución, porque el modelo experimental de rata es bastante diferente al trasplante humano convencional.
Nuestro grupo publicó en el año 2011 un estudio que combina la experiencia previa adquirida en la PRN con la utilización de la MPN en un modelo de TH de DA con 90 min TIC46. La utilización combinada de PRN y MPN se relaciona con una mejoría de la supervivencia a los 5 días, además de menor lesión isquémica y menor elevación de los parámetros inflamatorios y de lesión endotelial. El estudio confirma la importancia de la PRN en iniciar el proceso de reparación celular y de regeneración de las reservas energéticas en modelos de trasplante DA, pero también demuestra que la MPN ofrece las condiciones fisiológicas y el sustrato para continuar la mejoría de la calidad de este tipo de injerto.
Estudios sobre la MPN en órganos descartados para THEn los últimos años se han publicado 2 estudios sobre la perfusión normotérmica de hígados humanos descartados para trasplante. El primero, realizado por el grupo de Groningen, analiza 4 órganos provenientes de DA con TIC entre 12 y 17 min y TIF entre 4 y 9 h47. Todos los injertos presentaron una mejoría de los flujos arterial y portal a los 30 min, con una producción constante de bilis y con mejoría de sus características bioquímicas a lo largo del tiempo. El segundo, publicado por Sutton, establece una relación entre la calidad y la cantidad de la bilis secretada durante la MPN y la calidad del órgano48. Además, propone que un tiempo de 2,5 h de perfusión en MPN podría ser suficiente para valorar la potencial trasplantabilidad del órgano.
Aunque los resultados obtenidos en estos trabajos son prometedores, el estudio sobre órganos descartados representa un modelo teórico del comportamiento que tiene un hígado una vez trasplantado. Un análisis más detallado a nivel molecular podría ofrecer más información sobre los cambios que aparecen en estos tipos de injertos y su reversibilidad mediante MPN.
MPN en estudios clínicosEn contraste con la multitud de estudios experimentales, la experiencia clínica con la MPN es todavía muy limitada. El grupo de Oxford presentó en el año 2014 en el congreso ILTS de Londres el primer estudio clínico en TH utilizando la MPN organómetra en un grupo de 20 pacientes49. De estos, 10 pacientes recibieron injertos con criterios expandidos, 3 eran órganos provenientes de DA tipo 3. Los injertos se mantuvieron en perfusión normotérmica durante una media de 12 h aproximadamente antes del implante. Durante este tiempo, los órganos presentaron un buen aspecto macroscópico, una producción constante de bilis de aproximadamente 10ml/hora y se consiguió mantener un pH constante del líquido de perfusión. No hubo diferencias en el comportamiento clínico de los órganos provenientes de DME y de DA. Todos los pacientes presentaron una recuperación postoperatoria correcta, con una supervivencia a los 30 días de 100% y con unas tasas de fallo primero del injerto y de disfunción primaria del injerto de 0 y 15%, respectivamente. Cuando se compararon los resultados de este grupo de 20 pacientes con un grupo histórico de control con un ratio de 1/2, el único dato que registró diferencias estadísticas fue el pico de transaminasas en los primeros 7 días. Aunque el seguimiento fue limitado a solo 3 meses, no se reportaron complicaciones a medio plazo. Sin embargo, los resultados necesitaban una confirmación en un estudio prospectivo aleatorizado con un número mayor de pacientes.
Como siguiente paso en la utilización de la normotermia en el ámbito clínico, actualmente se está desarrollando el Trial COPE-WP2, un estudio prospectivo aleatorizado multicéntrico internacional que compara los resultados del TH utilizando la MPN vs. la preservación en frío50. Coordinado por el grupo de Oxford, el estudio cuenta con la participación de los más importantes centros de TH de Inglaterra, de los centros de Leuven y Essen y del Hospital Clínic de Barcelona. El estudio prevé la inclusión de 260 pacientes, aleatorizados con un ratio de 1/1 para recibir un injerto preservado en perfusión normotérmica o en frío. El objetivo principal es valorar el efecto de la MPN comparada con la preservación en frío en la prevención de las lesiones relacionadas con la preservación y de la disfunción primaria del injerto. El proyecto ofrece perspectivas muy interesantes para el estudio del comportamiento real de los órganos durante la perfusión normotérmica, ya que está prevista la recogida de un volumen importante de datos y de muestras séricas e histológicas.
Como el trabajo prevé incluir también TH con injertos provenientes de DA tipo 3, los resultados a largo plazo serán muy interesantes de cara a las complicaciones características de este tipo de donación (CI) y el efecto de la MPN en este contexto. Datos como la calidad y la cantidad de la secreción biliar, la biopsia de la vía biliar previa al implante o la realización de una colangio-resonancia magnética a los 6 meses post-TH específicamente dirigida a valorar posibles estenosis intrahepáticas podrían ofrecer nuevas garantías sobre la utilización de la normotermia en DA.
Aunque en el COPE-WP2 no está prevista la utilización de órganos provenientes de DA tipo 2, la aplicabilidad de la normotermia en este tipo de donación puede ser interesante. El éxito actual de la DA en el campo del TH está íntimamente relacionado con la utilización de unos criterios muy estrictos, lo que hace que la tasa de trasplantabilidad de estos hígados sea muy baja. La utilización de la MPN podría mejorar la calidad de estos órganos y aumentar su grado de utilización. Sin embargo, el paso del uso actual muy restrictivo de estos hígados a la utilización de unos criterios más liberales, asociado a la utilización de la MPN, se debe hacer mediante un estudio clínico prospectivo y validado posteriormente en series grandes de pacientes.
ConclusionesEn conclusión, la utilización de la MPN en el TH ofrece nuevas e interesantes perspectivas. Sobre todo en el campo de la DA, donde actualmente el factor limitante es la calidad del injerto, la perfusión normotérmica puede aumentar el número de injertos disponibles y a la vez ofrecer órganos de mayor calidad. La opinión de nuestro grupo es que la utilización combinada de la PRN y de la MPN es la opción ideal en estos injertos. Sin embargo, se necesitan todavía estudios clínicos para validar los buenos resultados obtenidos en el campo experimental.
Conflicto de interesesDeclaro que no existen conflictos de intereses.