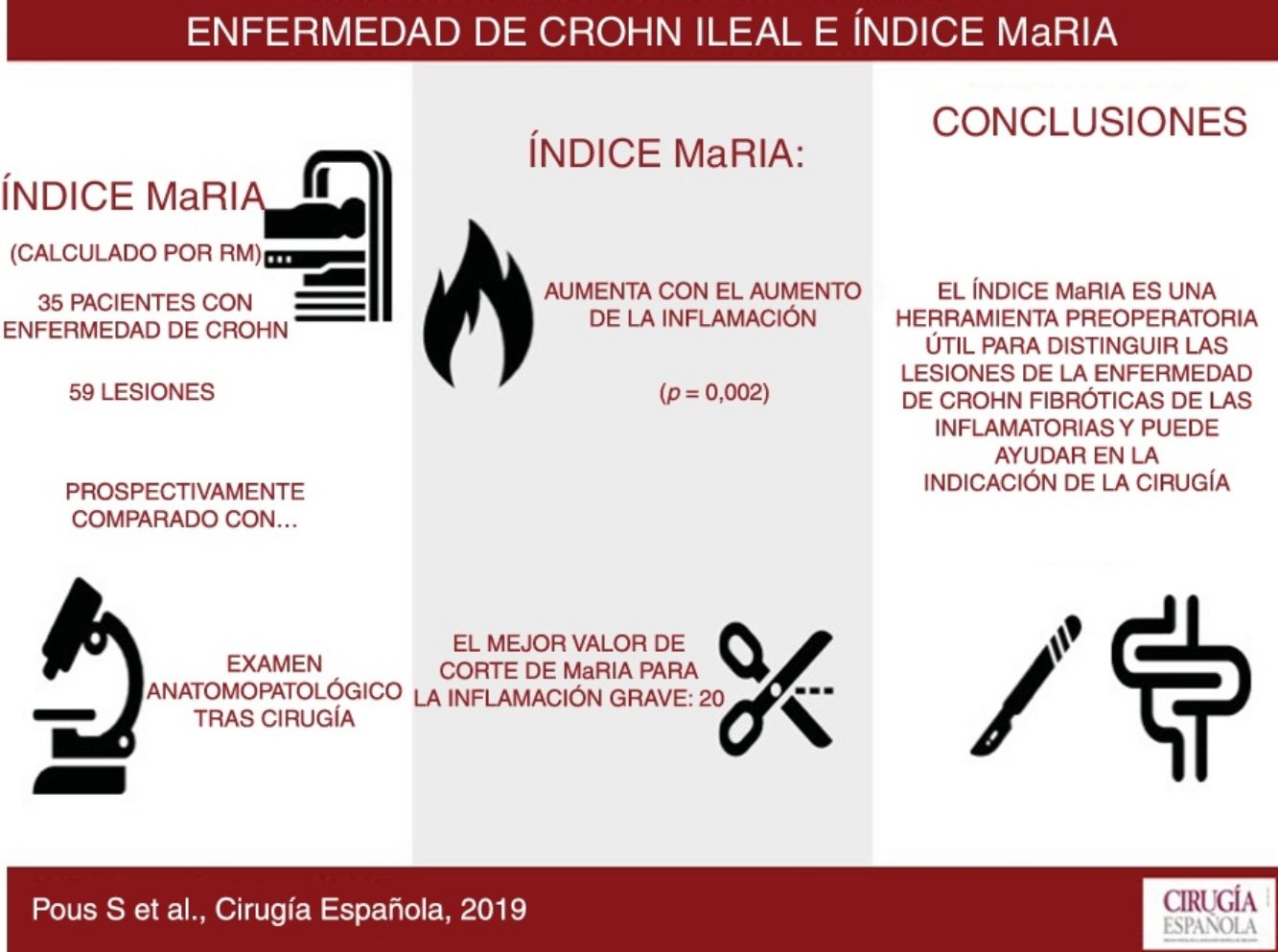
Es necesaria la correcta cuantificación de la actividad inflamatoria de las lesiones de la enfermedad de Crohn para establecer cuál es el tratamiento más adecuado para cada paciente. El objetivo del presente estudio es valorar la relación entre el índice de actividad inflamatorio por resonancia magnética (MaRIA) preoperatorio y el grado de inflamación histológico de las lesiones obtenidas en la cirugía.
MétodosEstudio prospectivo observacional consecutivo que incluye una serie de pacientes con enfermedad de Crohn ileal. Se realizó una enterografía mediante resonancia magnética, con protocolo y secuencias preestablecidas, en los 3 meses previos a la cirugía y se calculó el índice MaRIA. Todos los pacientes fueron intervenidos quirúrgicamente y se remitieron muestras de cada lesión parietal completa a estudio anatomopatológico. En el análisis histológico se empleó la clasificación de Chiorean. Se realizó un análisis de regresión ordinal e intergrupos.
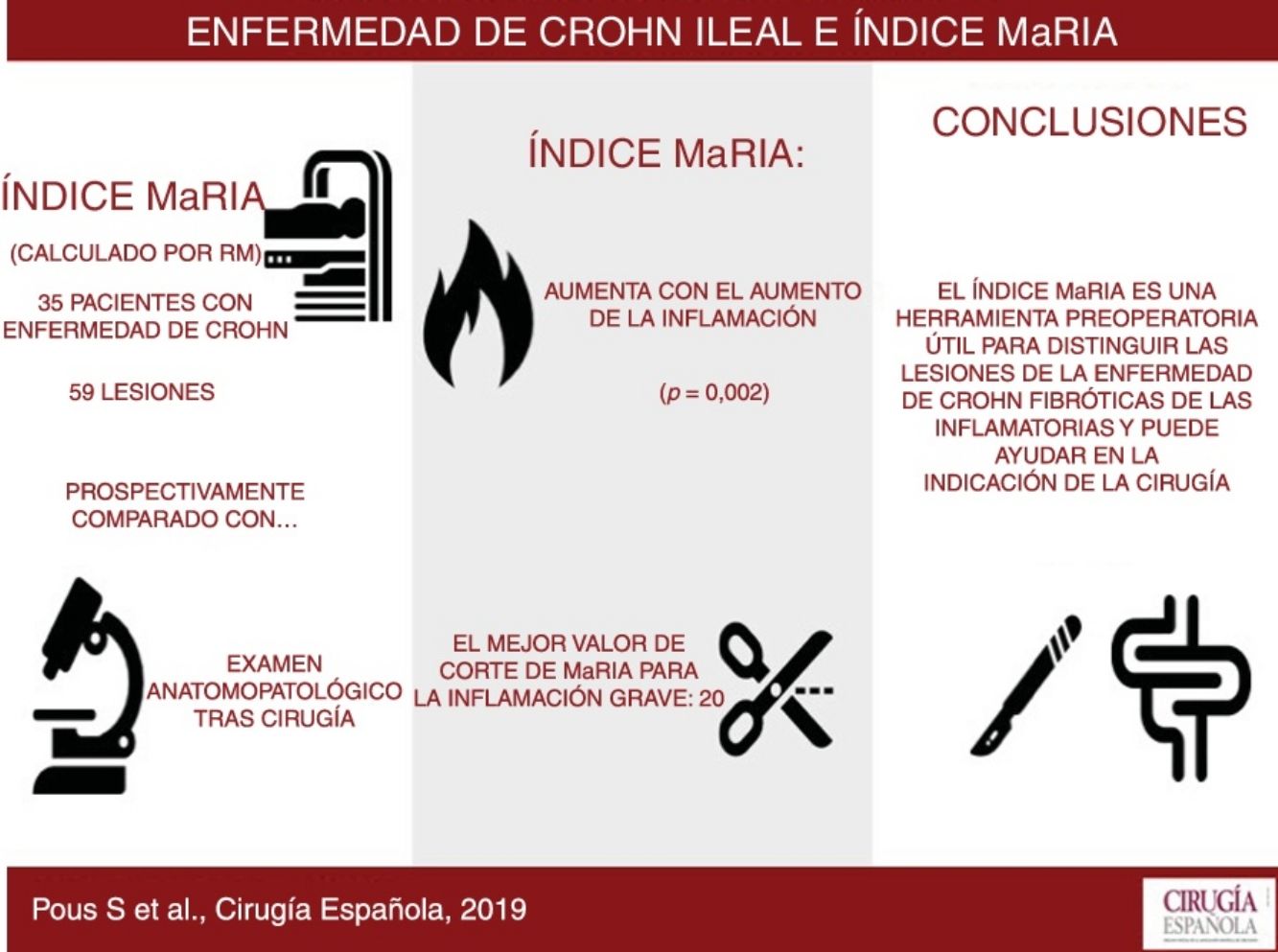
ResultadosSe incluye a 35 pacientes con 59 lesiones. A medida que aumenta el grado de inflamación, se obtienen, de forma significativa (p=0,002), valores mayores de MaRIA. El índice de MaRIA fue considerablemente diferente (p<0,001) en los diferentes tipo de lesiones por enfermedad de Crohn (inflamatoria/fibrótica). El mejor valor de corte del índice MaRIA para establecer la existencia de inflamación grave en una lesión ha resultado ser 20 (ABC, 0,741; sensibilidad, 74,1%, y especificidad, 78,1%).
ConclusionesEn el estudio de la enfermedad de Crohn ileal, la resonancia y el índice MaRIA son herramientas de gran utilidad para diferenciar entre lesiones inflamatorias y fibrosas, y por tanto, imprescindible para decidir el tratamiento más adecuado.
Accurate quantification of the inflammatory activity in Crohn's Disease is essential to determine adequate treatment for each patient. The aim of the present study is to assess the correlation between the pre-operative Magnetic Resonance Index of Activity (MaRIA) and the histologic degree of inflammation from surgically resected intestinal Crohn's Disease lesions.
MethodsThis is a prospective study including a consecutive case series of patients with small bowel Crohn's Disease, who underwent surgical resection. Magnetic resonance enterography was performed in the 3months prior to surgery, applying a pre-established protocol. Relative contrast enhancements, wall thickness, presence of edema or ulcerations were the parameters used to calculate the MaRIA Index. All patients underwent surgery and every specimen was analyzed. The modified Chiorean classification was applied for the histological analysis and an ordinal regression analysis was used to correlate MaRIA and the grade of inflammation for each lesion.
Results59 lesions from 35 different patients were analyzed. The degree of inflammation of the lesions was statistically correlated to the MaRIA values (P=.002). The MaRIA index was significantly different (P<.001) between the different histological types of the Crohn's Disease lesions (inflammatory/ fibrotic). The best cut-off for detecting severe inflammation using MaRIA was 20 (AUC: 0.741; 74.1% sensitivity and 78.1% specificity).
ConclusionMaRIA is a reliable tool to distinguish inflammatory from fibrotic lesions. Therefore, it could be considered essential for determining the most appropriate Crohn's Disease treatment for each patient.
Aunque las necesidades quirúrgicas de los pacientes con enfermedad de Crohn (EC) han disminuido en las últimas décadas, una tercera parte de ellos requerirá una intervención quirúrgica durante los primeros 5 años tras el diagnóstico y alrededor del 50%, durante los primeros 10 años1.
Al tratamiento de pacientes con EC se destinan muchos recursos sanitarios. Se han logrado desarrollar pruebas diagnósticas precisas de elevado coste. Se necesitan biomarcadores para evaluar el grado de inflamación y valorar el alcance de la enfermedad. Esto permitirá aplicar el tratamiento más eficaz en cada caso y reducirá los efectos secundarios, las complicaciones posquirúrgicas y los costes2,3. Las lesiones inflamatorias pueden mejorar principalmente con el tratamiento médico, al contrario de lo que ocurre con las lesiones con un componente fibrótico grande, donde está justificado un abordaje más agresivo, como la dilatación endoscópica o la cirugía. Se necesita una herramienta que nos permita identificar con precisión el componente inflamatorio o fibrótico de una lesión. Existen muchos estudios que intentan vincular los hallazgos de la resonancia magnética (RM) con la actividad y la gravedad de la EC. Entre las variables que se evalúan en los estudios se encuentran: grosor parietal, realce parietal, existencia de estenosis luminal, úlceras, edema (signo objetivo), hipervascularización (signo del peine), linfadenopatía, abscesos, fístulas, proliferación fibroadiposa, dilatación retrógrada, imágenes por difusión. Se han descrito varios índices radiológicos basados en estos hallazgos para evaluar la actividad y la gravedad de la EC4-19. Uno de los más conocidos es el índice de la actividad inflamatoria por RM (MaRIA, magnetic resonance index of activity), creado por Rimola et al. y validado externamente por ellos mismos en 2011, que muestra una correlación óptima con el índice de gravedad endoscópica de la enfermedad de Crohn (CDEIS, Crohn's disease endoscopic index of severity)10,11. Sin embargo, el MaRIA todavía necesita validación externa ya que la correlación con los hallazgos patológicos aún es poco segura.
El objetivo de este estudio es evaluar la precisión del MaRIA para establecer de manera fiable el grado de inflamación de las lesiones de la EC ileal, mediante el estudio anatomopatológico de muestras quirúrgicas.
MetodologíaPacientesEsta es una serie prospectiva de casos que incluye a 35 pacientes consecutivos con enfermedad de Crohn yeyunoileal, que necesitaron cirugía a causa del fracaso terapéutico o por complicaciones. En todos los pacientes se realizó una exploración por RM en los 3 meses anteriores a la cirugía (un mes si el paciente había recibido tratamiento con fármacos biológicos que actúan contra el factor de necrosis tumoral [anti-TNF]). Ya se ha publicado un subanálisis de la presente serie de casos que compara los hallazgos por RM y los hallazgos quirúrgicos20.
El Comité de Ética del Hospital aprobó el protocolo del estudio. Todos los pacientes aceptaron participar en el estudio y firmaron el consentimiento informado.
Evaluación de enfermedadesSe diagnosticó EC según los criterios de Lennard-Jones, tras excluir causas infecciosas, isquémicas o vasculares, neoplásicas o actínicas21.
Los pacientes se clasificaron por edad en el momento del diagnóstico, ubicación de la enfermedad y comportamiento de la enfermedad, de acuerdo con la clasificación de Montreal22,23. Se utilizó el índice Harvey-Bradshaw para describir la actividad clínica de la EC24.
Se realizó una colonoscopia preoperatoria a todos los pacientes para excluir la afectación del colon y, en la medida de lo posible, tomar una muestra para biopsia del íleon terminal. Todas las decisiones sobre la estrategia terapéutica se tomaron en una reunión de equipo multidisciplinario.
Enterografía mediante resonancia magnética (ERM)Las exploraciones de ERM se realizaron de acuerdo con un protocolo clínico estandarizado en un escáner 3T (GE Medical Systems, Milwaukee, Wisconsin, EE. UU.). Los pacientes permanecieron en ayunas por lo menos durante 6 h antes de la técnica y después ingirieron 1.500ml de una solución de manitol al 5% 45 min inmediatamente antes de la exploración para distender el intestino delgado. Para reducir el peristaltismo intestinal, se administraron 10mg de butilbromuro de hioscina por vía intravenosa (IV) (Buscopan; Boehringer Ingelheim, Ingelheim, Alemania) antes de iniciar el estudio y se administraron otros 10mg antes de administrar el bolo de contraste.
Se realizaron exploraciones dinámicas multifase con aumento de contraste (secuencia LAVA-XV) en el plano coronal antes y a los 35, 70, 120 y 420 s después de la administración IV de gadobenato de dimeglumina (Multihance; Bracco Diagnostics Inc., Milán, Italia). Se administraron 0,2ml/kg de gadobenato de dimeglumina a una velocidad de 2ml/s con un inyector eléctrico. Las imágenes se obtuvieron en decúbito prono. Las secuencias y los parámetros del protocolo de ERM se describen en publicaciones previas de los mismos autores (Supl. 1)20.
Postratamiento de datos de la ERM dinámicaLa captación de contraste se analizó en cada sección del intestino delgado afectado. Se colocaron 3regiones de interés (ROI) en el grosor de la pared intestinal con el mayor aumento de contraste durante 70 s después de la inyección de contraste y otras 3ROI se colocaron de manera predeterminada antes del contraste (en el mismo lugar) para calcular el aumento relativo del contraste (ARC). Los diámetros de las ROI siempre tuvieron el mismo tamaño y se incluyeron, al menos, las capas intestinales mucosa/submucosa y muscular (Supl. 2). El valor del índice MaRIA se calculó tras aplicar la fórmula publicada por Rimola et al.10 (MaRIA=1,5×grosor parietal+0,02×ARC+5×edema+10×ulceración), que incluye los siguientes parámetros: ARC, grosor parietal y existencia de edema y úlceras.
La evaluación cuantitativa del engrosamiento intestinal se midió en secuencias 3D potenciadas en T1 (LAVA-XV) después de la inyección de contraste. También se obtuvieron y se registraron los siguientes parámetros cualitativos: existencia de edema parietal (hiperintesidad en secuencias potenciadas en T2 de la pared intestinal en relación con la señal del músculo psoas) y existencia de úlceras profundas (depresiones en la superficie de la mucosa).
Todas las imágenes fueron evaluadas por 2radiólogos con experiencia en imágenes del abdomen. En caso de desacuerdo en los parámetros utilizados para calcular MaRIA, se realizó una evaluación final de la imagen por consenso. Los datos clínicos y de laboratorio se ocultaron a ambos radiólogos.
Informe de cirugía y anatomopatologíaA todas las secciones intestinales resecadas se les realizó un examen anatomopatológico que indicaba el número y la ubicación de las lesiones, y especificaba su distancia desde la válvula ileocecal. Durante la intervención quirúrgica, se localizaron las lesiones previamente identificadas por ERM. Aquellas que no fueron confirmadas durante la cirugía (n=2) o no fueron identificadas por ERM (n=7) se excluyeron del análisis. Al realizar la estenoplastia, se obtuvieron muestras completas de pared para un estudio histológico. Miembros de la Unidad de Cirugía Colorrectal operaron a todos los pacientes siguiendo criterios quirúrgicos estandarizados.
Los hallazgos de la ERM se ocultaron a 2anatomopatólogos experimentados, que están especializados en enfermedades del aparato digestivo y forman parte del equipo multidisciplinario para el tratamiento de enfermedades inflamatorias del intestino, cuando evaluaban todas las muestras. En caso de desacuerdo, la evaluación de los datos se realizaba por consenso.
La fibrosis y la inflamación de las lesiones se clasificaron según los criterios de Chiorean25. Las lesiones que presentaban un componente de inflamación moderada o grave, y en ausencia de fibrosis leve o moderada, se definieron como «lesiones inflamatorias». En caso de presentar estas 2características, es decir, un componente fibrótico grave e inflamación ausente o leve, se definieron como «lesiones fibróticas». Todos los demás casos se definieron como «lesiones mixtas» (Supl. 3).
En este estudio modificamos la clasificación de Chiorean al subdividir el grupo mixto en mixto leve (ausencia o inflamación leve, y fibrosis leve o moderada) y mixto grave (inflamación moderada o grave y fibrosis grave) (Supl. 3).
Análisis estadísticoSe analizaron datos de pacientes y lesiones. Las variables continuas se expresaron en medias y desviaciones estándar, mientras que las variables cualitativas se expresaron en frecuencias absolutas y porcentajes. En el análisis bivariante, se utilizó el análisis de la varianza o ANOVA como prueba paramétrica de comparación de medias entre varios grupos. Un valor de p<0,05 se consideró estadísticamente significativo.
Se realizó un estudio de regresión ordinal para correlacionar los valores de MaRIA con variables cualitativas ordinales o cuasicuantitativas como, por ejemplo, el grado de inflamación histológica. Para evaluar la fiabilidad de las variables radiológicas (MaRIA) como posibles pruebas de diagnóstico para establecer el grado de inflamación, se analizaron las curvas de eficacia diagnóstica (ROC, receiver's operating characteristic) y se calculó el área bajo la curva (ABC) de cada una de estas variables26. El índice de Youden (sensibilidad+especificidad – 1)27 se utilizó para seleccionar el valor más adecuado como valor de corte.
ResultadosEn el presente análisis se incluyó un total de 59 lesiones de EC de intestino delgado en 35 pacientes (media de edad: 39,2 años; rango: 17-64 años; 14 mujeres y 21 hombres). Los datos de referencia demográficos y clínicos de la población de estudio se resumen en la tabla 1.
Datos demográficos y clínicos de los pacientes (n=35). La edad en el momento del diagnóstico, la ubicación de la enfermedad y el comportamiento de la enfermedad se definieron de acuerdo con la clasificación de Montreal
| Frecuencia, n (%) | |
|---|---|
| Sexo | |
| Hombre | 21 (60) |
| Mujer | 14 (40) |
| Edad en el momento del diagnóstico | |
| A1 | 1 (2,9) |
| A2 | 27 (77,1) |
| A3 | 7 (20,0) |
| Ubicación de la enfermedad | |
| L1 ileal | 28 (80,0) |
| L3 ileocecal | 3 (8,6) |
| L1+L4 (GI superior) | 4 (11,4) |
| Comportamiento de la enfermedad | |
| B1 sin estenosis, no penetrante | 3 (8,6) |
| B2 estenótica | 24 (68,6) |
| B3 penetrante | 8 (22,9) |
| P perianal | 9 (25,7) |
| Índice de Harvey | |
| <6 | 10 (28.6) |
| 6-12 | 25 (71.4) |
| >12 | 0 |
| Cirugía anterior | 7 (20) |
| Medicamentos | |
| 5-ASA | 1 (2,8) |
| Corticoides | 17 (48,6) |
| Tiopurinas | 14 (40,0) |
| Anti-TNF-α | 11 (31,4) |
| Tiopurinas + anti-TNF-α | 7 (20,0) |
| Indicación para cirugía | |
| Fracaso del tratamiento médico | 20 (57,1) |
| Sin respuesta | 16 (45,7) |
| Complicación médica | 1 (2,9) |
| Dependencia de esteroides | 3 (8,6) |
| Complicaciones preoperatorias | 15 (42,9) |
| Obstrucción | 6 (17,1) |
| Fistulización | 4 (11,4) |
| Absceso | 1 (2,9) |
| Otros | 4 (11,4) |
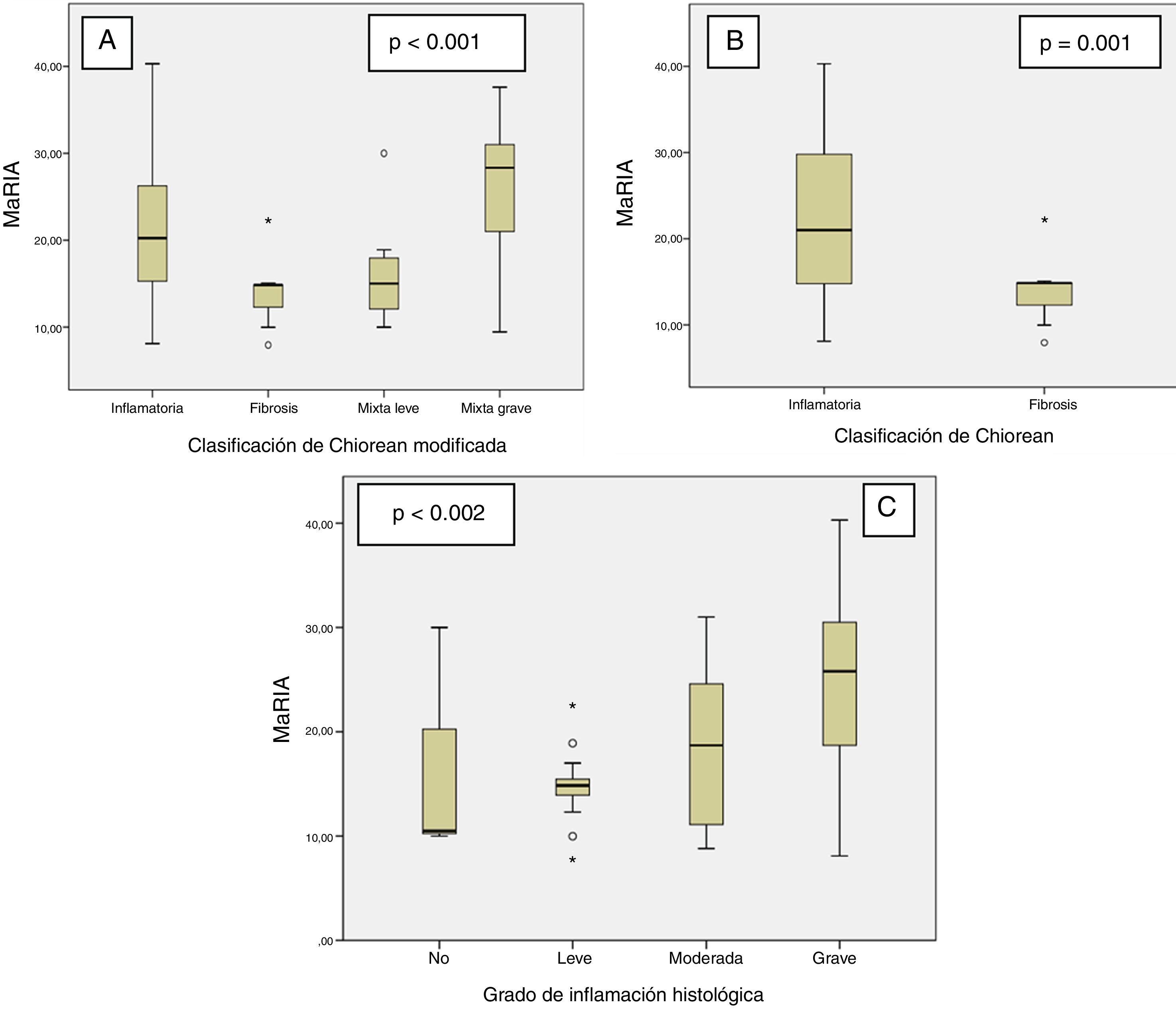
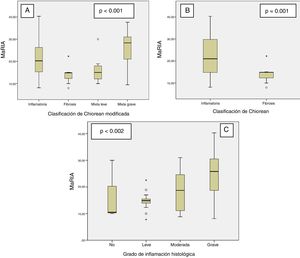
El índice MaRIA difería bastante (p<0,001) entre los diferentes tipos histológicos de las lesiones de la EC (inflamatorio, fibrótico, mixto con inflamación leve y mixto con inflamación grave) (fig. 1A y tabla 2). Las lesiones inflamatorias y las lesiones mixtas con inflamación grave o moderada mostraron valores de MaRIA más elevados que las lesiones fibróticas o mixtas con inflamación ausente o leve (valor medio: 21,1 frente a 14,8; p=0,002). Las lesiones fibróticas y las lesiones mixtas con inflamación leve presentaron valores similares de MaRIA (p=0,6).
Valores medios de MaRIA para cada grupo del sistema de puntuación de Chiorean modificado
| Sistema de puntuación de Chiorean modificado | MaRIAMedia (IC del 95%), mediana |
| Inflamatoria | 20,2 (16,6-23,8), 20,2 |
| Mixta grave | 25,4 (21,2-29,7), 28,3 |
| Mixta leve | 16,3 (11,0-21,5), 15,0 |
| Fibrosis | 14,2 (11,5-16,9), 14,8 |
Todas las lesiones con algún componente inflamatorio (lesiones inflamatorias y mixtas) mostraron un valor de MaRIA más elevado que las lesiones sin componente inflamatorio (lesiones fibróticas) con un valor estadísticamente significativo (p=0,012; tabla 3 y fig. 1B). Además, a medida que aumentaba el grado de inflamación patológica, se obtenían valores de MaRIA significativamente más elevados (p=0,002; fig. 1C).
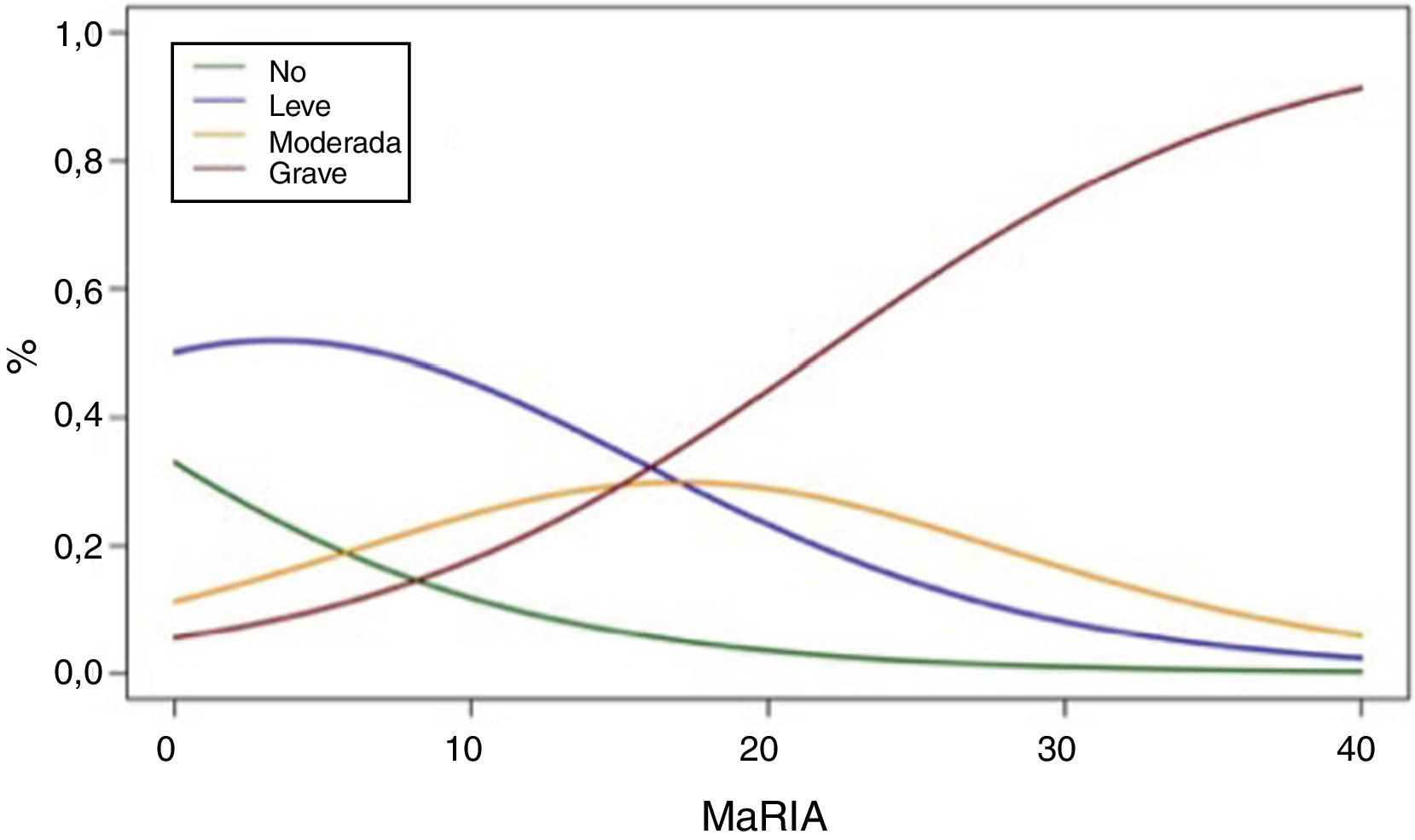
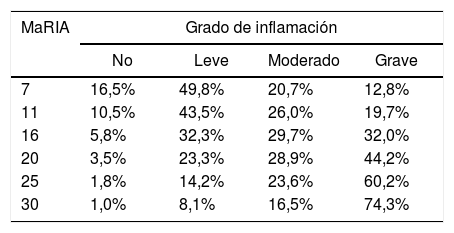
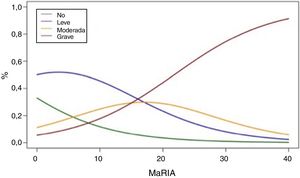
La figura 2 muestra la probabilidad de obtener diferentes grados de inflamación patológica con un valor determinado de MaRIA. Los valores más elevados de MaRIA tienen más probabilidades de mostrar una inflamación mayor y más grave de la lesión (tabla 4). El ABC ROC de MaRIA, como un biomarcador diagnóstico de inflamación grave, fue 0,741 (intervalo de confianza (IC) del 95%: 0,607-0,875), con una sensibilidad del 74,1% y una especificidad del 78,1%, considerando 20 como valor de corte. Para el diagnóstico de inflamación moderada o grave, el ABC fue 0,756 (IC del 95%: 0,629-0,883), con el mejor valor de corte en 16 (sensibilidad del 73,0% y especificidad del 77,8%).
Probabilidades de cada grado de inflamación en diferentes ejemplos de los valores de MaRIA
| MaRIA | Grado de inflamación | |||
|---|---|---|---|---|
| No | Leve | Moderado | Grave | |
| 7 | 16,5% | 49,8% | 20,7% | 12,8% |
| 11 | 10,5% | 43,5% | 26,0% | 19,7% |
| 16 | 5,8% | 32,3% | 29,7% | 32,0% |
| 20 | 3,5% | 23,3% | 28,9% | 44,2% |
| 25 | 1,8% | 14,2% | 23,6% | 60,2% |
| 30 | 1,0% | 8,1% | 16,5% | 74,3% |
La correlación entre los valores de MaRIA superiores a 16 y el diagnóstico de inflamación moderada o grave proporcionó una precisión diagnóstica del 74,6% y una fuerte asociación (OR=9,9 [IC del 95%: 2,6-35,3]). Se obtuvo la misma fiabilidad con valores de MaRIA superiores a 20 en el caso de la inflamación grave probada histológicamente, con una razón de probabilidades significativa (OR=8,6 [IC del 95%: 2,6-27,8]).
DiscusiónEntre los índices de la ERM descritos para la evaluación de la EC, MaRIA es, probablemente, el más citado en la bibliografía; sin embargo, no se usa comúnmente en la práctica clínica. El presente estudio establece el índice MaRIA como una herramienta fiable para establecer el grado de actividad inflamatoria de las lesiones de la EC que afectan al intestino delgado.
Otros índices, como el índice de Clermont, el índice de Londres y el Crohn disease MRI Index se han descrito previamente. En un estudio anterior28 en que se los comparaba junto con MaRIA, se concluyó que todos los sistemas de puntuación eran comparables por lo que respecta a la concordancia de la información entre los observadores, la correlación con la norma de referencia endoscópica e histopatológica, y la precisión diagnóstica; sin embargo, el índice de Londres, MaRIA y el índice de Clermont aportan el beneficio adicional de tener valores de corte validados para la enfermedad activa y endoscópica ulcerosa.
Recientemente, la RM ha adquirido mayor relevancia en el diagnóstico, en la clasificación del fenotipo y especialmente en el seguimiento de pacientes con EC. La ERM ha demostrado una alta fiabilidad sin el inconveniente de la radiación ionizante de la tomografía computarizada y con la ventaja sobre la ecografía de depender menos de la experiencia del radiólogo y la ubicación de las asas intestinales2.
En los últimos años, existe una tendencia a invertir la pirámide terapéutica en los pacientes con EC mediante la introducción temprana de inmunodepresores y fármacos biológicos anti-TNF. Esto comporta mayor incidencia de efectos secundarios y un aumento considerable de los costes del tratamiento (el coste aproximado del tratamiento con anti-TNF es de 10.000 € al año por paciente)29,30. Por tanto, es esencial evaluar el grado inflamatorio de cada lesión de la EC para decidir si está indicado el tratamiento médico o si es necesaria la resección quirúrgica22,23.
Es bien sabido que la EC es un trastorno dinámico cuyo fenotipo puede evolucionar con el tiempo. Por consiguiente, la inflamación crónica y continua puede provocar fibrosis de la pared intestinal. En estos casos, la intensificación del tratamiento podría empeorar la calidad de vida del paciente, con posibles complicaciones, efectos secundarios de los medicamentos y mayores costes.
Sin embargo, puesto que la ERM se ha convertido en una herramienta decisiva para la toma de decisiones terapéuticas31, con el tiempo y la experiencia han ido surgiendo algunas dudas sobre su uso en las ubicaciones ileales de la EC. En un estudio publicado por Rimola et al.10 se incluyó a 50 pacientes (11 con localización ileal y 24 con localización ileocecal) y los hallazgos de la ERM se correlacionaron con la actividad endoscópica evaluada por CDEIS. Las lesiones se clasificaron como ausentes, leves (inflamación sin úlceras) y graves (existencia de úlcera). El índice MaRIA demostró ser altamente fiable en el momento de establecer la actividad de la enfermedad (sensibilidad, 0,81 y especificidad, 0,89) y pronosticar la existencia de úlceras endoscópicas (sensibilidad, 0,95 y especificidad, 0,91)10. Más tarde, los autores validaron el índice y concluyeron que un valor de MaRIA igual o superior a 7 indicaba enfermedad activa; y mayor o igual a 11 indicaba enfermedad grave11. Sin embargo, los autores especificaron que una de las limitaciones del estudio es la falta de una cohorte independiente de resultados para la validación ya que la colonoscopia necesaria en el CDEIS (índice endoscópico) a menudo es muy difícil o incluso imposible de realizar en pacientes con lesiones (inflamatorias o fibróticas) estenóticas.
Nuestro estudio prospectivo correlacionó por primera vez el índice MaRIA con los hallazgos patológicos de las secciones intestinales resecadas. Las características demográficas de los pacientes analizados en nuestro estudio son similares a las de una serie mayor de pacientes a quienes se les realizó cirugía32.
La clasificación patológica publicada por Chiorean et al. en 200725 se utilizó como índice para las características inflamatorias y fibroestenóticas. Esta clasificación es la herramienta más fácil de utilizar y una de las más prácticas para clasificar las lesiones en principalmente inflamatorias o principalmente fibroestenóticas, o mixtas. Sin embargo, el grupo mixto con frecuencia incluye lesiones con características muy diferentes. Por este motivo, subdividimos el grupo mixto en leve y grave para analizar las diferencias en los valores de MaRIA. El grupo mixto grave (secciones con inflamación moderada o grave) mostró resultados similares a las secciones con predominio inflamatorio, mientras que las lesiones del grupo mixto leve (secciones con inflamación leve o ausente) mostraron valores similares a los encontrados en las lesiones fibróticas. El subgrupo mixto grave muestra los valores más elevados de la serie MaRIA, probablemente por el efecto agregado de las 2características patológicas.
Al igual que las publicaciones anteriores, nuestro estudio revela que, a medida que aumenta el valor del índice MaRIA, es más probable que aumente la gravedad de la inflamación de la lesión. En un análisis de regresión ordinal, utilizando los valores de MaRIA, es posible calcular las diferentes probabilidades de tener una lesión inflamatoria y calcular su grado de inflamación, por lo que este estudio tiene un interés práctico considerable. A diferencia de otros estudios, en nuestra serie, el valor medio del índice MaRIA obtenido en casos de fibrosis pura fue 14,2, mientras que los valores iguales o superiores a 16 indicaron lesiones con inflamación de moderada a grave y los valores iguales o superiores a 20 indicaron inflamación grave con una precisión del 74,6%. Otros autores comunicaron que valores iguales o superiores a 7 indican enfermedad activa y mayores o iguales a 11 indican enfermedad grave10,11. En su estudio, la actividad inflamatoria se midió por endoscopia (CDEIS) y hubo un elevado porcentaje de lesiones cólicas o ileocecales. En cambio, en nuestro estudio la actividad inflamatoria se midió por la histología de toda la pared de la sección intestinal afectada y evaluamos las lesiones yeyunoileales que no permitirían ni el muestreo endoscópico ni el CDEIS en la mayoría de los casos. Estos hechos probablemente podrían explicar la diferencia en los resultados de nuestro estudio y quizás indicarían la necesidad de modificar los valores de corte de MaRIA cuando se estudian las lesiones del intestino delgado.
Como sugirieron recientemente Rimola et al.33, la fibrosis grave también podría ser evaluada preoperatoriamente por la ERM sobre la base del aumento de la captación de contraste entre las fases temprana y tardía. También se ha propuesto recientemente que la fiabilidad de MaRIA podría mejorarse mediante la modificación con secuencias de RM potenciada por difusión34.
Por último, debe estudiarse más a fondo la precisión de MaRIA en la evaluación de la respuesta al tratamiento médico.
AutoríaDiseño del estudio: Salvador Pous-Serrano, Matteo Frasson, José Pàmies-Guilabert, Eduardo García-Granero y Pilar Nos Mateu.
Recogida de datos: Salvador Pous-Serrano, José Pàmies-Guilabert, Icíar Puchades-Roman y Belén Beltrán.
Análisis e interpretación de los datos: Salvador Pous-Serrano, José Pàmies-Guilabert y Matteo Frasson.
Redacción del artículo: Salvador Pous-Serrano, Matteo Frasson, José Pàmies-Guilabert y Polina Rudenko.
FinanciaciónNo se ha recibido ninguna financiación específica para este proyecto.
Conflicto de interesesNo existe ningún conflicto de intereses.