Introducción. Se estudia la participación de los radicales libres del oxígeno en la cicatrización de las anastomosis cólicas realizadas en condiciones de isquemia.
Métodos. Se han utilizado ratas adultas a las que se realizó una anastomosis en colon normal y en colon previamente desvascularizado (anastomosis isquémica).
Se han cuantificado las concentraciones de radicales super óxido (medida de los aniones superóxido y de la mieloperoxidasa), las principales enzimas desintoxicantes (superóxido-dismutasa y glutatión-peroxidasa), la producción de colágeno (OH-prolina) y la tensión de rotura.
Resultados. En las anastomosis realizadas en condiciones de isquemia se observa una menor síntesis de colágeno y, por consiguiente, su tensión de rotura es significativamente menor. Las concentraciones detectadas de radicales libres de oxígeno (mayores valores de anión superóxido y mayor grado de infiltración leucocitaria) son significativamente más elevadas que en las anastomosis realizadas en condiciones normales.
Conclusión. Nuestros resultados demuestran que los radicales libres de oxígeno están aumentados en las anastomosis con deficiente perfusión sanguínea de los extremos anastomo sados.
Introduction. We studied the role of oxygen free radicals in the healing of ischemic colonic anastomosis.
Methods. Adult rats were used. Anastomosis was performed in normal colon and in previously devascularized colon (ischemic anastomosis). Concentrations of superoxide radicals (measured from superoxide anions and myeloperoxidase), the main detoxifying enzymes (superoxide-dismutase and glutathione-peroxidase), collagen production (OH-proline) and tension strench were quantified.
Results. In anastomosis performed in ischemic colons collagen synthesis was reduced and consequently, tension strench was significantly lower. Concentrations of free oxygen radicals (higher values of superoxide anions and greater degree of leukocyte infiltration) were significantly higher than in anastomosis performed in normal conditions.
Conclusions. Our results demonstrate that concentrations of oxygen free radicals are elevated in anastomoses with insufficient blood perfusion in the anastomosed distal portions.
Introducción
La cicatrización de las anastomosis cólicas sigue constituyendo un problema importante en la clínica y su fallo va asociado con altas tasas de morbimortalidad1,2.
Muchas situaciones que provocan dehiscencia de las anastomosis (suturas a tensión, desvascularización excesiva de los extremos, etc.) tienen como denominador común la hipoperfusión de los extremos anastomosados3,4. La cicatrización, proceso dependiente del oxígeno, se ve así alterada.
Si la hipoxia es tan importante que interfiere en la viabilidad tisular, se produce necrosis de la zona y la cicatrización no tiene lugar. Pero en muchas ocasiones, menores grados de isquemia provocan déficit relativo de perfusión en los extremos anastomosados, originándose una situación de hipoxia tisular. En estos extremos, los fenómenos subsiguientes de la cicatrización provocan una situación de reperfusión que paradójicamente aumenta la lesión provocada por la isquemia, lo que es debido en parte a la generación de radicales libres del oxígeno (RLO)5,6.
Aunque la susceptibilidad de los distintos órganos a la lesión de isquemia/reperfusión es variable, el intestino es particularmente sensible porque contiene gran cantidad de xantinooxidasa (XO)7. Otra fuente posible de RLO la constituyen los leucocitos polimorfonucleares (PNM), que se disponen infiltrando los extremos intestinales anastomosados8,9.
En la presente publicación se analiza la participación de los RLO (medidos como anión superóxido [ASO]) en la cicatrización de las anastomosis cólicas, evaluando la tensión de rotura (breaking strength, [BS]) y la producción de hidroxiprolina (OH-prolina) en un modelo de anastomosis isquémica y cuantificando las concentraciones de producción de RLO y de las principales enzimas desintoxicadoras de las mismas, superóxido-dismutasa (SOD) y glutatión-peroxidasa (GPX).
Material y métodos
Hemos utilizado 50 ratas adultas de la raza Wistar, de 200-300 g de peso, que han sido asignadas de modo aleatorio en dos grupos de estudio, de 25 animales cada uno:
Grupo I: control constituido por animales en los que hemos realizado anastomosis cólicas en condiciones normales (véase más adelante).
Grupo II: isquemia de la cicatriz, en el que se realizó anastomosis cólica e isquemia a ambos lados de la cicatriz.
Todos los animales fueron mantenidos con dieta exclusivamente hídrica durante las 24 h previas a la intervención quirúrgica y después de la cirugía fueron alimentados ad libitum hasta el cuarto día en que fueron sacrificados.
Técnica quirúrgica
Anastomosis cólica normal (grupo I). Realizamos laparotomía media e identificamos un punto del colon situado a 2 cm de la reflexión peritoneal. Se llevó a cabo una sección limpia en esta localización del colon, evitando lesionar el mesocolon, de modo que se conserve la vascularización, y anastomosis terminoterminal con ocho puntos sueltos de 7/0 de material irreabsorbible (fig. 1).
Anastomosis cólica isquémica (grupo II). Previa a la realización de la anastomosis llevamos a cabo una ligadura de las arcadas vasculares lo más próxima posible a la pared del colon, en una extensión de 4 cm a partir de la reflexión peritoneal, realizando la sección del colon y posterior anastomosis según la técnica previamente descrita en el grupo I, de modo que a ambos lados de la misma queden 2 cm de colon desvascularizados cuya irrigación procede de la circulación intraparietal (fig. 2).
Variables estudiadas
Medida de la tensión de rotura (BS) de la anastomosis. Se realizó en 15 animales de cada grupo. Para ello se extrajo un segmento de colon de 5-6 cm que incluía en su centro la anastomosis, separando las adherencias de modo romo. El extremo proximal se pinzó y por el extremo distal se anudó sobre un catéter por el que se perfundió suero salino a velocidad de 1 ml/min.
El sistema va conectado a un registro de presión, de modo que cuando se producía la rotura de la anastomosis se registraba un descenso brusco de la curva de presión. El valor máximo de la curva fue el valor de BS considerado.
Diversos problemas técnicos como tracción excesiva de los extremos (en la extracción de las piezas o durante la realización de la prueba), dificultades en el registro de la curva de rotura, etc., nos obligaron a desechar 3 animales en el grupo II.
Determinaciones bioquímicas. En 10 animales de cada grupo se extrajo la anastomosis con 1 mm de margen a cada lado de la misma, y se congeló en nitrógeno líquido a 70 °C, almacenándose hasta la realización de las determinaciones.
Problemas técnicos relacionados con el mantenimiento de las piezas a esta temperatura nos obligaron a desechar las muestras de un animal del grupo II.
La cuantificación de la OH-prolina se realizó por el método de Woessner (1961)10 y los resultados se expresan en mg/g de proteína del homogenizado.
La determinación del radical superóxido (ASO) se realizó por el método de Boveris y Forman (1982)11, basado en la reducción del citocromo C, expresándose los resultados en nmol/mg de proteína del homogenizado/min.
La determinación de la actividad de la superóxido-dismutasa (SOD) y de la glutatión-peroxidasa (GPX) se ha realizado por los métodos de Misha y Fridovich (1972)12 y Paglia y Valentina (1967)13, respectivamente. Los resultados se han expresado en U/mg de proteína del homogenizado.
Métodos inmunohistoquímicos. Se llevó a cabo la cuantificación de la actividad de la mieloperoxidasa (MPO).
La MPO es una enzima específica de los neutrófilos; por tanto, su determinación es un reflejo del grado de infiltración por neutrófilos en los tejidos animales14.
La obtención de muestras se realizó a los 4 días de realizada la anastomosis intestinal, tomando segmentos de colon de 1 cm de longitud a cada lado de la línea de sutura, introduciendo inmediatamente la muestra en formol tamponado. Los anticuerpos (Ac) utilizados para el estudio inmunohistoquímico han sido: Ac antiperoxidasa de los granulocitos (DAKO MPO-7) (1:100), Ac antileucocitario con reacción sobre células linfoides y macrofágicas (DAKO CD-45 RB, PD7-26) (1:50) y Ac antileucocitario común (DAKO LC, 2B11 + PD7/26) (1:200).
Valoramos la positividad a los distintos antígenos cuantificando el número de células positivas captadoras del antígeno en 10 campos de 25 aumentos.
Los datos se presentan como los valores de la media aritmética y el error estándar de la misma (EE). La comparación de los distintos grupos se ha realizado mediante el cálculo de la t de Student utilizando el paquete estadístico StatView 4.01.
Resultados
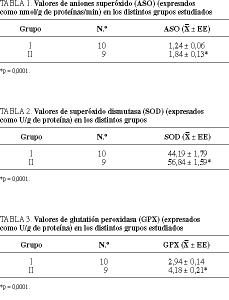
Las concentraciones de ASO, SOD y GPX están significativamente elevadas en las anastomosis isquémicas (grupo II) respecto a las anastomosis normales (grupo I) (tablas 1 a 3).
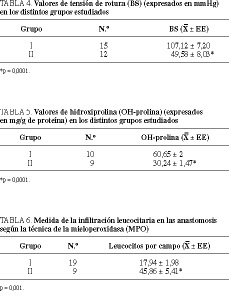
En las cicatrices isquémicas se ha detectado una menor síntesis de colágeno, medida por las concentraciones de OH-prolina y, en consecuencia, una menor resistencia a la rotura de la anastomosis (tablas 4 y 5).
La isquemia de la cicatriz produjo un aumento significativo (45,86 frente a 17,94 leucocitos por campo; p < 0,0001) del grado de infiltración por leucocitos, medidos según técnica de la MPO, lo que traduce la gran infiltración leucocitaria de las anastomosis (tabla 6).
Discusión
La cicatrización, como fenómeno complejo en que están implicados gran cantidad de sistemas, tanto intracelulares como extracelulares, sólo puede ser estudiada en modelos animales.
Aunque son muchas las publicaciones que tratan sobre el tema son escasas las que estudian la cicatrización en situaciones de isquemia15-19. Sin embargo las circunstancias de hipoxia más o menos marcada constituyen el común denominador de muchas situaciones en las que la cicatrización está alterada1,2,4.
La realización de una anastomosis siempre produce un cierto grado de desvascularización de los extremos a anastomosar, lo que en condiciones normales no tiene repercusiones sobre la cicatrización, pero desvascularizaciones excesivas o tensión de los extremos a anastomosar pueden producir una situación de riego comprometido de los mismos, alteración que sin duda subyace en muchas dehiscencias anastomóticas20.
En nuestro modelo realizamos la desvascularización de la pared del colon ligando los vasos del mesocolon próximo a la pared del colon. De este modo, la longitud del segmento desvascularizado es siempre la misma (4 cm, de modo que queden 2 cm a cada lado de la anastomosis). En otros modelos experimentales15 que realizan la ligadura de los vasos en el origen, la longitud del segmento desvascularizado puede ser variable en relación con las particularidades de la distribución vascular.
En estas anastomosis que hemos denominado isquémicas (irrigadas sólo por la circulación intraparietal del colon) se observa, como era de esperar, una cicatrización alterada con una significativa disminución de los valores medidos de OH-prolina y de BS.
Los RLO del oxígeno (moléculas con un número impar de electrones en su última capa) se originan en situaciones de isquemia-reperfusión y serían los causantes de las lesiones atribuidas a la reperfusión. En el caso del intestino se originarían por acción de la XO, enzima muy abundante en la mucosa intestinal7, y en los PNM que infiltran los tejidos (originados por la vía del NDPH, con producción de MPO)6,21.
Su cuantificación suele estimarse por métodos indirectos, midiendo los productos finales de su actuación (productos resultantes de la lipoperoxidación) o valorando las consecuencias de su neutralización (administración de alopurinol, SOD, etc.). En la presente publicación se han medido por un método directo, basado en la reducción del citocromo C, que es un método muy sensible y específico de determinación del ASO11.
Nuestros resultados indican que los RLO están aumentados en las anastomosis del grupo II (anastomosis isquémicas). Estos RLO se originan tanto a expensas de la XO como de los leucocitos activados que infiltran la zona (aumento de la MPO)8,21,22.
Estos PNM que se disponen infiltrando las anastomosis cólicas8,9 serían los responsables también del diferente perfil de síntesis de citocinas encontrado durante el proceso de cicatrización en situaciones de hipoxemia17,23.
La SOD y la GPX son las principales enzimas neutralizadoras endógenas de los RLO y su aumento en la isquemia/reperfusión es secundario al de la RLO14,21. Su administración a dosis farmacológicas ha demostrado en algunos modelos experimentales un aumento de la resistencia de los órganos a la isquemia reperfusión6,9.
En cualquier caso, la importancia de los RLO debe ser poco significativa en las anastomosis con extremos bien vascularizados, en las que cabe suponer que los fenómenos de isquemia-reperfusión son mínimos, ya que la neutralización de estos RLO mediante la administración de alopurinol no tiene repercusión sobre la cicatrización de estas anastomosis18.