Introducción
Desde su introducción en 1987, la cirugía laparoscópica ha experimentado un enorme desarrollo, y se ha convertido en la técnica de elección para el tratamiento de muchas afecciones abdominales, sobre todo de víscera hueca y en menor medida en órganos sólidos. En el campo de la cirugía hepática quística benigna, el abordaje laparoscópico es de fácil realización, ya que, en general, sólo es necesaria la fenestración del quiste y la evacuación de su contenido1-7. Sin embargo, la cirugía laparoscópica de los tumores sólidos tiene inconvenientes y plantea diversas controversias: a) los equipos quirúrgicos deben estar formados en cirugía hepática y cirugía laparoscópica; b) la técnica laparoscópica más adecuada no está bien definida (totalmente laparoscópica o asistida con la mano); c) la exploración quirúrgica correcta del hígado, tanto manual como ecográfica, es difícil de conseguir; d) el abordaje o disección de vena cava inferior y suprahepáticas entraña riesgos importantes; e) los métodos de sección parenquimatosa están menos desarrollados que en la cirugía hepática abierta; f) es necesario mejorar los métodos para realizar hemostasia, y g) el riesgo añadido de embolia aérea.
A pesar de estos problemas, existen situaciones en que la cirugía laparoscópica puede llevarse a cabo con seguridad, sobre todo en tumores benignos y también algunos malignos cuando las lesiones se localizan en segmentos anteriores del lóbulo derecho y en el lóbulo izquierdo8-10, y existen más dificultades en tumores grandes, tumores centrales y tumores localizados en segmentos posteriores del lóbulo derecho11-13.
Nuestro objetivo es presentar nuestra experiencia en resecciones hepáticas realizadas por vía laparoscópica (RHL) en tumores sólidos.
Pacientes y método
Entre enero de 2003 y mayo de 2005 hemos realizado el abordaje laparoscópico en 16 pacientes afectos de tumores hepáticos sólidos (THS). La edad media fue de 56 años (rango 26-76), y 9 fueron mujeres (69%).
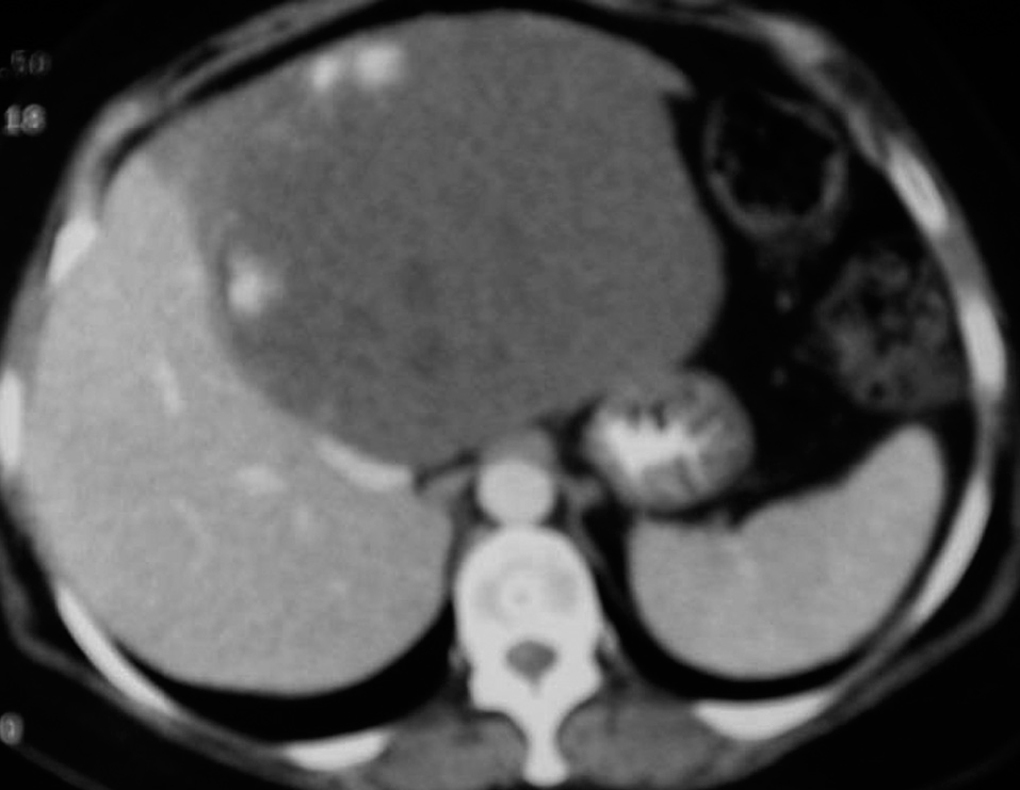
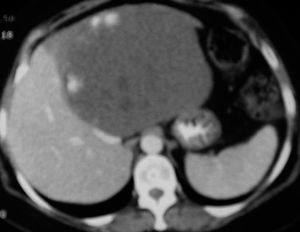
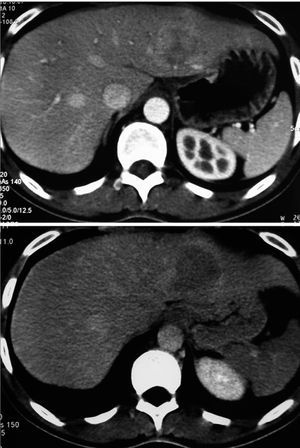
El diagnóstico preoperatorio fue de metástasis hepáticas de carcinoma colorrectal en 11 casos (metástasis hepáticas de carcinoma colorrectal [MHCCR]) y de tumor benigno en los 5 restantes (1 adenoma hepático de 8 cm de diámetro en segmento VII; 1 adenoma hepático de 6 cm en segmento II; 1 hiperplasia nodular focal (HNF) de 10 cm en segmento VI, que tenía el diagnóstico preoperatorio de adenoma; 1 hemangioma de 6 cm en la base del lóbulo izquierdo asociado a una litiasis biliar, y 1 hemangioma gigante en lóbulo hepático izquierdo con anemia y crecimiento progresivo, que había pasado de 10 cm a 16 cm en los últimos 6 meses) (fig. 1) (tabla 1).
Fig. 1. Hemangioma gigante. La tomografía computarizada con contraste por vía intravenosa, en fase arterial, muestra la captación periférica nodular típica de hemangioma.
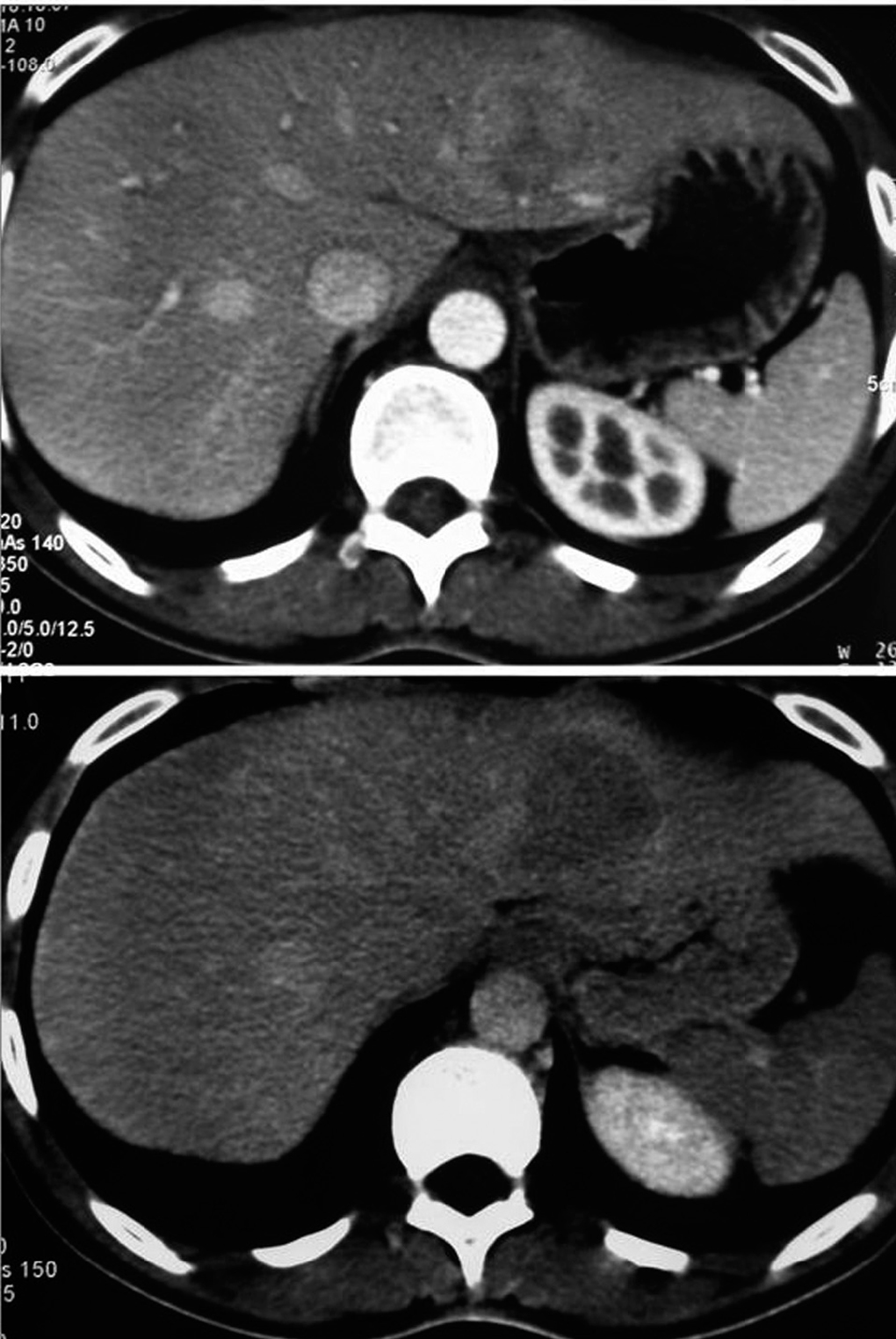
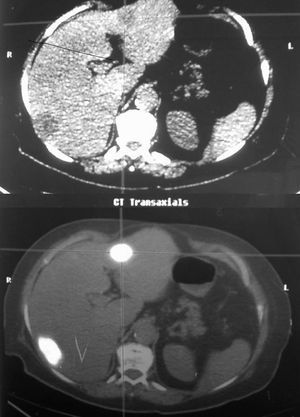
Las exploraciones preoperatorias realizadas en los tumores benignos fueron: analítica con marcadores tumorales, ECO-tomografía computarizada (TC), resonancia magnética (RM), gammagrafía con hematíes marcados y punción biopsia (fig. 2). En el caso de las metástasis, todos los pacientes fueron estudiados mediante analítica y marcadores (CEA, Ca 19,9), ECO-TC y tomografía por emisión de positrones (PET) (fig. 3).
Fig. 2. Adenoma hepático. Tomografía computarizada donde se aprecia lesión de 6 cm en el segmento II, con captación de contraste heterogénea en fase arterial, y próxima a la vena suprahepática izquierda.
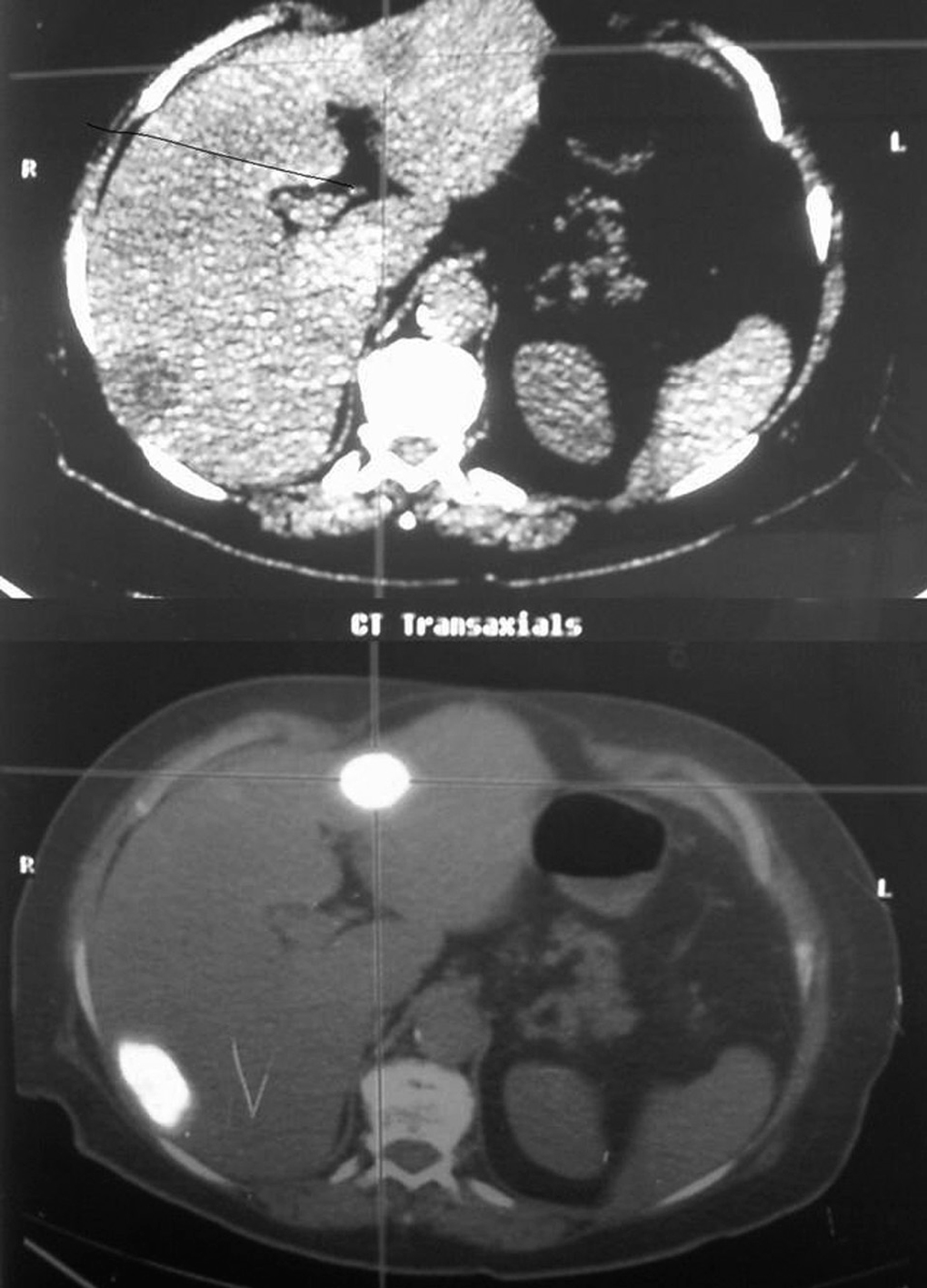
Fig. 3. Tomografía por emisión de positrones de la paciente n.o 14 donde se detectan 2 metástasis de carcinoma colorrectal.
Técnica quirúrgica
Se emplearon 2 tipos distintos de técnica quirúrgica: la hepatectomía laparoscópica completa (HLC) y la hepatectomía laparoscópica asistida con la mano izquierda del cirujano (HLA).
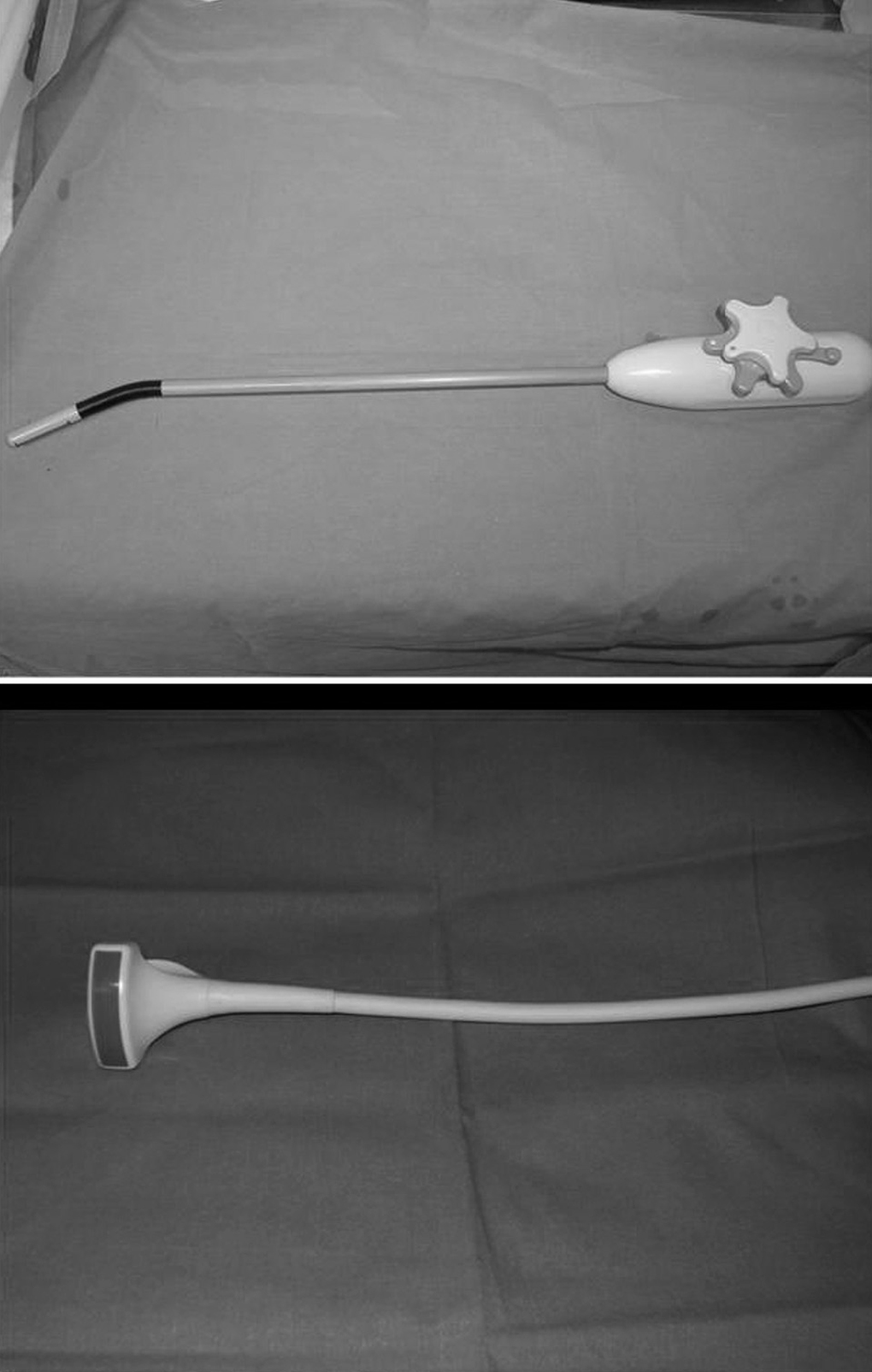
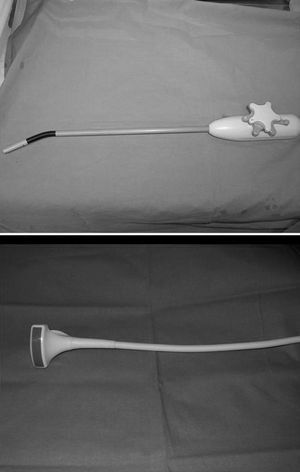
En la HLC (n = 8) el paciente se coloca en decúbito supino, independientemente de la localización de la lesión, con las piernas abiertas y ligeramente flexionadas sobre la pelvis. El cirujano se sitúa entre las piernas del paciente y el primer ayudante a la izquierda del mismo; el segundo ayudante está la derecha del paciente empleando para ello un segundo monitor. Se utilizaron 6 trocares (5 de 10 mm y uno de 12 mm), 4 de ellos siguiendo una línea cóncava a la lesión. Tras la creación del neumoperitoneo (12 mmHg de CO2), bien con aguja de Verres o con Optiview®, se coloca un trocar de 10 mm en la zona umbilical para la introducción de la óptica, y un segundo trocar de 10 mm, en una zona libre de adherencias. Se procede entonces a la lisis de adherencias (sobre todo en pacientes intervenidos previamente de carcinoma colorrectal), para pasar a colocar los 4 trocares restantes ya bajo visión directa. El primero, de 12 mm, a la izquierda del trocar umbilical, otro, de 10 mm, en el flanco izquierdo, línea axilar media, para introducir el clamp que realice la maniobra de Pringle; y los 2 restantes en la zona subcostal derecha y subxifoidea para introducir pinzas de separación hepática o para una mejor visión de las venas suprahepáticas y los ligamentos posteriores hepáticos. A continuación se realiza una ecografía con sonda laparoscópica flexible con un transductor multifrecuencia de 5,5, 6,5 y 7,5 MHz, con penetración máxima de 12 cm, introducida por un trocar de 12 mm (fig. 4). Tras la movilización necesaria del hígado se realiza sección del epiplón menor para el control del pedículo hepático y la posterior oclusión durante la resección hepática. Decidida la técnica quirúrgica a realizar, se procede a la oclusión del pedículo hepático con un clamp introducido por un trocar localizado en flanco izquierdo. La sección del parénquima hepático se realiza con Ligasure® Atlas de 10 mm (Tyco©). Una vez completada la hepatectomía se retira el clamp que ocluye el pedículo hepático y se completa la hemostasia con Tissuelink© (Primm©). Realizada la hepatectomía y la hemostasia, se suturan las posibles fugas biliares existentes, se aplica una sustancia hemostática en el lecho quirúrgico y se coloca un drenaje aspirativo sobre el lecho quirúrgico. En caso de que no haya adherencias, la pieza quirúrgica se extrae mediante incisión de Pfannestiel; y en el caso de pacientes intervenidos de MHCCR, se procede a la extracción de la pieza por una incisión media, en la parte supraumbilical de la cicatriz previa de la cirugía del cáncer colorrectal. Al tratarse de tumores sólidos, la pieza se extrae sin fragmentar, con el fin de comprobar los márgenes de resección. En los casos de conversión, se realizó incisión subcostal derecha o bilateral, según necesidades.
Fig. 4. Sondas ecográficas empleadas: la superior en la hepatectomía laparoscópica asistida y la inferior en la hepatectomía laparoscópica completa.
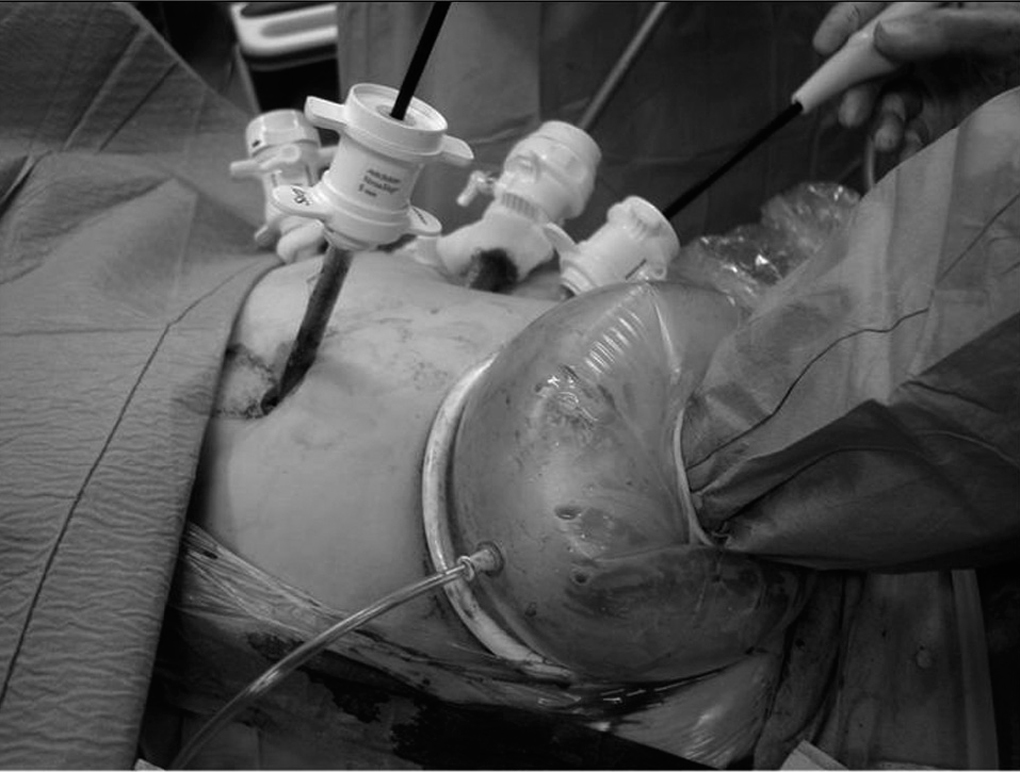
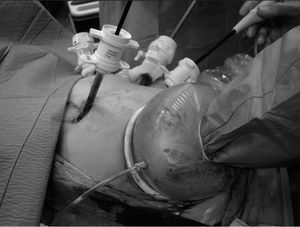
En la HLA (n = 8) la colocación del paciente y de los ayudantes son idénticas a la HLC. Se inicia la intervención realizando una incisión transversa en flanco derecho, a 3-5 traveses de dedo del reborde costal derecho (desde la línea axilar media a la línea axilar anterior). Se seccionan los músculos abdominales, llegando a la vaina anterior del recto que, generalmente, es abierta en pocos centímetros. Se liberan las adherencias de cirugía previa y se introduce el hand-port® (Tyco©) (fig. 5). Con la mano izquierda del cirujano dentro del abdomen, se introduce un trocar de 10 mm en una zona libre de adherencias, y se crea el neumoperitoneo (12 mmHg de CO2), procediendo a continuación a la colocación de los 5 trocares restantes, con la misma localización y función que en la HLC. Posteriormente, se realiza una ecografía con sonda abdominal (Entos®, CT8) (fig. 4) introducida por hand-port®. A continuación se realiza la movilización necesaria del hígado y la disección del pedículo hepático, seccionando el epiplón menor, para facilitar la oclusión del pedículo hepático durante la sección del parénquima. La sección del parénquima se realiza con Ligasure® Atlas de 10 mm (Tyco©) y se completa la hemostasia, una vez realizada la sección parenquimatosa, con Tissuelink (Primm©), todo ello previa oclusión del pedículo portal con clamp vascular. Una vez completada la hepatectomía, se suturan las posibles fugas biliares existentes, se aplica sustancia hemostática en el lecho quirúrgico y se coloca un drenaje aspirativo sobre el lecho quirúrgico. La pieza quirúrgica se extrae por la incisión en flanco derecho del hand-port. En el caso de requerir conversión, realizaríamos la incisión en "J de Makuuchi".
Fig. 5. Imagen intraoperatoria de la técnica laparoscópica asistida con la mano izquierda del cirujano.
Manejo anestésico y control postoperatorio
A diferencia de la cirugía abierta en la que empleamos una presión venosa central (PVC) inferior a 4 mmHg, en la técnica laparoscópica mantenemos una PVC entre 6 y 10 mmHg, con el fin de minimizar el riesgo de embolia aérea.
La indicación de transfusión se realiza en nuestra unidad cuando el hematocrito es inferior a 30%. En ningún caso hemos utilizado autotransfusión ni salvador de células.
Como profilaxis antibiótica se emplearon 3 dosis de amoxicilina-ácido clavulánico de 2 g, administrados 30 min antes de la intervención, a las 3 h del postoperatorio y a las 24 h. En alérgicos se empleó gentamicina más metronidazol (1,5 g por vía intravenosa/24 h) o clindamicina (600 mg 3 dosis/8 h).
El control postoperatorio consistió en una analítica completa cada 8 h (primeras 24 h), cada 24 h (3 primeros días) y cuando clínicamente se estimara necesario.
Resultados
Se completó la resección por vía laparoscópica en 13 de los 16 casos (81%), y se precisó conversión en los 3 restantes (19%). En tumores benignos se consiguió la RHL en 4 de los 5 casos (80%), mientras que en las MHCCR, se completó la RHL en 9 de los 11 casos (82%). Las causas de conversión fueron en 1 caso por hemorragia excesiva durante la resección de un adenoma hepático de 8 cm de diámetro localizado en segmento VII; y en 2 casos de MHCCR por dificultades técnicas al inicio de la cirugía por bloqueo adherencial. En uno de estos 2 casos se perforó inadvertidamente un asa intestinal. Todos los casos de conversión se resolvieron satisfactoriamente por laparotomía.
El tamaño medio tumoral fue de 4,5 cm (rango 1-16 cm), 9 cm para los tumores benignos (6-16 cm) y 3 cm para MHCCR (rango 1-6 cm). En el caso de las MHCCR, las exploraciones preoperatorias detectaron 14 nódulos, mientras que 16 nódulos se detectaron con la exploración intraoperatoria del hígado.
En los 13 pacientes que se resecaron vía laparoscópica, se extirpó un total de 17 lesiones, 4 benignas y 13 MHCCR (10 pacientes presentaban 1 lesión, 2 pacientes 2 lesiones y 1 paciente 3 lesiones). No existió mortalidad intra ni postoperatoria. Sólo 1 de los 13 pacientes resecados precisó transfusión (hemangioma de 16 cm asociado a anemia preoperatoria). La maniobra de Pringle se empleó para la extirpación de 12 de las 17 lesiones; ésta no se realizó en 5 casos (1 caso de resección del segmento V por bloqueo adherencial del hilio hepático por colecistectomía previa; 1 paciente con 2 lesiones, resecando la primera en segmento VI sin oclusión y la otra en segmento VII con oclusión; 1 paciente con 3 lesiones resecando 2 de ellas, localizadas en segmentos III y VIII sin oclusión y la restante en segmento VI con oclusión; 1 resección con control vascular hemihepático por hemangioma gigante en el lóbulo izquierdo). En los casos de oclusión del pedículo hepático, el tiempo real de la sección del parénquima equivale al tiempo de oclusión vascular. El tiempo medio de oclusión del pedículo portal, en los pacientes resecados por vía laparoscópica, fue de 20,6 min (rango 8-21 min). El tiempo medio quirúrgico fue de 180 min (120-230 min). La estancia media fue de 4,9 días (3-14 días).
No existieron complicaciones en 12 de los 13 casos. Sólo 1 paciente (7,7%) desarrolló un hematoma infectado que precisó drenaje radiológico (paciente intervenida por HNF); este caso fue el que presentó mayor estancia con 14 días.
Resultados según la técnica de abordaje laparoscópico
Con el empleo de la HLC (n = 8) se completó la resección en 5 casos (62%): 1 resección local de un hemangioma de 6 cm de diámetro en segmentos posteriores de lóbulo izquierdo; 1 resección local de una HNF etiquetada inicialmente como adenoma hepático; 1 segmentectomía del S. II por adenoma hepático de 6 cm de diámetro; y 2 lobectomías izquierdas (S. II y S. III) por MHCCR. Los 3 casos, ya comentados, que precisaron conversión pertenecen todos a la técnica HLC.
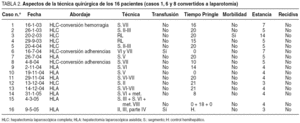
Con la técnica HLA (n = 8) se completó en todos los casos la resección: en 7 casos por MHCCR y en 1 caso por un hemangiona de 16 cm de diámetro en lóbulo hepático izquierdo. La técnica quirúrgica se muestra en la tabla 2.
Discusión
El abordaje laparoscópico de los quistes hepáticos simples (conservando la misma indicación quirúrgica que para cirugía abierta) es relativamente sencillo; en la actualidad se considera la vía de abordaje de elección independientemente de la localización del quiste en el hígado. En el caso de los quistes hidatídicos y la poliquistosis hepática, aunque también es posible su fenestración o resección, debido a los riesgos y dificultades que conlleva su realización, la indicación es más controvertida. La sencillez de realización no debe cambiar las indicaciones de cirugía en estos pacientes, tal y como ha ocurrido con otras afecciones; hay series que publican un número de resecciones laparoscópicas en quistes simples, que previa a la cirugía laparoscópica no se comunicaban1,3.
El abordaje de las lesiones hepáticas sólidas entraña una dificultad técnica superior por lo que no se ha conseguido su generalización, a diferencia de lo que ya ha ocurrido con la cirugía laparoscópica en otros órganos sólidos: bazo, glándulas suprarrenales y riñón. Han pasado ya 13 años desde la primera resección hepática por tumor sólido14 y 9 desde la primera segmentectomía lateral izquierda15, y aún existen muchos problemas sin resolver. Como bien publica Cherqui9, las dificultades se resumen en 3 aspectos: problemas técnicos (las maniobras básicas realizadas en cirugía abierta son difíciles de realizar vía laparoscópica palpación manual, ecografía, movilización del hígado, control vascular y sección parenquimatosa); presencia de complicaciones intraoperatorias (hemorragia y embolia aérea) y, por último, la realización de un tratamiento oncológico incorrecto o la posibilidad de diseminación tumoral.
Un aspecto fundamental de los resultados en cualquier tipo de cirugía es el factor cirujano. En este sentido, en la cirugía hepática por vía laparoscópica es necesario disponer de un cirujano que primero tenga experiencia en cirugía hepática, y segundo, que tenga o adquiera experiencia en cirugía laparoscópica. Algunos autores10 realizan las resecciones con dos cirujanos, un cirujano hepático y un cirujano laparoscopista. Si queremos mejorar en este sentido es necesario que los cirujanos hepáticos realicen cursos intensivos si no disponen de experiencia en cirugía laparoscópica.
El número de casos publicados en las series consultadas sobre tumores sólidos oscila entre 1 y 82 casos1-3,16-27; por tanto, la experiencia es escasa. Incluso en estudios multicéntricos europeos sólo se comunican 37 casos realizados en 11 centros, lo que supone sólo 3,3 casos por centro. Con esta escasa experiencia es muy difícil extraer conclusiones respecto de las indicaciones por afecciones, resultados a largo plazo en lesiones malignas, etc.; la mayoría de las series se limita a aportar el número de procesos, la localización y tamaño de las lesiones y los resultados postoperatorios inmediatos, tal y como ocurre en nuestra serie. En este sentido, y con el fin de sentar las indicaciones de las hepatectomías por laparoscopia en tumores sólidos, son necesarios estudios prospectivos con seguimientos a largo plazo que comparen la seguridad (morbimortalidad) y la eficacia curativa entre la vía abierta y laparoscópica. Además, las intervenciones deberían ser realizadas por los mismos cirujanos.
De acuerdo con Cherqui et al9-10, que probablemente posean la mayor experiencia mundial, la resección por vía laparoscópica sólo estaría indicada en lesiones menores de 5 cm, localizadas en la región anterior del lóbulo derecho (segmentos V y VI de Couinaud) o en lóbulo izquierdo. En segmentos I, VII y VIII consideran que la dificultad es mayor debido al difícil acceso existente y a que estos segmentos poseen comunicaciones con las venas hepáticas y la vena cava inferior. Estos mismos criterios son los empleados por los autores del único artículo publicado en Cirugía Española sobre el tema3 en el que se aportan 6 casos de THS. En nuestra experiencia, creemos que estas indicaciones son muy restrictivas y que, con una mayor experiencia, podrían expandirse. De hecho, las lesiones benignas resecadas por nuestro grupo poseían un diámetro medio de 9 cm (todas con un diámetro igual o superior a 6 cm), y se resecaron lesiones de hasta 16 cm de diámetro. Si bien no poseemos experiencia alguna, la cirugía laparoscópica del hepatocarcinoma puede estar indicada al evitarse la ascitis postoperatoria debido a la menor agresión sobre la pared abdominal y la conservación de la circulación colateral28-35.
La exploración ecográfica y manual del hígado es fundamental en la evaluación de las lesiones malignas. Es bien sabido que en cirugía abierta, la exploración manual y ecográfica detecta más nódulos que las exploraciones preoperatorias. Con la técnica de HLC sólo podemos explorar el hígado con ecografía, gracias al empleo de sondas que poseen una menor resolución que las empleadas por vía abierta. En la serie de Gigot et al19, la mayoría con técnica HLC, sobre lesiones malignas, todas fueron exploradas visualmente y sólo el 65% lo fueron ecográficamente. El empleo de la HLA permite explorar el hígado manualmente, y además el uso de sondas ecográficas de abdomen que poseen mayor profundidad y resolución que las empleadas vía laparoscópica. Además, la palpación de la superficie hepática permite una mejor caracterización anatómica de las lesiones preexistentes e incluso la detección de otras no identificadas preoperatoriamente11-13.
Algunos autores comunican las ventajas que posee la HLA frente a la HLC en lesiones posteriores del lóbulo derecho (segmentos VI y VII)12,13,36. En ambas vías de abordaje el paciente es colocado en decúbito lateral izquierdo. En nuestra técnica HLA, a diferencia de la empleada por otros autores12,13,37, el cirujano situado entre las piernas del paciente introduce su mano izquierda por el handport y realiza fácilmente la movilización de todo el lóbulo derecho hasta llegar a la vena cava inferior y suprahepática derecha, manejando los instrumentos de sección con la mano derecha. El paciente se colocó en todos los casos en decúbito supino, independientemente de la localización de la lesión a tratar, ya que la movilización completa del lóbulo derecho nos permite un buen acceso a los segmentos VI y VII. Nuestra experiencia con la técnica HLA incluye 2 bisegmentectomías VI-VII y 3 segmentectomías del VI. Por otra parte, la mano izquierda del cirujano gira el hígado hacia el lado izquierdo del paciente, siendo posible, además, la introducción de compresas detrás del lóbulo derecho (una vez liberado de sus ligamentos) para mantener el giro del hígado hacia la izquierda. La introducción de la mano izquierda por parte del cirujano permite no sólo la localización de la lesión mediante palpación, sino, en caso necesario, controlar el pedículo hepático, suprahepáticas y línea de sección hepática.
Una limitación importante de la laparoscopia hepática es su empleo en lesiones malignas por el riesgo de recidiva local o diseminación tumoral. La consecución de la resección con un margen de al menos 1 cm es más difícil por vía laparoscópica que por vía abierta. En este sentido, algunos autores10 sugieren que las lesiones hepáticas malignas podrían tener el riesgo de diseminación peritoneal durante la laparoscopia y de implantes tumorales en las puertas de entrada de los trocares38,39. A fin de disminuir estos riesgos, recientemente se ha aplicado la técnica de non-touch, mediante el uso de un saco para la extracción de la pieza quirúrgica40. Desde un punto de vista inmunológico, la cirugía laparoscópica, al inducir una menor agresión quirúrgica, permite preservar la respuesta inmunitaria mucho mejor que la vía abierta41. En nuestra serie, hemos realizado resección en 9 pacientes diagnosticados de MHCCR, sin implantes en orificios de los trocares, con un seguimiento medio de 8,7 meses (rango 2-24 meses) y no hemos tenido ninguna recidiva local. Los márgenes de resección fueron superiores a 1 cm en todos los casos. En nuestra opinión, dado el mejor control anatómico de las lesiones que se logra mediante HLA, su empleo es muy recomendable en caso de lesiones malignas.
Las complicaciones técnicas fundamentales son la hemorragia por sangrado durante la sección del parénquima o por desgarro durante la disección de los vasos portales, la vena cava inferior y las venas suprahepáticas, y la embolia aérea. Los métodos de sección del parénquima en cirugía hepática abierta están bastante perfeccionados, y se consigue realizar casi el 70-80% de las resecciones hepáticas sin transfusión. Por contra, en cirugía laparoscópica, los medios de hemostasia no están totalmente perfeccionados. Así, algunos autores prefieren el empleo del bisturí harmónico, pinzas bipolares o bisturí ultrasónico (cavitrón); el empleo del bisturí de argón es controvertido debido a que aumenta la presión intraabdominal, y con ello, el riesgo de embolia aérea. Nosotros preferimos el empleo del Ligasure Atlas.
Algunos estudios han demostrado que la realización de la maniobra de Pringle reduce las pérdidas hemáticas. Así, Lesurtel et al8 y Cherqui et al9 realizan la hepatectomía con oclusión vascular del pedículo portal, bien de forma continua o intermitente, comunicando tiempos de oclusión superiores a 1 h en 2 de los 30 pacientes que describen10. Más complejo técnicamente es el control vascular de venas suprahepáticas, maniobra que algunos autores realizan sólo en resecciones en el lóbulo izquierdo8-10, y que nosotros sólo hemos realizado en 1 caso. Consideramos que una disección correcta del pedículo portal, una liberación suficiente de los ligamentos hepáticos, y la oclusión completa del pedículo portal (bien continua o intermitente), permiten realizar las resecciones con suficientes garantías para el control de la hemorragia y evitar el riesgo de embolia aérea. Para conseguir un tiempo de oclusión corto, es necesario que los métodos de sección del parénquima sean lo más efectivos posible, ya que en nuestra serie, el tiempo de oclusión portal coincide con el tiempo de sección parenquimatosa (inferior a 25 min en todos los casos), empleando para ello Ligasure Atlas de 10 mm. Finalmente, una vez desclampado el hilio hepático, completamos la hemostasia con Tissuelink sobre la superficie de corte. Consideramos que en los nódulos localizados en los segmentos anteriores (III, IV, V) se puede conseguir la resección de forma segura, con el mismo material quirúrgico, sin oclusión vascular, como ha ocurrido en 4 de los 17 nódulos que resecamos. El empleo de HLA permite, al tener la mano izquierda del cirujano hepático introducida en abdomen, la compresión directa de la superficie de sección y disminuir las pérdidas hemáticas y una mayor seguridad ante posibles lesiones de elementos suprahepáticos.
Algunos autores, para evitar el riesgo de embolia aérea, emplean neumoperitoneo a baja presión, ya que cuando se emplea CO2, que es altamente soluble, este accidente es raro10,13,42. Otros proponen la monitorización de la presión de CO2 y el control vascular de venas suprahepáticas. Nosotros no hemos realizado el control de las venas suprahepáticas, salvo en 1 caso, pero hemos modificado la técnica que empleamos por cirugía abierta (PVC inferior a 4-5 mmHg, incrementando la diuresis o mediante el empleo de una perfusión de nitroglicerina), manteniendo una PVC por encima de los 6-10 mmHg. El riesgo de embolia aérea con PVC baja (0-5 mmHg) puede disminuirse colocando el paciente en posición de Trendelemburg12.
Si analizamos el porcentaje de conversión en lesiones sólidas comprobamos que es muy variable, con cifras que oscilan entre el 0 y el 55%3,10,12,13. Nuestras cifras, con una tasa de conversión del 19%, son comparables. La causa de conversión más frecuente es la hemorragia. En nuestra serie, la conversión se ha relacionado con el tipo de abordaje realizado. Así, en la HLC se convirtieron 3 de los 8 casos, 1 caso por sangrado y 2 por dificultades en el acceso a cavidad abdominal debido a la presencia de adherencias. Este problema, salvo en casos de síndrome adherencial masivo12, no se plantea con la HLA.
El tiempo quirúrgico es más largo que con cirugía abierta, por lo que algunos autores lo relacionan con un incremento de complicaciones respiratorias34,35. Se describe un tiempo superior en pacientes con hepatocarcinoma y cirrosis que aquellos con hígado no cirrótico, idénticos resultados a los obtenidos con cirugía abierta. Esto está en consonancia con la estancia hospitalaria elevada en algunas series, que es superior en pacientes cirróticos que no cirróticos28-35.
En resumen, la cirugía hepática laparoscópica de tumores sólidos benignos comparte todas las ventajas propias de la laparoscopia (mejor y más rápida recuperación postoperatoria, mejor resultado estético, menores necesidades de analgesia postoperatoria) con tasas de complicaciones idénticas a las reportadas para cirugía abierta. En caso de lesiones malignas, hace falta una mayor experiencia para confirmar su seguridad desde el punto de vista oncológico. En nuestra experiencia, la HLA estaría indicada en lesiones localizadas en el lóbulo derecho o de gran tamaño, mientras que las localizadas en el lóbulo izquierdo podrían tratarse con HLC.