Introducción. Presentamos un trabajo retrospectivo de la supervivencia del cáncer de mama a los 10 y 15 años en relación con diversos factores pronósticos.
Pacientes y método. Entre 1963 y 1998 hemos seleccionado a 1.147 pacientes, de las cuales 964 presentaban carcinoma infiltrante operable (en estadios T1-T3) con historia completa. Se han comparado dos series de 452 y de 512 enfermas, con una evolución media de 10 a 25 años. Las técnicas utilizadas han sido la mastectomía radical, modificada o ampliada (89,5%) y la cirugía conservadora (10,5%). También se ha utilizado la ovariectomía quirúrgica bilateral, la administración de andrógenos (serie 1) y antiestrógenos (serie 2). La radioterapia y quimioterapia postoperatorias se han empleado parcialmente en ambas series.
Resultados. La supervivencia a 10 y 15 años ha sido similar en ambas series, siendo en estadio N negativo significativamente mayor en T1 (p = 0,01) y T2 (p = 0,04) con respecto a T3. En estadio N positivo también se obtiene una diferencia significativa en la supervivencia de T1 (p < 0,001) y T2 (p < 0,001) respecto a T3.
Conclusión. El tratamiento del cáncer de mama debe ser realizado en estadio T1 o T2 por su supervivencia significativamente mayor.
Introduction. We present a retrospective study of the 10 and 15-year survival rates among breast cancer patients, relating them to a series of prognostic factors.
Patients and methods. We selected 1147 patients treated between 1963 and 1998. This series included 964 cases of resectable infiltrating carcinoma (T1 to T3) in which the complete history was available. They were divided into two groups of 452 and 512 patients with mean follow-up periods of 10 to 25 years. The patients underwent standard or modified radical mastectomy (89.5%) or breast-conserving therapy (10.5%). Bilateral surgical ovariectomy and administration of androgens (group 1) or antiestrogens (group 2) were also employed. Postoperative radiotherapy and chemotherapy were administered in some members of these groups.
Results. The 10-year and 15-years survival rates were similar in the two groups, being significantly greater among node-negative patients with lesions in stages T1 (p = 0.01) and T2 (p = 0.04) than in those with T3 tumors. With respect to node-positive patients, the survival was also significantly greater among those with lesions in stages T1 (p < 0.001) and T2 (p < 0.001) when compared with patients with lesions in stage T3.
Conclusion. Breast cancer should be treated in stages T1 or T2 when the survival rate is significantly higher.
Introducción
El tratamiento del cáncer de mama ha experimentado grandes cambios desde su inicio hace 100 años, realizándose tratamientos quirúrgicos y complementarios con radioterapia, quimioterapia y tratamiento hormonal cada vez menos agresivos respecto a los utilizados hace más de 20 años1. En este trabajo realizamos un estudio retrospectivo de la supervivencia del cáncer de mama con evolución media posible de 10 a 20 años, para establecer su relación con factores pronósticos fundamentales y básicos en la estadística del carcinoma mamario, como el tamaño tumoral, adenopatías positivas o negativas, grado histológico tumoral, técnica quirúrgica utilizada, receptores hormonales estrogénicos y progesterónicos, estado hormonal de las pacientes y, finalmente, la influencia de la radioterapia, quimioterapia y ovariectomía quirúrgica en los resultados obtenidos en nuestro servicio de patología mamaria en comparación con los de otros centros2-5.
Pacientes y método
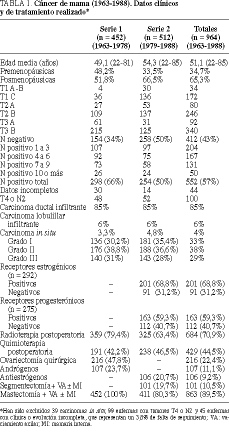
Desde 1963 hasta la actualidad han sido intervenidas por carcinoma de mama en nuestro servicio de 2.606 enfermas, 1.147 de las cuales han sido tratadas hasta el año 1988, es decir, con una evolución media igual o mayor a 10 años, constituyendo este grupo el objeto de este trabajo. Estas intervenciones forman parte de más de 6.615 biopsias de mama realizadas (tabla 1).
Las enfermas han sido divididas en dos grupos: uno que corresponde a los años 1963-1978 con un total de 452 enfermas en estadios T1-T3 operables con carcinoma infiltrante, y un segundo grupo, de los años 1979-1988, con un total de 512 enfermas (tabla 1).
El diagnóstico ha sido realizado mediante mamografía y termografía en los primeros 15 años y, además, con la citología mamaria posteriormente. La confirmación histológica preoperatoria realizada en el servicio de anatomía patológica representa el 96,5% de los carcinomas tratados (el diagnóstico en los carcinomas in situ ha sido diferido), lo que ha permitido practicar el tratamiento quirúrgico definitivo en un solo tiempo.
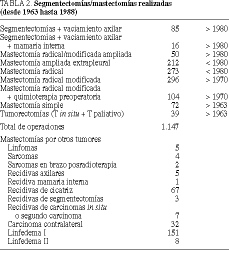
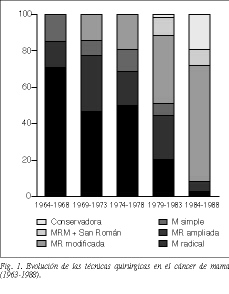
El tratamiento quirúrgico practicado en estos primeros 25 años ha consistido en las técnicas más radicales de la cirugía mamaria (tabla 2 y fig. 1)1,6-8. Para los tumores in situ de tipo papilar o cribiforme se han realizado segmentectomía y radioterapia, y para los tumores in situ comedones o cribiformes de grado III se han practicado la mastectomía más vaciamiento axilar. Hemos podido realizar estos tratamientos dentro del primer mes de la consulta gracias a las mamografías (tablas 2 y 3 y fig. 1).
En ambas series de enfermas hemos utilizado la radioterapia (dosis de 16.000 rads en mastectomías y 5.000 rads + 1.000 de sobreimpresión en segmentectomías) en tumores en estadio T3 o N positivo y la quimioterapia, en estadios N positivos iguales o mayores de 4, en pre y posmenopáusicas, en la primera serie, y con estadio N positivo en pre y posmenopáusicas (con N positivo >= 4 o factores de riesgo) en la segunda serie. Se han utilizado 12 ciclos de ciclofosfamida, metrotexato (o adriamicina) y 5-fluorouracilo cada 28 días. El tratamiento hormonal, en la segunda serie, se realizó en 106 enfermas posmenopáusicas con N positivo < 4 y receptores estrogénicos positivos, mediante tratamiento antiestrogénico con tamoxifeno9,10 a dosis de 20-40 mg/día. En la primera serie de enfermas, en que no existía el tratamiento con tamoxifeno, hemos realizado la ovariectomía quirúrgica bilateral en 206 mujeres premenopáusicas con estrógenos urinarios superiores a 5 µ g/l10. Igualmente, se ha llevado a cabo tratamiento hormonal mediante andrógenos, dromostanolona (100 mg/semana * 6-12 meses)10, en 107 enfermas N positivo pre y posmenopáusicas en la primera serie (tabla 1).
El seguimiento de las enfermas ha sido realizado en los tres servicios (radioterapia, oncología y cirugía de mama) con revisiones cada 6 meses durante los primeros 5 años y anualmente a partir de este momento, lo que supone más de 11.700 consultas durante 10 años. Se ha comprobado su evolución con analítica sanguínea, bioquímica hepática, marcadores tumorales como CEA, CA15-3, placa de tórax, mamografías, hepatograma o ecografía hepática y gammagrafía ósea en cada revisión.
Método estadístico
Las comparaciones entre proporciones se realizaron mediante el test de la * 2. Para establecer la significación de la tendencia en la reducción de la supervivencia según los estadios se calculó el test de la * 2 de linealidad. El estudio monovariante se ha realizado con curvas de Kaplan-Meier10 para comparar la probabilidad de supervivencia de diferentes grupos. Los análisis se realizaron mediante el paquete estadístico Epi Info versión 6. El nivel de significación se estableció en p = 0,05.
Resultados
En este trabajo hemos recogido la estadística que corresponde a 35 años (1963-1998) de cirugía de mama y que comprende 1.147 enfermas de los más de 2.606 casos operados hasta la actualidad.
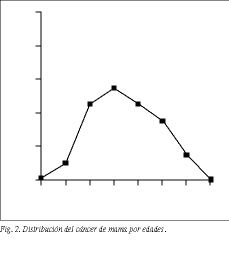
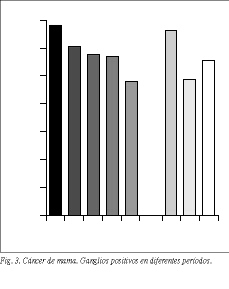
La edad media de las enfermas es de 51,1 años (tabla 1). La máxima incidencia se produce a los 40-60 años (61%) en ambas series (fig. 2). La localización más frecuente (63%) es el cuadrante superoexterno en ambas series, pero debemos considerar que un 26% de los tumores está localizado en cuadrantes internos (tabla 4). El carcinoa ductal in situ (CDIS) presenta una incidencia asociada de carcinoma infiltrante del 10% (4/39), con dos fallecimientos. Igualmente, se asocia a carcinomas ováricos, como sucedió en dos de nuestras enfermas. El carcinoma de mama bilateral representa el 3,3% (32/1.108). El carcinoma de mama en el varón representa el 1% (11/1.108). La recidiva axilar ha sido del 0,5% (5/1.108), y ha correspondido a 5 enfermas de más de 75 años en las cuales no se realizó un vaciamiento axilar completo (tabla 2). Hemos tenido dos recidivas paraesternales y un histiocitoma paraesternal bilateral. La recidiva local sobre la cicatriz ha sido menor del 6% (67/1.108), siendo más frecuente en tumores N positivos (48/67). La recidiva de las segmentectomías ha sido del 3% (3/101) y se han presentado segundos tumores en un 7% (7/101). Las recidivas sistémicas han sido del 28% (43/154) en la serie 1 y del 24% (62/258) en la serie 2, ambos en N negativo, y del 69% (374/542) en el N positivo, como media de ambas series. La radioterapia ha sido bien tolerada, excepto en 2 enfermas con linfangiosarcoma en la axila y brazo radiados que se presentó en los primeros casos, cuando se llevaba a cabo tratamiento radical incluso sobre la axila. El linfedema posradioterapia y cirugía presenta una incidencia del 22% (151/684), siendo grave en el 1% (7/684) de las enfermas tratadas (tabla 2). Los receptores estrogénicos han sido positivos en 201 enfermas (69%), siendo 170 posmenopáusicas y 31 premenopáusicas, y negativos en 91 (31%), de las cuales 73 eran posmenopáusicas y 18 premenopáusicas (tabla 1) (fig. 3).
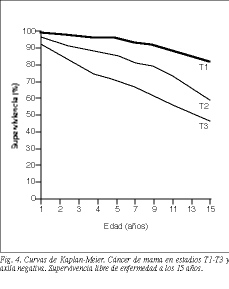
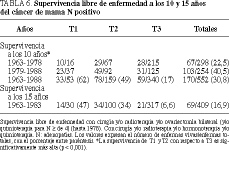
La supervivencia libre de enfermedad a los 10 años de la totalidad de los tumores N negativos (T1, T2 y T3) es del 73 (113/154) y del 77% (199/258) en las series 1 y 2, respectivamente, y del 54 (83/154) y el 64% (55/86) a los 15 años, respectivamente. No hay diferencias con significación estadística al comparar los estadios T1 y T2, pero sí existen cuando se comparan T1 o T2 con T3 (tabla 5 y fig. 4).
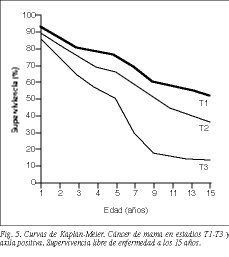
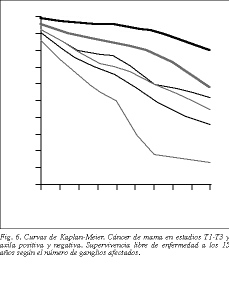
Para tumores N positivos en su totalidad, la supervivencia libre de enfermedad es del 22,5 (67/298) y del 40,5% (103/254) a los 10 años en las series 1 y 2, respectivamente, disminuyendo de manera considerable a los 15 años (tablas 5 y 6). Del mismo modo que con los tumores N negativos, sólo se aprecian diferencias estadísticamente significativas comparando T1 o T2 con T3 (p < 0,001) (figs. 5 y 6).
En la serie 1, el tratamiento de ovariectomía quirúrgica bilateral y de hormonoterapia no pone de manifiesto diferencias significativas en la supervivencia libre de enfermedad de enfermas pre y posmenopáusicas, tanto con tumores N negativos como positivos, entre estadios T1 y T2, pero sí en tumores T3 con respecto a los anteriores (tablas 5 y 6)11-13.
En el estadio T3 existe una supervivencia libre de enfermedad significativamente distinto entre la serie 1 (13%) y la serie 2 (25%), que se justifica por el diferente porcentaje de enfermas premenopáusicas, el 49% (105/215) en la serie 1 y el 33% (41/125) en la serie 2, que tienen una evolución nefasta en tumores T3, especialmente en los N positivos14-16.
Los resultados en la segunda serie para tratamiento antiestrogénico son del 88 (32/36), 85 (63/74) y 62% (10/16) para T1, T2 y T3, con receptores estrogénicos positivos a los 5 años, respectivamente, y del 82 (19/23), 58 (54/88) y 50% (18/36) para T1, T2 y T3 con receptores estrogénicos negativos y sin tratamiento antiestrogénico, respectivamente, lo que representa un porcentaje ligeramente inferior al obtenido con tratamiento antiestrogénico en enfermas posmenopáusicas, pero sin valor estadísticamente significativo.
La indiferenciación tumoral del cáncer de mama, al igual que de otros tejidos, constituye un factor pronóstico nefasto que reduce significativamente la supervivencia de las enfermas, siendo similar en ambas series: del 75% (238/317) en el grado I, del 64% (226/353) en el grado II, y del 43% (79/183) en el grado III. Se observan diferencias estadísticamente significativas entre todos los grados (p < 0,05)17,18.
La supervivencia global es un 5% mayor que la supervivencia libre de enfermedad en tumores N negativos durante los primeros 5 años y un 2,5% mayor durante los primeros 7 años en tumores N positivos, siendo superponible hasta los 15 años.
Discusión
Esta casuística que obtenemos comprende un número amplio de enfermas, lo que permite realizar una estadística con evoluciones de 10 o más años19-21.
A lo largo de estas décadas hemos observado un aumento en la incidencia del cáncer de mama, especialmente en los últimos 10 años, como consecuencia del aumento en la edad media de vida de la población, aunque manteniéndose la mayor frecuencia en período de 40 a 60 años, del incremento del diagnóstico precoz, la mayor utilización de la mamografía con técnicas y aparatos de rayos X más modernos y con menos radiación, de realización de campañas de información y del consumo de dieta rica en grasas animales de los países occidentales, que incrementa la incidencia respecto a países asiáticos o mediterráneos22,23.
Nuestra experiencia en el servicio de cirugía de mama comprende más de 35 años, con enfermas con un seguimiento de más de 10 años (hasta 25 años), necesario para realizar una estadística similar a la de otros centros internacionales. Para valorar estos resultados analizamos los factores pronósticos siguientes en relación con la supervivencia:
Tamaño tumoral
No hay diferencias significativas entre los tumores de tipo T1 y T2 y N negativo en las 2 series de enfermas a los 10 y 15 años (tablas 5 y 6). Las pacientes con tumores T1 y T2 tienen una supervivencia significativamente superior a las que presentan tumores T3 (p = 0,01 y p = 0,04), ya que el pronóstico de la enfermedad empeora en proporción directa al aumento del tamaño tumoral, como aparece en otras publicaciones (tabla 5 y fig. 4)24,25.
Afectación axilar
Representa otro factor pronóstico de alto riesgo, especialmente en los grupos de 4, 7 o 10 ganglios afectados, siendo representativo de recidiva de la enfermedad o metástasis a distancia. En los tumores de tipo T1, en caso de existir, es inferior al 30% y el número de ganglios afectados corresponde al grupo de mejor pronóstico, que es el de 1-3 ganglios positivos, con una supervivencia media superior al 60%, siendo inferior al 40% en el grupo de 7 o más ganglios afectados, e inferior al 20% en el grupo de 10 o más ganglios afectados (p < 0,001, test de la * 2 de linealidad con valor de pendiente de 0,26 y reducción de supervivencia del 26%) (tabla 6 y fig. 6).
Afectación de la mamaria interna
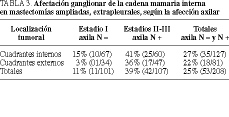
Es el otro grupo ganglionar que causa el fracaso del tratamiento cuando no se realiza su exéresis quirúrgica o su tratamiento con radioterapia, ya que la afectación de la cadena mamaria interna es del 11-39%, según la localización tumoral en cuadrantes internos o externos y la afectación axilar negativa o positiva (tabla 3). La supervivencia se encuentra reducida cuando existe afectación positiva de la mamaria interna, inferior al 40% en ambos grupos, del 27 (41/151) y del 39% (30/75), respectivamente, que se encuentra por debajo de la afectación axilar.
Grado histológico de diferenciación tumoral
Constituye el tercer factor pronóstico de alto riesgo, ya que disminuye la supervivencia de las enfermas de 75 al 40%, según los grupos histológicos I a III de la clasificación de ScarfBloom, con porcentajes en la primera serie de 30, 31 y 49%, respectivamente para los grados I-III, y del 35, 47 y 28%, respectivamente, en la serie 2. Las supervivencias del grado III son del 41% (57/140) en la serie 1 y de 43% (66/143) en la serie 2, siendo los grados I y II del 75 y 66%, respectivamente.
Carcinoma lobulillar infiltrante
Tiene una supervivencia del 62% (42/68), ligeramente superior a la del carcinoma ductal infiltrante, que es del 61% (499/819).
Enfermas premenopáusicas
Tienen una peor evolución que las posmenopáusicas, como se demuestra en tumores T3 N positivos (tabla 6), es decir, que la supervivencia es inversamente proporcional al porcentaje de enfermas premenopáusicas (el 49% en la serie 1 frente al 36% de la serie 2), no observándose en tumores del resto de los grupos. Del mismo modo, el porcentaje de obesidad en la serie 1 es mucho mayor por falta de control dietético adecuado, lo que ha contribuido a la menor supervivencia del grupo T3 N positivo de esta serie.
Vaciamiento axilar
Debe realizarse con la resección de los 3 niveles ganglionares (con estudio ganglionar mayor de 10 ganglios), con o sin resección del pectoral menor para permitir una cirugía localmente extensa y que evite las recidivas axilares que originan la compresión de la vena axilar y del plexo braquial, con linfedema de brazo y neuralgia braquial dolorosa que obliga a realizar reintervenciones.
La resección tumoral debe realizarse con márgenes de 1 cm en las segmentectomías y de 2 a 3 cm en las mastectomías, ya que las enfermas reciben tratamiento de radioterapia sobre el lecho operatorio de la mastectomía o de la cirugía conservadora, especialmente en tumores N positivos, con posibilidad de un estudio intraoperatorio que confirme la suficiente resección de los márgenes quirúrgicos y evite las recidivas de las cirugías conservadoras o mastectomías (tabla 2), que en nuestro trabajo son similares a las de otros centros.
Receptores de estrógenos y progesterona positivos
Aumentan la supervivencia en un 15% en la serie 2 (el 75% [151/201]), frente a receptores negativos (el 61% [56/91]), pero su diferencia se ve compensada cuando se trata a las enfermas con quimioterapia.
Radioterapia
Produce una proporción de linfedemas similar a la obtenida en otros centros, que pueden prevenirse respetando los linfáticos de grasa subcutánea, pero evita las recidivas locales.
Quimioterapia postoperatoria coadyuvante
Es similar en ambas series, sin diferencias en la supervivencia en T1 y T2 y N negativos y positivos, pero sí valorable en T3 y N positivo (tabla 6, serie 2) y que está en relación con el inferior número de enfermas premenopáusicas (46/125) de esta serie en comparación con la serie 1 (122/215).
Ovariectomía en premenopáusicas
Aumenta la supervivencia en tumores N positivos en la serie 1, con resultados comparables a los de la quimioterapia en la serie 2 (216/452).
Andrógenos
No son valorables por haber sido utilizados unidos a la quimioterapia en la serie 1 en el grupo T3 y N positivo, con transformación endocrina no beneficiosa para las enfermas.
Antiestrógenos
Utilizados en posmenopáusicas de la serie 2 presentan resultados similares a la quimioterapia en tumores T1 y T2 y N positivos: un 58% (35/60).
Mastectomía o segmentectomía
Produce el control local de la enfermedad en el 94-97% de las enfermas, especialmente si se explora o trata de manera adecuada la cadena mamaria interna, evitando recidivas en el 7-20%.
Dieta hipocolesterolemiante
Justifica los fracasos terapéuticos a partir del tercer al quinto año, especialmente en enfermas posmenopáusicas, por los problemas hormonales y genéticos que induce la reaparición del cáncer de mama y que podrán ser explicadas más adelante con las técnicas de biología molecular.
Tratamiento de las recidivas
Las recidivas locales de las mastectomías o segmentectomías deben ser tratadas con resección local o mastectomía como segunda cirugía y quimioterapia, ya que más del 50% de las mismas evolucionan fatalmente, en especial si se presentan recidivas inflamatorias que afectan a toda la mama o a una zona amplia del lecho quirúrgico de la mastectomía.
Las recidivas axilares representan un riesgo importante de infiltración de la vena axilar y del plexo braquial, debiendo realizarse su resección quirúrgica, que comprende la resección de la vena axilar, conociendo que se ampliará la circulación colateral de retorno venoso, evitando así necrosis tumorales de la recidiva y realizando igualmente tratamiento con quimioterapia o antiestrógenos en caso de que los receptores estrogénicos sean positivos, como ocurrió en una de las enfermas tratadas.
Conclusión
El cáncer de mama es una enfermedad local que recidiva cuando no se realiza el tratamiento adecuado (quirúrgico y/o radioterapéutico) y una enfermedad sistémica que debe ser tratada mediante antiestrógenos, quimioterapia y/u ovariectomía quirúrgica más una dieta adecuada, que puede y debe tratarse en estadio I cuando existe la suficiente información, prevención y tratamiento correcto de las enfermas, confiando que en próximas décadas la terapia génica consiga estos fines con menor morbilidad y mayor éxito para las pacientes.
Agradecimiento
Deseamos expresar nuestro agradecimiento a J.J. Granizo Martínez, de la Unidad de Investigación de la Fundación Jiménez Díaz, por la realización estadística de este trabajo.