Los PEComas (PEC) se han definido como tumoraciones de origen mesenquimal caracterizadas histológicamente por la proliferación de celulas epitelioides perivasculares y por la capacidad de coexpresar marcadores inmunohistoquímicos melanocíticos (HBM-45 y Melan-A) y musculares (actina y desmina)1.
En este marco se han incluido entidades clínicas como angiomiolipomatosis (AML), linfangioleiomiomatosis (LGM), tumores de células claras sugar del pulmón (CCST), más un grupo de tumores infrecuentes que han sido descritos con diferentes nombres: «tumor miomelanocítico de células claras del ligamento falciforme o ligamento Teres», «sarcoma abdominopelviano de células epitelioides perivascular», «tumor primario extrapulmonar de células claras sugar», entre otros. Hoy en día, el término PEC se utiliza para referirse a estas lesiones que no son AML ni LGM o CCST. Se han relacionado con la esclerosis tuberosa (ET)2.
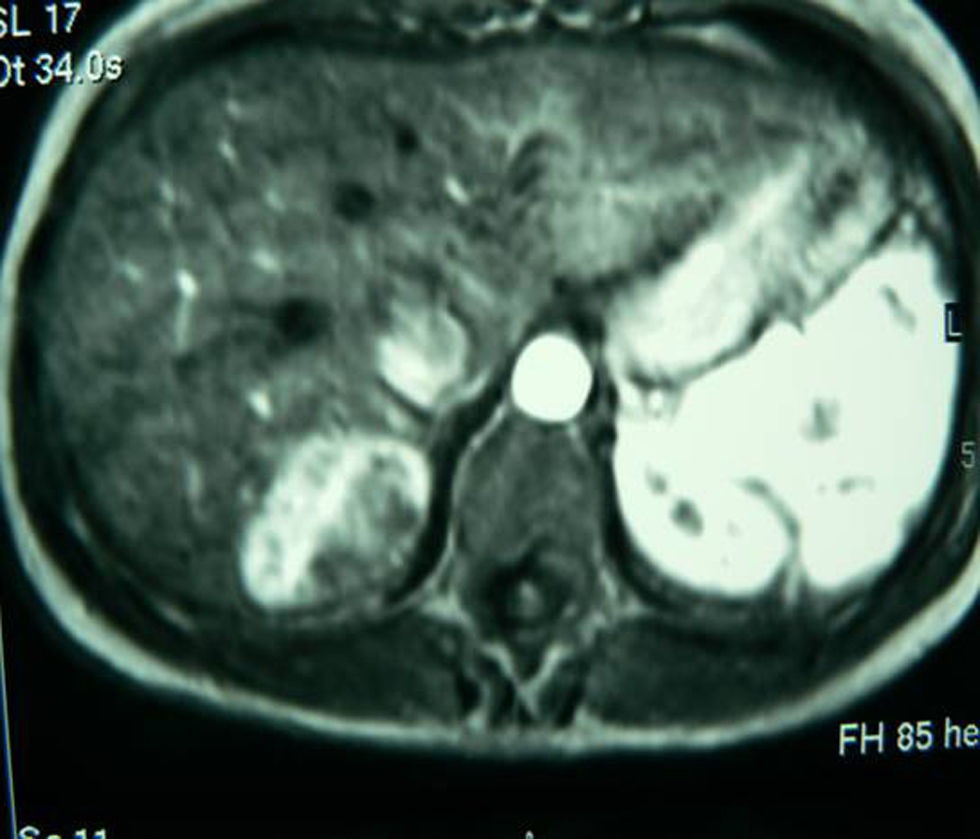
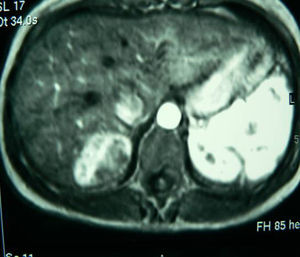
Presentamos el caso clínico de una mujer de 32 años sin antecedentes de interés, en estudio por pólipos vesiculares y molestias mantenidas en HD de 2 años de evolución. Exploración física, anodina. Normalidad en los parámetros analíticos, perfil hepático, marcadores virales y tumorales. Ecografía abdominal (ECO): lesión ocupante de espacio (LOE), hiperecogénica de 3,6cm. Tomografía computarizada (TC) con contraste: LOE de 5,5×3,8cm en el segmento VII con captación de fase arterial y centro hipodenso. Resonancia magnética (RM): LOE de 5×4×3cm en el segmento VII compatible con adenoma (fig. 1). Con dicho diagnóstico, la paciente fue intervenida mediante segmentectomía del VII, sin incidencias. Fue dada de alta al quinto día postoperatorio sin complicaciones.
El estudio anatomopatológico reveló que se trataba de un tumor de células epitelioides perivasculares, con positividad en los estudios inmunohistoquímicos para marcadores melanocíticos (HBM-45) y musculares (actina) y negatividad para desmina y S-100.
En 1996, Zamboni et al3 acuñaron el término PEComa para definir neoplasias producidas por células epitelioides perivasculares. La OMS, en 2002, admitió el término PEComa definiéndolo como «neoplasias mesenquimales compuestas por células epitelioides perivasculares con características histológicas e inmunohistoquímicas»2.
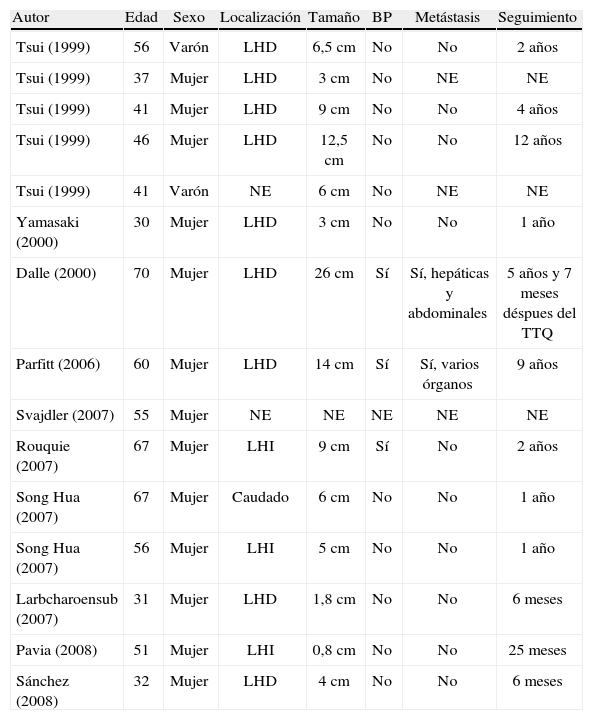
Los PEC han sido descritos en múltiples localizaciones: ligamento falciforme, yeyuno, riñón, vulva, próstata, etc. La mayoría se ha descrito en el útero (38%); en el hígado es excepcional, con sólo 14 casos en la literatura. Son más frecuentes en mujeres; alcanza el 86,6% en esta serie; con una media de edad de 49 (intervalo, 30–70) años (tabla 1). En ningún caso se asoció ET.
Revisión en la literatura de PEC hepáticos
| Autor | Edad | Sexo | Localización | Tamaño | BP | Metástasis | Seguimiento |
| Tsui (1999) | 56 | Varón | LHD | 6,5cm | No | No | 2 años |
| Tsui (1999) | 37 | Mujer | LHD | 3cm | No | NE | NE |
| Tsui (1999) | 41 | Mujer | LHD | 9cm | No | No | 4 años |
| Tsui (1999) | 46 | Mujer | LHD | 12,5cm | No | No | 12 años |
| Tsui (1999) | 41 | Varón | NE | 6cm | No | NE | NE |
| Yamasaki (2000) | 30 | Mujer | LHD | 3cm | No | No | 1 año |
| Dalle (2000) | 70 | Mujer | LHD | 26cm | Sí | Sí, hepáticas y abdominales | 5 años y 7 meses déspues del TTQ |
| Parfitt (2006) | 60 | Mujer | LHD | 14cm | Sí | Sí, varios órganos | 9 años |
| Svajdler (2007) | 55 | Mujer | NE | NE | NE | NE | NE |
| Rouquie (2007) | 67 | Mujer | LHI | 9cm | Sí | No | 2 años |
| Song Hua (2007) | 67 | Mujer | Caudado | 6cm | No | No | 1 año |
| Song Hua (2007) | 56 | Mujer | LHI | 5cm | No | No | 1 año |
| Larbcharoensub (2007) | 31 | Mujer | LHD | 1,8cm | No | No | 6 meses |
| Pavia (2008) | 51 | Mujer | LHI | 0,8cm | No | No | 25 meses |
| Sánchez (2008) | 32 | Mujer | LHD | 4cm | No | No | 6 meses |
LHD: lóbulo hepático derecho; LHI: lóbulo hepático izquierdo; NE: no encontrado; TTQ: tratamiento quirúrgico.
La presentación clínica varía desde asintomáticos, por lo que es un hallazgo incidental4, hasta molestias e incomodiad en el hipocondrio derecho y en forma de abdomen agudo5.
A pesar del avance en las técnicas de imagen, el grado de error diagnóstico es mayor del 90% en esta serie. La ECO, la TC y la RM son los principales métodos de imagen utilizados. La TC con contraste muestra masas heterogéneas realzadas en fase arterial. En la RM, en T1 observamos masas hipointensas y en T2, se comportan de forma hiperintensa, al administrar contraste con gadolinio se muestran con rápida homogeneización en fase arterial.
Sólo Dalle et al6, Parfitt et al1 y Rouquie et al7 utilizaron biopsia percutánea, pero aportó un diagnóstico erróneo (hepatocarcinoma, AML, metástasis de tumor adrenal, etc.) en los primeros dos casos y fue negativa en el último. Dudamos de su rentabilidad para el diagnóstico preoperatorio.
Entre los diagnósticos diferenciales encontramos: HCC, hiperplasia nodular focal, hemangioma, adenoma, metástasis de tumores endocrinos y renales, etc.
Con los datos expuestos, afirmamos que hay grandes dificultades para realizar un diagnóstico preoperatorio correcto.
Históricamente, se ha considerado que el comportamiento de los PEC es benigno; sin embargo, hemos encontrado casos malignos, tanto en forma de recidiva local como metástasis a distancia en diferentes localizaciones, como útero, tejidos blandos, base craneal, etc. Parfitt et al1 muestran una paciente con tumor hepático, con metástasis pulmonares, en vejiga, páncreas y tejidos blandos después de 9 años del primario, y Dalle et al6 presentan un caso de progresión local, metástasis abdominales y pulmonares tras 5 años del primario.
El seguimiento de estos pacientes nos plantea graves problemas, por un lado, la falta de conocimiento de su comportamiento biológico, como en el caso de Parfitt et al1, y por otro lado, la falta de protocolos y criterios firmes para identificar a los potencialmente malignos.
Algunos autores han encontrado parámetros relacionados con recurrencia local o la presencia de metástasis a distancias, como: a) tamaño >7–8cm; b) necrosis, y c) índice mitótico >1/50 HPF (high power field). Otros han referido una serie de hallazgos histológicos que indican malignidad: «crecimiento infiltrativo», «hipercelularidad» y «marcadores de pleomorfismo» y «atipia nuclear»8.
El tratamiento estándar es la cirugía, tanto para el primario como para la recurrencia local o de metástasis a distancia, con márgenes de resección libres9. En enfermedad localmente avanzada, recidiva local o metástasis a distancia se han utilizado terapias combinadas de cirugía, radioterapia, quimioterapia (vincristina, actinomicina D o ciclofosfamida)10 y/o inmunoterapia (interferón alfa) con resultados dispares.
Se necesita disponer de criterios claros que indiquen malignidad en estos tumores, además de un seguimiento muy a largo plazo aun en aquellos con histología de benignidad.