Introducción
El cáncer de mama es la neoplasia más frecuente entre las mujeres de nuestro país1,2. En España se diagnostican 16.000 casos nuevos al año; la tasa de incidencia ajustada por edad es de 70 por 100.000 habitantes3 (79,4 en la provincia de Las Palmas de Gran Canaria)4. Respecto de la mortalidad los datos también son llamativos, ya que provoca la muerte de 6.000 mujeres al año3, y es la primera causa de muerte por cáncer entre las mujeres5. Sin embargo, la aplicación de programas de detección temprana junto con los avances diagnósticos y terapéuticos introducidos recientemente, han conseguido un aumento de la supervivencia, que en la actualidad se sitúa por encima del 70% a los 5 años del diagnóstico3,6.
Todos estos datos hacen que deba considerarse el cáncer de mama como un problema de salud pública. Además, al no existir posibilidades de prevención primaria, nos encontramos con que el cribado y el diagnóstico temprano son las únicas herramientas de las que disponemos para luchar contra esta enfermedad5. Gracias a la aplicación de estos programas de cribado hemos asistido a un aumento significativo de los casos diagnosticados precozmente, con tumores de muy pequeño tamaño. En estas campañas, un porcentaje muy elevado de los tumores que se detectan miden menos de 2 cm, lo que lleva a que en muchos casos no se observe afectación ganglionar axilar7.
Por otro lado, es bien sabido que el tratamiento quirúrgico del cáncer de mama ha sufrido una evolución importante8,9, y se ha ido instaurando el tratamiento conservador como la opción de elección en el manejo del cáncer de mama en estadios iniciales. La linfadenectomía axilar ha formado siempre parte del tratamiento quirúrgico de la enfermedad, cumpliendo 3 objetivos: valorar la extensión de la enfermedad, establecer el pronóstico y proporcionar un efecto terapéutico (como control local de la enfermedad). El aumento de los casos con un diagnóstico temprano ha ido paralelo a un incremento en el número de linfadenectomías innecesarias desde el punto de vista terapéutico, ya que no se encuentran ganglios afectados en muchas de ellas. Sin embargo, la función de estadificación y pronóstico sigue siendo fundamental, ya que por una parte el tratamiento sistémico dependerá del estadio de la enfermedad, y por otra es bien sabido que el factor pronóstico más importante es el número de ganglios axilares afectados10.
La biopsia selectiva del ganglio centinela (BSGC) responde a la necesidad de adecuar el tratamiento quirúrgico de la axila a las pacientes que por haber sido diagnosticadas precozmente no presentarán afectación ganglionar. Es una técnica mínimamente invasiva que permite realizar una correcta estadificación de la enfermedad (en muchos casos al alza, como veremos más adelante), y aporta la información pronóstica necesaria para instaurar un tratamiento adecuado. De esta forma se reserva la linfadenectomía axilar únicamente para los casos en que se requiera un control local de la enfermedad, por presentar metástasis ganglionares.
El concepto de ganglio centinela (GC) en el cáncer de mama se fundamenta en un modelo mecanicista11,12. El argumento central se basa en que las células tumorales se diseminan ordenadamente a través del sistema linfático, y de esta forma, la afectación de los ganglios axilares no es un acontecimiento aleatorio sino que, al contrario, se rige por un orden mecánico determinado por el flujo linfático entre el tumor y su primera estación ganglionar. Por lo tanto, la diseminación linfática es ordenada y predecible, y las mestástasis a saltos (skip metastases) son infrecuentes13-15.
Así, se define el GC como el primer ganglio de una cadena que recibe el flujo linfático desde el tumor primario, y por lo tanto, el primero en acoger las células tumorales diseminadas por esta vía. El valor clínico del GC reside en su valor predictivo sobre el estado ganglionar axilar, ya que en el modelo actual de la enfermedad se acepta que si el GC no contiene células tumorales tampoco el resto de los ganglios axilares presentará afectación metastásica12.
En la actualidad aún se discute cuál es la mejor técnica para la localización del GC en el cáncer de mama. Las inyecciones peritumoral e intratumoral son las más utilizadas, y últimamente se está extendiendo el uso de la inyección subdérmica e incluso intradérmica. Sin embargo, pocos son los grupos que trabajan con la administración subareolar del trazador. Este tipo de inyección ni siquiera está contemplada en las recomendaciones del Consenso Nacional sobre Ganglio Centinela en Cáncer de Mama, celebrado en Salamanca en octubre de 2001, a pesar de lo cual la hemos utilizado en nuestro trabajo.
Por lo tanto, el propósito de este estudio fue validar la técnica de la BSGC que realizamos en nuestro centro con el fin de evitar linfadenectomías innecesarias, así como evaluar la eficacia y la utilidad de la inyección subareolar del radiotrazador en la localización del GC en el cáncer de mama.
Material y método
Sujetos
Entre mayo de 2000 y junio de 2003 estudiamos a un total de 100 pacientes diagnosticadas de cáncer de mama en estadios iniciales T1 y T2, con confirmación histológica. Todas las pacientes eran mujeres con una media de edad de 58,3 años (rango = 28-80). Los criterios de inclusión para el estudio fueron los siguientes: carcinoma operable, estadio T1 y T2 (menores de 3 cm), sin evidencia clínica de afectación ganglionar ni de extensión sistémica (N0, M0), y los de exclusión: carcinoma de mama multifocal, carcinoma inflamatorio, quimioterapia previa, cirugía o radioterapia mamaria o axilar previa, metástasis a distancia, embarazo o lactancia.
Técnica
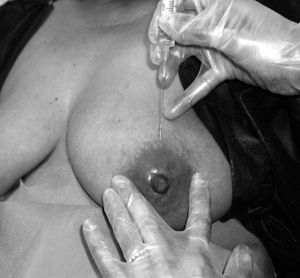
El mismo día de la intervención se administró a todas las pacientes una inyección en la región subareolar profunda de la mama afecta, de 0,8 mCi de nanocoloides de albúmina marcados con 99mTc (Nanocoll®). Esta inyección se administró utilizando una aguja intramuscular (0,8 mm x 40 mm), y se practicó en sentido craneocaudal, con la paciente sentada en el borde de la camilla. El lugar de la inyección fue el mismo en todos los casos: en la línea que separa la areola y la piel del resto de la mama, en la posición correspondiente a las 12.00 horas del reloj (fig. 1). Se introdujo la aguja unos 2/3 de su longitud, hasta que el extremo de la misma quedara aproximadamente enfrente del pezón. Tras aspirar para comprobar que no se había pinchado ningún vaso se procedió a la inyección del radiotrazador de forma lenta, tras lo cual se realizó un masaje en la zona, con el fin de facilitar el drenaje linfático de la solución inyectada hacia las estaciones ganglionares correspondientes.
Fig. 1. Localización de la inyección subareolar
A los 15-30 min postinyección se introdujo a la paciente en la gammacámara colocándola con el brazo correspondiente a la mama afecta formando un ángulo de 90° con el resto del cuerpo, para dejar libre la axila. Bajo visión gammagráfica, se procedió a la localización del GC, con obtención de imágenes en proyección anterior, lateral y oblicua anterior 30° utilizando una gammacámara monocabezal (SPX4 de General Electrics, Colimador LEGP, Matriz 256 x 256). Se realizó el marcaje sobre la piel con tinta indeleble, con el objetivo de orientar el lugar de la incisión en el acto quirúrgico.
En aquellos casos en los que no se evidenció drenaje al GC en las primeras imágenes tomadas a los 15-30 min postinyección, se continuó con el masaje en el lugar de la inyección para facilitar el tránsito del radiotrazador. Se adquirieron imágenes tardías que en ninguna paciente superaron las 3 h, y que permitieron en todos los casos realizar la cirugía la misma mañana de la inyección.
Durante la intervención y una vez realizada la exéresis del tumor primario, se realizó el abordaje axilar en el lugar marcado con tinta. Con la colaboración del médico nuclear se procedió a la localización y extracción del GC. Para ello se utilizó una sonda de rayos gamma en funda estéril capaz de detectar la radiación emitida desde el GC, y transformarla en señal acústica (Navigator Gamma Guidance System. Modelo GGS de USSC). Una vez extraído el GC y etiquetado como tal, se completó el vaciamiento axilar en todos los casos.
Para el análisis anatomopatológico (AP) del GC se incluyó el ganglio en su totalidad en cortes de 2 mm. Se realizaron 2 secciones seguidas, por bloque, una de ellas para tinción con hematoxilina-eosina (HE) y otra con citoqueratinas (CK). En los casos en que ambos análisis fueron negativos, se realizaron dos secciones adicionales seguidas de HE y CK a 3 niveles distintos (cada nivel distante 100 micras del anterior). El resto de los ganglios de la linfadenectomía se analizó con el procedimiento rutinario.
Análisis estadístico
Para el análisis de los datos se consideró como GC a la primera estación ganglionar capaz de concentrar el radiotrazador administrado en cantidad suficiente como para ser detectado por visión gammagráfica y posteriormente en el quirófano con la sonda de rayos gamma.
Se definió como verdadero positivo (VP) a los casos en que el GC mostró afectación por metástasis tras el análisis anatomopatológico, independientemente del resultado de la linfadenectomía, ya que el GC forma parte de la cadena axilar ganglionar y cuando está afectado se considera la linfadenectomía como positiva, aunque el resto de los ganglios estén libres de enfermedad. Se consideró verdadero negativo (VN) a los casos en que el GC no mostraba metástasis y el resto de la linfadenectomía tampoco.
Por las características del estudio no existen falsos positivos, ya que el drenaje linfático de la solución desde el lugar de inyección hasta axila sólo es posible a través de los canales linfáticos que confluyen en las estaciones ganglionares correspondientes, y como ya hemos dicho un GC positivo obliga a considerar la linfadenectomía como positiva ya que forma parte de la misma. Los falsos negativos (FN) fueron aquellos en los que el GC resultó negativo tras el análisis anatomopatológico y se encontró afectación metastásica en alguno de los ganglios del vaciamiento axilar.
Se utilizó el programa SPSS V. 10, y se realizó estadística descriptiva, calculando la sensibilidad (S) de la técnica, la especificidad (E), el valor predictivo positivo y negativo (VPP, VPN).
Resultados
El 34% de los tumores no eran palpables, y tras el análisis AP se objetivó que el tamaño tumoral medio fue de 1,98 cm. El 85% de los casos resultaron ser carcinomas ductales infiltrantes (CDI) y el resto correspondió a otros tumores.
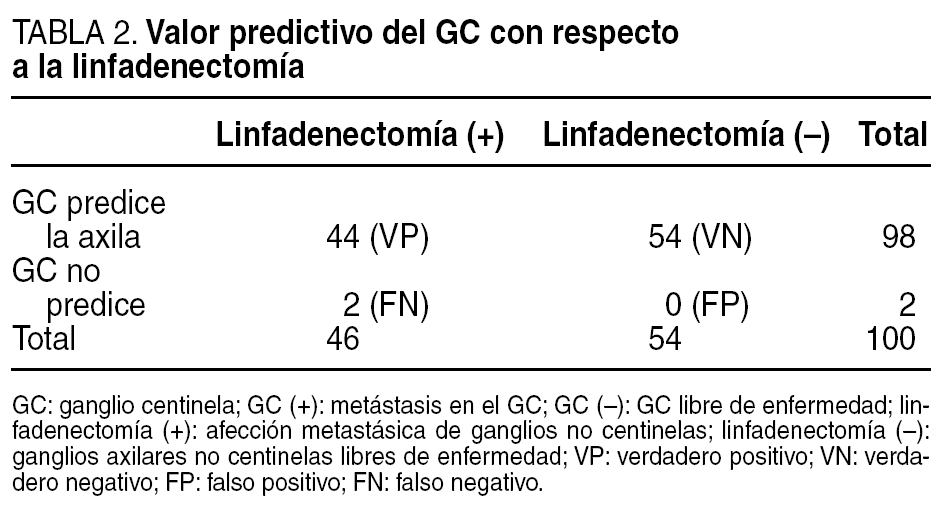
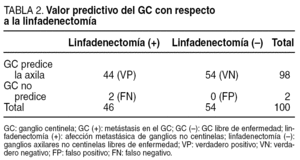
El GC se localizó gammagráficamente y se pudo extraer en todos los casos; se obtuvo una media de 1,95 ganglios por paciente (rango = 1-6). Los resultados obtenidos tras el análisis AP se muestran en la tabla 1.
De las 100 pacientes estudiadas 44 presentaron metástasis en el ganglio centinela (VP). De este grupo 15 pacientes presentaban también afectación metastásica en alguno de los ganglios del vaciamiento axilar, y en las 29 restantes sólo estaba afectado el GC.
De las 56 pacientes sin metástasis en el GC, sólo 2 tenían metástasis ganglionares en el resto del vaciamiento axilar (FN), y las 54 restantes no presentaban afectación de ninguno de los ganglios aislados (VN).
La sensibilidad fue del 95,65% (44/44 +2), la especificidad del 100% (54/54 +0), el VPP del 100% (44/44 +0) y el VPN del 96,4% (54/54 +2).
El GC fue capaz de predecir el estado del resto de la axila en el 98% de los casos, tal y como muestra la tabla 2. Los 2 FN se presentaron al inicio de la curva de aprendizaje. Uno de ellos resultó ser un carcinoma lobulillar infiltrante de 2,4 cm, y el otro un CDI que tras el análisis AP medía 3 cm. La tasa de FN fue de 4,5% (2/44).
De haber estado validada la técnica se podía haber evitado la linfadenectomía en 54 pacientes (54%), ya que en todos estos casos fue negativo el análisis del GC y en el vaciamiento axilar tampoco se encontró extensión de la enfermedad.
En 29 pacientes sólo fue positivo el GC; el resto del vaciamiento axilar fue negativo, lo que demuestra la fiabilidad de la técnica y refuerza la teoría de que la diseminación linfática es ordenada y predecible.
En 6 de las 100 pacientes estudiadas se puso de manifiesto en la gammagrafía la existencia de al menos 1 GC localizado en la cadena mamaria interna. En sólo 2 de estas 6 pacientes se realizó la BSGC; en ambos casos se obtuvo un resultado negativo que coincidió, además, con el observado en los GC axilares.
Discusión
La identificación y estudio del GC mediante la inyección de coloides marcados con 99mTc es una técnica útil en la estadificación del cáncer de mama en etapas iniciales, y permite obviar la linfadenectomía en los casos en los que el análisis del GC es negativo16. Además, la administración subareolar del radiotrazador es una técnica poco utilizada a pesar de que presenta múltiples ventajas respecto de otras inyecciones17.
La ventaja fundamental de la BSGC se centra en las propias enfermas, al desaparecer las complicaciones vinculadas a la linfadenectomía (seromas, síndrome doloroso axilar, limitaciones en la movilidad del hombro, parestesias, linfedema). Además, al ser una técnica mínimamente invasiva posibilita el tratamiento ambulatorio de estas pacientes, y disminuye el tiempo quirúrgico y las cargas asistenciales ya que requiere mínimos cuidados postoperatorios.
El principal inconveniente de la BSGC es la presencia de un FN. Para la mayoría de los autores se trata de una complicación propia de la curva de aprendizaje cuya incidencia es mínima una vez que el equipo ha adquirido la experiencia suficiente en el manejo de la técnica. Las consecuencias de un FN se traducen en dos hechos: un control axilar defectuoso y una inadecuada estadificación de la enfermedad, lo que conllevaría una recidiva axilar y a una incorrecta valoración del tratamiento adyuvante.
Para realizar la validación de la BSGC en nuestro centro hemos seguido las recomendaciones del Consenso Nacional sobre Ganglio Centinela en Cáncer de Mama, celebrado en Salamanca en octubre de 2001, que contó con la participación de la Asociación Española de Cirujanos, la Sociedad Nacional de Medicina Nuclear y la Sociedad Española de Anatomía Patológica. En ella participaron los principales hospitales españoles en los que se realiza la BSGC, y se dictaron las recomendaciones a seguir por los grupos que quisieran validar sus resultados e implantar la técnica18.
En los puntos 21, 22 y 23 de este Consenso se recomienda que "la acreditación para realizar la técnica debe ser personal y de grupo, y afectará a cirujanos, médicos nucleares y patólogos", y que "cada grupo debe validar la técnica mediante unos resultados mayores de un 90% de localización y menores o iguales al 5% de FN, en un número de 50 casos". En relación con esto, habría que comentar que el número de pacientes necesarios para validar la técnica ha sido una cuestión ampliamente discutida, que ha obligado a la celebración de consensos similares al de Salamanca en el ámbito internacional. Así, la American Scociety of Breast Surgeons publicó en septiembre de 2000 sus recomendaciones en las que aconseja la realización de al menos 30 casos con una identificación superior al 85% y menos de un 5% de FN, mientras que la Canadian Medical Association defiende que 20 casos son suficientes, con el mismo porcentaje de identificación y de FN.
Independientemente de las discrepancias existentes sobre el número de casos necesarios, en lo que sí hay acuerdo es en el hecho de que existe una curva de aprendizaje que se debe realizar antes de abandonar la linfadenectomía axilar sistemática19. En nuestro trabajo hemos seguido las recomendaciones citadas en cuanto al número de casos necesarios y los resultados satisfacen las exigencias de los aconsejados por el Consenso de Salamanca (100% de identificación, 4,5% de FN).
Con respecto a la realización de la técnica, en este consenso se recomienda la utilización de colorante para mejorar el porcentaje de identificación del GC (puntos 2, 10, 11 y 12). En nuestro trabajo no ha sido necesario, ya que usando sólo radiotrazador se pudo detectar y extraer el GC en todos los casos. También debemos apuntar que la actividad del radiotrazador administrado, a pesar de ser menor de la aconsejada (0,8 mCi), ha sido suficiente para la localización del GC en todas las pacientes (punto 6).
Sin embargo, en cuanto al lugar de inyección existe más controversia (punto 8). Ha sido un tema bastante discutido y aunque en el consenso no se contempla la inyección subareolar, en el ámbito internacional se acepta actualmente que esta técnica es válida, y hay trabajos que defienden que puede ser incluso superior20-22. Estos trabajos se basan en el hecho demostrado de que el drenaje linfático de la mama es recolectado en primer lugar en el plexo subareolar de Sappey, y desde allí conducido hasta la axila, a través de uno o varios canales linfáticos. La inyección subareolar sería entonces un procedimiento válido, e incluso en ocasiones superior, al realizado con la administración peritumoral23. Además esta vía de administración parece apropiada en todos los casos, independientemente de la localización del tumor primario, o de su tamaño. También hay estudios publicados que defienden su utilidad en tumores multicéntricos y en las pacientes en las que se ha realizado biopsia escisional previa24,25.
Por todo lo anterior, la administración subareolar del radiotrazador presenta varias ventajas respecto a otras vías de administración propuestas por el consenso: a) se trata de una inyección única; b) el paciente recibe menor dosis de radiación; c) no precisa localización del tumor con otras técnicas, por lo que es más fácil su administración por el médico nuclear, y d) la imagen de la inyección no interfiere con la de los ganglios axilares en aquellos casos en los que el tumor está localizado cerca de la axila17,26.
En lo que se refiere al tamaño tumoral máximo en el que se puede aplicar la BSGC tampoco existe acuerdo internacional. En el Consenso de Salamanca se recomienda excluir todos los tumores mayores de 3 cm, ya que las probabilidades de afectación ganglionar aumentan de forma directamente proporcional al tamaño del tumor y puede existir invasión masiva del GC que impida la concentración del radiotrazador necesaria para localizarlo (lo que también se conoce como "bloqueo metastásico"). Analizando los casos de FN obtenidos en nuestra serie encontramos que uno de ellos medía 2,4 cm, y el otro 3 cm.
Otra de las cuestiones actualmente en discusión es la referente a la BSGC cuando el GC aparece en la cadena mamaria interna. En nuestro estudio el 6% de las pacientes presentó drenaje hacia esta cadena linfática, porcentaje que se encuentra dentro de lo referido en la literatura médica (2,41-25,3%)27. Por lo tanto, contrariamente a lo enunciado en el consenso de Philadelphia28, la inyección subareolar sí puede poner de manifiesto drenaje extraaxilar. En nuestro centro se decidió no realizar de manera sistemática la biopsia de los GC situados en la cadena mamaria interna, ante la falta de estudios existentes que demostraran un alto nivel de evidencia que justificara lo contrario. No obstante, se llevó a cabo la BSGC en la cadena mamaria interna a las dos primeras pacientes que presentaron drenaje en ella.
Una de las ventajas de la BSGC es el hecho demostrado de que mejora la estadificación de la enfermedad, debido a que el análisis AP del GC es más preciso y exacto que el realizado en una linfadenectomía tradicional29. De esta forma el estudio exhaustivo del GC por parte del servicio de anatomía patológica, mediante la utilización de inmunohistoquímica, ha permitido la detección de células tumorales aisladas, también llamadas submicrometástasis o nidos celulares (< 0,02 cm). Desde esta forma la tasa de reestadificación por micrometástasis aumenta considerablemente y esto supone un beneficio añadido de la técnica, ya que lesiones que no podían ser detectadas anteriormente constituyen en la actualidad el punto de partida para tomar decisiones trascendentes en el proceso terapéutico.
Este hecho ha tenido tal repercusión que ha sido contemplado en la revisión de la clasificación TNM realizada por el American Joint Committee on Cancer Stating System for Breast Cancer en septiembre de 200230. En esta revisión se ha acordado, por ejemplo, una nomenclatura para las lesiones identificadas mediante inmunohistoquímica o técnicas moleculares, pero con resultado negativo en el estudio tradicional con HE.
Por lo tanto, a excepción de la actividad administrada y de la vía de inyección, hemos seguido las recomendaciones del citado Consenso Nacional de Salamanca sobre Ganglio Centinela en Cáncer de Mama, y hemos obtenido buenos resultados en la fase de validación de la técnica (100 casos, 100% de detección y 4,5% de FN).
En conclusión, podemos afirmar que la inyección subareolar del trazador, a pesar de ser una técnica poco extendida, es un procedimiento útil para la localización del GC en pacientes con cáncer de mama. Este tipo de inyección presenta múltiples ventajas frente a otros métodos, la más destacable es que no precise localizar el tumor. Además podría llegar a ser la técnica de elección en casos de tumores multicéntricos o con biopsia escisional previa.