Este estudio evaluó la tasa de transfusión de concentrados de hematíes alogénicos (TCHA) en la cirugía de resección del cáncer gástrico y la difusión de los protocolos de ahorro transfusional (PAT).
MétodosEstudio retrospectivo de todos los pacientes operados por adenocarcinoma gástrico con intención curativa en Cataluña y Navarra (2011-2013) e incluidos en el registro del grupo español EURECCA de cáncer esófago-gástrico. Los hospitales con PAT disponían de un circuito de optimización preoperatoria de la hemoglobina (Hb) y de política transfusional restrictiva. Los factores predictores de TCHA se identificaron mediante una regresión logística multinomial.
ResultadosSe incluyeron 652 pacientes, 274 (42%) de los cuales recibieron TCHA. Seis de los 19 hospitales disponían de PAT (22% de los pacientes). La Hb baja al diagnóstico (10 vs. 12,4g/dL), una puntuación ASA III/IV, pT3-4, la cirugía abierta, la resección visceral asociada y haber sido atendido en un hospital sin PAT fueron factores predictores de TCHA, con la Hb baja, la resección visceral asociada y la intervención en un centro sin PAT persistiendo como predictores en el análisis multivariante. Hubo un mayor porcentaje de uso de hierro en el preoperatorio (26,2 vs. 13,2%) y un menor porcentaje de transfusiones (31,7 vs. 45%) en los hospitales con PAT.
ConclusionesLa tasa transfusional en la cirugía del cáncer gástrico fue del 42%. Los PAT resultaron eficaces pero su implementación fue solo del 22%. La Hb baja, la intervención en un centro sin PAT y la resección visceral asociada fueron predictores de transfusión.
This study evaluated allogenic packed red blood cell (aPRBC) transfusion rates in patients undergoing resection for gastric cancer and the implementation of blood-saving protocols (BSP).
MethodsRetrospective study of all gastric cancer patients operated on with curative intent in Catalonia and Navarra (2011-2013) and included in the Spanish subset of the EURECCA Oesophago-Gastric Cancer Registry. Hospitals with BSP were defined as those with a preoperative haemoglobin (Hb) optimisation circuit associated with restrictive transfusion strategies. Predictors of aPRBC transfusion were identified by multinomial logistic regression analysis.
ResultsA total of 652 patients were included, 274 (42.0%) of which received aPRBC transfusion. Six of the 19 participating hospitals had BSP and treated 145 (22.2%) patients. Low Hb level at diagnosis (10 vs 12.4g/dL), ASA score III/IV, pT3-4, open surgery, associated visceral resection, and having being operated on in a hospital without BSP were predictors of aPRBC transfusion, while low Hb level, associated visceral resection, and non-BSP hospital remained predictors in the multivariate analysis. In case of comparable risk factors for aPRBC transfusion, there was a higher use of preoperative intravenous iron treatment (26.2% vs 13.2%) and a lower percentage of transfusions (31.7% vs 45%) in hospitals with BSP.
ConclusionsThe perioperative transfusion rate in gastric cancer was 42%. Hospitals with BSP showed a significant reduction of blood transfusions but treated only 22% of patients. Main predictors of aPRBC were low Hb level, associated visceral resection, and undergoing surgery at a hospital without BSP.
La anemia en el momento del diagnóstico está presente hasta en un 60% de los pacientes con cáncer gástrico, siendo significativa (hemoglobina [Hb] sérica<10g/dL) en un 40% de los casos1–3. Ello determina que las tasas transfusionales peroperatorias sean elevadas, con frecuencia superiores al 30%4–6. La transfusión de concentrados de hematíes alogénicos (TCHA) puede comprometer la inmunidad de los pacientes operados de cáncer, con posibilidades de aumentar la morbilidad postoperatoria e incluso influir negativamente en la recidiva tumoral y supervivencia a largo plazo7–9. La implementación de protocolos de ahorro transfusional (PAT) que incluyen la evaluación y tratamiento de la anemia preoperatoria promoviendo el uso de hierro intravenoso (iv), asociado a una política transfusional restrictiva, podrían ayudar a minimizar las TCHA perioperatorias, pero no se dispone de estudios que lo confirmen en series amplias de pacientes con cáncer gástrico10,11.
En la última década se ha realizado una progresiva centralización del tratamiento quirúrgico del cáncer esófago-gástrico en centros de referencia en territorios como Cataluña y Navarra, lo que se ha acompañado de un descenso en la morbimortalidad postoperatoria4,12, tal como se ha observado en otros países13–15. Sin embargo, esta centralización no se ha acompañado de una armonización de los protocolos terapéuticos, de modo que solo algunos hospitales cuentan con PAT destinados a optimizar el uso de TCHA16–19.
El objetivo del presente estudio fue analizar la tasa transfusional en los pacientes operados de cáncer gástrico, así como evaluar la implementación y el efecto de los PAT en nuestro entorno.
MétodosPacientesAnálisis retrospectivo de una cohorte integrada por todos los pacientes operados con intención radical de adenocarcinoma de estómago en los 19 centros autorizados para dicha intervención en Cataluña y Navarra entre enero de 2011 y diciembre de 2013. Dichos centros integraban el grupo español EUropean REgister for Cancer CAre (EURECCA) de cáncer esófago-gástrico12. Se seleccionaron los pacientes de los que se dispusiera de información sobre la concentración de Hb en el momento del diagnóstico, antes y después de la intervención, así como datos sobre el tratamiento preoperatorio con hierro iv y TCHA. Dichos datos no figuran en el registro EURECCA original y se solicitaron específicamente en los pacientes operados en el periodo de estudio, con aprobación de los Comités Éticos de cada uno de los hospitales que participan en este proyecto.
Variable principalLa variable principal del estudio fue la tasa transfusional, definida como el porcentaje de pacientes que recibió alguna TCHA respecto al total de pacientes operados. La tasa transfusional se dividió según si la administración fue efectuada en periodo preoperatorio (TCHA administrada desde el diagnóstico hasta el día de la intervención quirúrgica), intraoperatorio (durante el acto quirúrgico o en el postoperatorio inmediato durante la estancia del paciente en el área de reanimación) o postoperatorio (entre el primer día postoperatorio y el alta hospitalaria). Se calculó la media transfusional, definida como la media de concentrados de hematíes administrados en los pacientes transfundidos. El índice transfusional se definió como el cociente entre el total de bolsas de concentrados de hematíes transfundidas en cada periodo y el total de pacientes intervenidos.
Recogida de datosPara cada paciente se recogieron los datos siguientes: edad; sexo; riesgo anestésico mediante la clasificación del estado físico de la American Society of Anesthesiologists (ASA); localización tumoral; Hb en el momento del diagnóstico, antes y después de la intervención; tratamiento con quimioterapia neoadyuvante; administración de hierro iv en el preoperatorio, tipo de hierro y tiempo transcurrido entre su administración y la intervención quirúrgica; técnica quirúrgica (tipo de gastrectomía, acceso laparoscópico, resección visceral asociada y extensión de la linfadenectomía); estadio patológico (clasificación TNM de la Unión Internacional contra el Cáncer [UICC] 7.a edición); complicaciones médicas (pulmonares, cardíacas) y quirúrgicas (dehiscencia de anastomosis, fuga de muñón duodenal, reintervención quirúrgica); duración de la estancia hospitalaria y mortalidad intrahospitalaria.
El presente estudio es observacional y en él se incluyen pacientes de centros con prácticas muy variadas tanto en estudio de anemia como en criterios de indicación de hierro, tipo de hierro utilizado y criterios de transfusión sanguínea. En base a las recomendaciones de estrategias de ahorro transfusional, se diferenciaron los centros que disponían de PAT para los pacientes intervenidos de cáncer gástrico. Para ello se evaluó si cumplían las 3 condiciones siguientes: 1) evaluación sistemática de la Hb entre 2 y 4 semanas antes de la cirugía; 2) disponibilidad en el centro de un protocolo para el tratamiento preoperatorio de la anemia ferropénica con hierro iv; y 3) existencia de unas directrices en el hospital, generalmente coordinadas desde el comité de transfusión hospitalario, que apoyan la práctica de una conducta transfusional restrictiva, con umbrales transfusionales basados en las recomendaciones y guías de las sociedades científicas.
A partir del 2016 (y a raíz de los resultados del presente análisis) el grupo EURECCA cuenta con un protocolo común con unas recomendaciones consensuadas de optimización preoperatoria y práctica transfusional restrictiva.
Análisis estadísticoLos datos se expresan como media±desviación estándar o como frecuencias y porcentajes. Se utilizó la prueba de la t de Student para comparar variables cuantitativas y la prueba de ji al cuadrado para las variables cualitativas. El estudio multivariable de factores predictores de TCHA se realizó mediante una regresión logística multinomial. Para los cálculos se utilizó el programa estadístico IBM SPSS (versión 20). Se aceptó un nivel de significación de p<0,05 para las pruebas de contraste bilateral.
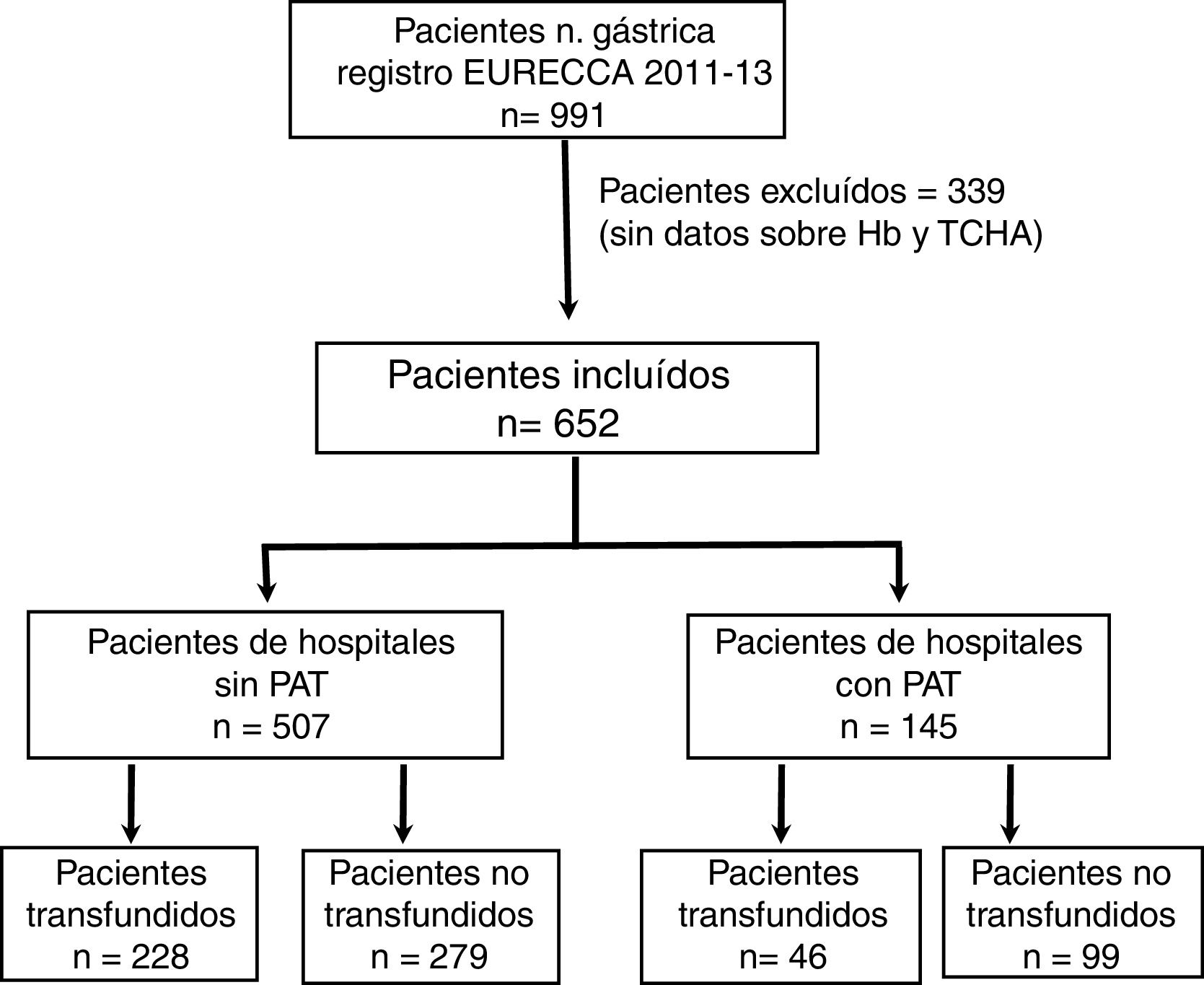
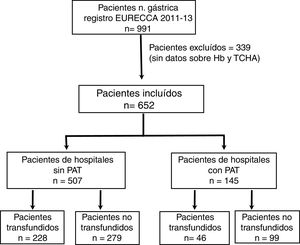
ResultadosCaracterísticas de los pacientesDesde enero de 2011 a diciembre de 2013 se incluyeron en el registro EURECCA un total de 991 pacientes consecutivos afectos de adenocarcinoma gástrico. Todos ellos fueron operados con intención de resección radical. Se excluyeron 339 (34,2%) pacientes por falta de datos de la Hb, tratamiento con hierro iv y/o TCHA, de modo que se incluyeron en el análisis 652 pacientes (fig. 1).
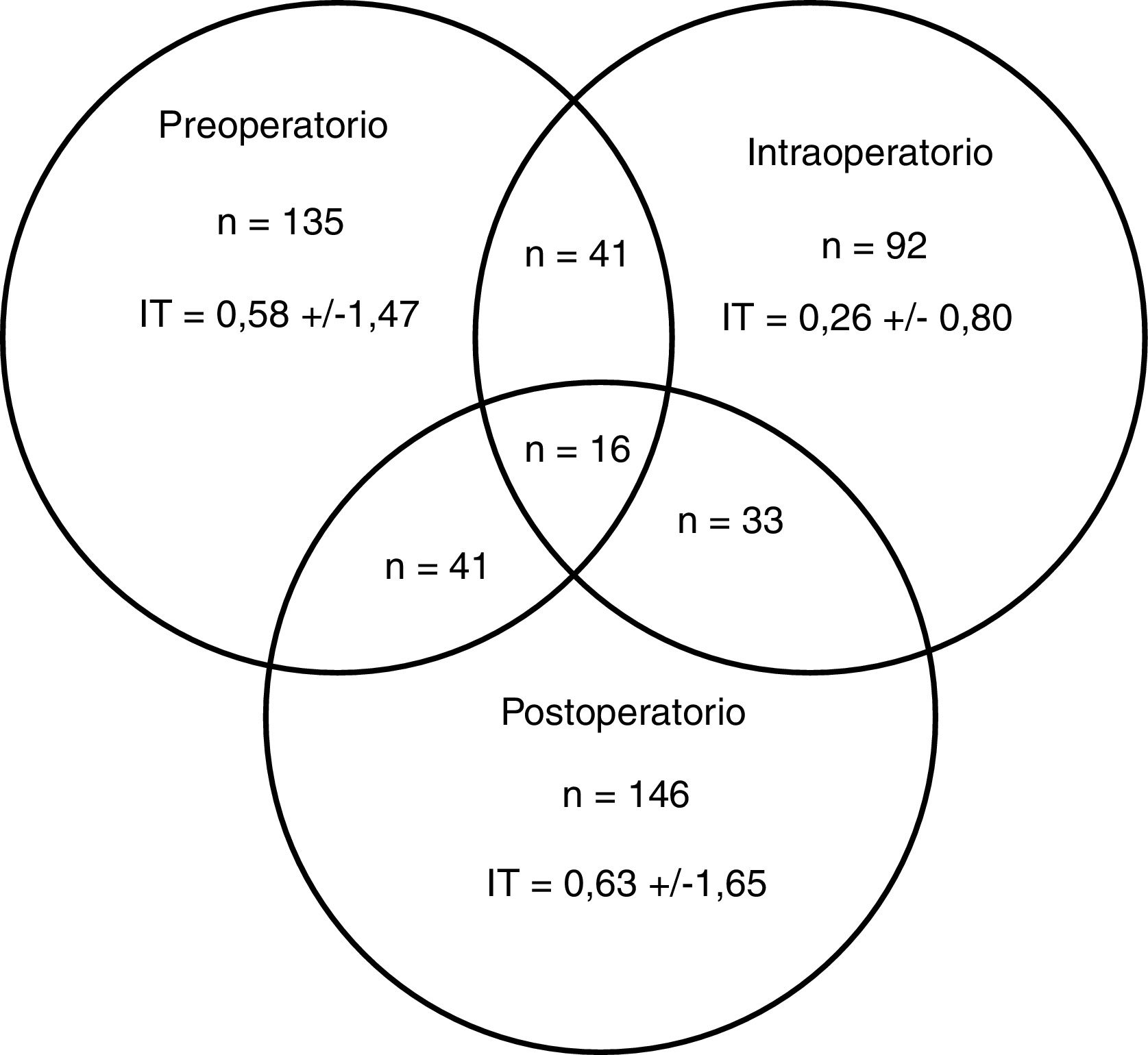
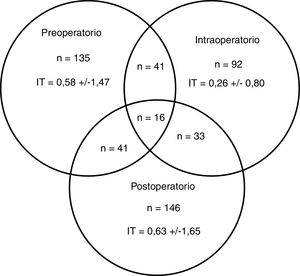
Un total de 274 pacientes (42,0%) recibieron alguna TCHA, 83 (30,3%) de los cuales en más de uno de los periodos preoperatorio, intraoperatorio o postoperatorio (fig. 2). El porcentaje de transfusiones para dichos periodos fue del 20,7; 14,1 y 22,4%, respectivamente. La media transfusional en los periodos preoperatorio, intraoperatorio y postoperatorio fue de 1,4; 0,6 y 1,5, respectivamente, y el índice transfusional fue 0,58±1,47; 0,26±0,80 y 0,63±1,65. En 6 de los 19 centros participantes se disponía de un PAT, habiéndose intervenido a 145 (22,2%) pacientes.
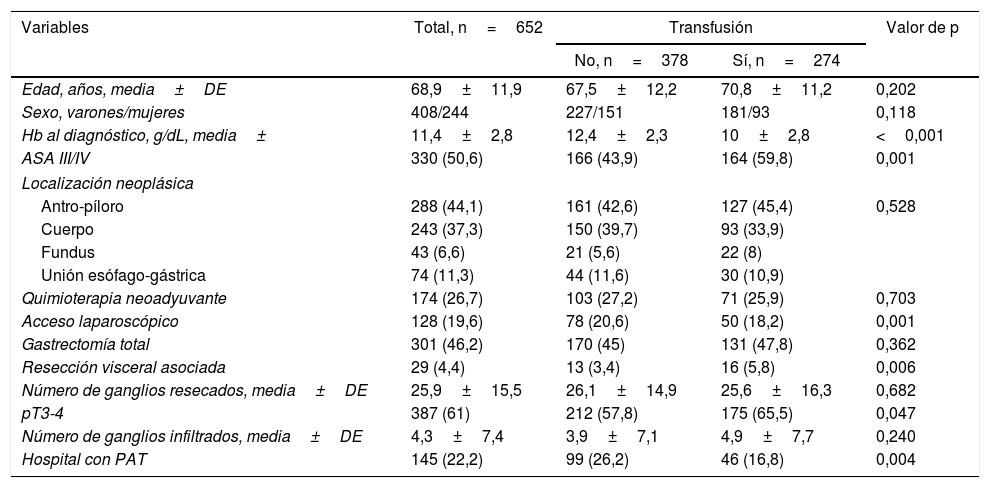
Factores predictores de transfusión de concentrados de hematíes alogénicosEn la tabla 1 se muestran las características de los pacientes transfundidos (n=274) respecto a los no transfundidos (n=378). En los pacientes transfundidos se observó una menor concentración de Hb en el momento del diagnóstico (10 vs. 12,4g/dL), mayor porcentaje de pacientes con puntuaciones ASA III/IV (59,8 vs. 43,9%), menor utilización de la vía laparoscópica (18,2 vs. 20,6%), mayor número de resecciones viscerales asociadas (5,8 vs. 3,4%) y estadios pT3-4 (65,5 vs. 57,8%), así como menor frecuencia de intervención en hospitales con PAT (16,8 vs. 26,2%), siendo estas diferencias estadísticamente significativas. En el análisis multivariante, los factores independientes de TCHA fueron la Hb baja en el momento del diagnóstico (odds ratio [OR] 15,53, intervalo de confianza [IC] del 95% 7,17-33,62), la atención en un centro sin PAT (OR 2,13, IC del 95% 1,37-3,34) y la resección visceral asociada (OR 1,59, IC del 95% 1,08-2,36).
Comparación de las características de los pacientes transfundidos y no transfundidos
| Variables | Total, n=652 | Transfusión | Valor de p | |
|---|---|---|---|---|
| No, n=378 | Sí, n=274 | |||
| Edad, años, media±DE | 68,9±11,9 | 67,5±12,2 | 70,8±11,2 | 0,202 |
| Sexo, varones/mujeres | 408/244 | 227/151 | 181/93 | 0,118 |
| Hb al diagnóstico, g/dL, media± | 11,4±2,8 | 12,4±2,3 | 10±2,8 | <0,001 |
| ASA III/IV | 330 (50,6) | 166 (43,9) | 164 (59,8) | 0,001 |
| Localización neoplásica | ||||
| Antro-píloro | 288 (44,1) | 161 (42,6) | 127 (45,4) | 0,528 |
| Cuerpo | 243 (37,3) | 150 (39,7) | 93 (33,9) | |
| Fundus | 43 (6,6) | 21 (5,6) | 22 (8) | |
| Unión esófago-gástrica | 74 (11,3) | 44 (11,6) | 30 (10,9) | |
| Quimioterapia neoadyuvante | 174 (26,7) | 103 (27,2) | 71 (25,9) | 0,703 |
| Acceso laparoscópico | 128 (19,6) | 78 (20,6) | 50 (18,2) | 0,001 |
| Gastrectomía total | 301 (46,2) | 170 (45) | 131 (47,8) | 0,362 |
| Resección visceral asociada | 29 (4,4) | 13 (3,4) | 16 (5,8) | 0,006 |
| Número de ganglios resecados, media±DE | 25,9±15,5 | 26,1±14,9 | 25,6±16,3 | 0,682 |
| pT3-4 | 387 (61) | 212 (57,8) | 175 (65,5) | 0,047 |
| Número de ganglios infiltrados, media±DE | 4,3±7,4 | 3,9±7,1 | 4,9±7,7 | 0,240 |
| Hospital con PAT | 145 (22,2) | 99 (26,2) | 46 (16,8) | 0,004 |
ASA: American Society of Anesthesiologists; DE: desviación estándar; Hb: hemoglobina; PAT: protocolo de ahorro transfusional.
Datos expresados como frecuencias y porcentajes en paréntesis a menos que se indique lo contrario.
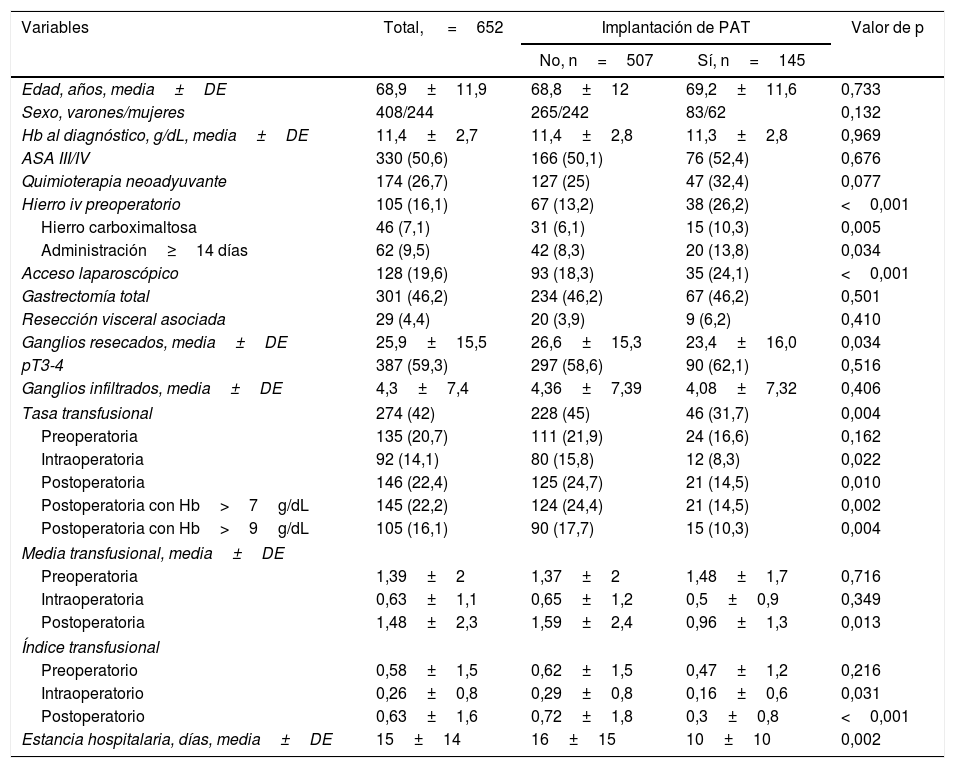
En la tabla 2 se comparan las datos de los pacientes atendidos en centros con PAT (n=145) y sin PAT (n=507). Ambos grupos de pacientes eran comparables en edad, sexo, puntuación ASA III/IV, Hb en el momento del diagnóstico, estadio tumoral (pT y pN), uso de quimioterapia neoadyuvante, tipo de gastrectomía y resección visceral asociada. Sin embargo, en los hospitales con PAT se practicaron menos resecciones por laparoscopia y linfadenectomías menos extensas. Los hospitales con PAT indicaron más hierro iv en el preoperatorio (26,2 vs. 13,2%), especialmente carboximaltosa de hierro y administrado con más frecuencia>14 días antes de la intervención (13,8 vs. 8,3%). Los centros con PAT presentaron una menor tasa transfusional global (31,7 vs. 45%). Al analizar las TCHA por periodos, no se observaron diferencias significativas en el preoperatorio pero sí una menor tasa transfusional intraoperatoria (8,3 vs. 15,8%) y postoperatoria (14,5 vs. 24,7%) en los hospitales con PAT. En concreto se indicaron menos TCHA postoperatorias para pacientes con Hb>7g/dL (14,5 vs. 24,4%) y Hb>9g/dL (10,3 vs. 17,7%). La media transfusional postoperatoria también fue menor en los centros con PAT, así como los índices transfusionales intra- y postoperatorios. Todo ello permitió estimar un ahorro global de 102 concentrados de hematíes en los hospitales con PAT. La media de estancia hospitalaria fue inferior en los centros con PAT (10±10 vs. 16±15 días, p=0,002).
Comparación entre pacientes atendidos en hospitales con y sin protocolo de ahorro de sangre
| Variables | Total, =652 | Implantación de PAT | Valor de p | |
|---|---|---|---|---|
| No, n=507 | Sí, n=145 | |||
| Edad, años, media±DE | 68,9±11,9 | 68,8±12 | 69,2±11,6 | 0,733 |
| Sexo, varones/mujeres | 408/244 | 265/242 | 83/62 | 0,132 |
| Hb al diagnóstico, g/dL, media±DE | 11,4±2,7 | 11,4±2,8 | 11,3±2,8 | 0,969 |
| ASA III/IV | 330 (50,6) | 166 (50,1) | 76 (52,4) | 0,676 |
| Quimioterapia neoadyuvante | 174 (26,7) | 127 (25) | 47 (32,4) | 0,077 |
| Hierro iv preoperatorio | 105 (16,1) | 67 (13,2) | 38 (26,2) | <0,001 |
| Hierro carboximaltosa | 46 (7,1) | 31 (6,1) | 15 (10,3) | 0,005 |
| Administración≥14 días | 62 (9,5) | 42 (8,3) | 20 (13,8) | 0,034 |
| Acceso laparoscópico | 128 (19,6) | 93 (18,3) | 35 (24,1) | <0,001 |
| Gastrectomía total | 301 (46,2) | 234 (46,2) | 67 (46,2) | 0,501 |
| Resección visceral asociada | 29 (4,4) | 20 (3,9) | 9 (6,2) | 0,410 |
| Ganglios resecados, media±DE | 25,9±15,5 | 26,6±15,3 | 23,4±16,0 | 0,034 |
| pT3-4 | 387 (59,3) | 297 (58,6) | 90 (62,1) | 0,516 |
| Ganglios infiltrados, media±DE | 4,3±7,4 | 4,36±7,39 | 4,08±7,32 | 0,406 |
| Tasa transfusional | 274 (42) | 228 (45) | 46 (31,7) | 0,004 |
| Preoperatoria | 135 (20,7) | 111 (21,9) | 24 (16,6) | 0,162 |
| Intraoperatoria | 92 (14,1) | 80 (15,8) | 12 (8,3) | 0,022 |
| Postoperatoria | 146 (22,4) | 125 (24,7) | 21 (14,5) | 0,010 |
| Postoperatoria con Hb>7g/dL | 145 (22,2) | 124 (24,4) | 21 (14,5) | 0,002 |
| Postoperatoria con Hb>9g/dL | 105 (16,1) | 90 (17,7) | 15 (10,3) | 0,004 |
| Media transfusional, media±DE | ||||
| Preoperatoria | 1,39±2 | 1,37±2 | 1,48±1,7 | 0,716 |
| Intraoperatoria | 0,63±1,1 | 0,65±1,2 | 0,5±0,9 | 0,349 |
| Postoperatoria | 1,48±2,3 | 1,59±2,4 | 0,96±1,3 | 0,013 |
| Índice transfusional | ||||
| Preoperatorio | 0,58±1,5 | 0,62±1,5 | 0,47±1,2 | 0,216 |
| Intraoperatorio | 0,26±0,8 | 0,29±0,8 | 0,16±0,6 | 0,031 |
| Postoperatorio | 0,63±1,6 | 0,72±1,8 | 0,3±0,8 | <0,001 |
| Estancia hospitalaria, días, media±DE | 15±14 | 16±15 | 10±10 | 0,002 |
ASA: American Society of Anesthesiologists; DE: desviación estándar; Hb: hemoglobina; PAT: protocolo de ahorro transfusional.
Tasa transfusional: pacientes transfundidos/total pacientes operados; Media transfusional: número total de concentrados de hematíes transfundidos/total pacientes transfundidos; Índice transfusional: número total de concentrados de hematíes transfundidos/total pacientes operados.
Datos expresados como frecuencias y porcentajes en paréntesis a menos que se indique lo contrario.
En los pacientes tratados con hierro iv y no transfundidos (n=64) se observó un incremento significativo de la Hb entre el diagnóstico y la intervención quirúrgica (9,8±1,8 hasta 10,8±1,6g/dL; p<0,001). Dicho aumento no se constató en los pacientes no tratados con hierro iv ni transfundidos preoperatoriamente (n=453), en los que la Hb varió de 12,4±2 a 11,9±3g/dL (p=0,532).
DiscusiónEl presente estudio de base poblacional demuestra que la tasa transfusional de los pacientes operados por adenocarcinoma gástrico en nuestro medio es del 42%. Aunque se trata de una tasa elevada, es comparable a la de varios estudios incluidos en un metaanálisis reciente6 y similar a la observada en el mismo territorio cuando no se había completado la centralización de la cirugía del cáncer esófago-gástrico4. Varios estudios demuestran que la concentración de la cirugía del cáncer, incrementando el volumen y la especialización en los centros autorizados, incide favorablemente en los resultados14,20. En concreto, los datos del registro EURECCA de gastrectomías oncológicas realizadas entre 2011 y 2013 en los 19 centros autorizados de Cataluña muestran un descenso significativo de las complicaciones y la mortalidad postoperatoria respecto a datos previos disponibles del mismo territorio, con la actividad dispersa en 69 hospitales4,12. Sin embargo, a pesar de la mejora de estos indicadores de calidad asistencial, no se ha reducido la tasa transfusional, probablemente porque la centralización no se ha acompañado de una racionalización y armonización de los protocolos. En esa línea, Simunovic et al.21 demostraron, comparando el proceso de centralización de la cirugía del cáncer de páncreas en 2 regiones de Canadá, que el aumento del volumen hospitalario no era suficiente para mejorar los parámetros de calidad asistencial si no se acompañaba de intervenciones de actualización de los procesos. Precisamente, el registro EURECCA, iniciado en 2011 para el cáncer esófago-gástrico, tiene como objetivo comparar datos y resultados de diferentes territorios europeos a fin de lograr una mayor estandarización de los protocolos terapéuticos12,15,22.
La TCHA puede comprometer la inmunidad de los pacientes operados, lo que podría influir negativamente en su morbilidad postoperatoria23,24. Además, la inmunosupresión derivada de la TCHA se ha relacionado con un mayor riesgo de recidiva tumoral a largo plazo en los pacientes operados por cáncer de forma independiente del estadio tumoral6,8,9,25,26. Asimismo, considerando la condición de recurso limitado de la sangre humana, resulta aconsejable que las instituciones sanitarias promuevan los PAT basados en la optimización preoperatoria de la Hb e indicación restrictiva de TCHA16–19. El presente estudio demuestra que solo el 22% de los pacientes fueron atendidos en hospitales con PAT, en los que la optimización con hierro iv y la indicación transfusional están protocolizadas y supervisadas. En estos centros se indicaron menos TCHA, a pesar de que sus pacientes eran comparables al resto en el valor de Hb en el momento del diagnóstico, ASA, estadio oncológico, localización tumoral y tipo de gastrectomía. Más aún, en los centros con PAT se practicaron menos cirugías mínimamente invasivas, abordaje que tanto en la literatura como en el presente estudio se asocia con menor necesidad transfusional27,28. A pesar de la baja implementación territorial de los PAT, el ahorro estimado global en los hospitales que lo tenían fue de 102 concentrados de hematíes. Con el objetivo de extender los resultados de estos pocos centros, los hospitales integrantes del grupo EURECCA hemos consensuado un PAT común en cáncer esófago-gástrico cuya implementación está siendo valorada prospectivamente desde marzo de 2017.
El primer pilar de los PAT es la optimización preoperatoria de la anemia mediante estimulación de la eritropoyesis, donde el hierro iv tiene un papel relevante. La anemia preoperatoria afectó al 55,2% de los pacientes del presente estudio, porcentaje similar al descrito en otros registros2,7,29. El tratamiento con hierro iv, en especial en su forma carboximaltosa, ha demostrado mejorar la Hb, disminuyendo el índice transfusional y la estancia hospitalaria tras cirugía electiva por cáncer colorrectal30,31. Dicho beneficio solo ha sido demostrado para el cáncer gástrico en el periodo postoperatorio32. Los datos del presente estudio muestran que el hierro iv permitió mejorar la Hb de los pacientes quirúrgicos. A pesar de este beneficio, la ferroterapia iv preoperatoria fue indicada solo en un 16,1% de los casos, lo que supone un amplio margen de mejora. Incluso en los centros con PAT el hierro iv se administró tan solo al 26,2% de los pacientes, hecho explicable en parte por la presión asistencial y la urgencia de la intervención de las neoplasias. No obstante, un margen de 2 semanas ha demostrado ser suficiente, y el mínimo aconsejable, para mejorar la Hb con una dosis promedio de 1000mg de hierro iv31. Otras posibles causas de la pobre implementación de la ferroterapia preoperatoria pueden ser su coste económico y las condiciones requeridas para su administración33. Sin embargo, la TCHA, a pesar de proceder de donaciones altruistas, presenta también un coste elevado asociado a sus procesos de recolección de la sangre, análisis, preparación, conservación y administración. Múltiples estudios han demostrado que la optimización con hierro iv es una medida coste-efectiva, especialmente en su forma carboximaltosa34,35.
Además de favorecer la optimización preoperatoria, los PAT apoyan una conducta transfusional restrictiva, intentando minimizar las TCHA en pacientes estables y no sangrantes, con umbrales establecidos según las recomendaciones de guías de práctica clínica: TCHA en pacientes con Hb<7g/dL sin factores de riesgo cardiovascular; en pacientes con factores de riesgo, TCHA con Hb>7g/dL y <9g/dL; en los casos con Hb≥9g/dL no estaría indicada la transfusión en ausencia de hemorragia activa17. En este aspecto, nuestro registro demuestra que los pacientes con Hb>7g/dL y Hb>9g/dL atendidos en centros con PAT presentaron menor riesgo de ser transfundidos, a pesar de que en ambos grupos de hospitales los pacientes presentaban una edad y riesgo anestésico similar.
La principal limitación de este estudio es su naturaleza retrospectiva y descriptiva, lo que, impide establecer la relación causal inequívoca entre TCHA y los factores de riesgo. Además, el registro EURECCA no recogía en esa época mediciones objetivas de la comorbilidad de los pacientes a excepción de la puntuación ASA, lo que limita la comprensión de los criterios de indicación de TCHA. El principal interés del estudio radica en que se basa en un registro poblacional, lo que permite disponer de información fiable sobre la conducta transfusional en nuestro entorno.
En conclusión, un 42% de los pacientes fueron transfundidos en el perioperatorio de gastrectomía oncológica, tasa que no ha disminuido en los últimos 15 años a pesar de la centralización de la patología. El tratamiento con hierro iv preoperatorio permitió mejorar la Hb, pero solamente fue administrado en el 16% de los pacientes. En los hospitales con PAT se registró una mayor utilización de ferroterapia iv preoperatoria y una menor tasa transfusional intraoperatoria y postoperatoria. Los factores predictores de TCHA fueron la Hb baja en el momento del diagnóstico, la intervención en un centro sin PAT y la resección visceral asociada.
FinanciaciónFinanciado en parte con una beca de la Societat Catalana de Cirurgia del año 2016 para estudios multicéntricos. El laboratorio Vifor Pharma España, S. L. colaboró económicamente en la creación de la base de datos multicéntrica EURECCA España y en su apoyo logístico.
Contribución de los autoresJavier Osorio: diseño del estudio, adquisición y recogida de datos, análisis e interpretación de los resultados, redacción del artículo.
Carlos Jericó: adquisición y recogida de datos, redacción del artículo.
Elisenda Garsot: adquisición y recogida de datos, revisión crítica y aprobación de la versión final.
Alexis Luna: adquisición y recogida de datos, revisión crítica y aprobación de la versión final.
Mónica Miró: adquisición y recogida de datos, revisión crítica y aprobación de la versión final.
Maite Santamaría: adquisición y recogida de datos, revisión crítica y aprobación de la versión final.
Eva Artigau: adquisición y recogida de datos, revisión crítica y aprobación de la versión final.
Joaquín Rodríguez-Santiago: adquisición y recogida de datos, revisión crítica y aprobación de la versión final.
Sandra Castro: adquisición y recogida de datos, revisión crítica y aprobación de la versión final.
Josep Feliu: adquisición y recogida de datos, revisión crítica y aprobación de la versión final.
Aurora Aldeano: adquisición y recogida de datos, revisión crítica y aprobación de la versión final.
Carles Olona: adquisición y recogida de datos, revisión crítica y aprobación de la versión final.
Dulce Momblan: adquisición y recogida de datos, revisión crítica y aprobación de la versión final.
David Ruiz: adquisición y recogida de datos, revisión crítica y aprobación de la versión final.
Gonzalo Galofré: adquisición y recogida de datos, revisión crítica y aprobación de la versión final.
Inmaculada Pros: adquisición y recogida de datos, revisión crítica y aprobación de la versión final.
Xabier García-Albéniz: diseño del estudio, análisis e interpretación de los resultados, revisión crítica y aprobación de la versión final.
Miguel Lozano: adquisición y recogida de datos, revisión crítica y aprobación de la versión final.
Manuel Pera: diseño del estudio, adquisición y recogida de datos, análisis e interpretación de los resultados, revisión crítica y aprobación de la versión final.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen al Prof. Lluís Grande sus valiosos comentarios y sugerencias, a la Dra. Marta Pulido su labor editorial en la revisión del manuscrito y a Marta Gimeno como data manager en la gestión y mantenimiento del registro EURECCA de España.