La diabetes tipo 2 (DT2) puede inducir la expresión de moléculas de adhesión celular (ICAM, VCAM) y citocinas (IL-6 y PCR). Posiblemente asociado con dichos mecanismos, el gen transcription factor 7-like 2 (TCF7L2) ha sido asociado con DT2 en diferentes poblaciones, aunque existen pocos datos en población mediterránea. Nuestro objetivo es estudiar la asociación de dicho gen con la DT2 y marcadores de inflamación en población de alto riesgo cardiovascular.
MétodosSe incluyeron 1.001 participantes de alto riesgo cardiovascular del estudio PREDIMED-Valencia. Se determinó la glucemia en ayunas y las concentraciones de lípidos plasmáticos. En una submuestra aleatoria se determinaron las concentraciones de IL-6, PCR, VCAM e ICAM. Se analizó el polimorfismo rs7903146 (C>T) en el gen TCF7L2.
ResultadosLa prevalencia de DT2 fue de 47,4%. La frecuencia de genotipos fue: 38,1% CC, 47,7% CT y 14,3% TT, siendo la frecuencia alélica del alelo T 0,381. Se hallaron diferencias significativas de concentraciones plasmáticas de glucosa según el genotipo (CC: 117,3±37,8; CT: 124,1±41,1; TT: 128,7±45,2mg/dl; p=0,011). Los portadores del alelo T presentan un mayor riesgo de DT2 (OR=1,37; 95%IC: 1,05-1,80; p=0,022) con respecto a individuos CC. El alelo T también se asoció como mayores concentraciones de VCAM (CC: 914,3±355,4; CT: 1.147,0±422,6; TT: 1.258,1±447,3 ng/ml; p=0,001). No se encontraron diferencias estadísticamente significativas para los demás marcadores de inflamación.
ConclusiónEl alelo T del polimorfismo rs7903146 en el gen TCF7L2 se asocia con un mayor riesgo de DT2 en población mediterránea española, siendo consistente con los resultados obtenidos en otras poblaciones europeas.
Type 2 diabetes (T2D) can induce the expression of cell adhesion molecules (ICAM, VCAM) and cytokines (IL-6 and CRP). Possibly related to these mechanisms, the transcription factor 7-like 2 (TCF7L2) gene has been associated with T2D in distinct populations, but there are few data for the Mediterranean population. Our objective was to study the association of this gene with T2D and inflammation markers in a population at high cardiovascular risk.
MethodsWe included 1,001 high cardiovascular risk participants in the PREDIMED-Valencia study. Fasting blood glucose and plasma lipid concentrations were determined. Plasma concentrations of IL-6, CRP, VCAM and ICAM were also determined in a random subsample. The rs7903146 (C>T) polymorphism in the TCF7L2 gene was analyzed.
ResultsThe prevalence of T2D was 47.4%. The frequency of genotypes was 38.1% for CC, 47.7% for CT and 14.3% for TT (the allelic frequency of the T allele was 0.381). We found statistically significant differences in fasting plasma glucose concentrations depending on the TCF7L2 genotype (CC: 117.3±37.8; CT: 124.1±41.1; TT: 128.7±45.2mg/dl; p=0.011). T allele carriers had an increased risk of T2D (OR=1.37; 95% CI: 1.05-1.80; p=0.022) compared with CC individuals. The T allele was also associated with higher concentrations of VCAM (CC: 914.3±355.4; CT: 1147.0±422.6; TT: 1258.1±447.3 ng/ml; p=0.001). No statistically significant differences were found for the other markers of inflammation.
ConclusionConsistent with the results obtained in other European populations, this study found that the T allele of the rs7903146 polymorphism in the TCF7L2 gene is associated with an increased risk of T2D in a Mediterranean Spanish population.
La diabetes mellitus tipo 2 (DT2) es una enfermedad con gran impacto en la salud pública1. En España su prevalencia, ajustada por edad, se ha estimado cercana al 10%, oscilando entre el 6,1 y el 13,3%. Se ha descrito también un gradiente norte-sur, y una mayor prevalencia en hombres (12%) que en mujeres (8%)2. La prevalencia de DT2 aumenta de manera paralela al incremento de la edad poblacional y a la obesidad e inactividad física3. Por otro lado, las enfermedades cardiovasculares (ECV) son la principal causa de morbimortalidad en los individuos diabéticos; de hecho, presentan un riesgo de ECV de dos a cuatro veces superior al de los individuos que no sufren DT2, y este aumento es mayor en mujeres que en varones4.
En el desarrollo de la DT2 subyacen dos mecanismos. Por un lado se produce un estado de resistencia a la insulina y, por otro, un defecto en la secreción de insulina de las células beta pancreáticas5, lo que conduce a un estado de hiperinsulinemia e hiperglucemia. Por otra parte, la DT2 suele acompañarse de factores de riesgo cardiovascular como dislipidemia, cuyos principales componentes son aumento de triglicéridos (TG), concentración baja de colesterol ligado a lipoproteínas de alta densidad (c-HDL) y predominio de lipoproteínas de baja densidad (LDL) pequeñas y densas, obesidad, hipertensión (HTA) y un estado protrombótico6. Se ha constatado que diferentes mecanismos inmunológicos e inflamatorios subyacen al proceso de DT2 y de aterosclerosis7,8.
Además de los múltiples factores ambientales involucrados en la etiología de la DT2, recientemente se ha descubierto un gen con gran relevancia en la misma. Este gen, denominado transcription factor 7-like 2 (TCF7L2), se encuentra localizado en el cromosoma 10. Codifica para TCF4, un factor de transcripción que contiene la caja HMG (High Mobility Group) y que está implicado en la ruta de señalización mediada por Wnt. TCF4 se une a β-catenina, y este complejo induce la expresión de genes diana implicados en el desarrollo pancreático9 y en la homeostasis de la glucosa tales como genes que expresan incretinas en células enteroendocrinas que potencian la secreción de insulina en células β pancreáticas10,11. Además, dicho complejo también está involucrado en la expresión de genes implicados en el proceso de inflamación12.
Variaciones en el gen TCF7L2 han sido consistentemente asociadas con DT2 en diferentes poblaciones de origen caucásico, asiático y africano13–16. De todos ellos, el polimorfismo rs7903146 es el que más fuertemente se asocia13. Dicho polimorfismo se encuentra en el intrón 3 del gen TCF7L2. Su efecto sobre la función y regulación de TCF7L2 que conduce a mayor susceptibilidad de DT2 no está claramente definido. Se ha observado que este polimorfismo se asocia con el efecto sobre la capacidad de secreción de insulina por parte de las células beta y no tanto con la resistencia a la insulina14,17. Sin embargo, existe escasa evidencia del efecto de dicho polimorfismo sobre otros factores de riesgo cardiovascular, como niveles plasmáticos de lípidos y marcadores de inflamación en población española.
Nuestro objetivo es estudiar la frecuencia del polimorfismo rs7903146 en el gen de TCF7L2 en población española de alto riesgo cardiovascular, valorando el impacto de dicho polimorfismo en el riesgo de DT2, así como su influencia en las concentraciones de glucosa, lípidos plasmáticos y marcadores de inflamación.
Pacientes y métodosPacientesSe incluyeron 1.001 individuos de elevado riesgo cardiovascular, participantes en el estudio PREDIMED (PREvención con DIeta MEDiterránea)18 reclutados en el nodo de Valencia. Los criterios de inclusión fueron hombres (entre 55 y 80 años) y mujeres (entre 60 y 80 años), sin ECV previa (historia documentada de ECV, como enfermedad coronaria [angina, infarto de miocardio, técnicas de angioplastia coronaria o existencia de Q anormales en el electrocardiograma (ECG)], accidente vascular cerebral [tanto isquémico como hemorrágico, incluidos los accidentes vasculares transitorios], y arteriopatía periférica sintomática diagnosticada mediante técnicas de imagen) y que presenten además DT2 o reúnan tres o más factores de riesgo cardiovascular, como tabaquismo, HTA, c-LDL>160mg/dl, c-HDL <40mg/dl, sobrepeso u obesidad o historia familiar de cardiopatía isquémica precoz. Los criterios de exclusión incluían: ECV previa, enfermedad médica grave que impida al paciente participar en un estudio de intervención nutricional, abuso de tóxicos o alcoholismo crónico, dificultad o no voluntad para cambiar los hábitos dietéticos, participación en ensayos clínicos farmacológicos o toma de cualquier fármaco en investigación en el último año, imposibilidad de acudir a las reuniones trimestrales, dirección postal no fija, analfabetismo y presencia de infección o inflamación aguda en los últimos tres meses.
En este trabajo se presentan los resultados transversales obtenidos en los 1.001 primeros participantes reclutados en Valencia. Este tamaño de muestra responde a criterios operativos del diseño del estudio PREDIMED18, ya que se trata de un estudio multicéntrico en el que participan nodos reclutadores de distintas provincias y se prefijó inicialmente que cada nodo reclutador tenía que aportar unos 1.000 participantes. De todos ellos se obtuvo el consentimiento informado para participar en el estudio. El estudio fue aprobado por el Comité de Ética de la Universidad de Valencia, cumpliendo la Declaración de Helsinki de 1975, con la revisión de octubre de 2000.
Datos antropométricos, clínicos y bioquímicosLas variables de clínicas y de estilo de vida se obtienen a través de cuestionarios estandarizados que se suministran a los participantes en centros de atención primaria. Las variables antropométricas se obtienen con la medida directa de peso, talla y perímetro de la cintura mediante protocolos estandarizados18. El peso y la talla se miden en ropa ligera y sin zapatos sobre una báscula digital con tallímetro incorporado (SECA modelo 220). El índice de masa corporal (IMC) se calcula como el peso en kilogramos dividido por la talla en metros cuadrados. La medida de la cintura se realiza con una cinta métrica, y se mide en espiración el punto medio entre el reborde costal y la cresta ilíaca. Se determina la presión arterial por duplicado con un tensiómetro electrónico (modelo OMRON M6). De acuerdo con los criterios de la OMS, se define como obesa a toda persona con un IMC superior o igual a 30kg/m2. En el centro de atención primaria también se obtienen las muestras biológicas para la obtención de variables bioquímicas y de ADN. La extracción de sangre venosa periférica se realiza tras ayuno mínimo de 12h. Las muestras son rápidamente procesadas siguiendo un protocolo estándar de fraccionamiento en alícuotas y conservadas a –80°C, y posteriormente se realizan las determinaciones de interés. Se obtuvieron niveles plasmáticos de glucosa, lípidos (colesterol total, c-HDL, c-LDL y TG) en los 1.001 participantes y marcadores de inflamación (proteína C reactiva [PCR], interleucina 6 [IL-6], molécula de adhesión intercelular [ICAM] y molécula de adhesión celular vascular [VCAM]) en 120 participantes de los 1.001 incluidos. Este tamaño de muestra se fijó también inicialmente en el estudio PREDIMED con criterios operativos para reducir el coste de las determinaciones, estableciéndose realizar inicialmente las determinaciones bioquímicas más costosas en aproximadamente un 10% de los participantes de cada nodo. Los métodos para la determinación de los niveles plasmáticos de glucosa, lípidos y marcadores de inflamación se han descrito previamente18.
Análisis genéticoEl ADN fue extraído a partir de buffy-coat de manera automatizada con kits de aislamiento de ADN para MagNaPure (ROCHE Diagnostics). El genotipado del polimorfismo rs7903146 fue llevado a cabo mediante discriminación alélica con sondas TaqMan (TaqMan SNP Genotying Assays, Applies Biosystems, Foster City, California, EE.UU.) y la fluorescencia se midió con el sistema de detección ABI 7900 (Applied Biosystems).
Análisis estadísticoSe comprobó la normalidad de las variables continuas y se realizó una transformación logarítmica de los TG plasmáticos, PCR, IL-6, VCAM e ICAM. Se empleó el test de χ2 para la comparación de porcentajes, el test T de Student para la comparación de medias de dos grupos independientes y el test ANOVA para la comparación de medias de más de dos grupos. Se emplearon modelos multivariantes (ANCOVA) para ajustar el efecto de las estimaciones por otras variables de confusión. Se utilizó el análisis de regresión logística simple y múltiple (tras ajuste por variables de confusión) para estimar la odds ratio (OR) y su intervalo de confianza (IC) al 95% de la asociación entre el polimorfismo y DT2 agrupando portadores del alelo mutado frente a la categoría de referencia (homocigotos CC). El valor de P se calculó siempre con 2 colas y se consideró estadísticamente significativo un valor de p<0,05. Para ajustar por variables de confusión se utilizó el análisis de regresión multivariante. Los análisis estadísticos se realizaron con el programa SPSS V.15 para Windows.
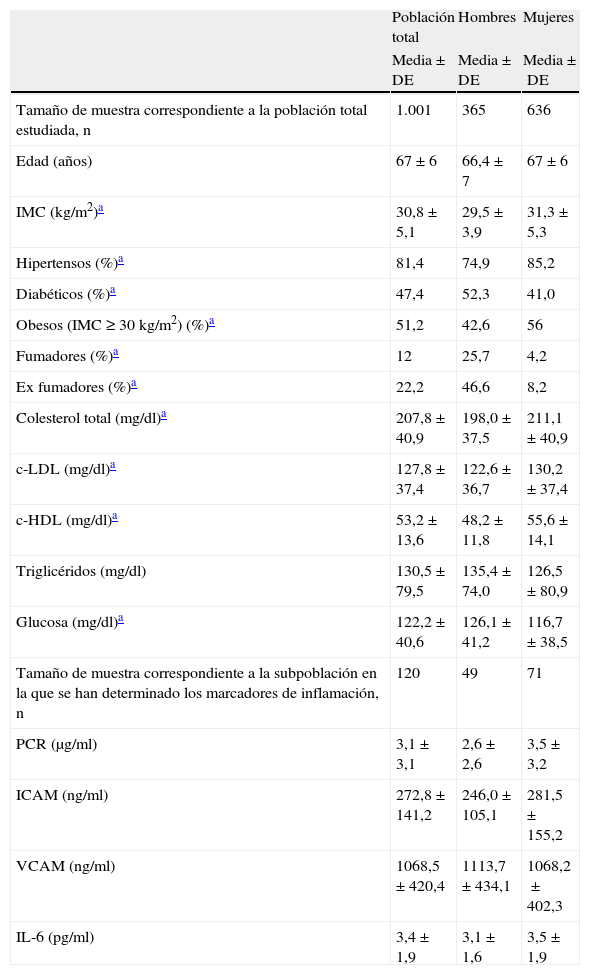
ResultadosLas características antropométricas, clínicas y bioquímicas de los participantes y comparando por sexo se muestran en la tabla 1.
Características antropométricas, bioquímicas, clínicas y de estilo de vida de la población estudiada según sexo
| Población total | Hombres | Mujeres | |
| Media±DE | Media±DE | Media±DE | |
| Tamaño de muestra correspondiente a la población total estudiada, n | 1.001 | 365 | 636 |
| Edad (años) | 67±6 | 66,4±7 | 67±6 |
| IMC (kg/m2)a | 30,8±5,1 | 29,5±3,9 | 31,3±5,3 |
| Hipertensos (%)a | 81,4 | 74,9 | 85,2 |
| Diabéticos (%)a | 47,4 | 52,3 | 41,0 |
| Obesos (IMC ≥30 kg/m2) (%)a | 51,2 | 42,6 | 56 |
| Fumadores (%)a | 12 | 25,7 | 4,2 |
| Ex fumadores (%)a | 22,2 | 46,6 | 8,2 |
| Colesterol total (mg/dl)a | 207,8±40,9 | 198,0±37,5 | 211,1±40,9 |
| c-LDL (mg/dl)a | 127,8±37,4 | 122,6±36,7 | 130,2±37,4 |
| c-HDL (mg/dl)a | 53,2±13,6 | 48,2±11,8 | 55,6±14,1 |
| Triglicéridos (mg/dl) | 130,5±79,5 | 135,4±74,0 | 126,5±80,9 |
| Glucosa (mg/dl)a | 122,2±40,6 | 126,1±41,2 | 116,7±38,5 |
| Tamaño de muestra correspondiente a la subpoblación en la que se han determinado los marcadores de inflamación, n | 120 | 49 | 71 |
| PCR (μg/ml) | 3,1±3,1 | 2,6±2,6 | 3,5±3,2 |
| ICAM (ng/ml) | 272,8±141,2 | 246,0±105,1 | 281,5±155,2 |
| VCAM (ng/ml) | 1068,5±420,4 | 1113,7±434,1 | 1068,2±402,3 |
| IL-6 (pg/ml) | 3,4±1,9 | 3,1±1,6 | 3,5±1,9 |
DE: desviación estándar; IMC: índice de masa corporal; c-HDL: colesterol ligado a lipoproteínas de alta densidad; c-LDL: colesterol ligado a lipoproteínas de baja densidad; PCR: proteína C reactiva; ICAM: molécula de adhesión intercelular; VCAM: molécula de adhesión celular vascular; IL-6: interleucina-6.
La media de edad en hombres y en mujeres es 66±7 y 67±6 años, respectivamente. Puesto que se trata de una población con elevado riesgo cardiovascular la prevalencia de HTA, DT2, obesidad e hipercolesterolemia es alta (81,4, 47,4, 51,2 y 74,2%, respectivamente). El 12,5% de los individuos incluidos en el estudio son fumadores y el 22,2% ex fumadores. Los hombres presentan un porcentaje marcadamente más elevado de fumadores y de ex fumadores que las mujeres, hallándose diferencias estadísticamente significativas.
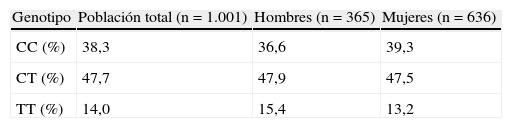
Las frecuencias genotípicas del polimorfismo rs7903146 de gen TCF7L2 no se desvían del equilibrio de Hardy-Weinberg, y además no existen diferencias entre sexo en cuanto a la distribución del genotipo (tabla 2). La frecuencia del alelo T para la población total es de 0,381.
Frecuencias genotípicas del polimorfismo rs7903146 en el gen TCF7L2 en la población estudiada de manera global y por sexo
| Genotipo | Población total (n=1.001) | Hombres (n=365) | Mujeres (n=636) |
| CC (%) | 38,3 | 36,6 | 39,3 |
| CT (%) | 47,7 | 47,9 | 47,5 |
| TT (%) | 14,0 | 15,4 | 13,2 |
ap<0,05, encontrándose diferencias estadísticamente significativas entre hombres y mujeres. Se empleó la prueba χ2 para comparar porcentajes.
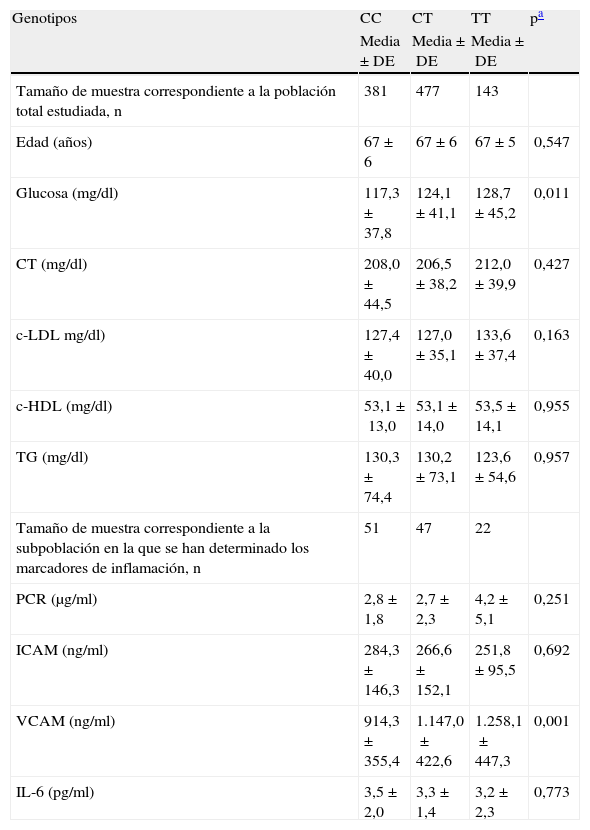
En la tabla 3 se muestran los resultados del análisis de asociación entre el polimorfismo rs7903146 y las concentraciones plasmáticas de glucosa, colesterol total, c-LDL, c-HDL, TG y marcadores de inflamación (PCR, ICAM, VCAM e IL-6). Se observa una clara asociación entre dicho polimorfismo y la concentración de glucosa, siendo ésta mayor a medida que aumenta el número de alelos T. Tras ajustar por edad, sexo e IMC, esta asociación continúa existiendo (p=0,027). No se observa asociación con la concentración de lípidos plasmáticos. Sin embargo, se obtuvieron diferencias significativas en la concentración plasmática de VCAM según el genotipo, de modo que los individuos con genotipo TT presentaron mayores niveles de VCAM que los individuos CT y CC, mostrándose de nuevo un efecto alélico. Dichas diferencias también se mantuvieron tras ajustar por edad, sexo e IMC (p=0,002). Los individuos TT presentaron mayores concentraciones de PCR, pero sin alcanzar la significación estadística. No se obtuvieron diferencias para IL-6 e ICAM.
Niveles plasmáticos de glucosa, lípidos y marcadores de inflamación para cada genotipo del polimorfismo rs7903146 del gen TCF7L2
| Genotipos | CC | CT | TT | pa |
| Media±DE | Media±DE | Media±DE | ||
| Tamaño de muestra correspondiente a la población total estudiada, n | 381 | 477 | 143 | |
| Edad (años) | 67±6 | 67±6 | 67±5 | 0,547 |
| Glucosa (mg/dl) | 117,3±37,8 | 124,1±41,1 | 128,7±45,2 | 0,011 |
| CT (mg/dl) | 208,0±44,5 | 206,5±38,2 | 212,0±39,9 | 0,427 |
| c-LDL mg/dl) | 127,4±40,0 | 127,0±35,1 | 133,6±37,4 | 0,163 |
| c-HDL (mg/dl) | 53,1±13,0 | 53,1±14,0 | 53,5±14,1 | 0,955 |
| TG (mg/dl) | 130,3±74,4 | 130,2±73,1 | 123,6±54,6 | 0,957 |
| Tamaño de muestra correspondiente a la subpoblación en la que se han determinado los marcadores de inflamación, n | 51 | 47 | 22 | |
| PCR (μg/ml) | 2,8±1,8 | 2,7±2,3 | 4,2±5,1 | 0,251 |
| ICAM (ng/ml) | 284,3±146,3 | 266,6±152,1 | 251,8±95,5 | 0,692 |
| VCAM (ng/ml) | 914,3±355,4 | 1.147,0±422,6 | 1.258,1±447,3 | 0,001 |
| IL-6 (pg/ml) | 3,5±2,0 | 3,3±1,4 | 3,2±2,3 | 0,773 |
DE: desviación estándar; CT: colesterol total; c-HDL: colesterol ligado a lipoproteínas de alta densidad; c-LDL: colesterol ligado a lipoproteínas de baja densidad; TG: triglicéridos; PCR: proteína C reactiva; ICAM: molécula de adhesión intercelular; VCAM: molécula de adhesión celular vascular; IL-6: interleucina-6.
Al estudiar la asociación de este polimorfismo con el riesgo de DT2 se observa una mayor prevalencia de portadores del alelo T en los diabéticos en comparación con los no diabéticos (66,2% vs 58,4%). La frecuencia del alelo T en diabéticos fue de 0,410 y la de no diabéticos, de 0,354. La OR de DT2 para los portadores del alelo T se ha estimado en OR=1,37 (95% IC: 1,05-1,80; p=0,022) tras ajustar por edad y sexo. Tras ajustar por IMC, prácticamente no varía la estimación de la OR para el alelo T: OR=1,35 (95% IC: 1,03-1,77); p=0,030.
Por último, hemos calculado también la OR de alteración de la glucosa en ayunas (sujetos >100mg/dl de glucemia), obteniendo los siguientes resultados: OR=1,56 (95% IC: 1,18-2,06); p=0,002 (ajustando por edad y sexo); OR=1,71 (95% IC: 1,29-2,25); p<0,001 (ajustando por IMC), y OR=1,66 (95% IC: 1,25-2,20); p<0,001 (ajustando por sexo, edad e IMC).
DiscusiónEn el presente estudio se ha encontrado una importante asociación del polimorfismo rs7903146 en el gen de TCF7L2 con una mayor prevalencia de DT2 en los portadores del alelo T en población española mediterránea de alto riesgo cardiovascular. La frecuencia de esta variante en la población estudiada, así como, en individuos diabéticos y no diabéticos, es similar a la obtenida en otros estudios llevados a cabo en población general19,20 y en población mayor de 65 años21 del sur de Europa y africanos13,14. Sin embargo, es elevada si se compara con poblaciones del norte de Europa17,22 y, sobre todo, con poblaciones del este de Asia que presentan las frecuencias del alelo T más bajas15.
La asociación entre el polimorfismo rs7903146 con mayor prevalencia de DT2 ya ha sido previamente observada en múltiples estudios. Entre los primeros estudios destaca el llevado a cabo por Grant et al23. Descubrieron un microsatélite (DG10S478) en el intrón 3 del gen TCF7L2 que se asociaba con DT2 en una muestra de casos y controles en Islandia. Este grupo replicó sus resultados en dos poblaciones caucásicas más obteniendo un riesgo global de 1,54. El polimorfismo rs7903146 se encontró en fuerte desequilibrio de ligamiento con DG10S478 y mostró una asociación con DT2 similar. Tras este hallazgo, numerosos estudios se han sucedido en diferentes poblaciones. Diversos metaanálisis han mostrado gran consistencia en los resultados obtenidos en diferentes grupos étnicos que engloban caucásicos, africanos y asiáticos13,16,24. El riesgo estimado en este estudio es menor que el obtenido por Grant et al23 y en poblaciones francesas19,20, y similar al obtenido en otras poblaciones europeas17,25 (1,40 y 1,37, respectivamente). También es menor al riesgo global estimado en los metanálisis de Cauchi et al13, Florez24 y Tong et al16 (1,46, 1,44 y 1,42, respectivamente). En población española existen escasos estudios sobre el polimorfismo rs7903146 y riesgo de DT2. González-Sánchez et al26 hallaron asociación en una población general de la zona central de España y estimaron una OR de 1,29, menor a la obtenida en este estudio pero similar a la obtenida en poblaciones italianas21.
El polimorfismo rs7903146 también se asoció con concentraciones plasmáticas de glucosa. Se ha mostrado evidencia de un efecto aditivo del alelo T, ya que a medida que aumenta el número de alelos T la concentración de glucosa es mayor. Este efecto se ha mostrado en numerosos estudios20,21,27,28.
Con respecto al estudio de asociación del polimorfismo rs7903146 con riesgo cardiovascular, no se encontraron diferencias estadísticamente significativas en la concentración de lípidos plasmáticos según el genotipo. De este modo, no se han encontrado evidencias que relacionen la variante estudiada con la dislipidemia que suele acompañar a la DT2 coincidiendo con el estudio realizado por Cauchi et al19 en población francesa. Sin embargo, existe controversia en los resultados obtenidos en otros estudios. Huertas-Vázquez et al29 investigaron si el polimorfismo rs7903146 contribuía a la susceptibilidad genética de dislipidemia en familias con hiperlipidemia combinada. Encontraron asociación del alelo T con mayor concentración plasmática de TG. Sousa et al30 observó que los portadores del alelo T no diabéticos presentaban mayor riesgo de enfermedad isquémica arterial y los diabéticos, menores concentraciones de c-LDL. Sin embargo, Bielinski et al31 no encontraron asociación entre el polimorfismo rs7903146 y ECV. Por otro lado, otros estudios han encontrado asociación del alelo T con un perfil lípidico de menor riesgo. Así pues, Melzer et al21 observaron que individuos TT presentaban menores concentraciones de TG y mayores de c-HDL en población italiana mayor de 65 años, y Bo et al28 mostraron la misma asociación con TG en población italiana con síndrome metabólico. Por lo tanto, posteriores estudios serán relevantes para mostrar si existe relación entre el polimorfismo rs7903146 y concentraciones de lípidos plasmáticos y riesgo cardiovascular, y en qué sentido.
Por otro lado, entre los marcadores de inflamación estudiados únicamente se observaron diferencias estadísticamente significativas según el genotipo en la concentración de VCAM, mostrando los individuos TT mayores niveles, lo que sugiere una mayor especificidad que hace que puedan detectarse los efectos con un reducido tamaño de muestra. Existen escasos estudios dedicados a investigar la asociación entre variaciones en el gen de TCF7L2 y marcadores de inflamación. Recientemente se ha publicado un estudio32 en el que no se encontró asociación entre los marcadores de inflamación (PCR, IL-2, IL-6, TNF-α y MCP-1) y variantes en el gen TCF7L2 tales como rs12255372 y rs7903146. In vivo, varias investigaciones han estudiado la relación entre TCF7L2 e inflamación. Se ha observado que adipocitocinas como IL-6 y TNF-α activan la ruta de Wnt de modo que aumenta la actividad transcripcional de TCF7L2 dando lugar a la reducción de la adipogénesis, proceso relacionado con DT2, y a un cambio hacia un fenotipo más proinflamatorio de las células del tejido adiposo33,34. Además, se ha mostrado que TCF7L2 también está involucrado en la expresión de genes implicados en el proceso de inflamación como ciclooxigenasa-2 (COX-2)12. Por otro lado, se ha observado que en el estado de hiperglucemia aumenta la expresión de moléculas de adhesión en las células endoteliales35. Sin embargo, la secuencia de eventos que relacionan la actividad de TCF7L2 con inflamación y DT2 no está definida in vivo, así como el efecto de variaciones en el gen de TCF7L2 en dichos procesos.
Entre los polimorfismos que se han asociado de manera reproducible con DT2, la variante rs7903146 es la que mayor efecto produce sobre el riesgo de DT213,25. Así pues, actualmente se considera prioritario investigar el mecanismo de acción del alelo de riesgo T sobre el metabolismo de la glucosa. De este modo, se ha observado, de forma consistente en diversos estudios, que el alelo T se asocia con defecto en la secreción de insulina en las células β pancreáticas y no con resistencia a la insulina11,14,17,27,36. Esta evidencia se ve reforzada con el hecho de que el alelo T confiere mayor riesgo de DT2 independientemente de factores de riesgo como IMC, edad, sexo, historia familiar de DT213,37, fármacos14 y cambios en el estilo de vida14,28,38. Sin embargo, se ha observado que estos cambios mitigan el efecto del alelo T sobre la DT214,28,38, y dietas ricas en cereales integrales39 y dietas programadas para la reducción de peso disminuyen la expresión de TCF7L2 en tejido adiposo40. En conclusión, en nuestro estudio llevado a cabo en población española de alto riesgo cardiovascular hemos encontrado una importante asociación entre el alelo T del rs7903146 en el gen TCF7L2 con un mayor riesgo de DT2 que es consistente con la observada en otras poblaciones. Sin embargo, ya que se trata de un estudio transversal, el impacto clínico y la relevancia en cuanto a marcador predictivo es muy baja, por lo que deben realizarse posteriores estudios longitudinales en los que se evalúe su utilidad clínica.
FinanciaciónEste trabajo ha sido parcialmente financiado por las ayudas G03/140, PI042234, PI061326, PI070954, CB06/03/1006 del Instituto de Salud Carlos III, Ministerio de Ciencia e Innovación y por las ayudas ACOMP09/318 y ACOMP/2010/181 de Conselleria de Educación de la Generalitat Valenciana.
Contribución de autoríaP. Carrasco y D. Corella han contribuido a la redacción del artículo. Todos los autores han aprobado la versión final del artículo y han contribuido a la revisión crítica de su contenido. Todos ellos han participado en distintas fases relacionadas con la idea, diseño, o recogida de datos y análisis e interpretación de los mismos.
Conflicto de interesesNinguno de los autores tiene conflictos de intereses.
Una comunicación referente a esta línea de trabajo, titulada «Consistente asociación del polimorfismo rs7903146 en el gen TCF7L2 con mayor riesgo de diabetes en población mediterránea española», fue presentada en el XXII Congreso Nacional de la SEA (Pamplona, 2009) y galardonada con una Mención Especial.