La combinación de fármacos es habitual en el tratamiento de las dislipidemias, siendo las estatinas y la ezetimiba la asociación más utilizada. Al actuar a distinto nivel, con esta combinación se facilita la consecución de los objetivos terapéuticos. Sin embargo, poco se sabe sobre cómo estos fármacos –en monoterapia o asociados– podrían afectar cualitativamente la composición de las subfracciones lipoproteicas, las cuales difieren en tamaño y potencial aterogénico, así como su efecto antiinflamatorio.
MétodosSe incluyeron 39 pacientes con hiperlipidemia, los cuales fueron aleatoriamente distribuidos en 2 grupos: a uno se le administró simvastatina (40mg/día) y al otro ezetimiba (10mg/día) durante 4 semanas, transcurridas las cuales se les adminsitró de forma conjunta ambos fármacos durante 4 semanas más. Se valoró el perfil lipídico, subfracciones lipoproteicas de LDL y HDL, así como parámetros inflamatorios.
ResultadosEl tratamiento farmacológico en monoterapia (simvastatina vs ezetimiba) redujo el cLDL (−40,2 vs. −19,6%) y el colesterol no-HDL (−37,1 vs. −18,8%) y la simvastatina en monoterapia indujo un descenso de triglicéridos (−18,6%) y un aumento de cHDL (+7,4%). La coadministración produjo una reducción de hasta el 57% sobre el cLDL. La terapia con simvastatina disminuyó las subfracciones de HDL más pequeñas y aumentó las más grandes. Además, aumentó significativamente el diámetro, reduciendo el porcentaje de sdLDL y provocó un descenso significativo del TNFα.
ConclusionesLa combinación de simvastatina y ezetimiba mostró un efecto sumatorio hipocolesterolemiante. Asimismo, la simvastatina redujo las subfracciones lipoproteicas más aterogénicas y más a largo plazo mostró efectos antiinflamatorios.
Coadministration of drugs is common in the pharmacologic treatment of dyslipidemia, with statins and ezetimibe generally constituting the medication of choice. By acting at different levels, the combination of these drugs allows the therapeutic objective to be achieved. However, it is not known how these drugs qualitatively affect the composition of lipoprotein subfractions, which differ in size and atherogenic potential. We set out to evaluate this effect as well as their anti-inflammatory effects.
MethodsThirty-nine hyperlipidemic patients were randomly assigned to one of 2 groups: one received simvastatin (40mg/day) and the other received ezetimibe (10mg/day) for 4 weeks, after which both groups were administered combined therapy for an additional 4-week period. Lipid profile, lipoprotein subfractions of LDL and HDL, and inflammatory parameters were evaluated.
ResultsAn improvement was detected in most lipid parameters after administration of hypolipemic drugs as monotherapy. Treatment with simvastatin vs ezetimibe reduced LDLc by 40.2% vs 19.6% and non-HDLc by 37.1% vs 18.8%, respectively. Coadministration of the two pharmacological agents induced a reduction of LDLc of up to 57%. Only simvastatin induced alterations in the levels of triglycerides (−18.6%) and HDLc (+7.4%). Simvastatin also reduced the smaller HDL subfractions and increased the larger ones. In addition, it lowered the percentage of sdLDL and increased the diameter of the LDL particles, and produced a significant reduction in TNFα.
ConclusionsThe coadministration of simvastatin and ezetimibe has an additive cholesterol-lowering effect. Furthermore, only simvastatin reduces atherogenic lipoprotein subfractions and exerts anti-inflammatory effects over longer periods of time.
La aterosclerosis es la principal causa de enfermedad cardiovascular (ECV) lo que resulta en un problema de salud pública de primer orden. El proceso aterosclerótico se origina como resultado de diversos procesos complejos que incluyen cúmulo de lipoproteínas, procesos inflamatorios y disfunción endotelial.
El descenso de las cifras de colesterol ligado a lipoproteínas de baja densidad (cLDL) constituye la principal estrategia para la prevención primaria y secundaria del riesgo cardiovascular en todas las guías de actuación1. Sin embargo, las partículas LDL son heterogéneas en términos de tamaño, densidad y propiedades físicas, lo que les confiere diferente potencial aterogénico. Típicamente, los individuos con partículas de LDL grandes se clasifican como patrón A, mientras que individuos predominantemente con LDL pequeñas y densas (sdLDL) se clasifican como patrón B y tienen mayor riesgo de desarrollar ECV2 incluso en presencia de una concentración de cLDL relativamente normal3. De hecho, el patrón B de las LDL ha sido aceptado como un factor de riesgo cardiovascular emergente por el National Cholesterol Education Programme Adult Treatment Panel III4.
Las estatinas son utilizadas ampliamente para el tratamiento de las dislipidemias, en especial la hipercolesterolemia. Su mecanismo de acción está mediado a través de la inhibición competitiva de la 3-hidroxi-3 metil glutamil coenzima A reductasa (HMGCoA reductasa), la enzima que regula la velocidad de síntesis de colesterol, por lo tanto, disminuyen la síntesis y el contenido intracelular de colesterol que estimula la expresión y la traducción del gen que codifica para el receptor de LDL. Esto también reduce la formación de lipoproteínas que contienen apolipoproteína B (Apo B) y su entrada a la circulación,y además pueden reducir las concentraciones séricas de triglicéridos y lipoproteínas remanentes. Como resultado final, se produce una disminución significativa del cLDL (17 a 54%), un aumento discreto del colesterol ligado a lipoproteínas de alta densidad (cHDL) (5 a 10%) y, en el caso de algunas estatinas como la simvastatina, un descenso de los triglicéridos de hasta un 20%.
La combinación de estatinas, particularmente con ezetimiba, constituye una terapia muy efectiva en el tratamiento de la hiperlipidemia, reduciendo hasta un 60% los niveles de cLDL5. Este efecto se debe a que la ezetimiba es un fármaco hipolipidemiante que inhibe la absorción de colesterol –tanto dietético como biliar– a nivel intestinal inhibiendo el transportador Niemann-Pick C1-like 1 (NPC1L1) y, por lo tanto, al actuar a distinto nivel que las estatinas la combinación tiene efectos aditivos sobre la reducción del cLDL.
Sin embargo, pocos estudios han analizado el efecto de estos fármacos o su combinación sobre las subfracciones de cLDL y cHDL. En general, las estatinas inducen reducciones similares en todas las subclases de LDL, pero esto varía entre las diferentes estatinas y dosis, y puede depender del perfil lipídico basal6. Además, asociadas al consumo de estatinas se han constatado otras acciones no lipídicas o pleiotrópicas entre las que se encuentran una potente acción antiinflamatoria, efectos antitrombóticos y reducción del estrés oxidativo7.Como consecuencia de todas estas acciones, las estatinas combaten directa o indirectamente la disfunción endotelial, y modifican la estructura y la composición de las placas de ateroma, que se vuelven más estables a la erosión y a la ruptura. Por otra parte, escasos estudios han evaluado hasta ahora los efectos de la ezetimiba en el tamaño de las partículas de LDL y/o en la distribución de subfracciones, con resultados contradictorios8. Mientras algunos autores han encontrado que la ezetimiba se asocia con una reducción de sdLDL y/o un aumento del tamaño9–12, otros no han visto cambios13–15. Por lo tanto, el objetivo de este trabajo fue evaluar la composición cualitativa o subfracciones de las lipoproteínas –LDL y HDL– así como las propiedades antiinflamatorias asociadas al consumo de estatinas y/o ezetimiba solas o en combinación en una población hipercolesterolémica.
Pacientes y métodosSujetosEn el estudio se incluyeron pacientes con hiperlipidemia, procedentes de Consultas Externas del Servicio de Endocrinología y Nutrición del Hospital Universitario Doctor Peset de Valencia. Los criterios de inclusión del estudio fueron los siguientes: niveles de cLDL≥160mg/dl con menos de 2 factores de riesgo cardiovascular; cLDL≥130mg/dl con 2 o más factores de riesgo cardiovascular; o pacientes con cLDL≥100mg/dl en prevención secundaria. Se consideraron factores de riesgo cardiovascular: a) edad: hombres≥45 años y mujeres≥55 años; b) tabaquismo; c) hipertensión arterial (≥140/90mmHg) o medicación antihipertensiva; d) cHDL≤40mg/dl; y e) antecedentes familiares de enfermedad cardiovascular precoz (≤65 años en mujeres y ≤55 años en hombres). Estos criterios se marcaron siguiendo las instrucciones de tratamiento del Third Report of the Nacional Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III).
Los criterios de exclusión fueron: pacientes diabéticos, pacientes con enfermedades hepáticas, tiroideas o renales no tratadas y sujetos con triglicéridos >400mg/dl.
Tras una evaluación inicial, los pacientes se distribuyeron aleatoriamente en 2 grupos: un grupo (grupo A) fue tratado con simvastatina (40mg, una vez al día) durante 4 semanas; y el otro grupo (grupo B) fue tratado con ezetimiba (10mg/día) durante 4 semanas. Al cabo de estas 4 semanas, al grupo con ezetimiba se le añadirá simvastatina 40mg/día y al grupo con simvastatina se le añadirá 10mg de ezetimiba al día durante 4 semanas más. En todos los casos, se evaluaron parámetros antropométricos y analíticos antes de iniciar el tratamiento (día 0), a las 4 semanas y a las 8 semanas.
Este estudio se realizó siguiendo las recomendaciones de la Declaración de Helsinki y tras ser aprobado por el Comité de Ética del Hospital. Antes de comenzar el estudio, se obtuvo por escrito el consentimiento informado de todos los pacientes.
Parámetros analíticosLas muestras de sangre de los pacientes se recogieron tras 12h de ayuno antes de iniciar el tratamiento (día 0), a las 4 semanas y a las 8 semanas; se centrifugaron a 2.000g durante 15min a 4°C y en el suero resultante se determinó el perfil lipídico y los parámetros del metabolismo hidrocarbonado, congelando el resto de las alícuotas a -80°C hasta la determinación de los niveles circulantes de moléculas inflamatorias y subfracciones lipoproteicas de HDL y LDL.
La glucosa, el colesterol total y los triglicéridos se midieron utilizando métodos enzimáticos, y el cHDL por método directo en un autoanalizador Beckman LX-20 (Beckman Coulter, La Brea, CA, EE. UU.). El coeficiente de variación interna fue <3,5% en todas las determinaciones. El cLDL se calculó usando la fórmula de Friedewald para valores de triglicéridos inferiores a 300mg/dl. El índice aterogénico del plasma (IAP) se calculó mediante el logaritmo del cociente de los triglicérido y el cHDL.
Las apolipoproteínas (Apo) A-I, B, y la proteína C reactiva ultrasensible (PCRus) se determinaron por inmunonefelometría (Dade Behring BNII, Marburg, Alemania) (coeficiente de variación interna <5,5%), mientras que la insulina se determinó por el método de inmunoquimioluminiscencia utilizando el analizador Immulite (DPC, Los Angeles, EE. UU.) (coeficiente de variación interna <4,0%). Para excluir la confusión del estado inflamatorio agudo, en el análisis de la PCRus se excluyeron los valores por encima de 10mg/l. La insulín-resistencia se calculó mediante el modelo homeostático (HOMA-IR). Los niveles de homocisteína se midieron mediante quimioluminiscencia (Abbott IMX, Abbott laboratorios, Abbott park, IL, EE. UU., coeficiente de variación interna fue < 4%) y la lipoproteína (a) se determinó por nefelometría en un equipo automatizado (Beckman Array 360 System, Beckman Instruments, Brea, Ca, EE. UU.).
El factor de necrosis tumoral α (TNFα) y la interleucina 6 (IL6) se determinaron mediante la tecnología X-MAP de Luminex (Millipore Corp, Missouri, EE. UU.) (coeficiente de variación interna <10,0% para ambos analitos).
Las subfracciones de HDL y LDL fueron separadas utilizando el sistema Lipoprint® Quantimetrix (Redondo Beach, CA. EE. UU)16. Este método consiste en una electroforesis en gel de poliacrilamida de alta resolución (específico para HDL o LDL) con un gradiente fijo del 3% dispuesto en un tubo de cristal. Brevemente, se mezclaron 25μl de suero en la parte superior del tubo de gel junto a 200μl o 300μl de un gel de carga que contenía negro sudán B para teñir las lipoproteínas. Una vez polimerizada la mezcla durante 30min mediante una lámpara fluorescente, los tubos se colocaron en una cámara electroforética que se sometió a una corriente eléctrica -3mA por tubo de gel durante 60 o 55min. El tampón usado estaba compuesto por trisaminometano y ácido bórico, con pH de 8,2-8,6. Una vez realizada la electroforesis y separadas las bandas, se llevó a cabo una densitometría a 610nm, los datos fueron exportados y analizados mediante un método informático desarrollado para el Sistema Lipoprint® Quantimetrix y el programa de imagen NIH version 1.62 (Bethesda, MD, EE. UU.). Como control de calidad se utilizó el Liposure® (Quantimetrix Corporation, Redondo Beach, CA, EE. UU.). El informe generado presenta el perfil de la distribución de lipoproteínas junto a los porcentajes de áreas y colesterol que contiene cada fracción. Este sistema permite cuantificar, por una parte, hasta 10 subfracciones distintas de cHDL, llamadas grandes -desde HDL 1-3-, intermedias –desde HDL 4-7– y pequeñas –desde HDL 8-10–, y por otra, concentraciones relativas de cHDL, cIDL, VLDL y LDL (hasta un máximo de 7 subfracciones distintas, llamadas desde LDL 1-2 las partículas grandes y desde LDL 3-7 las partículas pequeñas). También proporciona el tamaño medio de las partículas LDL.
Análisis estadísticoEl análisis estadístico se realizó con el programa estadístico SPSS versión 15.0. Los resultados se expresan en las tablas como media y desviación estándar, y como error estándar de la media en las figuras y como mediana y cuartiles cuando su distribución no fue normal. Para analizar el efecto de la combinación de los fármacos en un brazo, se realizó una ANOVA de una vía de medidas repetidas seguido de una prueba t-test apareada o, en el caso de datos no normales, mediante una prueba de Friedman seguida de un test signo-rango Wilcoxon. Para comparar a un mismo tiempo el efecto de uno u otro tratamiento, se realizó una t de Student o una U de Mann-Whitney cuando los datos se distribuyeron de forma paramétrica o no paramétrica, respectivamente. Por último, la correlación entre variables se determinó usando el coeficiente de correlación de Pearson. La significación estadística se alcanzó cuando p<0,05 para un intervalo de confianza del 95%.
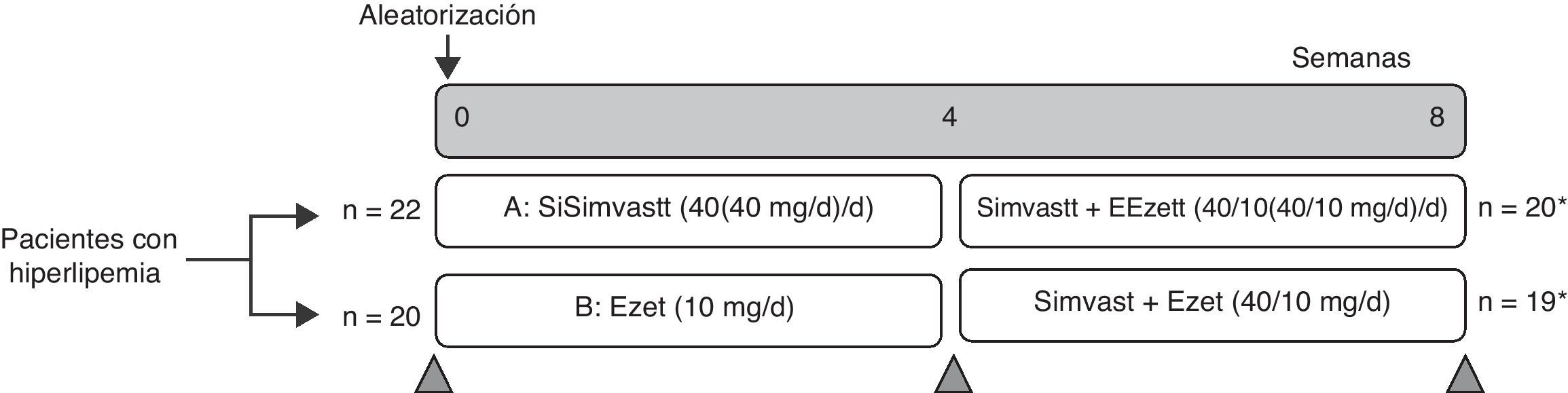
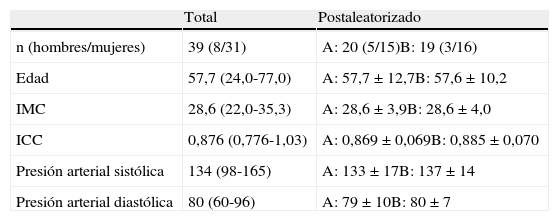
ResultadosEn este estudio de intervención se incluyeron un total de 42 pacientes con hiperlipidemia, los cuales fueron aleatoriamente distribuidos en 2 grupos, un grupo al que se le administró una dosis de simvastatina (40mg/día) durante 4 semanas transcurridas las cuales se le adicionó 10mg/día de ezetimiba durante 4 semanas más (grupo A), y otro grupo que comenzó tomando ezetimiba durante las primeras 4 semanas y a continuación se le adicionó la simvastatina durante otras 4 semanas (grupo B). De los 42 sujetos incluidos en el estudio, 39 pacientes (8 hombres y 31 mujeres) completaron el estudio y 3 abandonaron por intolerancia al medicamento tal y como puede verse en la figura 1. Las características basales de los pacientes fueron similares en ambos grupos, no encontrando diferencias en el porcentaje de hombres/mujeres, índice de masa corporal (IMC), índice cintura/cadera (ICC) o presión arterial (tabla 1).
Diseño del estudio.
*Observaciones: 2 pacientes abandonan el estudio por intolerancia a la ezetimiba en el grupo A y un paciente abandona el estudio por intolerancia a la simvastatina en el grupo B.
Características basales de la población antes y después de la aleatorización
| Total | Postaleatorizado | |
| n (hombres/mujeres) | 39 (8/31) | A: 20 (5/15)B: 19 (3/16) |
| Edad | 57,7 (24,0-77,0) | A: 57,7±12,7B: 57,6±10,2 |
| IMC | 28,6 (22,0-35,3) | A: 28,6±3,9B: 28,6±4,0 |
| ICC | 0,876 (0,776-1,03) | A: 0,869±0,069B: 0,885±0,070 |
| Presión arterial sistólica | 134 (98-165) | A: 133±17B: 137±14 |
| Presión arterial diastólica | 80 (60-96) | A: 79±10B: 80±7 |
Los datos se expresan como media±desviación estándar. Entre paréntesis se indican los valores máximos y mínimos de la distribución de la población. A: en el primer mes recibieron 40mg/día de simvastatina y durante el segundo mes a la simvastatina se le adicionó 10mg/día de ezetimiba. B: en el primer mes recibieron 10mg/día de ezetimiba y durante el segundo mes a la ezetimiba se le adicionó 40mg/día de simvastatina.
ICC: índice cintura/cadera; IMC: índice de masa corporal.
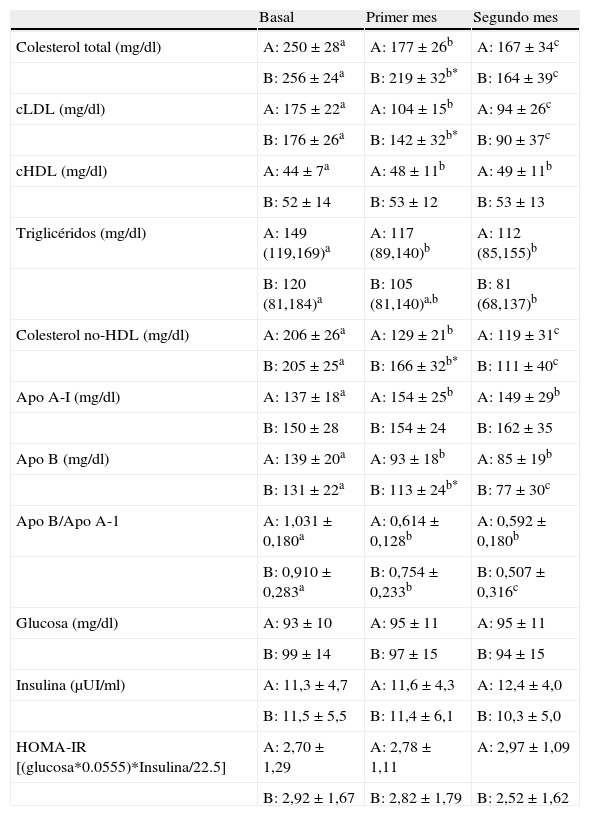
Como se muestra en la tabla 2, tras las primeras 4 semanas de tratamiento tanto con simvatatina (grupo A) como con ezetimiba (grupo B) encontramos un descenso significativo en el colesterol total, cLDL, colesterol no-HDL, Apo B y Apo B/Apo A, siendo este descenso más pronunciado con la simvastatina (colesterol total: 29,2 vs. 14,5% p<0,001; cLDL: 40,2 vs. 19,6% p<0,001; colesterol no-HDL: 37,1 vs. 18,8% p<0,001; Apo B: 33,0 vs. 12,9% p<0,001; Apo B/Apo A: 40,5 vs. 15,1% p<0,001, respectivamente). Además en el grupo A encontramos un aumento de los niveles de cHDL (7,4%) y Apo A-I (14,3%) y un descenso de los triglicéridos (18,6%).
Perfil lipídico y del metabolismo hidrocarbonado en pacientes hiperlipidémicos antes y después de la intervención farmacológica
| Basal | Primer mes | Segundo mes | |
| Colesterol total (mg/dl) | A: 250±28a | A: 177±26b | A: 167±34c |
| B: 256±24a | B: 219±32b* | B: 164±39c | |
| cLDL (mg/dl) | A: 175±22a | A: 104±15b | A: 94±26c |
| B: 176±26a | B: 142±32b* | B: 90±37c | |
| cHDL (mg/dl) | A: 44±7a | A: 48±11b | A: 49±11b |
| B: 52±14 | B: 53±12 | B: 53±13 | |
| Triglicéridos (mg/dl) | A: 149 (119,169)a | A: 117 (89,140)b | A: 112 (85,155)b |
| B: 120 (81,184)a | B: 105 (81,140)a,b | B: 81 (68,137)b | |
| Colesterol no-HDL (mg/dl) | A: 206±26a | A: 129±21b | A: 119±31c |
| B: 205±25a | B: 166±32b* | B: 111±40c | |
| Apo A-I (mg/dl) | A: 137±18a | A: 154±25b | A: 149±29b |
| B: 150±28 | B: 154±24 | B: 162±35 | |
| Apo B (mg/dl) | A: 139±20a | A: 93±18b | A: 85±19b |
| B: 131±22a | B: 113±24b* | B: 77±30c | |
| Apo B/Apo A-1 | A: 1,031±0,180a | A: 0,614±0,128b | A: 0,592±0,180b |
| B: 0,910±0,283a | B: 0,754±0,233b | B: 0,507±0,316c | |
| Glucosa (mg/dl) | A: 93±10 | A: 95±11 | A: 95±11 |
| B: 99±14 | B: 97±15 | B: 94±15 | |
| Insulina (μUI/ml) | A: 11,3±4,7 | A: 11,6±4,3 | A: 12,4±4,0 |
| B: 11,5±5,5 | B: 11,4±6,1 | B: 10,3±5,0 | |
| HOMA-IR [(glucosa*0.0555)*Insulina/22.5] | A: 2,70±1,29 | A: 2,78±1,11 | A: 2,97±1,09 |
| B: 2,92±1,67 | B: 2,82±1,79 | B: 2,52±1,62 |
Los datos se expresan como media±desviación estándar excepto para los triglicéridos que se expresan como mediana (cuartil 25, cuartil 75). Los diferentes superíndices (a,b y c) indican diferencias significativas entre los distintos grupos (a es distinto de b, a es distinto de c y b es distinto de c) medida mediante una ANOVA de vía de medidas repetidas seguida de test de Student-Neumann-Keuls como post hoc o una prueba de Friedman seguida del test de Dunn como post hoc para variables paramétricas o no paramétricas, respectivamente. *p<0,05 cuando comparamos los diferentes tratamientos farmacológicos a un mismo tiempo mediante una t de Student o una U de Mann-Whitney para variables paramétricas o no paramétricas, respectivamente. A: en el primer mes recibieron 40mg/día de simvastatina y durante el segundo mes a la simvastatina se le adicionó 10mg/día de ezetimiba. B: en el primer mes recibieron 10mg/día de ezetimiba y durante el segundo mes a la ezetimiba se le adicionó 40mg/día de simvastatina.
Durante el segundo mes de intervención, al combinar ambos tratamientos en cada uno de los grupos se muestra que la suplementación con ezetimiba en el grupo A fue capaz de reducir los niveles de colesterol total (5,7%), cLDL (10,5%) y colesterol no-HDL (8,9%), sin embargo esta no alteró los niveles de cHDL, triglicéridos y Apo B. Por otra parte, la adición de simvastatina en el grupo B fue capaz de reducir los niveles de colesterol total (25,3%), cLDL (37,2%), colesterol no-HDL (34,1%), Apo B (32,8%), y Apo B/Apo A-I (35,2%) (tabla 2). Al finalizar el periodo de intervención, los 2 tratamientos fueron igualmente eficaces, reduciéndose los niveles de cLDL un 50,7 y un 56,8% en el grupo A y B, respectivamente, y el colesterol no-HDL un 46,0 y un 52,9% en el grupo A y B, respectivamente, respecto a los niveles basales aunque la respuesta en el grupo A se manifestó principalmente durante el primer mes de intervención y se modificó ligeramente durante el segundo mes, y en el grupo B la respuesta hipocolesterolemiante fue alcanzándose paulatinamente.
Respecto a los parámetros del metabolismo hidrocarbonado, no encontramos diferencias en ninguno de los tratamientos evaluados (tabla 2), además los pacientes no modificaron el IMC a lo largo del estudio (datos no mostrados).
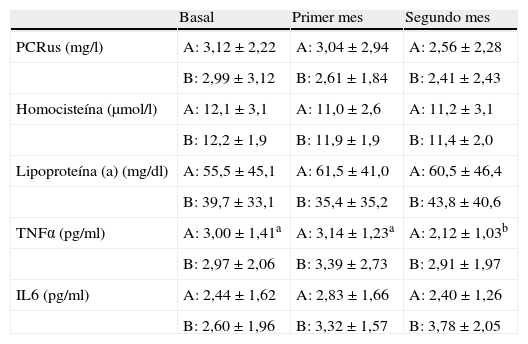
Por otra parte, este descenso en los lípidos durante las 2 fases del estudio indujo un descenso en la PCRus (17,9 vs. 19,4%, en el grupo A y B, respectivamente) aunque estos cambios no fueron significativos. Además observamos un descenso significativo del 29,3% en el TNFα en el grupo A, sin embargo no encontramos cambios en los otros marcadores emergentes de riesgo cardiovascular (homocisteína, lipoproteína A, IL6) (tabla 3).
Marcadores emergentes de riesgo cardiovascular en pacientes hiperlipidémicos antes y después de la intervención farmacológica
| Basal | Primer mes | Segundo mes | |
| PCRus (mg/l) | A: 3,12±2,22 | A: 3,04±2,94 | A: 2,56±2,28 |
| B: 2,99±3,12 | B: 2,61±1,84 | B: 2,41±2,43 | |
| Homocisteína (μmol/l) | A: 12,1±3,1 | A: 11,0±2,6 | A: 11,2±3,1 |
| B: 12,2±1,9 | B: 11,9±1,9 | B: 11,4±2,0 | |
| Lipoproteína (a) (mg/dl) | A: 55,5±45,1 | A: 61,5±41,0 | A: 60,5±46,4 |
| B: 39,7±33,1 | B: 35,4±35,2 | B: 43,8±40,6 | |
| TNFα (pg/ml) | A: 3,00±1,41a | A: 3,14±1,23a | A: 2,12±1,03b |
| B: 2,97±2,06 | B: 3,39±2,73 | B: 2,91±1,97 | |
| IL6 (pg/ml) | A: 2,44±1,62 | A: 2,83±1,66 | A: 2,40±1,26 |
| B: 2,60±1,96 | B: 3,32±1,57 | B: 3,78±2,05 |
Los datos se expresan como media±desviación estándar. Los diferentes superíndices (a y b) indican diferencias significativas entre los distintos grupos (a es distinto de b) medida mediante una ANOVA de vía de medidas repetidas seguida de test de Student-Neumann-Keuls como post hoc. A: en el primer mes recibieron 40mg/día de simvastatina y durante el segundo mes a la simvastatina se le adicionó 10mg/día de ezetimiba. B: en el primer mes recibieron 10mg/día de ezetimiba y durante el segundo mes a la ezetimiba se le adicionó 40mg/día de simvastatina.
IL6: interleucina 6; PCRus: proteína C reactiva ultrasensible; TNFα: factor de necrosis tumoral alfa.
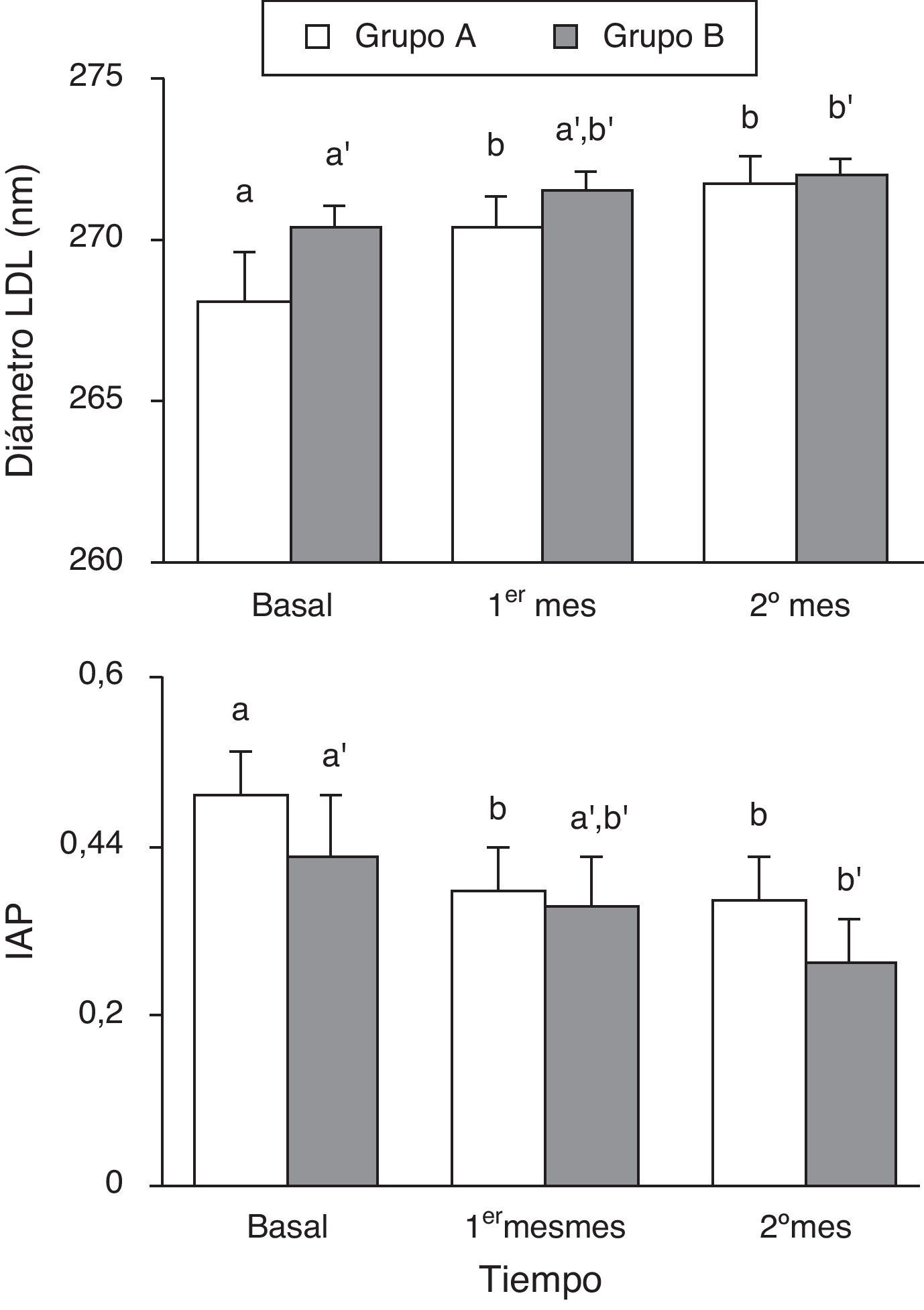
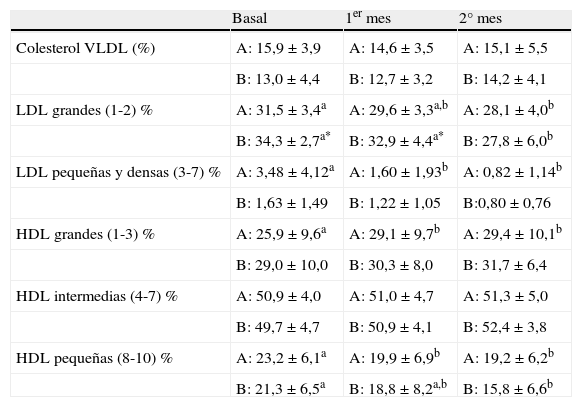
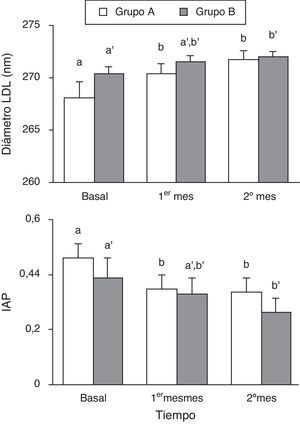
Cuando analizamos las subfracciones lipoproteicas de HDL en cada uno de los grupos, se observa que en el grupo A la administración de simvastatina durante 4 semanas fue capaz de aumentar el porcentaje de HDL grandes y disminuir el porcentaje de HDL más pequeñas, no modificándose este efecto tras la suplementación con ezetimiba. En el grupo B, tras las primeras 4 semanas con ezetimiba no se observan cambios en las subfracciones de HDL, sin embargo cuando se combina esta con la simvastatina se aprecia un descenso significativo en las HDL pequeñas respecto al porcentaje inicial (tabla 4). La simvastatina, en monoterapia o adicionada a la ezetimiba, también fue capaz de reducir el porcentaje de sdLDL y LDL más grandes y aumentar el diámetro de las partículas LDL, así como el IAP, un excelente marcador de las partículas más aterogénicas que se correlacionó de forma negativa con el diámetro (r=0,502; p<0,001), como se muestra en la figura 2.
Subfracciones lipoproteicas en pacientes hiperlipidémicos antes y después de la intervención farmacológica
| Basal | 1er mes | 2° mes | |
| Colesterol VLDL (%) | A: 15,9±3,9 | A: 14,6±3,5 | A: 15,1±5,5 |
| B: 13,0±4,4 | B: 12,7±3,2 | B: 14,2±4,1 | |
| LDL grandes (1-2) % | A: 31,5±3,4a | A: 29,6±3,3a,b | A: 28,1±4,0b |
| B: 34,3±2,7a* | B: 32,9±4,4a* | B: 27,8±6,0b | |
| LDL pequeñas y densas (3-7) % | A: 3,48±4,12a | A: 1,60±1,93b | A: 0,82±1,14b |
| B: 1,63±1,49 | B: 1,22±1,05 | B:0,80±0,76 | |
| HDL grandes (1-3) % | A: 25,9±9,6a | A: 29,1±9,7b | A: 29,4±10,1b |
| B: 29,0±10,0 | B: 30,3±8,0 | B: 31,7±6,4 | |
| HDL intermedias (4-7) % | A: 50,9±4,0 | A: 51,0±4,7 | A: 51,3±5,0 |
| B: 49,7±4,7 | B: 50,9±4,1 | B: 52,4±3,8 | |
| HDL pequeñas (8-10) % | A: 23,2±6,1a | A: 19,9±6,9b | A: 19,2±6,2b |
| B: 21,3±6,5a | B: 18,8±8,2a,b | B: 15,8±6,6b |
Los datos se expresan como media±desviación estándar. Los diferentes superíndices (a y b) indican diferencias significativas entre los distintos grupos (a es distinto de b) medida mediante una ANOVA de vía de medidas repetidas seguida de test de Student-Neumann-Keuls como post hoc. *p < 0,05 cuando comparamos los diferentes tratamientos farmacológicos a un mismo tiempo mediante una t de Student. A: en el primer mes recibieron 40mg/día de simvastatina y durante el segundo mes a la simvastatina se le adicionó 10mg/día de ezetimiba. B: en el primer mes recibieron 10mg/día de ezetimiba y durante el segundo mes a la ezetimiba se le adicionó 40mg/día de simvastatina.
Diámetro de las partículas LDL e índice aterogénico del plasma en pacientes hiperlipidémicos antes y después de la intervención farmacológica.
Los diferentes superíndices indican diferencias significativasentre los distintos grupos medida mediante una ANOVA de vía de medidas repetidas seguida de test de Student-Neumann-Keuls como post hoc siendo a distinto de b y a’ distinto de b’. No se encontraron diferencias significativas (p<0,05) cuando comparamos los diferentes tratamientos farmacológicos a un mismo tiempo mediante una t de Student.
Los datos se expresan como media±error estándar de la media. A: en el primer mes recibieron 40mg/día de simvastatina y durante el segundo mes a la simvastatina se le adicionó 10mg/día de ezetimiba. B: en el primer mes recibieron 10mg/día de ezetimiba y durante el segundo mes a la ezetimiba se le adicionó 40mg/día de simvastatina.
En este estudio de intervención, llevado a cabo en pacientes hiperlipidémicos de mediana edad con sobrepeso, observamos una mejoría del perfil lipídico tras la administración de simvastatina o ezetimiba en monoterapia y una reducción adicional tras la combinación de ambas, alcanzándose finalmente el objetivo terapéutico independientemente del tratamiento. Sin embargo, la simvastatina en monoterapia fue más eficaz que la ezetimiba y adicionalmente fue capaz de modificar cualitativamente la composición de las partículas de LDL y de HDL, estableciendo un perfil menos aterogénico. Además, nuestros resultados apuntan a un efecto antiinflamatorio de la simvastatina aunque este efecto parece manifestarse más a largo plazo.
Las estatinas son utilizadas ampliamente para el tratamiento de las dislipidemias, en especial la hipercolesterolemia. El descenso del cLDL tras la administración de 40mg de simvastatina durante las primeras semanas está bien documentada15,17–19 y coincide con nuestros resultados donde encontramos una reducción del cLDL del 40,2% y del 37,1% en el colesterol no-HDL trascurridas 4 semanas de tratamiento, cuando el efecto hipocolesterolemiante máximo ya se ha manifestado. Además encontramos un aumento del 7,4% en el cHDL y un descenso de 18,6% en los triglicéridos. Por otra parte, la ezetimiba en monoterapia, de acuerdo con otros autores15,18,20 redujo un 19,6% los niveles de cLDL y un 18,8% el colesterol no-HDL e indujo un descenso moderado aunque no significativo en los triglicéridos. Por tanto, la monoterapia con ezetimiba tuvo efectos beneficiosos pero de magnitud más limitada sobre el perfil lipídico en comparación con la simvastatina. El diferente mecanismo de acción de la ezetimiba y de las estatinas ha planteado la posibilidad de que sus efectos sean aditivos, hecho que se ha evaluado en numerosos ensayos15,18–20. Nuestros resultados muestran que la combinación de simvastatina y ezetimiba tiene efectos aditivos sobre el cLDL y colesterol no-HDL. Sin embargo, una vez se han conseguido notables descensos con la simvastina, al adicionar ezetimiba la eficacia de esta se ve disminuida, ya que induce un descenso adicional del cLDL del 10,5% y del colesterol no-HDL del 8,9%, descenso que es ligeramente inferior al de la ezetimiba en monoterapia. Recientemente se ha demostrado que la terapia con estatinas está asociada con un aumento de la absorción intestinal de colesterol21, y por tanto, la adición de ezetimiba, aun a pesar de inhibir la absorción, no ha conseguido igualar los efectos obtenidos en monoterapia.
Si bien el efecto hipocolesterolemiante de la simvastatina y/o la ezetimiba y su combinación ha sido analizado en múltiples ensayos, los efectos de estos mismos tratamientos sobre las diferentes subfracciones lipoproteícas –cLDL y cHDL– son en gran parte desconocidos6,8. De acuerdo con otros estudios, nuestros resultados muestran que la simvastatina en monoterapia provoca un aumento del diámetro de las LDL asociado a un descenso específico de las sdLDL17,22,23, además provoca un aumento de las subfracciones de mayor tamaño de las HDL en detrimento de una reducción de las HDL más pequeñas24–26, lo que en general reduce el potencial aterogénico de las lipoproteínas.
En cuanto a los efectos cualitativos de la ezetimiba en monoterapia, no hemos detectado cambios ni en las subfracciones de LDL ni en las del HDL a pesar de que el diámetro de las LDL experimentó un ligero ascenso aunque no significativo. La bibliografía existente a este respecto es bastante limitada y aunque algunos estudios han encontrado cambios en el tamaño de las partículas de LDL9,10 otros no lo han hecho12,13,15. Sin embargo, cuando se realizó un análisis multivariante el cambio de los triglicéridos fue el único factor determinante independiente de la disminución de las sdLDL9,10. Por lo tanto, es probable que el efecto de la monoterapia con ezetimiba sobre el tamaño de las LDL dependa de los cambios de triglicéridos, tal y como hemos observado. En cuanto a la combinación, en general podemos decir que los efectos de ambos fármacos son independientes en cuanto a las subfracciones se refiere. La adición de la simvastatina a la ezetimiba induce un aumento del tamaño de las LDL y un descenso de las subfracciones de HDL más pequeñas, mientras que la adición de ezetimiba no cambia sustancialmente el perfil excepto porque se produce una reducción de las LDL grandes que parece estar más asociada a la simvastatina en sí que a la adición de ezetimiba, ya que este efecto se reproduce cuando al grupo que está tomando ezetimiba en monoterapia se le añade la simvastitina. De acuerdo con nuestros resultados, Florentin et al.17 mostraron que tanto la simvastatina en monoterapia como la combinación de simvastatina y ezetimiba redujeron las concentraciones de sdLDL y LDL grandes y aumentó el diámetro de las LDL.
Existe evidencia de que el tratamiento con estatinas se asocia a un descenso de la PCRus17,27–29 que puede ser favorable en términos de reducción de riesgo de ECV30 aunque este efecto no se ha observado en otros estudios31,32. En realidad, pocos de estos estudios sugieren que la reducción de la PCRus sea independiente del efecto de la estatina reduciendo el cLDL, y por tanto atribuyendo a las estatinas un efecto pleiotrópico antiinflamatorio27,28. Nosotros hemos encontrado una tendencia al descenso en el grupo que comenzó tomando simvastatina al finalizar el tratamiento que se asoció a cambios significativos en el TNFα. Si el efecto que hemos observado es consecuencia de la adición de ezetimiba o de la prolongación del tratamiento con simvastatina es algo que no podemos concluir aunque, puesto que el tratamiento con ezetimiba durante 8 semanas no ha modificado los niveles de TNFα, nos inclinamos a pensar que es el efecto de la estatina a largo plazo el responsable de los cambios observados. De hecho, estudios previos han mostrado un descenso en los niveles de TNFα después de 3 meses de tratamiento con simvastatina33. Por otra parte, no parece que la ezetimiba modifique ninguno de los parámetros inflamatorios analizados. Los datos publicados sobre los efectos pleiotrópicos de la ezetimiba son limitados y se derivan principalmente de pequeños estudios con hallazgos inconsistentes. Además, un reciente metaanálisis no ha logrado esclarecer si los efectos pleiotrópicos de la ezetimiba existen realmente, si son dependientes de los lípidos y la importancia clínica que estos pudieran tener34.
Para finalizar, en cuanto al efecto de los diferentes tratamientos sobre el metabolismo hidrocarbonado no hemos encontrado cambios en ninguno de los parámetros analizados. Sin embargo, los efectos de la ezetimiba sobre el metabolismo de la glucosa no son concluyentes34, mientras que las estatinas parecen aumentar ligeramente el riesgo de incidencia de diabetes35,36, aunque estos efectos, de manifestarse, lo harían muy a largo plazo.
En resumen, teniendo en cuenta que la combinación de simvastatina y ezetimiba muestra un efecto sumatorio como tratamiento hipocolesterolemiante y que la simvastatina tiene efectos beneficios sobre las subfracciones lipoproteicas y más a largo plazo sobre parámetros inflamatorios, proponemos esta combinación como una opción de primera línea en el tratamiento de la hipercolesterolemia en la práctica clínica diaria.
Contribución de los autoresDiseño del estudio (AH-M; MR), recogida y análisis de datos (CB, LB, AJ, ES), interpretación de datos (CB, MR, VMV), redacción del borrador del artículo o revisión crítica de su contenido (AH-M, CB, MR) y aprobación final de la versión a publicar (AH-M; MR).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este estudio ha sido financiado por una beca de la Sociedad Española de Arteriosclerosis y la Fundación Española de Arteriosclerosis 2009 para la investigación Clínico-Epidemiológica. MR es beneficiaria de un contrato Miguel Servet del Instituto de Salud Carlos III (CP10/0036) y VMV es beneficiario de un contrato de estabilización de la Consejería de Sanidad de la Comunidad Valenciana y del Instituto de Salud Carlos III (CES10/030).