Los pacientes con artritis reumatoide (AR) presentan una aterosclerosis acelerada, que se ha relacionado en parte con alteraciones del metabolismo lipídico asociadas al proceso inflamatorio, que incluye a la proteína sérica amiloide A.
ObjetivoEvaluar el perfil lipídico en pacientes con AR tratada y su relación con la actividad inflamatoria y la presencia de amiloidosis secundaria.
MétodosSe estudiaron 78 pacientes mujeres con AR. A todas se les realizó una extracción sanguínea para analizar el perfil lipídico (colesterol total, c-HDL, c-HDL3, c-HDL2, c-LDL, triglicéridos, lipoproteína(a) y apolipoproteínasA-I y B), una punción aspirativa (PAAF) de la grasa abdominal para descartar la presencia de amiloide, y se valoró la actividad de la enfermedad mediante parámetros clínicos y analíticos. El grupo control fue seleccionado de un estudio de base poblacional.
ResultadosLas pacientes con AR presentaban concentraciones significativamente más elevadas del c-HDL y más bajas de la apolipoproteínaB que la población general seleccionada. En el 11% se detectó depósito de amiloide y no se observaron, respecto a las pacientes sin amiloidosis, diferencias significativas en las concentraciones de c-HDL, aunque el c-HDL3 era más elevado, con diferencias cercanas a la significación estadística (p=0,087). La actividad inflamatoria de las pacientes se correlacionaba negativamente con el c-HDL, el c-HDL3 y la apolipoproteína AI.
ConclusionesEn mujeres con AR tratada existe una correlación negativa significativa entre los parámetros lipídicos cardioprotectores y la actividad inflamatoria, sin influir la presencia de depósitos de amiloide en la grasa abdominal.
Patients with rheumatoid arthritis (RA) display an accelerated atherosclerosis that is related in part to lipid metabolism disorders associated with the inflammatory process, which includes serum amyloid protein A.
ObjectiveTo evaluate the lipid profile in treated RA patients and its relationship to inflammatory activity and the presence of secondary amyloidosis.
MethodsSeventy-eight female patients with RA were studied. Blood samples were obtained from all patients, to analyze the lipid profile (total cholesterol, HDL-c, HDL3-c, HDL2-c, LDL-c, triglycerides, lipoprotein(a) and apolipoproteinsAI and B), an abdominal fat pad aspirate was performed to determinate the presence of amyloid, and the activity of the disease by clinical and laboratory parameters was evaluated. The control group was selected from a population-based study.
ResultsThe RA patients had significantly higher concentrations of HDL-c and lower of apolipoprotein B than selected general population. Amyloid deposition was detected in 11%, and compared to patients without amyloidosis, significant differences in HDL-c concentrations was not observed, although the HDL3-c was higher, with differences near to statistical significance (p=0.087). Inflammatory activity correlated negatively with HDL-c, HDL3-c and apolipoprotein AI in RA patients.
ConclusionsThere is a significant negative correlation between cardioprotective lipid parameters and inflammatory activity in women with treated RA, that is not related with the presence of amyloid deposits.
La artritis reumatoide (AR) es una enfermedad sistémica, de causa desconocida, que se caracteriza principalmente por la inflamación crónica de las articulaciones y afecta al 0,5% de la población general adulta en España1. Numerosos estudios epidemiológicos han puesto de manifiesto que los pacientes con AR tienen una tasa de mortalidad superior a la esperada2. Esto se atribuye a un incremento de la enfermedad cardiovascular (principalmente enfermedad coronaria)3, como resultado de un proceso de aterosclerosis acelerada4, que no se explica en su totalidad por los factores de riesgo cardiovascular tradicionales5. Aunque se desconoce con exactitud la causa de este proceso de ateromatosis acelerada en la AR, entre los posibles mecanismos implicados se incluyen alteraciones del metabolismo lipídico relacionadas con el propio proceso inflamatorio6. Algunos mecanismos autoinmunes e inflamatorios que intervienen en la patogénesis de la AR podrían estar implicados en el origen de la dislipidemia y la enfermedad cardiovascular de estos pacientes7.
Los cambios en el perfil lipídico y los reactantes de fase aguda se asocian a la aterosclerosis temprana en la AR y otras enfermedades inflamatorias. En este sentido, se ha descrito que la AR activa y no tratada presenta un perfil lipídico proaterogénico, que consiste principalmente en una disminución del colesterol de las lipoproteínas de alta densidad (c-HDL) y la apolipoproteínaAI (apo AI)8,9. Estas alteraciones lipídicas parecen ser secundarias a la inflamación crónica, dado que mejoran con el tratamiento de la AR, sin utilizar un agente reductor de lípidos10,11. Además, en las enfermedades inflamatorias crónicas, las citocinas aumentan las concentraciones sanguíneas de los reactantes de fase aguda, como el fibrinógeno, la proteína C reactiva (PCR) o la proteína sérica amiloide A (SAA), entre otros. Estos marcadores de inflamación activa se han relacionado con una mayor tendencia a presentar eventos cardiovasculares12,13. La SAA es un precursor de las fibrillas de amiloide, que se depositan en diversos tejidos de pacientes con amiloidosis secundaria. Esta es una complicación tardía descrita en la AR como consecuencia de la inflamación crónica, que se presentará hasta en un 10-20% de estos pacientes14, aunque en muchas ocasiones permanecerá asintomática. El objetivo de este estudio es evaluar el perfil lipídico en pacientes mujeres con AR tratada y su relación con la actividad inflamatoria de la enfermedad, incluyendo parámetros de laboratorio, clínicos y la presencia de amiloidosis secundaria.
Pacientes y métodosPacientes con artritis reumatoideSe incluyeron de forma consecutiva 78 mujeres con AR, diagnosticadas según los criterios de la American College of Rheumatology revisados en 198715, procedentes de la consulta externa de Reumatología del Hospital Universitari de Bellvitge en Barcelona y con una duración de la enfermedad superior a un año. Este estudio fue aprobado por el comité ético de este hospital.
A todas las pacientes que aceptaron participar en el estudio se les programó una visita adicional. En esta visita cada paciente fue evaluada de forma sistemática a través de una entrevista estructurada, un cuestionario autoadministrado y un examen médico general para obtener información acerca de los siguientes aspectos: las características de la enfermedad, la medicación en el momento de la inclusión en el estudio, la altura y el peso para el cálculo del índice de masa corporal (IMC), el sedentarismo, que se definió como el hecho de no caminar 30min consecutivos por lo menos 3veces a la semana, la presión arterial (se recogió el promedio de 2mediciones obtenidas en un intervalo de 5min, después de que los sujetos hubiesen permanecido en posición supina durante al menos 10min), la capacidad para realizar las actividades de la vida diaria valoradas mediante el cuestionario autoadministrado Health Assessment Questionnaire (HAQ), y la actividad de la enfermedad según un índice validado compuesto, el Disease Activity Score, basado en la evaluación de 28 articulaciones (DAS 28). También se realizó una punción aspiración (PAAF) de la grasa abdominal para descartar la presencia de amiloide mediante la tinción de rojo congo y estudio microscópico con luz polarizada.
La clase funcional de la enfermedad se valoró según la clasificación de Steinbrocker (clasei: completamente capaz de realizar todas las actividades de la vida diaria: autocuidado, vocacionales y no vocacionales; claseii: capaz de realizar el autocuidado habitual y las actividades vocacionales, pero con limitación en las actividades no vocacionales; claseiii: capaz de realizar las actividades del autocuidado, pero con limitaciones en las actividades vocacionales y no vocacionales; claseiv: limitación en la capacidad de realizar el autocuidado habitual, en las actividades vocacionales y no vocacionales).
El dolor y el estado general de salud por parte del paciente en relación a la semana previa, y de la actividad de la enfermedad por parte del médico, se valoraron mediante la escala analógica visual (EVA), con una puntuación entre 0 y 100mm, donde 0 representa la mejor situación posible.
El cuestionario autoadministrable de la versión española del HAQ o Cuestionario de Evaluación de Salud se utilizó para evaluar la capacidad de realizar las actividades diarias con un rango de 0 a 3, donde 0 representa capacidad funcional normal y 3 incapacidad funcional total16.
La actividad inflamatoria de la enfermedad se valoró mediante un índice validado compuesto que incluye parámetros analíticos, datos obtenidos por la exploración física y la valoración subjetiva por parte del paciente, denominado DAS28 y basado en la evaluación de 28 articulaciones17. El DAS28 incluye el recuento de articulaciones dolorosas y tumefactas (hombros, codos, muñecas, metacarpofalángicasi-v, interfalángicas del pulgar, interfalángicas proximalesii-v y rodillas), la velocidad de sedimentación globular (VSG) y la evaluación del estado general por parte del paciente, donde <3,2 equivale a actividad leve de la enfermedad, entre 3,2 y 5,1 moderada, y >5,1 grave. Además, como indicadores de inflamación también se valoraron otros parámetros bioquímicos y hematológicos, como la PCR, el fibrinógeno y las plaquetas.
El aclaramiento de creatinina se calculó mediante la fórmula de Cockcroft-Gault corregida por la superficie corporal18.
Se excluyeron a las pacientes en tratamiento con fármacos hipolipidemiantes, agentes betabloqueantes no cardioselectivos o terapia hormonal posmenopáusica sustitutiva, o que presentaban condiciones clínicas que afectasen al metabolismo lipídico, como la obesidad extrema (índice de masa corporal ≥38kg/m2), el aclaramiento de creatinina <30ml/min y/o creatinina sérica >1,5mg/dl (133mmol/l), hiperglucemia severa (glucemia basal >9 mmol/l), proteinuria >1g/24h o dislipidemia severa, es decir, colesterol total ≥7,7 mmol/l y/o triglicéridos [TG] >5,6 mmol/l, que podría sugerir un trastorno genético autosómico dominante del metabolismo lipídico.
Ninguna de las pacientes incluidas presentaba clínica de infección aguda o historia clínica conocida de enfermedad neoplásica o disfunción tiroidea.
ControlesEl grupo control (n=450 mujeres) para la comparación de los parámetros lipídicos fue seleccionado de un estudio de base poblacional (estudio DRECE)19, a excepción de la lipoproteína(a) [Lp(a)], que fue obtenida de un estudio de continuación (DRECE II)20. Para la selección de la muestra se aplicaron los mismos criterios de exclusión que en las pacientes estudiadas, con rangos de edad y de IMC comparables y ajustado por estado menopáusico.
Medida de las concentraciones séricas de los lípidosLas muestras de sangre se obtuvieron en el mismo día de la visita para tener una buena correlación entre la actividad de la enfermedad según los marcadores biológicos de inflamación y los parámetros clínicos. El estudio analítico incluyó un hemograma, una bioquímica de rutina, y un perfil de los lípidos y las lipoproteínas séricas.
La sangre fue recogida en tubos sin anticoagulante, después del ayuno nocturno como mínimo de 12h (los pacientes habían sido instruidos previamente). Cada muestra fue centrifugada a 1.200G durante 10min a temperatura ambiente, y se almacenó a 4¿C hasta su análisis. Las concentraciones séricas de c-HDL se midieron mediante un método enzimático colorimétrico directo (HDL-c plus, Roche Diagnostics, Basilea, Suiza). Las concentraciones séricas de c-HDL3 se midieron en el sobrenadante obtenido después de la precipitación de la subfracción HDL2 mediante la adición de una solución de polietilenglicol 15% (PEG 20.000) a un pH de 7,5. Las concentraciones séricas de c-HDL2 se calcularon como la diferencia entre las concentraciones de c-HDL y c-HDL3. Las concentraciones séricas de c-LDL se calcularon mediante la ecuación de Friedewald21. La estimación del c-LDL se descartó cuando el nivel de TG excedía 2,3mmol/l. El colesterol y los TG se midieron por métodos enzimáticos colorimétricos (CHOD-PAP, Roche Diagnostics, Basileal, Suiza, y GPO-PAP, Roche Diagnostics, Basilea, Suiza, respectivamente) y la apo AI, la apolipoproteínaB (apoB) y la lipoproteína(a) por métodos inmunoturbidimétricos (Roche Diagnostics, Basilea, Suiza). Todas las mediciones se realizaron en un analizador de sistema modular (Roche Diagnostics, Basilea, Suiza).
Análisis estadísticoLos datos se analizaron mediante el paquete estadístico SPSS para Windows, versión 15.0 (SPSS, Chicago, Illinois). Los valores de p menores de 0,05 se consideraron significativos. La normalidad de las variables se analizó mediante el test de Kolmogorov-Smirnov. Los resultados de las variables cuantitativas se expresan como media±desviación estándar (DE), las variables cuantitativas que no seguían una distribución normal se han descrito como mediana y rango intercuartil, y las variables categóricas y ordinales, como frecuencias relativas (%). La comparación entre grupos se ha realizado mediante la prueba t de Student para las variables cuantitativas normales, la U de Mann-Whitney para las que no seguían una distribución normal y la chi-cuadrado para las variables cualitativas. La asociación entre los lípidos y los parámetros inflamatorios se analizó mediante el coeficiente de correlación de Pearson. Dos valores atípicos de la PCR (>100mg/l) han sido excluidos del análisis. En el análisis comparativo entre las pacientes con y sin amiloidosis, 4 fueron excluidas por muestra insuficiente en la punción aspirativa de la grasa abdominal.
ResultadosLa tabla 1 presenta las principales características demográficas y clínicas de las pacientes incluidas en el estudio. La mayoría de ellas tenía una larga duración de la enfermedad, el factor reumatoide positivo, presencia de erosiones y una actividad moderada de la enfermedad de acuerdo con la definición del DAS28. Un elevado porcentaje recibían tratamiento con glucocorticoides a dosis bajas, con una dosis media equivalente de prednisona de 5mg/día (2-10mg/día), y terapia modificadora de la enfermedad, principalmente metotrexato, y algunas de ellas antagonistas del factor de necrosis tumoral alfa. En cuanto a los factores de riesgo cardiovascular, el 42% (n=33) de las pacientes habían sido diagnosticadas previamente de hipertensión arterial y el 5% (n=4) de diabetes mellitus. El 72% eran obesas o con sobrepeso (IMC>25kg/m2) y solo un pequeño porcentaje fumaban en el momento del estudio. Una cuarta parte eran sedentarias y la mayoría menopáusicas. Ninguna paciente mostró disfunción renal grave o hiperglucemia marcada. En 8 (11%) de las pacientes estudiadas se demostró la presencia de depósito de amiloide en el estudio de la grasa abdominal mediante PAAF y tinción de rojo Congo.
Características clínicas de las pacientes con artritis reumatoide
| Mujeres con AR (n=78) | |
| Edad, años | 60 (12) |
| Duración de la enfermedad, años | 13 (9) |
| Rigidez matutina >1 h | 8% |
| Clase funcional, 1-4a | 2 (2-3) |
| Factor reumatoide positivo | 82% |
| Nodular | 28% |
| Erosiva | 82% |
| HAQ 1-4 | 1,4 (0,8) |
| DAS 28 | 4,79 (1,36) |
| EVA EG | 46 (24) |
| EVA dolor | 45 (27) |
| EVA médico | 32 (22) |
| Fumador actual | 4% |
| HTA/DM | 42%/5% |
| PAS/PAD | 150 (25)/85 (10) |
| Índice de masa corporal | |
| >25 y ≤30kg/m2 | 42% |
| >30kg/m2 | 30% |
| Sedentarismo | 27% |
| Estado menopáusico | 78% |
| Amiloide (PAAF grasa abdominal) | 11% |
| Tratamiento antirreumático durante el período del estudio | |
| AINE | 86% |
| Glucocorticoides | 83% |
| Metotrexato | 57% |
| Bloqueadores TNF-alfa | 12% |
| Otros fármacos modificadores de la enfermedad | 28% |
EVA EG: escala analógica visual del estado general de salud; HAQ: Health Assessment Questionnaire; PAAF: punción aspiración con aguja fina la grasa abdominal; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
Las variables cualitativas se expresan en frecuencias relativas (%). Las variables continuas se expresan como media (desviación estándar).
Las variables biológicas, principalmente las relacionadas con la reacción de fase aguda, se muestran en la tabla 2. Se puede observar que los valores medios de los marcadores inflamatorios estaban moderadamente aumentados.
Características biológicas de las pacientes con artritis reumatoide
| Mujeres con AR (n=78) | Valores de referencia | |
| VSG (mm/h) | 36 (19) | 3-20 |
| PCR (mg/l)a | 10 (4-23) | ≤5 |
| Fibrinógeno (mg/ml) | 4,6 (1,1) | 2-4 |
| Plaquetas (×10E9/l) | 280 (67) | 180-400 |
| Glucosa (mmol/l) | 5,2 (0,8) | 4,1-6,9 |
| Creatinina (μmol/l) | 81 (16) | ≤86 |
| Proteinuria (g/24 h)a | 0,10 (0,07-0,13) | ≤0,15 |
| Aclaramiento de creatinina corregido por la superficie corporal (ml/min/1,73m2) | 73 (20) | >60 |
Las variables continuas se expresan como media (desviación estándar).
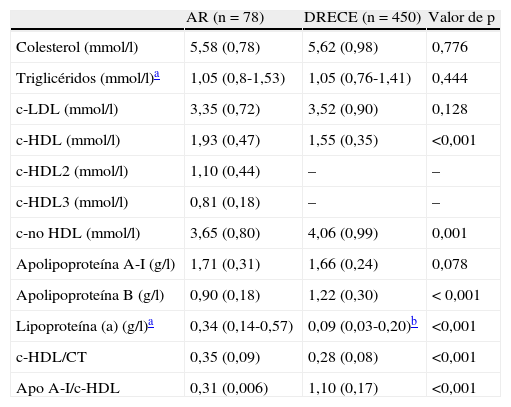
La comparación entre los valores de los lípidos séricos, las lipoproteínas y las apolipoproteínas entre los pacientes de este estudio y los del grupo DRECE se expone en la tabla 3. Las pacientes con AR presentan concentraciones plasmáticas significativamente más elevadas de c-HDL respecto a los sujetos del DRECE (p<0,001), y casi significativas de la apoA-I (p=0,078). También se observa que las pacientes presentan concentraciones plasmáticas significativamente más bajas de la apoB que la población general seleccionada (p<0,001). No se han observado diferencias estadísticamente significativas respecto al resto de parámetros lipídicos analizados. Las concentraciones elevadas de c-HDL de las pacientes con AR se deben principalmente a la subfracción HDL2.
Concentraciones plasmáticas de lípidos y lipoproteínas en pacientes con artritis reumatoide (AR) y los sujetos del estudio DRECE
| AR (n=78) | DRECE (n=450) | Valor de p | |
| Colesterol (mmol/l) | 5,58 (0,78) | 5,62 (0,98) | 0,776 |
| Triglicéridos (mmol/l)a | 1,05 (0,8-1,53) | 1,05 (0,76-1,41) | 0,444 |
| c-LDL (mmol/l) | 3,35 (0,72) | 3,52 (0,90) | 0,128 |
| c-HDL (mmol/l) | 1,93 (0,47) | 1,55 (0,35) | <0,001 |
| c-HDL2 (mmol/l) | 1,10 (0,44) | – | – |
| c-HDL3 (mmol/l) | 0,81 (0,18) | – | – |
| c-no HDL (mmol/l) | 3,65 (0,80) | 4,06 (0,99) | 0,001 |
| ApolipoproteínaA-I (g/l) | 1,71 (0,31) | 1,66 (0,24) | 0,078 |
| ApolipoproteínaB (g/l) | 0,90 (0,18) | 1,22 (0,30) | <0,001 |
| Lipoproteína(a) (g/l)a | 0,34 (0,14-0,57) | 0,09 (0,03-0,20)b | <0,001 |
| c-HDL/CT | 0,35 (0,09) | 0,28 (0,08) | <0,001 |
| Apo A-I/c-HDL | 0,31 (0,006) | 1,10 (0,17) | <0,001 |
Las variables continuas se expresan como media (desviación estándar).
En la tabla 4 se muestran los resultados de un subanálisis realizado para evaluar las diferencias entre el perfil lipídico entre las pacientes con AR con o sin amiloidosis secundaria. No se observaron diferencias significativas entre las concentraciones del c-HDL de ambos grupos de pacientes, si bien las afectadas de amiloidosis presentaban concentraciones plasmáticas más elevadas de la subfracción HDL3, con diferencias cercanas a la significación estadística (p=0,087).
Concentraciones plasmáticas de lípidos y lipoproteínas en pacientes con artritis reumatoide (AR) con y sin amiloidosis secundaria
| AR con amiloidosis (n=8) | AR sin amiloidosis (n=66) | Valor de p | |
| Colesterol (mmol/l) | 5,96 (0,90) | 5,55 (0,77) | 0,167 |
| Triglicéridos (mmol/l)a | 1,10 (0,83-1,58) | 1,05 (0,80-1,45) | 0,834 |
| c-LDL (mmol/l) | 3,66 (1,07) | 3,32 (0,67) | 0,212 |
| c-HDL (mmol/l) | 2,01 (0,64) | 1,93 (0,45) | 0,629 |
| c-HDL2 (mmol/l) | 1,10 (0,50) | 1,10 (0,44) | 0,968 |
| c-HDL3 (mmol/l) | 0,91 (0,20) | 0,80 (0,18) | 0,087 |
| c-no HDL (mmol/l) | 3,95 (1,24) | 3,62 (0,75) | 0,293 |
| ApolipoproteínaA-I (g/l) | 1,75 (0,37) | 1,71 (0,31) | 0,701 |
| ApolipoproteínaB (g/l) | 0,95 (0,29) | 0,90 (0,17) | 0,432 |
| Lipoproteína(a) (g/l)a | 0,22 (0,08-0,49) | 0,34 (0,14-0,57) | 0,524 |
| c-HDL/CT | 0,35 (0,14) | 0,35 (0,08) | 0,994 |
| Apo A-I/c-HDL | 0,30 (0,09) | 0,31 (0,05) | 0,729 |
Las variables continuas se expresan como media (desviación estándar).
En los análisis de correlación entre las variables de inflamación y los parámetros lipídicos se observa una correlación negativa y estadísticamente significativa entre el DAS28 y el c-HDL (r=–0,242, p=0,04), el c-HDL3 (r=–0,369, p=0,003), la apo AI (r=–0,324, p=0,006) y los cocientes c-HDL3/CT (r=–0,343, p=0,006) y apoA1/HDL (r=–0,273, p=0,020) (fig. 1); la VSG con el c-HDL3 (r=–0,297, p=0,018) y los cocientes c-HDL3/CT (r=–0,410, p=0,001) y apoA1/HDL (r=–0,255, p=0,031); la PCR con el c-HDL3 (r=–0,291 p=0,017) y el cociente c-HDL3/CT (r=–0,261, p=0,033); y el fibrinógeno con los cocientes c-HDL3/CT (r=–0,246, p=0,045) y apoA1/HDL (r=–0,267, p=0,020). Se observa una correlación positiva significativa entre el fibrinógeno y el c-LDL (r=230, p=0,45) y la apoB (r=231, p=0,44).
DiscusiónEn el presente estudio la actividad inflamatoria en las pacientes mujeres con AR se correlaciona negativamente con el c-HDL, el c-HDL3 y la apolipoproteínaAI. De acuerdo con la mayoría de los estudios anteriores, estos resultados confirman una correlación inversa entre algunos de los parámetros lipídicos con propiedades cardioprotectoras y la inflamación. Sin embargo, en contraste con algunos de ellos, en los que se incluyeron pacientes con AR activa y no tratada, este estudio evalúa pacientes con enfermedad activa y en tratamiento con fármacos antirreumáticos modificadores de la evolución de la enfermedad y glucocorticoides a dosis bajas. Además, en el presente estudio, a diferencia de lo comunicado en otras publicaciones, se ha observado que las concentraciones del c-HDL se encuentran dentro de unos valores normales o altos, aunque se mantiene la correlación negativa entre el grado de inflamación y el c-HDL.
Estos hallazgos podrían indicar que la reacción de fase aguda no explique en su totalidad las alteraciones del metabolismo lipídico descritas en las pacientes con AR, y que otros mecanismos, además de la inflamación, podrían estar implicados. En este sentido, en un trabajo previo observamos que el tratamiento con dosis bajas de glucocorticoides tenía un efecto favorable sobre el metabolismo lipídico, que consistía principalmente en un incremento del c-HDL sin aumento del c-LDL22.
Otro hallazgo interesante del presente estudio ha sido el observar la alta proporción de colesterol en la subfracción HDL2 que presentaban estas pacientes. Las partículas de HDL han sido subclasificadas según su tamaño y contenido en lípidos23. En el plasma humano predominan 2 subclases principales: la más grande y más rica en lípidos, la HDL2, y la más pequeña y más densa, la HDL3. Existe controversia acerca de qué fracción del c-HDL juega mayor papel antiaterogénico, aunque en algunos estudios se ha constatado que los pacientes con enfermedad coronaria tienen generalmente las partículas HDL más pequeñas (HDL3), lo que conduce a la teoría de que las partículas más grandes de HDL (HDL2) pueden estar asociadas con una mayor protección contra la enfermedad de las arterias coronarias. A diferencia de la población general sana, en la que se ha observado una mayor proporción del c-HDL3 sobre el c-HDL2, en estas pacientes el c-HDL predominaba en la subfracción HDL2. En consonancia con ello, sólo el colesterol de la subfracción HDL3 mostró una correlación inversa con los marcadores de actividad inflamatoria de la AR, al igual que el c-HDL total. La mayor proporción del c-HDL2 respecto al c-HDL3 observada en las pacientes de este estudio podría explicarse por 2 mecanismos. Tanto la inflamación como los glucocorticoides pueden disminuir la actividad de la lipasa hepática de triglicéridos, lo que disminuye la conversión de las partículas HDL2 más grandes en las partículas más pequeñas HDL3 a través de la hidrólisis de los triglicéridos de las HDL. Por otra parte, la inflamación puede disminuir la actividad de la lipoproteinlipasa (LPL), que resulta en una disminución del flujo del colesterol libre hacia las HDL, y conduce a cambios en su maduración. Sin embargo, este último mecanismo podría estar contrarrestado por el efecto de los glucocorticoides, ya que estos aumentan la actividad de la LPL. Valorado en conjunto, la inflamación y la terapia con dosis bajas de glucocorticoides podrían explicar la mayor proporción de c-HDL2 sobre el c-HDL3 que hemos observado en este grupo de pacientes.
Aunque estos cambios en las HDL podrían ser interpretados como favorables, se ha observado que durante la inflamación las HDL pierden algunos de sus componentes habituales, como los ésteres de colesterol, la apo AI, la paraoxonasa y la lecitina colesterol acil transferasa, que son sustituidos por colesterol libre, la apolipoproteína J, la proteína SAA, la mieloperoxidasa y otras moléculas proinflamatorias. Estos cambios en la composición estructural de las HDL disminuyen su capacidad para participar en el trasporte reverso del colesterol y deterioran otros mecanismos relacionados con su capacidad protectora frente a la arteriosclerosis, entre ellos la acción antiinflamatoria, antioxidante y antiproliferativa. La baja proporción de ApoAI en las partículas de HDL observada en este estudio podría hacer suponer la existencia de estos cambios en su composición, en este grupo de pacientes con actividad inflamatoria moderada a pesar el tratamiento antirreumático. Otro hallazgo a favor de que probablemente se trate de HDL proinflamatorias sería la mayor concentración de colesterol de la subfracción HDL2 sobre la HDL3, partículas de mayor tamaño, que de forma indirecta podría traducir la disfuncionalidad de las HDL, es decir, la incapacidad de entregar el colesterol para su eliminación. Este aspecto es especialmente relevante en las pacientes con AR y amiloidosis secundaria, en las que la proteína SAA podría incorporarse a la partícula de HDL alterando su estructura y su función protectora frente a la arteriosclerosis.
En base a estos resultados, concluimos que existe una correlación negativa entre la actividad inflamatoria en pacientes mujeres con AR, especialmente entre el DAS28 y los parámetros lipídicos. Dicha correlación puede ser contrarrestada en parte por el efecto antiinflamatorio del tratamiento con dosis bajas de glucocorticoides.
Contribución de los autoresTodos los autores cumplen los requisitos exigidos por la revista para ser coautores en el artículo.
FinanciaciónEste trabajo ha podido ser realizado gracias a la Beca FEA/SEA 2006 de la Sociedad Española de Arteriosclerosis.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.