La proteína C-reactiva (PCR) es un marcador de inflamación y de pronóstico de la enfermedad cardiovascular. Además, esta proteína parece realizar funciones mediadoras de esta enfermedad, dado sus múltiples efectos proaterogénicos y su presencia en las lesions ateroscleróticas.
Material y métodosEn este estudio, se analizó la expresión de la PCR, mediante la reacción en cadena de la polimerasa a tiempo real, en las lesiones avanzadas de carótida obtenidas mediante endarterectomía. Además, mediante inmunohistoquímica, se analizó la expresión de esta proteína en estas lesiones ateroscleróticas avanzadas y en muestras de arteria carótida que se encontraban en diferentes estadios de progresión.
ResultadosLos valores de ácido ribonucleico mensajero de PCR fueron significativamente más elevados en las lesiones ulceradas no complicadas, comparado con las lesiones ulceradas complicadas (p=0,001) y fibrosas (p=0,01). Mediante inmunohistoquímica, se observó marcaje para PCR en las lesiones más avanzadas, principalmente en las células inflamatorias infiltradas y en vasos de nueva formación. En cambio, en lesiones más tempranas y en las arterias carótidas sanas no se encontró tinción para la PCR.
ConclusiónLa expresión de la PCR en las lesiones ateroscleróticas de carótida se induce en estadios medios y avanzados de la progresión, y puede estar implicada en la inflamación y la neovascularización que aparece en estos estadios, lo que conlleva riesgo de complicaciones hemorrágicas.
C-reactive protein (CRP) is an inflammatory and powerful marker of future vascular events. Recently, it has been proposed as a mediator molecule of atherosclerotic disease due to its multiple proatherogenic effects and its presence in atherosclerotic plaques.
Material and methodsCRP expression was analyzed by real time polymerase chain reaction (PCR) in advanced carotid plaques. Furthermore, protein expression was analyzed by immunohistochemistry in carotid atherosclerotic lesions obtained by endarterectomy and in carotid samples in different phases of progression.
ResultsAnalysis by real time PCR showed significantly higher levels of CRP in ulcerated non-complicated lesions as compared to complicated ulcerated lesions (p=0.001) or fibrous lesions (p=0.01). An immunohistochemistry assay for CRP showed that in advanced lesions, mainly infiltrated inflammatory cells and new vessels were stained. In contrast, no CRP staining was observed in early lesions and carotid artery controls.
ConclusionCRP expression in carotid atherosclerotic lesions is induced in moderated and advanced stages of plaque progression, suggesting a possible role of this molecule in inflammation and neovascularization and triggering atherothrombotic complications.
La aterosclerosis es la causa principal de enfermedad cardiovascular1,2 y aparece como consecuencia de un proceso inflamatorio local y sistémico3. La progresión de las lesiones ateroscleróticas en la arteria carótida desencadena la aparición de placas inestables que puede finalizar en complicaciones trombóticas y, como consecuencia, pueden producirse episodios clínicos. La proteína C reactiva (PCR) es un marcador de fase aguda cuyos valores de expresión circulantes y en tejido aumentan en pacientes con enfermedades inflamatorias4–9. Además, se ha descrito que hay una asociación entre los valores de PCR depositados en la íntima y el desarrollo de las lesiones ateroscleróticas10. La PCR es un pentámero compuesto por 5 monómeros globulares idénticos de 23 KDa, unidos mediante enlaces no covalentes, dispuestos alrededor de un poro central. Su síntesis se produce principalmente en el hígado con el control de la interleucina (IL) 611,12. El marcador de inflamación PCR es una proteína evolutivamente conservada que se encuentra con valores inferiores a 1mg/l en personas sanas. Como respuesta a estímulos de fase aguda, la concentración de los valores circulantes de PCR puede aumentar unas 100 veces de forma rápida y considerable13. En pacientes con riesgo de presentar enfermedad aterosclerótica, los valores de PCR aumentan por encima de 3mg/l y permanecen elevados durante meses o años14.
Aunque originalmente la PCR se mostró como un marcador de la enfermedad aterosclerótica, en estudios posteriores se ha observado que esta proteína puede considerarse mediadora de esta enfermedad15. La PCR produce una gran cantidad de efectos en la biología de la pared vascular que favorecen el fenotipo aterosclerótico, como la atracción de monocitos hacia el interior de la pared arterial, la captación de lipoproteínas de baja densidad (LDL) modificadas mediante macrófagos16,17, la disminución de la liberación de óxido nítrico en células endoteliales humanas17,18, la sobreexpresión de moléculas de expresión19, la estimulación de la proliferación y migración de células musculares lisas20, el aumento de los valores de expresión de las metaloproteasas de matriz (MMP) por células endoteliales y macrófagos21–23, lo que activa el sistema del complemento24 e induce la expresión y la actividad del inhibidor 1 del activador del plasminógeno (PAI-1) en células endoteliales de aorta humana25.
Se ha observado la expresión de PCR en tejidos extrahepáticos, macrófagos alveolares, neuronas, linfocitos y en células vasculares26–29. En lesiones ateroscleróticas, se ha observado colocalización de PCR y células musculares lisas (CML) y macrófagos mediante análisis inmunohistoquímicos18,30, mediante reacción en cadena de la polimerasa analizada a tiempo real e hibridación in situ. Estos datos indican que la PCR podría estar sintetizándose en las lesiones ateroscleróticas y no infiltrándose en este tejido desde la sangre circulante. Con el fin de esclarecer esta hipótesis, con este estudio se quiso examinar la presencia de PCR en lesiones ateroscleróticas de carótida y, además, analizar la expresión endógena de la PCR en estas lesiones.
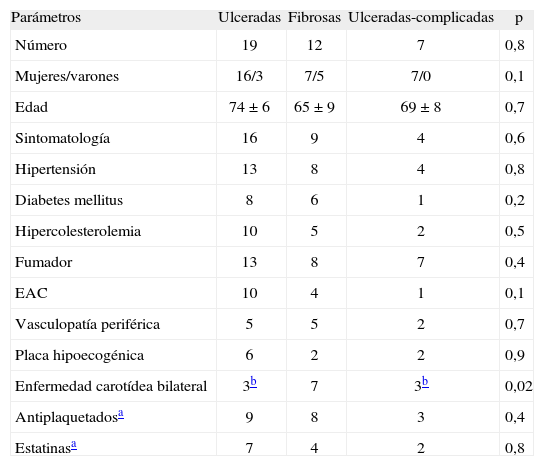
Material y métodosPacientes y muestras de tejidoEn este estudio, se incluyó a 38 pacientes sometidos a endarterectomía por mostrar estenosis carotídea sintomática (> 70%), confirmada mediante resonancia magnética o arteriografía convencional, o ataque isquémico transitorio. Se analizó la posible presencia de enfermedad bilateral (> 50% estenosis) mediante imagen de ecografía Doppler. Se recogieron los datos clínicos de los pacientes, como la presencia de factores de riesgo vascular y los tratamientos con estatinas o fármacos antiplaquetarios (tabla 1). No se incluyó en el estudio a los pacientes anticoagulados. Además, también se han estudiado 15 muestras de lesiones ateroscleróticas de carótida con estenosis baja o moderada, obtenidas de pacientes post mórtem y de donantes de órganos. Como controles de ARN mensajero e inmunohistoquímica, se utilizaron arterias carótidas sanas obtenidas de trasplantes vasculares. El comité ético aprobó el estudio según las normas institucionales del Hospital Universitario de Bellvitge (Barcelona).
Datos clínicos de los pacientes
| Parámetros | Ulceradas | Fibrosas | Ulceradas-complicadas | p |
| Número | 19 | 12 | 7 | 0,8 |
| Mujeres/varones | 16/3 | 7/5 | 7/0 | 0,1 |
| Edad | 74 ±6 | 65 ± 9 | 69 ± 8 | 0,7 |
| Sintomatología | 16 | 9 | 4 | 0,6 |
| Hipertensión | 13 | 8 | 4 | 0,8 |
| Diabetes mellitus | 8 | 6 | 1 | 0,2 |
| Hipercolesterolemia | 10 | 5 | 2 | 0,5 |
| Fumador | 13 | 8 | 7 | 0,4 |
| EAC | 10 | 4 | 1 | 0,1 |
| Vasculopatía periférica | 5 | 5 | 2 | 0,7 |
| Placa hipoecogénica | 6 | 2 | 2 | 0,9 |
| Enfermedad carotídea bilateral | 3b | 7 | 3b | 0,02 |
| Antiplaquetadosa | 9 | 8 | 3 | 0,4 |
| Estatinasa | 7 | 4 | 2 | 0,8 |
EAC: enfermedad arterial coronaria.
Las muestras de plasma se recogieron después de un período de ayuno nocturno, inmediatamente antes de la intervención quirúrgica y se congelaron directamente en nitrógeno líquido a −80°C para su posterior procesado. La PCR de alta sensibilidad (hsPCR) se cuantificó en las muestras de plasma con ácido etilendiaminotetraacético (EDTA) mediante inmunofelometría, usando BN Systems (Dade Behring). Se excluyó del estudio a los pacientes con historial arterial agudo o tromboembolia aguda, con condiciones de infección o inflamación activas, fallo renal, enfermedad hepática, neoplasmas, traumatismos recientes o sometidos a cirugía. Además, todos los demás análisis hematológicos y bioquímicos se realizaron de forma sistemática.
Conservación y caracterización de las muestras de carótidaLas placas ateroscleróticas de carótida se extirparon mediante cirugía, sin dañar la superficie luminar de la arteria. Inmediatamente después de la cirugía, se analizaron la morfología y las características anatomopatológicas de estas placas. Las muestras se lavaron en búfer fosfato salino, y se cortaron longitudinalmente en 2 porciones. Una de las secciones se congeló en nitrógeno líquido y se almacenó a −80°C, y la otra porción se fijó durante 24h en paraformaldehído al 4% y se cortó en secciones para realizar técnicas histológicas de hematoxilina-eosina (HE). Las placas ateroscleróticas avanzadas se clasificaron como ulceradas no complicadas (UNC), ulceradas complicadas (UC), las que exhibían trasformaciones hemorrágicas o fibrosas (F). Las lesiones UC muestran un bajo contenido celular y un elevado componente necrótico, por lo que las clasificamos como lesiones no activas. En cambio, las lesiones UNC muestran un elevado componente celular, principalmente de células inflamatorias. Las lesiones ateroscleróticas de carótida con estenosis baja o moderada, obtenidas de pacientes post mórtem y de donantes de órganos, se asociaron a un estadio de la progresión aterosclerótica según la clasificación de la American Heart Association (AHA), determinada mediante la observación microscópica de secciones teñidas con HE.
InmunohistoquímicaSe realizaron secciones seriadas de 8μm de grosor mediante un criostato. El método usado para observar la tinción inmunohistoquímica fue la peroxidasa (Vectastain kit; Vector). Después de bloquear la peroxidasa endógena, las secciones se incubaron con suero normal más el anticuerpo (clon PCR-8; Sigma; 1:100) durante 1h. Seguidamente, se realizaron lavados y las secciones se incubaron 1h con anticuerpo secundario (1:200) a temperatura ambiente. La reacción peroxidasa se visualizó con 0,05% de diaminobenzidina31. También se incluyó en el estudio inmunohistoquímico un control negativo incubado con suero sin anticuerpo.
Extracción de ARN y síntesis de ADNcEl ARN total se aisló de las placas ateroscleróticas de carótida avanzadas mediante el uso del kit Tripure Isolation Reagent (Roche Molecular Biochemical), de acuerdo con las instrucciones de la casa comercial. La integridad y la concentración del ARN obtenido se midieron usando el Bioanalyzer (Agilent). Posteriormente, el ARN total se convirtió a una única cadena de ácido desoxirribonucleico complementario (ADNc) usando el kit High-Capacity cDNA archive kit (Applied Biosystems).
Reacción en cadena de la polimerasa a tiempo realLos valores de ARN mensajero de la PCR se analizaron mediante la reacción en cadena de la polimerasa a tiempo real. Los primers y la sonda se obtuvieron de Applied Biosystems (Assay Hs00357041) y como control endógeno se usó GUS β-glucoranidasa) (Assay Hs99999908). La reacción en cadena de la polimerasa se corrió en el equipo ABI Prism 7900 Ht sequence Detection System (Applied Biosystems). Las condiciones térmicas cíclicas fueron las siguientes: 2min a 50°C, 10min a 95°C, 40 ciclos de desnaturalización a 95°C durante 15s, y la extensión y anillamiento se produjo a 60°C durante 1min.
Análisis estadísticoLos datos clínicos, histológicos y los obtenidos mediante la reacción en cadena de la polimerasa se compararon mediante el uso de análisis estadísticos no paramétricos (debido a que los datos no están distribuidos de una forma normal), usando el test Spearman rank para muestras pares, y el test U de Mann–Whitney para muestras impares. Los análisis fueron de 2 colas. Para análisis correlativos, el coeficiente se calculó del rango de correlación de Spearman. Los valores se consideraron significativos a p < 0,05, y los valores de grupos individuales se expresaron como media ± desviación estándar. El análisis estadístico lo llevó a cabo un médico profesional especialista en estadística mediante el uso del programa StatView.
ResultadosCaracterísticas de los pacientesLas características de los pacientes están detalladas en la tabla 1. Los pacientes incluidos en el estudio se dividieron en 3 grupos, según las características anatomopatológicas de las placas carotídeas: placas UNC, placas UC y placas F. No había diferencias significativas entre los grupos estudiados en cuanto al sexo, enfermedad carotídea sintomática, factores de riesgo individuales o combinados, tratamientos, o coexistencia de otra enfermedad vascular. Los pacientes con placas UNC mostraron lesiones carotídeas unilaterales comparado con los otros 2 grupos (p = 0,02). No se observaron diferencias significativas en los parámetros bioquímicos entre los 3 grupos estudiados. Las muestras de arteria carótida, obtenidas de pacientes post mórtem y de donantes de órganos, se clasificaron según los diferentes estadios de la progresión aterosclerótica. Siete de estas lesiones se clasificaron como lesiones tipo I/II (lesiones leves) según la clasificación de la AHA, y las restantes 8 lesiones se clasificaron como lesiones de tipo IV-V (lesiones moderadas). La media de edad de los pacientes que mostraban lesiones leves fue de 53 años y, en cambio, los pacientes con lesiones moderadas tenían una media de edad de 74 años.
Expresión de PCR en placas ateroscleróticas de carótidaLos valores de ARN mensajero de PCR, analizados mediante la reacción en cadena de la polimerasa a tiempo real, fueron significativamente más elevados en las lesiones UNC, comparado con las lesiones UC (p = 0,001) y F (p = 0,01). El aumento de expresión de la PCR en las lesiones UNC no se asoció con ningún factor de riesgo cardiovascular o tratamiento (tabla 1). Además, los parámetros bioquímicos medidos en sangre, así como los valores de fibrinógeno, HsCRP, número de leucocitos o valores de colesterol plasmático, fueron comparables entre los 3 grupos de estudio.
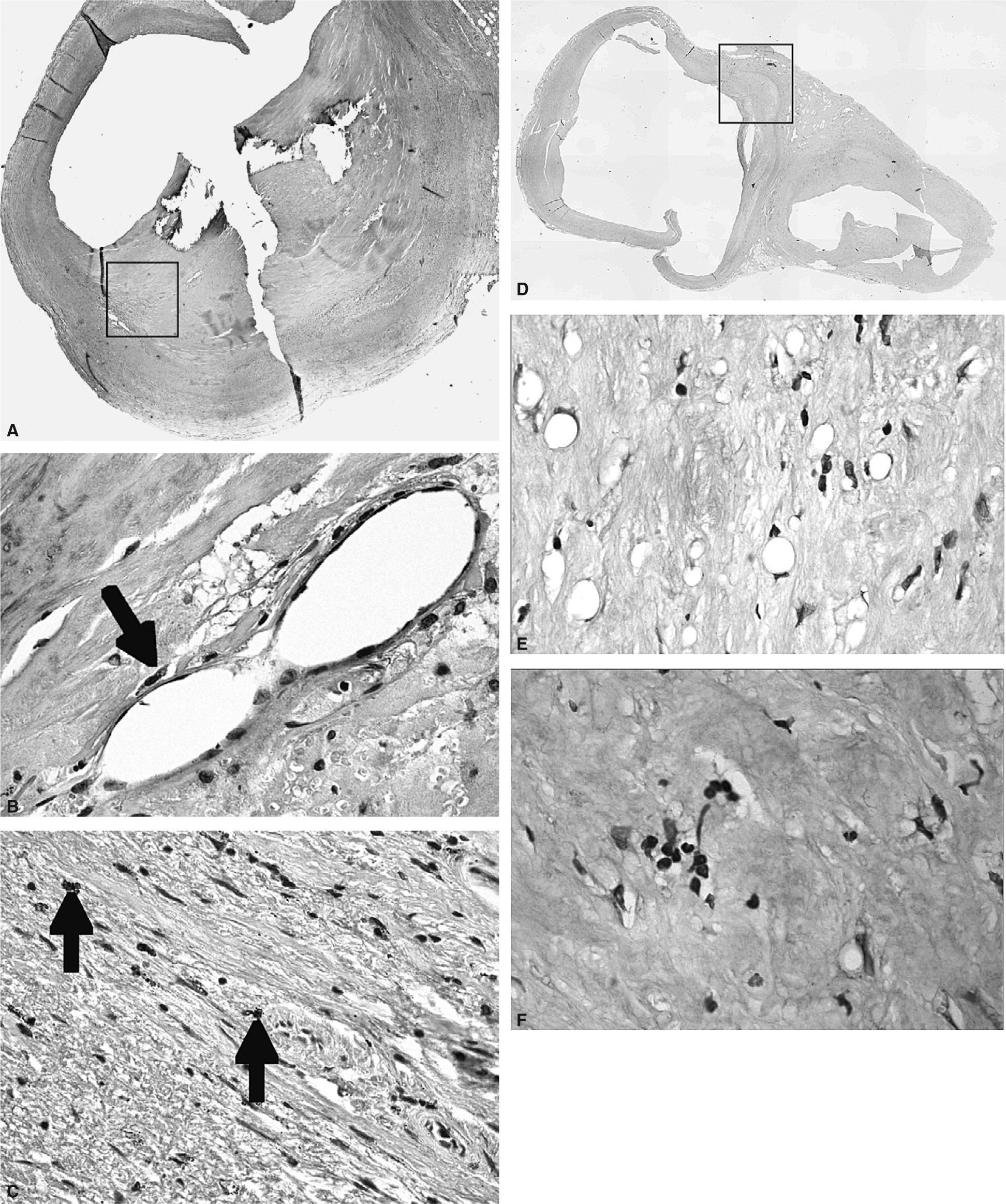
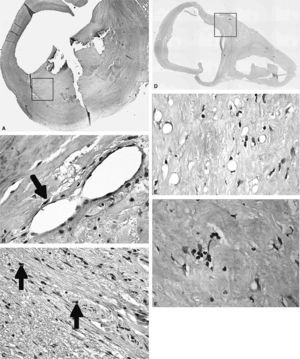
InmunohistoquímicaLos valores de PCR en las placas avanzadas de carótida, observados mediante inmunohistoquímica, mostraron el mismo comportamiento que los valores de ARN mensajero analizados mediante reacción en cadena de la polimerasa a tiempo real. Se demostró un aumento de tinción mediante el uso de anticuerpos contra PCR en las lesiones UNC, comparado con las lesiones UC o F, donde la tinción observada fue mucho más débil e, incluso, ausente en algunas lesiones. En las placas UNC, se observó tinción de PCR en áreas con un elevado contenido en células inflamatorias infiltradas. También se encontró tinción de PCR en áreas angiogénicas, en las que se observa un elevado número de microvasos de nueva formación. También se analizó la presencia de PCR mediante inmunohistoquímica en lesiones moderadas de carótida (lesiones tipo III-V) y se observó un marcaje intenso en la zona de la cubierta fibrosa fina, propensa a la rotura (fig. 1A), tiñéndose los vasos de nueva formación (fig. 1B) y las células inflamatorias infiltradas (fig. 1C) que se encuentran en esta zona. Las células endoteliales luminales también mostraron tinción. En cambio, en las lesiones leves (tipo I-II) y en las arterias carótidas sanas usadas como grupo control, no se encontró tinción para PCR, o la tinción observada fue muy tenue (figs. 1D-1F).
Imnunohistoquímica de proteína C reactiva (PCR). A. En las placas avanzadas, se observó tinción específica de PCR cerca del núcleo lipídico y en la zona de la cubierta fibrosa fina, propensa a la rotura. B. La PCR en estas lesiones se observó en áreas angiogénicas donde se ve un elevado número de microvasos de nueva formación. C. Presencia de PCR en áreas con un elevado contenido en células inflamatorias infiltradas. D, E, F. Las lesiones más tempranas (tipo I-II) no mostraron tinción para PCR.
En este estudio se ha demostrado, mediante reacción en cadena de la polimerasa a tiempo real e inmunohistoquímica, que las placas de carótida UNC contienen unos valores de ARN mensajero y proteína de PCR mucho más elevados que las lesiones UC o las lesiones F. Además, este estudio demuestra que la expresión de PCR está ligada a la progresión de las lesiones ateroscleróticas de carótida, ya que la detección de esta proteína en estas lesiones aparece en estados moderados y avanzados de aterosclerosis y, en cambio, es ausente en los estadios más tempranos de aterosclerosis carotídea y en arteria sana.
La PCR se localiza frecuentemente en lesiones ateroscleróticas de humanos y de modelos animales, aunque su origen y el significado que esto comporta en la enfermedad no están completamente elucidados. En humanos, se conoce poco acerca de la expresión de PCR en el tejido vascular26,27,32–34. Yasojima et al26 describieron por primera vez la expresión de PCR en tejido vascular humano, en la íntima engrosada de lesiones de aorta media, colocalizada con CML y macrófagos. Otros estudios han encontrado expresión de PCR en arterias coronarias humanas32, arterias femorales33 y en áreas activas de lesiones ateroscleróticas (tipos IV y V) de arterias coronarias medias, principalmente en CML que se encontraban en la íntima de estas arterias27. Sattler et al34 describieron una expresión importante de marcadores de inflamación, incluidos el factor nuclear-κB y la PCR, en áreas ricas en contenido celular de placas ateroscleróticas de carótida, especialmente en los codos de lesiones ateroscleróticas.
Mediante este estudio, hemos observado un aumento de tinción mediante el uso de anticuerpos contra PCR en las lesiones UNC, comparado con las lesiones UC o F, donde la tinción observada fue mucho más débil, e incluso ausente en algunas lesiones. Además, en las arterias carótidas sanas usadas como grupo control, no se encontró tinción para la PCR. En nuestras lesiones ateroscleróticas de carótida, observamos que la PCR hallada en la placa UNC se localizó principalmente en la capa neoíntima en áreas enriquecidas con un elevado componente en células inflamatorias. Además, se observó tinción de la PCR en áreas de angiogenia que mostraban un número elevado de microvasos de nueva formación, tanto en células endoteliales como en las células inflamatorias que se han infiltrado en estas áreas. Los valores de ARN mensajero analizados mediante reacción en cadena de la polimerasa a tiempo real mostraron el mismo patrón de expresión que los valores de PCR en placa, observados mediante inmunohistoquímica. De esta forma, las lesiones UNC que contienen un número elevado de regiones ricas en componente celular, ya que muestran un elevado número de células inflamatorias y células endoteliales que se encuentran formando nuevos vasos en zonas angiogénicas, contenían un aumento significativo de los valores de ARN mensajero, comparado con las lesiones UC o F. Por otro lado, el análisis de la presencia de PCR en lesiones de tipo III-V también demostró localización de esta proteína en áreas de inflamación y angiogenia cercanas al núcleo lipídico y en la cubierta fibrosa fina, propensa a la rotura. En cambio, en las lesiones ateroscleróticas más tempranas (tipo I-II), y en las arterias carótidas sanas usadas como grupo control, no se observó tinción para PCR o la tinción fue muy tenue. Por lo tanto, la expresión de esta proteína aparece en lesiones que se encuentran en estados más vulnerables, próximas a la rotura de la cubierta fibrosa. Este aumento de la expresión de PCR en la etapa de vulnerabilidad de la lesión carotídea respecto a las lesiones tempranas o arteria carótida sana, indica la posible implicación de esta proteína en la progresión de la placa aterosclerótica hacia estados más avanzados, con un riesgo elevado de producir episodios cerebrovasculares. La PCR que se encuentra en estas lesiones podría contribuir a su desestabilización, ya que varios estudios han demostrado un papel proaterogénico de esta proteína. Estos resultados concuerdan con los resultados de otro grupo, que demuestran una asociación entre los valores de expresión de PCR en lesiones coronarias y las características histológicas que describen a las lesiones vulnerables35. Además, se ha demostrado que la PCR induce la producción de metaloproteinasa-1 en monocitos36, y estas metaloproteasas están implicadas en la rotura de la cubierta fibrosa, con lo que puede desencadenarse un proceso sintomatológico.
Nuestro estudio indica que la PCR no está relacionada sólo con el proceso inflamatorio, sino que también parece ejercer un papel en el mecanismo de angiogenia. Se ha descrito que la PCR induce la proliferación de CML y de células endoteliales37. Por lo tanto, la PCR producida por las células inflamatorias infiltradas (monocitos y linfocitos), que se encuentran en lesiones ateroscleróticas activas, podrían contribuir al aumento del número de neovasos observados en nuestras lesiones, y podrían asociarse con un aumento del riesgo de hemorragia intraplaca.
En resumen, la expresión de la PCR en las lesiones ateroscleróticas de carótida aparece en estadios medios y avanzados de la progresión. El papel que ejerce la PCR en las lesiones ateroscleróticas no está relacionado sólo con la modulación del proceso inflamatorio, sino que también podría regular el desarrollo y el remodelado de las lesiones ateroscleróticas que finaliza en la rotura de la placa38. Aunque la medición de los valores de ARN mensajero podría ser importante en la identificación de pacientes con lesiones vulnerables, las técnicas actuales no permiten la determinación in situ de la PCR. Por lo tanto, se requieren nuevos estudios que permitan confirmar que la respuesta de inflamación local y las transformaciones hemorrágicas van seguidas de complicaciones vasculares de los pacientes.