Diferentes estudios epidemiológicos han sugerido que la Lp(a) puede ser un factor de riesgo especialmente en pacientes con hipercolesterolemia.
MétodosUn total de 909 sujetos fueron seleccionados para este estudio, de los cuales 307 fueron diagnosticados de hipercolesterolemia familiar dependiente del LDLR o APOB (HF+), 291 de hiperlipidemia familiar combinada (HFC) y 311 de hipercolesterolemias primarias no dependientes del LDLR ni APOB (HF–). Se estudiaron los principales factores de riesgo, consumo de estatinas, lípidos plasmáticos, Lp(a), HbA1c y proteína C reactiva (PCR). En todos ellos medimos el grosor íntima-media (GIM) de la carótida común y bulbo en ambos lados.
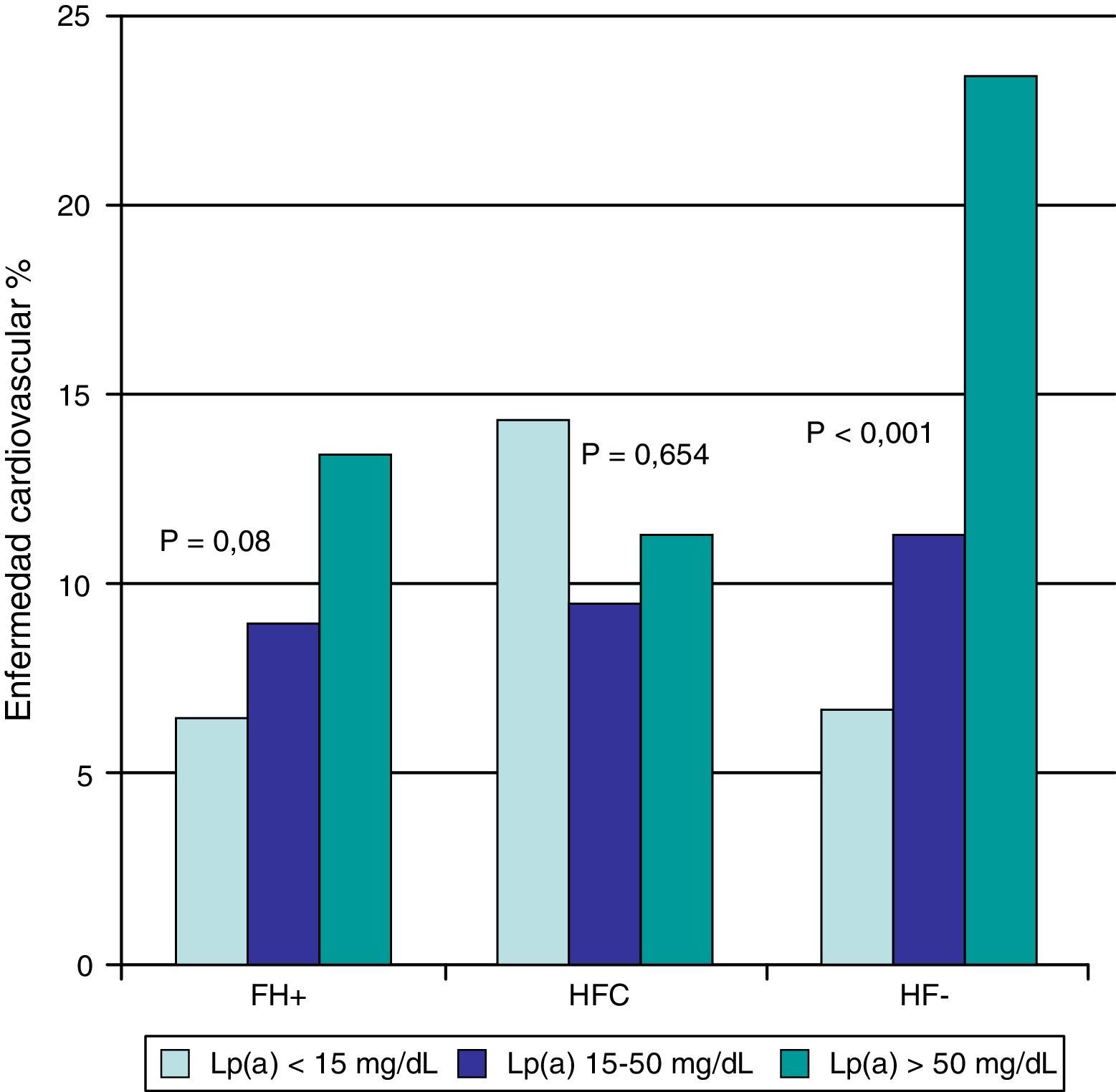
ResultadosLos valores de Lp(a) fueron de 21,9mg/dl (9,24-50,5) en sujetos HF+, 22,4mg/dl (6,56-51,6) en sujetos con HFC y 32,7mg/dl (14,6-71,5) en sujetos con HF– (p<0,001). El análisis de regresión mostró que la concentración de Lp(a) se asoció de forma independiente con el GIM únicamente en los sujetos del grupo HF–. La enfermedad cardiovascular fue más frecuente en sujetos con Lp(a) >50mg/dl (17,7%) que en los sujetos con concentraciones <15mg/dl (9,6%) y entre 15-50mg/dl (10,1%), y se concentró fundamentalmente en el grupo de sujetos HF– (6,7, 11,3, y 23,4% para los grupos de Lp[a] <15mg/dl, 15-50mg/dl, y >50mg/dl, respectivamente).
ConclusionesLa Lp(a) se asocia al desarrollo de arteriosclerosis especialmente en sujetos con HF– (no dependientes del LDLR ni APOB) y concentraciones de Lp(a) >50mg/dl.
Several studies have suggested that Lp(a) could be a risk factor mainly in hypercholesterolemic patients.
MethodsA total of 909 individuals were selected for this study. 307 were diagnosed of familiar hypercholesterolemia with a pathogenic mutation in LDLR or APOB genes (FH+), 291 of familiar combined hyperlipidemia (FCH) and 311 of familial hypercholesterolemia without a pathogenic mutation in LDLR nor APOB genes (FH-). Main risk factor were studied, included statin treatment. Plasma lipids, Lp(a), HbA1c and C-reactive protein. Intima-media thickness (IMT) of common and bulb carotid in both sides were measured in all subjects.
ResultsLp(a) values (median, interquartile range) were 21.9mg/dL (9.24-50.5) in FH+, 22.4mg/dL (6.56-51.6) in FCH and 32.7 (14.6-71.5) in FH- (P<.001). Regression analysis including age, gender, HDL cholesterol, LDL cholesterol corrected for Lp(a), Lp(a), C-reactive protein, packs of cigarettes/day per year, systolic blood pressure and glucose as independent variables, demonstrate that Lp(a) was associated with carotid IMT in FH- subjects. Cardiovascular disease was more frequent in subjects with Lp(a) >50mg/dL (17.9%) than in subjects with Lp(a) <15mg/dL (9.6%), and between 15-50mg/dL (10.1%), and it was concentrated mostly in FH-group (6.7, 11.3, and 23.4% for the groups of Lp(a) <15mg/dL 15-50mg/dL, and >50mg/dL, respectively).
ConclusionsOur results indicate that Lp(a) is associated with atherosclerosis burden especially in subjects with FH- and concentrations of Lp(a)>50mg/dL.
La lipoproteína(a) —Lp(a)— es una partícula lipoproteica presente en el plasma humano que presenta una gran similitud a las lipoproteínas de baja densidad (LDL). La diferencia fundamental con la LDL es la presencia de una molécula adicional, la apolipoproteína(a) —apo(a)— que se encuentra unida covalentemente por medio de enlaces disulfuro a la apo B de las LDL1. La función de la Lp(a) es desconocida, pero parece intervenir en la formación de placas de ateroma y en el proceso de formación del trombo, ya que está presente en todas las fases de la placa de ateroma2. El mecanismo de su aterogenicidad sigue sin estar demostrado y pudiera estar relacionado con su semejanza con las partículas LDL, con su capacidad de promover la inflamación por su alto contenido en fosfolípidos oxidados, o con su potencial capacidad antifibrinolítica debido a la homología de la apo(a) con el plasminógeno3,4.
En los últimos años varios estudios prospectivos de base poblacional han demostrado que la concentración plasmática de Lp(a) se asocia positivamente con el desarrollo de enfermedad coronaria e ictus de forma independiente de los principales factores de riesgo cardiovascular5. En un metaanálisis reciente, que incluyó 36 estudios y más de 125.000 sujetos de población general, cada incremento de una desviación estándar en la concentración plasmática de Lp(a) se acompañó de un aumento de un 16% en el riesgo de enfermedad cardiovascular6. Sin embargo la asociación no es lineal, sino con un efecto mayor cuando las concentraciones de colesterol no-HDL son elevadas y las cifras de Lp(a) son superiores a 50mg/dl6. A pesar de esta asociación las principales recomendaciones internacionales para el tratamiento de la hipercolesterolemia en la población general no recomiendan determinación sistemática de Lp(a) en la práctica clínica7,8.
En contraposición a población general, las principales guías clínicas internacionales para el manejo clínico de la hipercolesterolemia familiar (HF)9–12 recomiendan la cuantificación de Lp(a) en los sujetos con HF, con el objetivo de estratificar el riesgo cardiovascular y establecer objetivos terapéuticos diferenciales con concentraciones de Lp(a) por encima de 50-60mg/dl. Sin embargo, los estudios que señalan la hiper Lp(a) como factor independiente de riesgo en la HF son escasos13, con resultados contradictorios, algunos con relación positiva14–16, pero otros sin encontrar asociación17–19, en su mayor parte sin diagnóstico genético de la enfermedad14,15,17,18 y sin analizar a los diferentes tipos de hipercolesterolemias primarias, incluida la hiperlipidemia familiar combinada (HFC), que ha sido analizada de forma independiente en un estudio20. Por tanto, el objetivo de este estudio fue establecer el papel de la concentración sérica de Lp(a) con la arteriosclerosis clínica y subclínica medida a través de ecografía carotídea, en sujetos con diferentes formas de hipercolesterolemias primarias.
Material y métodosSujetos del estudioA todos los sujetos adultos entre 18 y 80 años de edad atendidos en la Unidad de Lípidos del Hospital Universitario Miguel Servet de Zaragoza desde enero de 2008 hasta enero de 2013, con el diagnóstico clínico de HF o HFC, se les ofreció participar en un proyecto de investigación que incluyó un amplio estudio clínico, genético, ecográfico vascular y metabólico. El protocolo seguido ha sido previamente publicado21, y todos los participantes firmaron un consentimiento informado que fue aprobado previamente por el comité ético local (Comité Ético de Investigación Clínica de Aragón).
El diagnóstico de HF se realizó cuando las concentraciones de colesterol LDL se encontraban por encima del percentil 95 de la población española, ajustado por edad y sexo22, niveles de triglicéridos por debajo de 200mg/dl, transmisión familiar vertical de la hipercolesterolemia y concentraciones de colesterol LDL por encima del percentil 95 en al menos un familiar de primer grado. La HFC se definió cuando las concentraciones de colesterol y triglicéridos se encontraban por encima del percentil 90, la concentración de apo B por encima de 120mg/dl, transmisión vertical de la hiperlipidemia, y al menos un familiar de primer grado con concentraciones de colesterol total o triglicéridos por encima del percentil 9021.
Determinaciones clínicas y bioquímicasSe elaboró una historia clínica completa que incluyó: edad, antecedentes personales y familiares de enfermedad cardiovascular y sus diferentes factores de riesgo, consumo de tabaco, alcohol, nivel de actividad física y consumo de fármacos. La exploración clínica incluyó: presión arterial sistólica y diastólica, peso, talla, perímetro de cintura, presencia de arco corneal, xantomas tendinosos y xantelasmas. Se calcularon el índice de masa corporal (IMC), consumo total de tabaco (número de paquetes de cigarrillos al día×número de años fumando), tratamiento con estatinas (años de tratamiento×dosis de estatinas equivalentes en mg de simvastatina), colesterol LDL por la fórmula de Friedewald y colesterol LDL corregido por Lp(a) según la formula de Dahlen: colesterol LDL–Lp(a)×0,323.
Se extrajo una muestra en ayunas, sin tratamiento hipolipidemiante en al menos las últimas 4 semanas, analizándose, entre otras, las concentraciones de: colesterol total, colesterol HDL, triglicéridos, apo A1, apo B, Lp(a), HbA1c, glucosa, TSH y proteína C reactiva (PCR). La Lp(a) en suero se determinó mediante un método nefelométrico automatizado (Beckmann Coulter, EE. UU.) bastante insensible a las zonas repetitivas de apo(a). El colesterol LDL se calculó por la formula de Friedewald cuando los triglicéridos fueron inferiores a 400mg/dl. Las determinaciones analíticas fueron realizadas según el protocolo previamente descrito21.
Análisis genéticoEn todos los sujetos con diagnóstico clínico de HF, y en aquellos sujetos con el diagnóstico de HFC y concentraciones de colesterol total >335mg/dl o apoB >185mg/dl24 se estudiaron los genes LDLR y APOB con la plataforma Lipochip®25. Aquellos sujetos con mutaciones patogénicas en LDLR o APOB fueron diagnosticados de HF+; los pacientes con diagnóstico clínico de HF sin mutaciones patogénicas en LDLR ni APOB fueron diagnosticados de HF–; los sujetos con diagnóstico clínico de HFC y mutación en LDLR o APOB fueron reclasificados como HF+; y por último, aquellos pacientes con diagnóstico clínico de HFC y sin mutaciones funcionales en LDLR ni APOB se les mantuvo el diagnóstico de HFC.
Cuantificación del grosor íntima-media carotídeoEl estudio ultrasonográfico carotídeo se realizó con el ecógrafo Acuson Sequoia (Siemens®) a través de una sonda 7Mhz. Por cada sujeto se adquirió una imagen por territorio (3 correspondientes al lado derecho y 3 al izquierdo). Posteriormente se obtuvieron, a través de la lectura de cada imagen, los valores máximo y medio del grosor íntima-media (GIM) de cada territorio (carótida común, bifurcación o bulbo y carótida interna). Todas las lecturas fueron medidas por la misma persona con el software Exetrack® creado en Amsterdam Medical Center21.
Análisis estadísticoFue llevado a cabo con el software SPSS versión 15.0 (Chicago, Illinois, EE. UU.) usando un nivel de significación de p<0,05. Los datos están expresados como medias±desviación estándar (DS) para las variables numéricas con una distribución normal y medianas (percentil 25-percentil 75) para variables con una distribución no normal. Las variables categóricas fueron comparadas utilizando la prueba de Chi-cuadrado. Las pruebas de ANOVA y Kruskal-Wallis fueron realizadas para comparar múltiples variables independientes. El estudio de las variables se asoció independientemente con GIM máximo de carótida común y bulbo, y se realizó a través de una regresión lineal múltiple introduciendo como variables independientes: sexo, edad, paquetes/días por año, colesterol LDL, colesterol HDL, Lp(a), hipertensión, presión sistólica y dosis de estatinas por año.
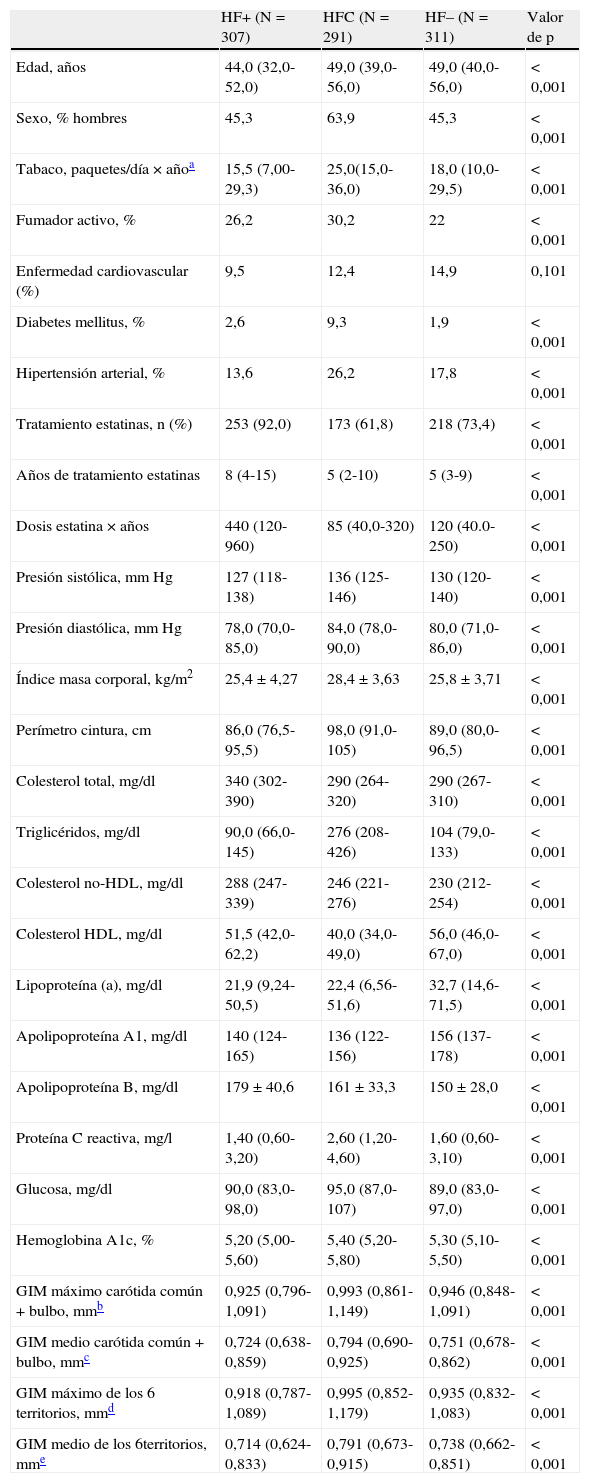
ResultadosCaracterísticas de los sujetosEl estudio incluye 909 sujetos distribuidos en los siguientes grupos diagnósticos: 307 pacientes HF+, 311 HF– y 291 HFC. Las principales características de los 3 grupos se describen en la tabla 1. Todos los sujetos del estudio se encuentran en un rango de edades semejante, siendo los sujetos con HF+ unos 5 años más jóvenes que el resto. En el grupo HFC hay un porcentaje mayor de hombres (63,9%) que en los grupos HF+ y HF– (45,3% en ambos). Una mayor prevalencia de tabaquismo activo (30,2%), hipertensión arterial (26,2%) y diabetes mellitus (9,3%) se encuentra en los sujetos con HFC. El grupo de HF+ presenta un mayor consumo de estatinas y mayores concentraciones de colesterol total, colesterol no-HDL y apo B que los otros grupos. Los sujetos con HFC tuvieron un IMC mayor, concentraciones más altas de triglicéridos, glucosa, PCR y HbA1c y más bajas de colesterol HDL que los sujetos HF. Los sujetos con HF– tuvieron concentraciones más elevadas de colesterol HDL y Lp(a) que los otros 2 grupos de hipercolesterolemia, y una tendencia no significativa a mayor presencia de enfermedad cardiovascular. En relación con los valores del GIM los sujetos con HFC tuvieron valores más altos que los sujetos HF–, y estos a su vez más altos que los sujetos HF+ (tabla 1).
Características clínicas, analíticas y ecográficas de los sujetos del estudio
| HF+ (N=307) | HFC (N=291) | HF– (N=311) | Valor de p | |
| Edad, años | 44,0 (32,0-52,0) | 49,0 (39,0-56,0) | 49,0 (40,0-56,0) | <0,001 |
| Sexo, % hombres | 45,3 | 63,9 | 45,3 | <0,001 |
| Tabaco, paquetes/día×añoa | 15,5 (7,00-29,3) | 25,0(15,0-36,0) | 18,0 (10,0-29,5) | <0,001 |
| Fumador activo, % | 26,2 | 30,2 | 22 | <0,001 |
| Enfermedad cardiovascular (%) | 9,5 | 12,4 | 14,9 | 0,101 |
| Diabetes mellitus, % | 2,6 | 9,3 | 1,9 | <0,001 |
| Hipertensión arterial, % | 13,6 | 26,2 | 17,8 | <0,001 |
| Tratamiento estatinas, n (%) | 253 (92,0) | 173 (61,8) | 218 (73,4) | <0,001 |
| Años de tratamiento estatinas | 8 (4-15) | 5 (2-10) | 5 (3-9) | <0,001 |
| Dosis estatina×años | 440 (120-960) | 85 (40,0-320) | 120 (40.0-250) | <0,001 |
| Presión sistólica, mmHg | 127 (118-138) | 136 (125-146) | 130 (120-140) | <0,001 |
| Presión diastólica, mmHg | 78,0 (70,0-85,0) | 84,0 (78,0-90,0) | 80,0 (71,0-86,0) | <0,001 |
| Índice masa corporal, kg/m2 | 25,4±4,27 | 28,4±3,63 | 25,8±3,71 | <0,001 |
| Perímetro cintura, cm | 86,0 (76,5-95,5) | 98,0 (91,0-105) | 89,0 (80,0-96,5) | <0,001 |
| Colesterol total, mg/dl | 340 (302-390) | 290 (264-320) | 290 (267-310) | <0,001 |
| Triglicéridos, mg/dl | 90,0 (66,0-145) | 276 (208-426) | 104 (79,0-133) | <0,001 |
| Colesterol no-HDL, mg/dl | 288 (247-339) | 246 (221-276) | 230 (212-254) | <0,001 |
| Colesterol HDL, mg/dl | 51,5 (42,0-62,2) | 40,0 (34,0-49,0) | 56,0 (46,0-67,0) | <0,001 |
| Lipoproteína (a), mg/dl | 21,9 (9,24-50,5) | 22,4 (6,56-51,6) | 32,7 (14,6-71,5) | <0,001 |
| Apolipoproteína A1, mg/dl | 140 (124-165) | 136 (122-156) | 156 (137-178) | <0,001 |
| Apolipoproteína B, mg/dl | 179±40,6 | 161±33,3 | 150±28,0 | <0,001 |
| Proteína C reactiva, mg/l | 1,40 (0,60-3,20) | 2,60 (1,20-4,60) | 1,60 (0,60-3,10) | <0,001 |
| Glucosa, mg/dl | 90,0 (83,0-98,0) | 95,0 (87,0-107) | 89,0 (83,0-97,0) | <0,001 |
| Hemoglobina A1c, % | 5,20 (5,00-5,60) | 5,40 (5,20-5,80) | 5,30 (5,10-5,50) | <0,001 |
| GIM máximo carótida común+bulbo, mmb | 0,925 (0,796-1,091) | 0,993 (0,861-1,149) | 0,946 (0,848-1,091) | <0,001 |
| GIM medio carótida común+bulbo, mmc | 0,724 (0,638-0,859) | 0,794 (0,690-0,925) | 0,751 (0,678-0,862) | <0,001 |
| GIM máximo de los 6 territorios, mmd | 0,918 (0,787-1,089) | 0,995 (0,852-1,179) | 0,935 (0,832-1,083) | <0,001 |
| GIM medio de los 6territorios, mme | 0,714 (0,624-0,833) | 0,791 (0,673-0,915) | 0,738 (0,662-0,851) | <0,001 |
Las variables están expresadas como media±desviación estándar, o mediana (percentil 25-percentil 75) para variables sin distribución normal. Diferencias significativas calculadas mediante el test de ANOVA, H de Kruskal-Wallis, o Chi-cuadrado según aplique.
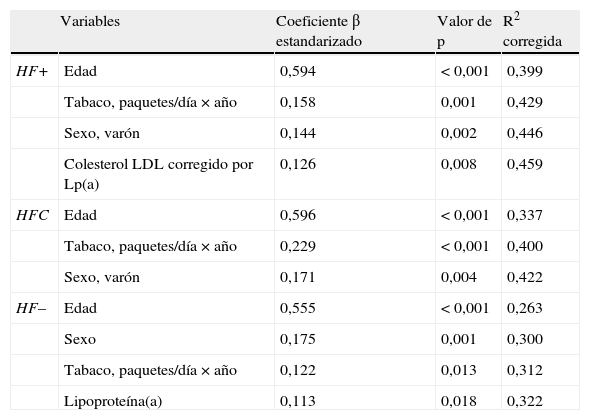
El análisis de regresión mostró para los valores máximos y medios del GIM que la edad, el ser varón y el consumo de tabaco eran los factores independientes más importantes para los 3 grupos. Sin embargo, las variables lipídicas tuvieron un comportamiento diferente por dislipidemia. El colesterol LDL corregido para Lp(a) se asoció de forma independiente con el GIM solo en sujetos HF+, la concentración de Lp(a) únicamente en sujetos con HF– y las variables lipídicas no mostraron asociación independiente significativa con el GIM en sujetos con HFC. En la tabla 2 se presentan los resultados para el GIM medio de carótida común y bulbo para los 3 tipos de hipercolesterolemia.
Análisis de regresión múltiple de las variables asociadas a GIM medio de carótida común y bulbo en cada dislipidemia*
| Variables | Coeficiente β estandarizado | Valor de p | R2 corregida | |
| HF+ | Edad | 0,594 | <0,001 | 0,399 |
| Tabaco, paquetes/día×año | 0,158 | 0,001 | 0,429 | |
| Sexo, varón | 0,144 | 0,002 | 0,446 | |
| Colesterol LDL corregido por Lp(a) | 0,126 | 0,008 | 0,459 | |
| HFC | Edad | 0,596 | <0,001 | 0,337 |
| Tabaco, paquetes/día×año | 0,229 | <0,001 | 0,400 | |
| Sexo, varón | 0,171 | 0,004 | 0,422 | |
| HF– | Edad | 0,555 | <0,001 | 0,263 |
| Sexo | 0,175 | 0,001 | 0,300 | |
| Tabaco, paquetes/día×año | 0,122 | 0,013 | 0,312 | |
| Lipoproteína(a) | 0,113 | 0,018 | 0,322 |
Las variables introducidas en el modelo fueron: sexo, edad, paquetes/día por año, colesterol LDL corregido por Lp(a), colesterol HDL, Lp(a), hipertensión, diabetes, presión sistólica y dosis de estatina×años de tratamiento con estatinas.
En la tabla 3 se describen las características clínicas y bioquímicas de los sujetos del estudio divididos por la concentración de Lp(a). Aquellos sujetos con Lp(a) >50mg/dl tuvieron una prevalencia de enfermedad cardiovascular prácticamente doble (17,9 vs 9,6 y 10,1%) que los sujetos con concentraciones <15mg/dl y entre 15-50mg/dl respectivamente, sin diferencias clínicamente relevantes con respecto al resto de variables analizadas. Por el contrario, el grupo de sujetos con concentraciones de Lp(a) más bajas (<15mg/dl) presentaron concentraciones significativamente más altas de triglicéridos y más bajas de colesterol total, colesterol HDL y apo A1 que los otros grupos. Los sujetos con concentraciones>50mg/dl de Lp(a) supusieron hasta el 39,1% del total de sujetos HF–, y solo el 25% de los sujetos HF+ e HFC (tabla 3).
Características clínicas y analíticas de los sujetos en función de los grupos de Lp(a)
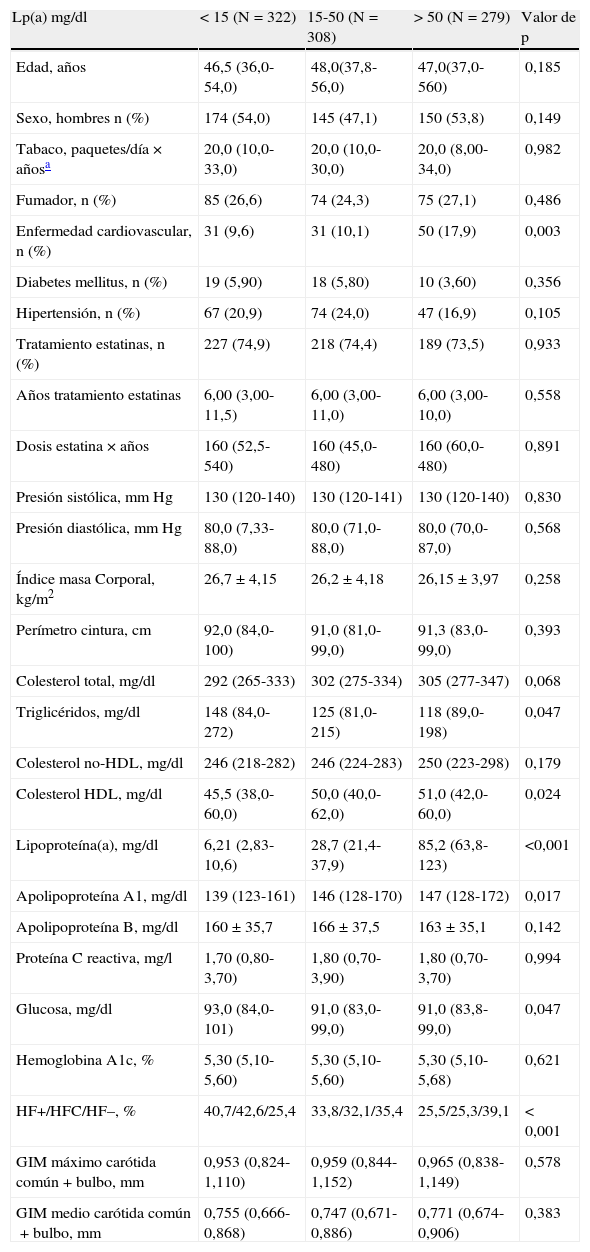
| Lp(a) mg/dl | <15 (N=322) | 15-50 (N=308) | >50 (N=279) | Valor de p |
| Edad, años | 46,5 (36,0-54,0) | 48,0(37,8-56,0) | 47,0(37,0-560) | 0,185 |
| Sexo, hombres n (%) | 174 (54,0) | 145 (47,1) | 150 (53,8) | 0,149 |
| Tabaco, paquetes/día×añosa | 20,0 (10,0-33,0) | 20,0 (10,0-30,0) | 20,0 (8,00-34,0) | 0,982 |
| Fumador, n (%) | 85 (26,6) | 74 (24,3) | 75 (27,1) | 0,486 |
| Enfermedad cardiovascular, n (%) | 31 (9,6) | 31 (10,1) | 50 (17,9) | 0,003 |
| Diabetes mellitus, n (%) | 19 (5,90) | 18 (5,80) | 10 (3,60) | 0,356 |
| Hipertensión, n (%) | 67 (20,9) | 74 (24,0) | 47 (16,9) | 0,105 |
| Tratamiento estatinas, n (%) | 227 (74,9) | 218 (74,4) | 189 (73,5) | 0,933 |
| Años tratamiento estatinas | 6,00 (3,00-11,5) | 6,00 (3,00-11,0) | 6,00 (3,00-10,0) | 0,558 |
| Dosis estatina×años | 160 (52,5-540) | 160 (45,0-480) | 160 (60,0-480) | 0,891 |
| Presión sistólica, mmHg | 130 (120-140) | 130 (120-141) | 130 (120-140) | 0,830 |
| Presión diastólica, mmHg | 80,0 (7,33-88,0) | 80,0 (71,0-88,0) | 80,0 (70,0-87,0) | 0,568 |
| Índice masa Corporal, kg/m2 | 26,7±4,15 | 26,2±4,18 | 26,15±3,97 | 0,258 |
| Perímetro cintura, cm | 92,0 (84,0-100) | 91,0 (81,0-99,0) | 91,3 (83,0-99,0) | 0,393 |
| Colesterol total, mg/dl | 292 (265-333) | 302 (275-334) | 305 (277-347) | 0,068 |
| Triglicéridos, mg/dl | 148 (84,0-272) | 125 (81,0-215) | 118 (89,0-198) | 0,047 |
| Colesterol no-HDL, mg/dl | 246 (218-282) | 246 (224-283) | 250 (223-298) | 0,179 |
| Colesterol HDL, mg/dl | 45,5 (38,0-60,0) | 50,0 (40,0-62,0) | 51,0 (42,0-60,0) | 0,024 |
| Lipoproteína(a), mg/dl | 6,21 (2,83-10,6) | 28,7 (21,4-37,9) | 85,2 (63,8-123) | <0,001 |
| Apolipoproteína A1, mg/dl | 139 (123-161) | 146 (128-170) | 147 (128-172) | 0,017 |
| Apolipoproteína B, mg/dl | 160±35,7 | 166±37,5 | 163±35,1 | 0,142 |
| Proteína C reactiva, mg/l | 1,70 (0,80-3,70) | 1,80 (0,70-3,90) | 1,80 (0,70-3,70) | 0,994 |
| Glucosa, mg/dl | 93,0 (84,0-101) | 91,0 (83,0-99,0) | 91,0 (83,8-99,0) | 0,047 |
| Hemoglobina A1c, % | 5,30 (5,10-5,60) | 5,30 (5,10-5,60) | 5,30 (5,10-5,68) | 0,621 |
| HF+/HFC/HF–, % | 40,7/42,6/25,4 | 33,8/32,1/35,4 | 25,5/25,3/39,1 | <0,001 |
| GIM máximo carótida común+bulbo,mm | 0,953 (0,824-1,110) | 0,959 (0,844-1,152) | 0,965 (0,838-1,149) | 0,578 |
| GIM medio carótida común+bulbo,mm | 0,755 (0,666-0,868) | 0,747 (0,671-0,886) | 0,771 (0,674-0,906) | 0,383 |
Las variables están expresadas como media±desviación estándar o mediana (percentil 25-percentil 75) o porcentaje. Diferencias significativas calculadas mediante el test de ANOVA o H de Kruskal-Wallis, o Chi-cuadrado, según proceda.
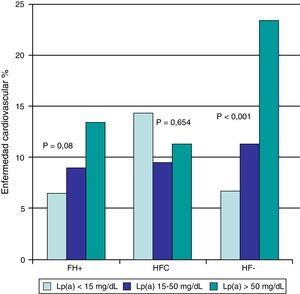
Hubo una tendencia, que no alcanzó significación estadística, a mayor enfermedad cardiovascular en los sujetos HF+ en sujetos con Lp(a) >50mg/dl (fig. 1). La concentración de Lp(a) no parece guardar relación con la enfermedad cardiovascular en HFC, y sin embargo hubo diferencias altamente significativas (p<0,001) en sujetos con diagnóstico de HF–, con porcentajes de enfermedad cardiovascular del 6,7, 11,3 y 23,4% para los grupos de Lp(a) <15mg/dl, 15-50mg/dl y >50mg/dl, respectivamente (fig. 1).
Porcentaje de sujetos con HF+, HFC e HF- afectos de enfermedad cardiovascular de acuerdo a su concentración de Lp(a).
HF+: hipercolesterolemia familiar con mutación patogénica en LDLR o APOB; HF–: hipercolesterolemia familiar sin mutación patogénica en LDLR ni APOB; HFC: hiperlipidemia familiar combinada; Lp(a): lipoproteína(a); NS: no significativo.
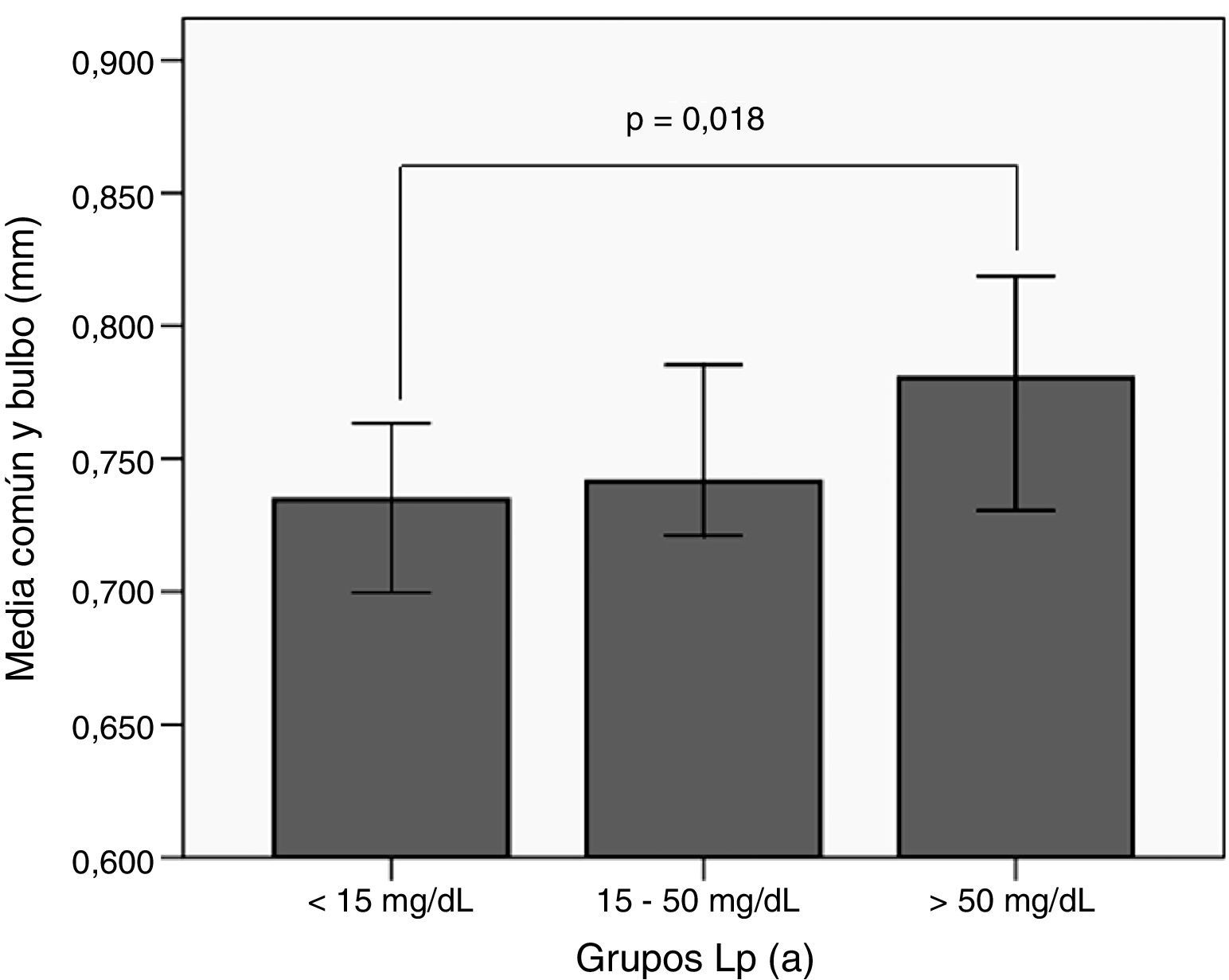
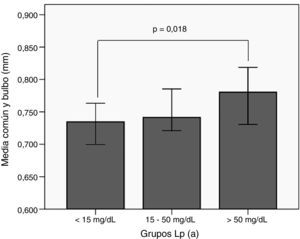
Al comparar el GIM medio de la carótida común y bulbo en función de grupos de Lp(a) no se encontró ninguna diferencia significativa (tabla 3). Sin embargo, como ocurrió con la enfermedad cardiovascular, cuando este mismo análisis se realizó dividiendo a los sujetos por el tipo de hipercolesterolemia, las diferencias fueron significativas únicamente para los sujetos HF– con mayor GIM en los sujetos con Lp(a) >50mg/dl, con respecto a los HF– y Lp(a)<15mg/dl (fig. 2).
GIMc medio de carótida común y bulbo en función de la concentración de Lp(a) en pacientes con HF–.GIMc: Grosor íntima-media carotídeo; HF–: hipercolesterolemia familiar sin mutación patogénica en LDLR ni APOB; Lp(a): lipoproteína(a). Diferencias significativas entre el primer y tercer grupo calculadas mediante el test de U de Mann-Whitney.
El presente trabajo recoge las características clínicas de un gran número de sujetos con los 3 tipos más importantes de hipercolesterolemias primarias: la HF+, HF– e HFC, y además supone el primer estudio donde se analiza el efecto diferencial de la concentración de Lp(a) en estas 3 hipercolesterolemias. Junto al elevado número de sujetos, otras fortalezas del estudio son la caracterización genética de las hipercolesterolemias y que todos los pacientes proceden de una única unidad de lípidos, lo que confiere una mayor homogeneidad en los procedimientos clínicos y analíticos de la muestra. Nuestros resultados confirman que la concentración de Lp(a) se encuentra elevada especialmente en las HF de origen desconocido, y de esta forma contribuye a la elevación del colesterol LDL en esta población26. La partícula Lp(a) contiene una cantidad variable de colesterol consecuencia de la heterogeneidad de la apo(a), por lo que el contenido en colesterol de las partículas Lp(a) varía de unas a otras27. Nosotros hemos estimado el colesterol de la Lp(a) por la fórmula de Dahlen, que ha sido plenamente aceptada por otros estudios y confirmada recientemente28.
Aunque la elevación del colesterol LDL puede justificarse en un porcentaje de sujetos con HF– por el colesterol transportado en las partículas Lp(a), en la mayor parte de casos la hiperLp(a) contribuye, pero no llega a explicar de forma completa el origen de la hipercolesterolemia. Recientemente, Talmud et al. han sugerido que parte de las HF– son realmente formas poligénicas, ya que asociaron con mayor frecuencia múltiples alelos con efecto sobre el colesterol LDL en la población29. Aunque dicho trabajo tiene muchas limitaciones, especialmente la definición de HF, parece claro que la diferencia entre HF– e hipercolesterolemia poligénica en ocasiones no es fácil, como hemos tenido la oportunidad de discutir30. Ciertamente, algunos casos diagnosticados de HF– son de origen poligénico, y entre los genes causales se encuentra el gen que codifica apo(a).
La información más importante de nuestro trabajo es la asociación de la concentración de Lp(a) con la enfermedad cardiovascular en las hipercolesterolemias primarias. Sin embargo, esta contribución es mucho más evidente en sujetos HF–, fundamentalmente porque son ellos los que acumulan la mayor parte de sujetos con hiperLp(a), y ayudan a explicar las diferencias encontradas en estudios previos14–19. Nuestro datos apoyan las recientes recomendaciones de la Sociedad Europea de Arteriosclerosis que considera un riesgo cardiovascular en la HF la presencia de una Lp(a)>50mg/dl12. En nuestro estudio, a partir de esa concentración, la contribución como factor de riesgo independiente es mucho más clara.
Un dato consistente en nuestro estudio es la asociación inversa entre Lp(a) y triglicéridos, que ha sido publicada anteriormente y que no tiene una explicación fácil31. Esta asociación resulta más evidente en aquellos sujetos con concentraciones de Lp(a) muy bajas que asocian hipertrigliceridemia y colesterol HDL bajo con mayor frecuencia. Dado que la concentración de Lp(a) depende mayoritariamente de su síntesis hepática y que está determinada genéticamente32, no parece que guarde relación con una resistencia periférica a la insulina, causa principal de colesterol HDL bajo y triglicéridos altos en la población. La apo(a) también es transportada por las partículas ricas en triglicéridos, por lo que sería plausible que la apo(a) favoreciera el catabolismo de estas partículas, como se ha sugerido anteriormente31,33.
En resumen, nuestro estudio demuestra que los sujetos con HF– tienen concentraciones más altas de Lp(a) que los pacientes con HF+ e HFC, que los sujetos con hipercolesterolemia primaria y Lp(a) bajas tienen concentraciones más altas de triglicéridos y más bajas de colesterol HDL y que la concentración de Lp(a) se asocia a enfermedad cardiovascular en sujetos con hipercolesterolemias primarias, especialmente en HF–. Dado que los fármacos hipolipidemiantes eficaces en la reducción del riesgo cardiovascular no modifican la concentración de Lp(a), y que los que la reducen no han demostrado beneficio clínico relevante34, los nuevos fármacos hipolipidemiantes, fundamentalmente inhibición de CETP o PCSK935, podrán dar respuesta al potencial beneficio clínico de la reducción de Lp(a) en la enfermedad cardiovascular.
FinanciaciónTrabajo financiado con proyectos FIS PI12/01087 y RETIC RIC RD12/0042/0055 del Instituto de Salud Carlos III, Madrid,España, e INNPACTO: IPT-2011-1337-010000 del Ministerio deCiencia e Innovación de España.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Trabajo financiado con proyectos FIS PI12/01087 y RETIC RIC RD12/0042/0055 del Instituto de Salud Carlos III, Madrid, España, e INNPACTO: IPT-2011-1337-010000 del Ministerio de Ciencia e Innovación de España.