Numerosos estudios indican que el proceso de ateroesclerosis comienza en la infancia1,2, progresa lentamente en la adolescencia y posteriormente conduce al desarrollo de enfermedades cardiovasculares. La importancia de los valores sanguíneos de colesterol total (CT) y colesterol unido a lipoproteínas de baja densidad (cLDL) ha llevado a la aceptación de la hipótesis lipídica en la génesis de la ateroesclerosis, aunque ésta no excluye la existencia de otros factores de riesgo endógenos y exógenos3.
En la actualidad, se han identificado una serie de factores que pueden iniciar o contribuir al desarrollo de la arteriosclerosis, entre los que cabe destacar la lipoproteína(a) (Lp [a]).
La Lp(a) es una variante de la LDL, en la que la apolipoproteína B100 va unida mediante un puente disulfuro a la apolipoproteína a (apo[a])4,5, que presenta importantes similitudes estructurales con el plasminógeno. A partir de la presencia de LDL en la partícula de Lp(a) se ha propuesto que esta partícula podría promover la aterogénesis por mecanismos similares a la LDL. Por otro lado, la similitud entre la apo (a) y el plasminógeno sugiere que la apo (a), y por extensión la Lp(a), podría interferir con la función normal del plasminógeno, e inhibir la fibrinólisis. Estas propiedades de la Lp(a) indican que puede contribuir al desarrollo de la enfermedad aterotrombótica por dos mecanismos, el proaterogénico y el protrombótico/antifibrinolí-tico6,7.
Diversos estudios han demostrado que valores elevados de Lp(a) se asocian con un mayor riesgo de enfermedad cardiovascular y presentan un factor de riesgo independiente para esta enfermedad8-11. Las concentraciones de Lp(a) están determinadas genéticamente, y la edad (los niños más jóvenes tienden a tener valores más bajos), el sexo, la maduración sexual o los factores dietéticos influyen ligeramente.
Por otro lado, se ha establecido que la obesidad es un factor de riesgo de enfermedad cardiovascular. El índice de masa corporal (IMC) y otras medidas antropométricas están correlacionadas de forma significativa con el metabolismo de los lípidos y lipoproteínas en niños y adultos12. Sin embargo hay muy pocos estudios que relacionen el IMC u otras medidas antropométricas con los valores séricos de Lp(a).
El objetivo de nuestro estudio ha sido determinar los valores séricos de Lp(a) y su relación con variables antropométricas, factores lipídicos y trombogénicos, en la infancia.
Material y métodos
Se ha estudiado a 98 niños/as (44 niñas y 54 niños) de 6 y 7 años, procedentes de un estudio epidemiológico sobre prevalencia de hipercolesterolemia en Vizcaya, todos ellos supuestamente sanos. En todos los casos se solicitó la autorización de los padres para incluir a los niños en el estudio.
A todos los participantes se les realizó un cuestionario sobre antecedentes de enfermedad cardiovascular en padres y abuelos. Para la determinación de peso y talla, las medidas se realizaron en los niños vestidos con ropa ligera y sin zapatos. A partir de estas medidas se calculó el IMC (peso en kg/talla en m2).
A cada uno de ellos se le realizó una extracción sanguínea tras 12 h de ayuno, se centrifugaron las muestras de sangre y se obtuvieron subfracciones de suero y plasma en las cuales se determinaron los siguientes parámetros: colesterol total (CT), triglicéridos, cHDL, cLDL, Lp(a), dímero-D, fibrinógeno y el inhibidor del activador del plasminógeno (PAI-1). La Lp(a) se determinó por ELISA (TintElize® Lp[a]. Biopool), el intervalo de medición fue de 0-60 mg/dl y el coeficiente de variación (CV) interserie de 7,7% (x = 10 mg/dl) y 2,7% (x = 40 mg/dl). Para la determinación de los valores de dímero-D se utilizó un test inmunoenzimático tipo sandwich D-Dimer New (Biomerieux) por la técnica ELFA (Enzyme Linked Fluorescent Assay), con un intervalo de medición de 45-10.000 ng/ml, el CV interserie fue de 5,7% (x = 264 ng/ml) y 7,1% (x = 7.283 ng/ml). El fibrinógeno fue medido por coagulometría (Instrumental Laboratorios, IL) de acuerdo con el método de Clauss, el intervalo de medición fue de 70-700 mg/dl, el CV interserie fue de 1,31% (x = 334 mg/dl) y de 2,83% (x = 96 mg/dl). Para la determinación del PAI-1 activo en plasma se utilizó un método de bioinmunoanálisis cuantitativo (Biopool International), el intervalo de medición fue de 2-50 U/ml y el CV interserie de 16,9% (x = 2 U/ml) y 3,6% (x = 36 U/ml). El CT, los triglicéridos y la cHDL se determinaron por métodos enzimáticos de rutina (Roche Diagnóstica). El cLDL se calculó por la fórmula de Friedewald.
Análisis estadístico
Las variables paramétricas se expresaron en medias y desviaciones estándar, las no paramétricas en medias geométricas o medianas y rangos intercuartílicos (primer cuartil-tercer cuartil) debido a que la distribución de los valores presentaba una asimetría importante.
Para valorar las diferencias en los valores de factores lipídicos y trombogénicos por cuartiles de Lp(a), utilizamos el análisis de la varianza (ANOVA) para las variables paramétricas y el test de Kruskal-Wallis para las variables no paramétricas.
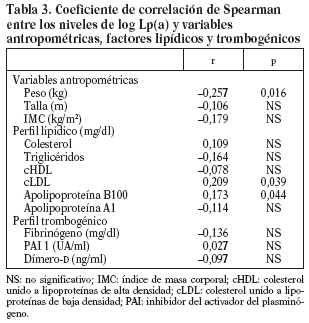
Para valorar la asociación entre los valores de Lp(a) y los diferentes parámetros estudiados utilizamos el coeficiente de correlación de Spearman.
En todos los casos se consideró significativo un valor de p < 0,05. Para el análisis estadístico de los datos se utilizó el paquete estadístico SPSS v 11.5.
Resultados
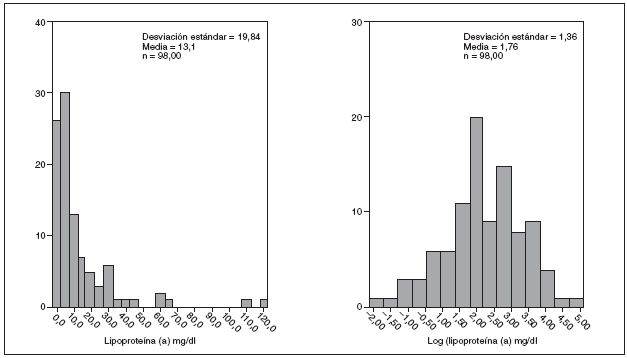
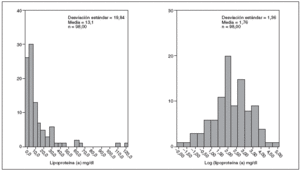
Del total de niños estudiados 54 (55,10%) eran niños y 44 (44,89%) niñas. En la figura 1 se muestra la distribución de valores de Lp(a) y log Lp(a) de los 98 niños incluidos en el estudio. El valor mínimo encontrado fue de 0,17 mg/dl y el máximo de 120 mg/dl, la mediana fue de 5,56 mg/dl (rango intercuartílico de 2,37-13,46). El 62,24% de la muestra (61 niños) presentó valores de Lp(a) inferiores a 10 mg/dl, el 28,57% (28 niños) valores entre 10-30 mg/dl y el 9,19% (9 niños) concentraciones superiores a 30 mg/dl.
Figura 1. Distribución de los valores de lipoproteína(a) y valores en logaritmos en la muestra global.
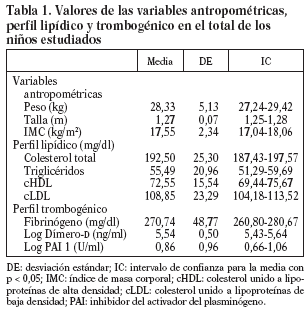
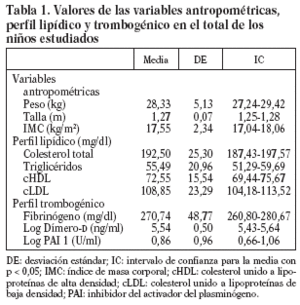
La tabla 1 recoge los valores de las variables paramétricas, del perfil lipídico (CT, cHDL, cLDL, triglicéridos) y trombogénico (fibrinógeno, dímero-D y PAI-1) en el total de la muestra estudiada; en todos ellos se incluye el intervalo de confianza para una p < 0,05.
Del total de los niños estudiados, 32 (33,67%) tenían antecedentes familiares de enfermedad cardiovascular en padres o abuelos. Los valores de Lp(a) fueron más elevados en este grupo 8,83 mg/dl (3,63-21,94) respecto al que no tenía antecedentes 5,22 mg/dl (2,17-13,37); esta diferencia no fue estadísticamente significativa.
Valores de los parámetros estudiados por cuartiles de lipoproteína(a)
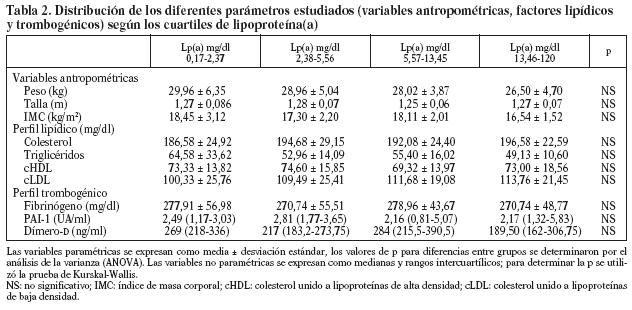
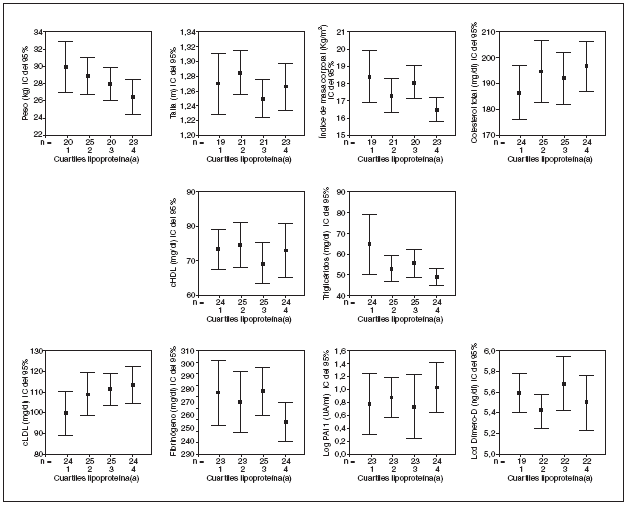
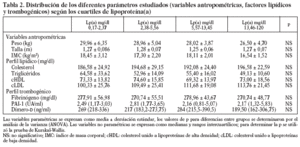
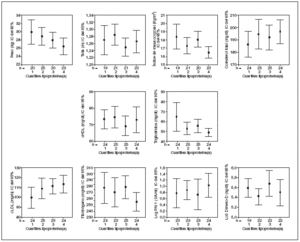
En la tabla 2, se muestra la distribución de todos los parámetros estudiados por cuartiles de Lp(a). A medida que aumentan las concentraciones de Lp(a) aumentan las de cLDL y disminuye el peso sin llegar a alcanzar significación estadística. La figura 2 muestra un diagrama de barras de error correspondiente a los datos de la tabla 2.
Figura 2. Barras de error. Valores medios e intervalos de confianza del 95% para los diferentes parámetros estudiados por cuartiles de lipoproteína(a).
Correlación entre los valores de Lp(a), variables antropométricas y factores lipídicos y trombogénicos
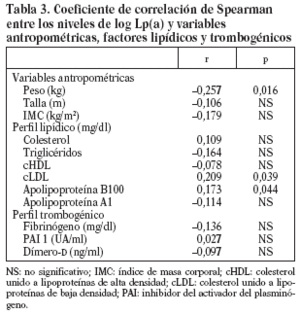
Los niveles de Lp(a) se correlacionan de forma positiva y significativa con el cLDL (0,02) y de forma negativa y significativa con el peso (0,008), sin encontrar ningún tipo de correlación con los factores trombogénicos (tabla 3).
Discusión
Las concentraciones de Lp(a) en la población infantil estudiada varían desde 0,17 a 120 mg/dl, mostrando una distribución no gaussiana con tendencia a la acumulación hacia valores inferiores de la curva de distribución, similar a la descrita por otros autores13,14.
En nuestro estudio los valores séricos de Lp(a) se correlacionaron positivamente con la cLDL y negativamente con el peso. Sorprendentemente ninguno de los factores trombogénicos se correlacionaba con los valores de Lp(a).
En diversos estudios realizados en población infantil y juvenil también se describe una correlación significativa entre los valores de Lp(a) y la cLDL13-15. Por otro lado, también se ha descrito un aumento en los valores de Lp(a) en pacientes con hipercolesterolemia. El hecho de que los valores elevados de Lp(a) se asocien con valores elevados de cLDL sugiere que el metabolismo de la LDL puede estar involucrado en la generación de Lp(a).
La obesidad es otro factor de riesgo cardiovascular significativamente asociado con los lípidos y el metabolismo lipoproteico. Las personas obesas suelen tener un metabolismo lipídico alterado y pueden desarrollar dislipemia más adelante. Aunque el IMC es un buen predictor de los valores lipídicos y lipoproteicos entre los adultos y los niños, hay pocos estudios de asociación entre el IMC u otras medidas antropométricas y los valores de Lp(a). En nuestro estudio, los niños con valores más altos de Lp(a) son los que tienen menor peso y menor IMC, y se encuentra una correlación inversa y significativa entre los valores de Lp(a) y el peso. Nain-Feng Chu et al14, en un estudio en población adolescente de 12-16 años, no encontraron ningún tipo de relación entre las variables antropométricas y los valores de Lp(a); sin embargo, Randall et al16 en un estudio en el que se interviene con dieta y ejercicio a 343 afroamericanos obesos, durante 3 meses, encontraron una reducción del peso y un aumento de los valores de Lp(a), sin encontrar una clara justificación a este hecho.
La similitud entre la apo (a) y el plasminógeno sugiere que la apo (a) y, por extensión, la Lp(a) podrían interferir con la función normal del plasminógeno en la fibrinólisis. En numerosos estudios in vitro17,18 se ha probado que la Lp(a) puede obstaculizar la fijación del plasminógeno a sustratos como la fibrina, superficies celulares y matriz extracelular, y actúa como un inhibidor competitivo de los procesos de generación de plasmina, lisis del coágulo y fijación de plasminógeno a células endoteliales, monocitos y plaquetas, por lo que las concentraciones altas de esta lipoproteína predisponen a complicaciones trombóticas, fomentando, así, un estado protrombótico. In vivo la mayoría de los estudios19-21 no han conseguido demostrar esta relación. Imhof et al22, en un estudio de casos-control, concluyen que los valores elevados de Lp(a) son un factor de riesgo independiente de enfermedad coronaria, pero no encuentran ninguna relación entre esta lipoproteína y diversos marcadores de coagulación y fibrinólisis; sin embargo, Matsuda et al23 estudian la influencia de la Lp(a) sobre la lesión estenótica residual de las arterias coronarias tras un infarto de miocardio en pacientes a los cuales no se les realizó tratamiento de reperfusión, y concluyen que valores elevados de Lp(a) inhiben la fibrinólisis. De acuerdo con los datos obtenidos en este trabajo, no encontramos ningún tipo de relación entre los valores de Lp(a) y los diferentes factores trombogénicos estudiados.
Algunos estudios evidencian aumentos en las concentraciones de Lp(a) en niños con presencia de factores de riesgo cardiovascular en la familia13. Wilcken et al24 describen en una muestra de 1.030 niños de 8-12 años la existencia de relación entre los valores de Lp(a) y la presencia de episodios coronarios en los abuelos. Bailleul et al25, en una muestra de 499 niños de 2-4 años, describen que los niños con antecedentes familiares de enfermedad cardiovascular presentan valores más elevados de Lp(a) que los que no tienen antecedentes, aunque la diferencia no fue estadísticamente significativa. Sin embargo, otros autores no han encontrado diferencias26. En nuestro estudio, los niños con antecedentes de enfermedad cardiovascular en padres o abuelos presentaron concentraciones más altas de Lp(a), aunque sin significación estadística, igual que en el estudio de Bailleul et al25.
En conclusión, nuestros resultados sugieren que solamente el cLDL y el peso están significativamente asociados con los niveles de Lp(a) en niños. Si tenemos en cuenta que la Lp(a) es un factor de riesgo independiente de enfermedad cardiovascular y el efecto aditivo que suponen los factores de riesgo de esta enfermedad, consideramos que resultaría interesante la determinación de este parámetro en los niños que presenten un perfil lipídico desfavorable, o antecedentes familiares de enfermedad cardiovascular. Esto permitiría poder identificar, en individuos sanos, el riesgo individual frente a la enfermedad y se podría controlar y disminuir los factores de riesgo "modificables".