Los pacientes con síndrome metabólico (SM) presentan un incremento del riesgo de experimentar ateroesclerosis y, como consecuencia de ella, un aumento del riesgo de enfermedad cardiovascular (ECV)1,2. La inflamación desempeña un papel crucial en el proceso de la ateroesclerosis y está involucrada en muchas de las alteraciones presentes en el SM, entre las cuales las más importantes son la resistencia a la insulina (RI) y la adiposidad.
Entre los parámetros de inflamación, en varios estudios se ha demostrado la relación entre la elevación de los valores de la proteína C reactiva ultrasensible (PCR-us), que es un reactante de fase aguda y un marcador sensible del proceso inflamatorio subclínico, y la RI, así como cada uno de los componentes del SM3-6. La elevación de los valores de la PCR-us predice el desarrollo de la diabetes mellitus7,8 y la ECV9-11. Sin embargo, los estudios que relacionan los valores de ferritina con el SM son escasos12,13.
Este estudio se plantea con el objetivo de determinar la asociación entre los valores basales de ferritina y cada uno de los componentes del SM, definido por los criterios del Tercer informe del grupo de expertos sobre la detección, evaluación y tratamiento de la hipercolesterolemia en adultos del programa nacional de educación sobre el colesterol (ATP III), definidos en el año 200114. Asimismo, se pretende valorar la relación que hay entre este marcador de inflamación y la RI.
Material y métodos
Se ha realizado un estudio transversal descriptivo de una cohorte de pacientes con sobrepeso y obesidad, atendidos en la consulta de Endocrinología y Nutrición en un hospital del área de A Coruña durante un período de 7 años, entre 1996 y 2003. La muestra estudiada estaba compuesta de 598 individuos, con 203 varones (33,9%) y 395 mujeres (66,1%) diagnosticados de sobrepeso u obesidad. Se aplicaron los criterios definidos por la SEEDO en el año 200015.
Se incluyó a todos los pacientes adultos mayores de 18 años, con diagnóstico clínico de sobrepeso u obesidad, que dieron su consentimiento para su valoración de forma consecutiva. Los criterios de exclusión para la valoración de la ferritina fueron los siguientes:
1. Enfermedades neurológicas, endocrinológicas u otras enfermedades sistémicas, incluida malignidad (n = 4).
2. Historia o reciente evidencia clínica de hemocromatosis basada en valores anormales de múltiples parámetros del hierro (varón: nivel sérico de hierro > 190 µg/dl, nivel sérico de ferritina > 300 µg/l, o saturación de transferrina > 60%; mujer: nivel sérico de hierro > 175 µg/dl, nivel sérico de ferritina > 200 µg/l, o saturación de transferrina > 60%) (n = 1).
3. Historia de drogas o abuso de alcohol, definida ésta por la ingesta > 80 g/día en varones y > 40 g/día en mujeres, o valores séricos de transaminasas por encima del doble del valor normal (n = 5).
4. Elevada concentración de creatinina (n = 2).
5. Episodio cardiovascular agudo en los últimos 6 meses previos (n = 3).
6. Enfermedad aguda y evidencia reciente de una enfermedad inflamatoria o infecciosa aguda o crónica (n = 8).
7. Tratamiento para la anemia en los últimos 3 meses previos (n = 9).
8. Cirrosis o hepatitis crónica (n = 4).
Se admitió a los pacientes con diagnóstico previo de hipertensión o dislipemia o diabetes mellitus en tratamiento, y se hizo constar la pauta y la posología administrada.
A los pacientes incluidos se les realizó un estudio de la composición corporal, que incluyó medidas antropométricas, entre las que se incluyeron peso, talla, índice de masa corporal (IMC), diámetro de cintura y cadera, índice de la cinturacadera y perímetro sagital. Para la valoración del peso se utilizó una báscula Seca® y se midió en kilogramos; para la talla se utilizó un tallímetro Holtain® y se midió en centímetros. Para todo esto se utilizaron los criterios de estandarización de medida incluidos en el consenso de la SEEDO 199616.
Se determinaron los valores de glucosa por el método enzimático17 y se midieron los de insulina mediante la técnica del radioinmunoanálisis18. Se determinaron el colesterol total, los triglicéridos y el colesterol unido a lipoproteínas de alta densidad (cHDL) por métodos enzimáticos en un analizador Technicon RATM100019. Se determinaron los valores de ferritina en ayunas con un método simple de incubación por el método IRMA (Bio-Rad, Hercules, CA).
La presión arterial (PA) se midió con un esfigmomanómetro homologado, tras un período de reposo de 10 min de duración, en decúbito supino y con 2 mediciones separadas 5 min entre sí. Se ha considerado como criterio de hipertensión la presencia de PA sistólica (PAS)/diastólica (PAD) por encima de 130/85 mmHg, respectivamente, según el criterio del ATP III. También se consideró hipertensos a los pacientes previamente diagnosticados de hipertensión arterial en tratamiento actual con antihipertensivos y con cifras de presión normales en el momento de la valoración.
La RI se ha definido mediante el empleo del método HOMA, método indirecto de insulinorresistencia, que corresponde a un acrónimo formado por las palabras Homeostasis Model Assessment. Se calcula utilizando la fórmula descrita por Matthews et al20: HOMAIR = insulina en ayunas (µU/ml) glucosa en ayunas (mmol/ml) / 22,5, y la resistencia a la insulina se define como un valor por encima del percentil 75 de los valores de HOMA entre la población no diabética, que es de 3,99 en la muestra utilizada21.
El SM se definió de acuerdo con las guías del ATP III14, cuyos criterios para definir el SM sería cumplir 3 o más de los criterios siguientes:
1. Obesidad central: perímetro de la cintura > de 102 cm en varones y > de 88 cm en mujeres.
2. Hipertrigliceridemia: triglicéridos é 150 mg/dl (é 1,7 mmol/l).
3. Valores de HDL < 40 mg/dl (< 1,1 mmol/l) en varones y
< 50 mg/dl (< 1,3 mmol/l) en mujeres.
4. Hipertensión arterial: PAS é 130 mmHg o PAD é 85 mmHg o tratamiento antihipertensivo.
5. Glucosa plasmática en ayunas é 110 mg/dl.
Análisis estadístico
Se realizó un análisis descriptivo de todos los parámetros estudiados. La normalidad de la distribución de las variables se determinó mediante el test de Kolmogorov-Smirnov. La comparación de variables numéricas entre grupos se realizó mediante el test de la t de Student o el test de Mann-Whitney, según procediese. Para la comparación de porcentajes se utilizó el test de la *2. A su vez, la asociación entre parámetros numéricos se determinó por medio del coeficiente de correlación Rho de Spearman. Finalmente, la capacidad de los valores de PCR-us y ferritina para discriminar a los individuos con criterios de SM o RI se valoró mediante curvas de ROC (receiver operating characteristic) y el cálculo del área bajo la curva, con un intervalo de confianza del 95%.
Todos los tests se realizaron con un planteamiento bilateral. Se consideraron significativos valores de p < 0,05. El análisis estadístico se realizó con el programa SPSS 12.0 para Windows.
Resultados
El número total de pacientes elegidos para el estudio de inflamación fueron de 598, de los cuales 203 eran varones (33,94%) y 395, mujeres (66,05%). La media de edad de los pacientes estudiados fue de 38,4 años ± desviación estándar 16,0 años, con un IMC medio de 32,4 ± 5,4 kg/m2 y una mediana de 31,6 kg/m2.
Como media, los varones fueron significativamente más jóvenes que las mujeres (media 33,5 frente a 41,0 años; p < 0,001), y tuvieron significativamente valores más bajos de cHDL (media 40,5 frente 48,4 mg/dl; p < 0,001), valores más elevados en cuanto al perímetro de la cintura (PC) (media 105,8 frente a 91,6 cm; p < 0,001), y valores más altos de triglicéridos (media 154,9 frente a 111,9 mg/dl; p < 0,001). Sin embargo, la diferencia de sexos no difirió de manera significativa en lo se refiere al IMC, la PA o glucosa basal en ayunas. Entre los varones la prevalencia de SM (32,7%) y RI (35%) fue mayor que entre las mujeres (25,5 y 26,7%, respectivamente), aunque en ninguno de los casos la diferencia fue estadísticamente significativa. Los varones tuvieron significativamente valores más altos de ferritina (171,4 frente a 54,0 ng/ml; p < 0,001) (tabla 1).
El valor medio de ferritina en los individuos estudiados fue de 82,4 ± 97,0 ng/ml, con una mediana de 46,2 ng/ml, y un rango de 1,40-563,10 ng/ml. Los pacientes que cumplen los criterios que definen al SM presentaron valores más altos de ferritina que los que no, con valores medios de 128,4 ± 138,8 ng/ml y 66,7 ± 70,2 ng/ml y medianas de 69,55 y 41,4 ng/ml, respectivamente. En la tabla 2 se expresa cómo los criterios que definen el SM, excepto valores bajos de cHDL e hipertensión, se incrementan progresivamente a medida que se incrementan los valores de la ferritina. Asimismo, en la tabla 2 se observaron valores de ferritina significativamente más altos en los pacientes con valores mayores de triglicéridos (124,6 ng/ml frente a 65,0 ng/ml; p = 0,001) o glucosa (105,9 ng/ml frente a 78,6 ng/ml; p = 0,023). Lo mismo se constató en los individuos con adiposidad abdominal (96,7 ng/ml frente a 71,3 ng/ml; p = 0,073), aunque la diferencia no alcanzó la significación estadística. No se observaron diferencias en los valores de ferritina entre los pacientes hipertensos y no hipertensos (97,9 ng/ml frente a 71,4 ng/ml; p = 0,809), mientras que resultaron ser significativamente más bajos entre los individuos con menor cHDL (82,9 ng/ml frente a 87,9 ng/ml; p = 0,039).
Globalmente, no se encontró una correlación significativa entre los valores de ferritina y los valores de HDL y PA. Sí se constató un aumento significativo de los valores de ferritina para los más altos del PC, triglicéridos, glucosa y HOMA (tabla 3).
Según los resultados del análisis de regresión múltiple, de las características que diagnostican al SM, sólo el criterio de los triglicéridos (p = 0,032) y la RI según HOMA (p = 0,067), se asociaron con los valores plasmáticos de ferritina más elevados (tabla 4).
En la tabla 5 se muestra la distribución de los valores de ferritina después de que se clasificara a los pacientes de acuerdo con el número total de componentes del SM que cumplan. Hay un incremento progresivo en los valores de ferritina según el número de componentes del SM. La media de los valores de ferritina para los pacientes que cumplían 0, 1, 2, 3 o más de las características del SM según los criterios del ATP III fueron 40,0; 39,7; 47,2 y 69,5 ng/ml, respectivamente.
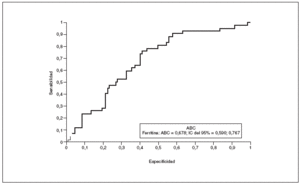
Tras relacionar los valores de ferritina con la RI con el empleo del método HOMA, se observa una correlación positiva entre los valores HOMA y los de ferritina (Rho = 0,281; p < 0,001). Así, los pacientes con RI presentan valores más altos de ferritina (119,3 ng/ml frente a 79,1 ng/ml; p = 0,001), con un área bajo la curva ROC de 0,678 y con un intervalo de confianza del 95% igual a 0,590-0,767 (tabla 6, fig. 1).
Figura 1. Curvas ROC y área bajo la curva (ABC) para los valores de ferritina en la predicción de resistencia a la insulina a partir del método HOMA (Homeostasis Model Assessment). IC: intervalo de confianza.
Discusión
En este estudio, en el que un requisito previo para la inclusión de los pacientes era descartar numerosas causas de inflamación, se identificaron unas correlaciones positivas significativas entre la ferritina con la RI (determinada por el método HOMA), con varios criterios del SM, especialmente el PC, la glucemia y los triglicéridos séricos, y con las variables continuas correspondientes.
Cada vez hay más pruebas de que, por una parte, existe una relación entre el SM, los componentes individuales del SM, la RI y la diabetes mellitus tipo 2, y, por otra parte, entre estos trastornos y cantidades elevadas de depósitos de hierro, determinadas mediante la concentración de la ferritina en suero, reactante de fase aguda12,13,22-26, aunque la naturaleza de esta relación dista mucho de estar completamente clara. Por ejemplo, aunque es evidente que antes de que aparezca la diabetes mellitus se produce un aumento de las concentraciones de ferritina22,26, la relación temporal entre la elevación de la ferritina y el SM está menos clara23. No obstante, parece probable que la ferritina elevada indique la existencia de inflamación y de acciones independientes del exceso de hierro. Se sabe que una acumulación excesiva de hierro afecta a la síntesis y a la secreción de insulina en el páncreas27 e interfiere en la capacidad del hígado para extraer insulina28, lo que da lugar así a hiperinsulinemia periférica y alteración de la secreción de insulina. Por otra parte, el depósito de hierro en el músculo reduce la captación de glucosa debido al daño muscular23. Igualmente, se sabe que el hierro acelera la ateroesclerosis y lesiona el endotelio en modelos experimentales29 (el hierro catalítico convierte especies de radicales relativamente poco reactivas, como el H2O2, en especies muy reactivas, como el radical hidroxilo, y así favorece la agresión oxidativa a las membranas celulares y otros componentes de la célula)30-32. Como, a su vez, la insulina estimula la captación de hierro por las células al incrementar la exteriorización de los receptores de la transferrina y también podría estimular la producción de eritropoyetina33, podría establecerse un círculo vicioso que diera lugar a la RI y a la diabetes mellitus. También se ha indicado que el SM y los factores genéticos pueden ser la causa de la acumulación de hierro debido al desarrollo de esteatosis34-36, lo que podría alterar la producción de hepcidina, una proteína que regula el metabolismo del hierro en el ámbito central, al modular la absorción intestinal o el reciclaje de los macrófagos37.
Entre los distintos trabajos que evaluaron la relación entre SM y ferritina, se debe destacar los siguientes. Uno de ellos se realizó en una población americana-mexicana de varones26, en la que los valores circulantes de ferritina se asociaron de forma significativa tanto con la adiposidad central, como con otros parámetros de la obesidad. Asimismo, en otro estudio con población sana española, realizado por Fernández-Real et al12, los valores de ferritina se relacionaron positivamente con los valores basales de glucosa y con el área bajo la curva para la glucosa durante una prueba de tolerancia a la glucosa e, inversamente, con los valores de cHDL. Después del ajuste del IMC, un probable factor de confusión, no cambió la relación entre los valores de ferritina y la PAD.
Sin embargo, los estudios que relacionan la RI con los valores de ferritina en la población general son escasos. Entre ellos destacaremos el de Fernández-Real et al12, ya previamente comentado. En este trabajo también se observó que los valores de ferritina se correlacionaban estrechamente con la sensibilidad a la insulina. Igualmente, Sheu et al13 encontraron una correlación positiva entre los valores de ferritina y la RI en el grupo de las mujeres, pero no en el de los varones, y los resultados del NHANES III38, en el que se observó también una relación estrecha entre los valores de la ferritina y la RI. En el presente estudio también se obtuvo resultados similares a los trabajos previos, y se demostró una asociación estrecha entre los valores de ferritina y la RI, así como con distintos criterios del SM (triglicéridos y glucosa).
Aunque de este estudio se excluyó a los pacientes con diversas causas conocidas de inflamación distintas del SM y la RI, como crítica, en los análisis estadísticos no se excluyó ni se tuvieron en cuenta otros posibles factores que pueden influir en las concentraciones de ferritina. Entre ellos figuran quemaduras, el uso reciente de ácido acetilsalicílico, otros antiinflamatorios no esteroideos y la donación reciente de sangre (que reduce las reservas de hierro e incrementa la sensibilidad a la insulina)39. Asimismo, la RI se evaluó con el método HOMA, que se basa en las concentraciones de glucosa e insulina en ayunas, y no mediante un pinzamiento (clamp) euglucémico-hiperinsulinémico. No obstante, se sabe que hay una correlación muy elevada entre los resultados del HOMA y del pinzamiento20,40.
Así pues, la determinación y el seguimiento de la ferritina podría resultar útil para valorar la necesidad de un tratamiento temprano y agresivo de los factores de riesgo cardiovascular en las fases iniciales de inflamación subclínica, al detectarse una elevación de este marcador inflamatorio, lo que permite así disminuir la morbimortalidad cardiovascular de los pacientes con SM.