La absorción intestinal de colesterol está regulada por diversas proteínas transportadoras, donde NPC1L1 desempeña un papel crucial. Los ácidos grasos (AG) modulan la absorción de colesterol por un mecanismo desconocido.
ObjetivosEvaluar los efectos de los AG saturados (AGS), monoinsaturados (AGMI) y poliinsaturados (AGPI) sobre la expresión de NPC1L1 y estudiar su posible regulación a través de los receptores nucleares PPARγ, PPARδ, LXR y RXR.
MétodosSe incubaron enterocitos Caco-2/TC-7 durante 24 h con concentraciones no tóxicas (50, 100, 200 y 300 μM) de los diferentes AG y también con agonistas PPARγ (rosiglitazona), PPARδ (GW501516), LXR (T0901317) y RXR (9-cis ácido retinoico). La expresión génica de NPC1L1 se analizó por transcripción inversa de la reacción en cadena de la polimerasa cuantitativa a tiempo real y la expresión de la proteína localizada en la membrana de los enterocitos se analizó por Western blot.
ResultadosLos AG poliinsaturados n-3, EPA y DHA, disminuyeron significativamente los valores de ARNm de NPC1L1 entre un 35-58% (p < 0,05). Los ácidos linoleico (LA, n-6), palmítico (PA) yoleico (OA, n-9) no mostraron ningún efecto en losvalores de ARNm de NPC1L1. Los agonistas LXR y LXR+RXR disminuyeron los valores de ARNm de NPC1L1 un 28 y un 57%, respectivamente (p < 0,05). EPA y DHA a una concentración de 200 μM disminuyeron la expresión de la proteína NPC1L1 un 58 y un 59%, respectivamente.
ConclusionesHemos demostrado que los AGPI n-3, EPA y DHA disminuyen in vitro los valores de ARNm de NPC1L1 en células Caco-2/TC-7. Además, los n-3 también disminuyen la expresión de la proteína en la membrana de los enterocitos. La activación de LXR y RXR induceun efecto inhibitorio similar. El efecto hipolipemiante de los n-3 puede estar mediado, en parte, por su actuación sobre la expresión de NPC1L1.
Several transporter proteins regulate intestinal cholesterol absorption. Of these proteins, NPC1L1 plays a major role to this process. Fatty acids (FA) modulate cholesterol absorption by a mechanism that remains unknown.
ObjectivesTo evaluate the effect of saturated (SFA), monounsaturated (MUFA), and polyunsaturated (PUFA) fatty acids on the expression of NPC1L1 in human enterocytes in vitro and to study the role of the nuclear receptors PPARγ PPARδ, LXR and RXR.
MethodsCaco-2/TC-7 enterocytes were incubated for 24 h with non-cytotoxic concentrations (50, 100, 200 and 300 μM) of the different FA. NPC1L1 gene expression was analyzed by quantitative rtPCR and the protein present in enterocyte membranes was analyzed by western blot.
ResultsNPC1L1 mRNA levels were reduced 35 to 58% by the n-3 PUFA, EPA and DHA (p < 0.05). LA (n-6), PA, and OA did not affect NPC1L1 mRNA expression. ABCA1 mRNA levels were reduced 44 to 70% by n-6 AA and 43 to 55% by n-3 EPA (p < 0.05). LXR and LXR+RXR agonists decreased NPC1L1 mRNA expression by 28 and 57%, respectively (p < 0.05). A concentration of 200 μM of EPA and DHA decreased NPC1L1 protein expression in enterocyte membranes by 58% and 59%, respectively.
ConclusionsWe have demonstrated that the PUFAs n-3 EPA and DHA down-regulate NPC1L1 mRNA expression in vitro. In addition, PUFA also down-regulate NPC1L1 protein expression in enterocyte membranes. LXR and RXR activation induced a similar repression effect. The lipid lowering effect of n-3 PUFA could be mediated in part by their action at the NPC1L1 gene level.
Estudios de prevención secundaria demuestran que la ingesta de ácidos grasos poliinsaturados n-3 (AGPI) procedentes de pescado o en forma de suplemento reducen la mortalidad prematura y la muerte súbita en individuos que han tenido infarto de miocardio1,2 o enfermedades coronarias3. Además, estudios de intervención primaria demuestran que la ingesta de suplementos ricos en AGPI n-3 presentan efectos beneficiosos sobre factores de riesgo metabólico: reducen los valores de triglicéridos (TG)4–6, y aumentan el tamaño de las lipoproteínas de baja densidad (LDL)7,8. Aunque faltan resultados consistentes, también se ha descrito que los AGPI n-3 reducen los valores plasmáticos de colesterol unido a LDL (cLDL), tanto en humanos como en animales4,9. Además, se ha descrito que los AGPI n-3 reducen la absorción de colesterol en modelos animales11–14. Se ha descrito que la ingesta de ácidos grasos monoinsaturados (AGMI) reduce los valores de cLDL sin modificar los valores de colesterol unido a lipoproteínas de alta densidad (cHDL)6,15, aunque algunos autores han descrito un aumento en el cHDL10,16. Por otro lado, está claramente demostrado que los ácidos grasos saturados (AGS) aumentan los valores de cLDL y cHDL6,10,17. Aunque no está del todo claro el mecanismo por el cual los ácidos grasos insaturados (AGI) mejoran el perfil lipídico, parece ser que puede estar mediado por la activación de diferentes factores de transcripción (PPAR, LXR, RXR y SREBP-1c)18.
La principal fuente de colesterol en sangre procede del colesterol absorbido de la dieta y del colesterol sintetizado de novo en el hígado y tejidos extrahepáticos. La absorción intestinal de colesterol es un proceso altamente regulado19. En humanos, los valores de cLDL se correlacionan positivamente con la absorción de colesterol20. Los individuos que presentan una elevada absorción son hipercolesterolémicos y, generalmente, presentan una mayor probabilidad de presentar episodios cardiovasculares21,22. La eficiencia en la absorción intestinal de colesterol está determinada por el balance neto entre la captación y la eliminación de colesterol a través de la membrana del enterocito23. La inhibición de la absorción intestinal de colesterol provoca una reducción en los valores de cLDL23. Por todo ello, es de gran importancia comprender el funcionamiento de los mecanismos implicados en la absorción de colesterol en el intestino. La absorción intestinal de colesterol está regulada por una serie de proteínas, pero la identificada recientemente como NPC1L1 parece ser clave en este proceso24,25. Ratones deficientes en NPC1L1 (NPC1L1-/-), presentan una reducción del 69% en la absorción intestinal de colesterol24. Esta reducción es similar a la observada en ratones salvajes tratados con ezetimibe, un potente y específico inhibidor de la absorción intestinal de colesterol, mientras que en ratones NPC1L1-/-la ezetimiba no produjo ningún efecto24,26,27. Estas observaciones sugieren que la proteína NPC1L1 es la diana terapéutica para ezetimibe. En humanos se ha demostrado que ezetimibe reduce un 50% la absorción intestinal de colesterol y disminuye aproximadamente un 22% los valores plasmáticos de cLDL28. Estas observaciones clínicas han resaltado el papel crucial de NPC1L1 en la homeostasis del colesterol. La proteína NPC1L1 se expresa en muchos tejidos humanos, especialmente en hígado e intestino delgado24,29,30, aunque hay cierta controversia acerca de su localización subcelular24,30–34. Se sabe poco de la regulación de la expresión intestinal de NPC1L1 y pocos estudios han tratado este aspecto. Se ha demostrado que la activación de los factores de transcripción PPARδ y PPARα, produce una inhibición in vitro de la expresión génica de NPC1L1 en modelos humanos y animales35,36.
La dieta influye directamente en los valores de colesterol en sangre, por tanto, parece lógico pensar que los componentes de la dieta puedan intervenir en la regulación del mecanismo de absorción. De los componentes de la dieta, los ácidos grasos (AG) son los principales candidatos implicados en esta regulación, ya que se ha demostrado que los AGPI n-3 son agentes hipocolesterolémicos4,9,10. Una concentración relativamente elevada de AG es transportada en forma de TG hacia el lumen intestinal y después de la hidrólisis de los TG los AG son absorbidos por los enterocitos37. Hay pocas investigaciones acerca del efecto de los AG sobre el enterocito, pero se sabe que los AG son ligandos naturales de una serie de factores de transcripción (PPAR, LXR y RXR) y que son capaces de modular la expresión génica38–40. Por tanto, nuestra hipótesis es que los AG podrían afectar la expresión génica y proteica de moléculas directamente implicadas en la absorción intestinal de colesterol.
En este estudio evaluamos los efectos de las AG, PA, OA, LA, AA, EPA y DHA sobre la expresión de NPC1L1 y estudiar su posible regulación a través de los receptores nucleares PPARγ, PPARδ, LXR y RXR.
MétodosCultivos celularesLa línea celular humana Caco-2/TC-7 procedente de cáncer de colon se obtuvo de Celltec (Barcelona, España). Las células (pases 47–49) se cultivaron en flascones de plástico de 75cm2 a una densidad de 1,25 × 104 células/cm2 en medio Dulbecco's Modified Eagle's (DMEM) rico en glucosa y con L-glutamina, suplementado con un 20% de suero bovino fetal inactivado (FBS), 100 U/ml de penicilina y 100μg/ml de estreptomicina, y se mantuvieron a 37°C en atmósfera húmeda con un 5% de CO2. Las células se tripsinizaron cuando alcanzaron un 80% de confluencia y se sembraron en placas de 6 pozos para los experimentos de ARN, y en placas de 10cm2 para los experimentos de Western blot.
En todos los experimentos, las células se dejaron crecer 21 días posconfluencia (6–7 días después de sembrarlas). Durante este período, las células Caco-2/TC-7 se diferencian a enterocitos y expresan enzimas específicas de intestino, cuya actividad enzimática alcanza aproximadamente la mitad de la que se observa en intestino delgado. El medio de cultivo se cambió 3 veces por semana.
Análisis de expresión génicaPara estudiar el efecto de los AG sobre la expresión de NPC1L1 en el ARNm, los enterocitos Caco-2/TC-7 se incubaron con soluciones de AG unidas a albúmina sérica bovina (BSA) (AG-BSA: ácido palmítico [PA, C16:0], ácido oleico [OA, C18:1], ácido linoleico [LA, C18:3], ácido araquidónico [AA, C20:4], ácido eicosapentanoico [EPA, C22:6] y ácido docosahexanoico [DHA, C22:6]) a 50, 100, 200 y 300μM durante 24h en medio de cultivo libre de suero. Después del período de incubación se aisló el ARN total de las células con el sistema de extracción semiautomático ABI PRISM 6100 Nucleic Acid PrepStation (Applied Biosystems, Foster City, USA) según los protocolos del fabricante. La concentración y la calidad del ARN total extraído se determinaron por absorbancia a 260nm y por la ratio 260/280nm, respectivamente. Las células no tratadas se utilizaron como controles.
Para estudiar el efecto de los agonistas PPARγ, PPARδ, LXR y RXR sobre la expresión génica de NPC1L1, los enterocitos Caco-2/TC-7 se incubaron con agonista PPARγ (BRL, 2μM), agonista PPARδ (GW501516, 100 nM), agonista LXR (T0901317, 2μM) y agonistas LXR+RXR (T0901317+9cRA, 2 y 10μM) durante 24h en medio de cultivo libre de suero. Después de 24h de incubación se realizó la extracción de ARN total y se analizó la expresión génica de NPC1L1 en el ARNm. Las células incubadas con el vehículo (DMSO) se utilizaron como controles.
Todos los experimentos se realizaron por triplicado y se repitieron 3 veces.
Preparación de las soluciones de ácidos grasosLas soluciones se prepararon según el método de Wu et al41 con algunas modificaciones. Brevemente, 10mg de cada AG (Sigma, St Quentin Fallavier, France) se mezcló con 0,5ml de EtOH y NaOH 5M en una cantidad suficiente para que la ratio molar AG:NaOH fuera 1:1. La mezcla se evaporó bajo atmósfera de nitrógeno hasta la obtención de la sal de AG y entonces se disolvió con 2ml de agua destilada estéril (soluciones stock de AG). Para evitar la oxidación de AG se añadió hidroxitolueno butilado (BHT, 1μM) a cada solución stock de AG. Las soluciones stock del complejo AG-BSA se realizaron mezclando cada AG con BSA 5mM en una cantidad suficiente para que la ratio molar AG:BSA fuera 3:1, se filtraron y se utilizaron frescas.
Análisis de ARNm por PCR cuantitativa a tiempo realEl ADN complementario se sintetizó a partir de 1μg de ARN total utilizando random hexamers y la transcriptasa inversa SuperScript II (Invitrogen Ltd, Paisley, UK), según el protocolo del fabricante. Las reacciones se llevaron a cabo en el termociclador PE Biosystems 2400 (Applied Biosystems, Foster City, USA). Para la reacción de amplificación de PCR a tiempo real se utilizaron los primers y las sondas TaqMan® para NPC1L1, gliceraldehído-3-fosfato deshidrogenasa (GAPDH) y 18S prediseñados y validados "Assays-on-Demand" products (Applied Biosystems, Foster City, USA). La cuantificación de los resultados se realizó mediante el método 2-¿¿Ct (ABI Prism 7700 Sequence Detection System; user bulletin n.° 2, Revision A. Foster City [USA]: Applied Biosystems, 1997). El grupo control (células no tratadas) se utilizó como calibrador. Como controles internos de normalización se utilizaron GAPDH y 18S.
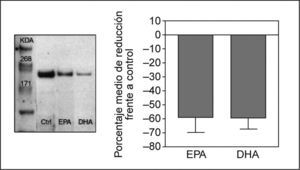
Determinación de la proteína NPC1L1 en lisados totales y en membrana de enterocitosPara las extracciones de proteínas se utilizaron las células incubadas durante 24h con EPA y DHA a concentración 200μM. Los extractos de proteína de membrana de los enterocitos se obtuvieron con el kit Mem-Per Eukaryotic Membrane Protein Extraction Reagent Kit (Pierce, Rockford, EE.UU.) y los lisados totales se obtuvieron por pasos sucesivos de congelación-descongelación en tampón de homogenización que contiene PBS a pH 7,4 e inhibidores de la proteasa, complete mini protease inhibitors (Roche, Manheim, Alemania). Las muestras se conservaron a −80°C hasta la realización del experimento.
La concentración de la proteína se cuantificó por el método de Bradford (Bio-Rad Laboratories, California, EE.UU.). La electroforesis y la transferencia se realizaron utilizando el NUPAGE® Large Protein Analysis System (Invitrogen Ltd, Paisley, Reino Unido). La membrana transferida se bloqueó al 2% con ECL Advance Blocking Reagent (Amersham Biosciences, Bucks, Reino Unido), y se incubó con el anticuerpo anti-NPC1L1 (1:2500, NB 400–127, Novus Biologicals, Littleton, EE.UU.). Los complejos antígeno-anticuerpo se detectaron incubando la membrana con IgG-HRP (1:20000, P0448, Dako, Glostrup, Dinamarca). Las señales se detectaron con ECL Advanced Reagent Mixture (Amersham Biosciences, Bucks, Reino Unido) y las bandas se visualizaron por autorradiografía, se capturaron en el Versadoc 4000 imaging system y se analizaron y cuantificaron con el Quantity One software (Bio-Rad Laboratories, California, EE.UU.). Como control de proteína cargada, las proteínas transferidas se tiñeron con Ponceau S y se utilizó actina como control interno de normalización para la cuantificación de las bandas. El tamaño de las proteínas se confirmó comparándose con estándares de peso molecular (Invitrogen Ltd., Paisley, Reino Unido). Todos los experimentos se realizaron por triplicado y se repitieron 3 veces.
Análisis estadísticoLos resultados se presentan como la media ± SEM. Las diferencias significativas entre grupos se analizaron mediante oneway ANOVA y se calcularon utilizando el test de Bonferroni para comparaciones múltiples. Se utilizó el software the statistical package for the Social Science (SPSS) versión 14.
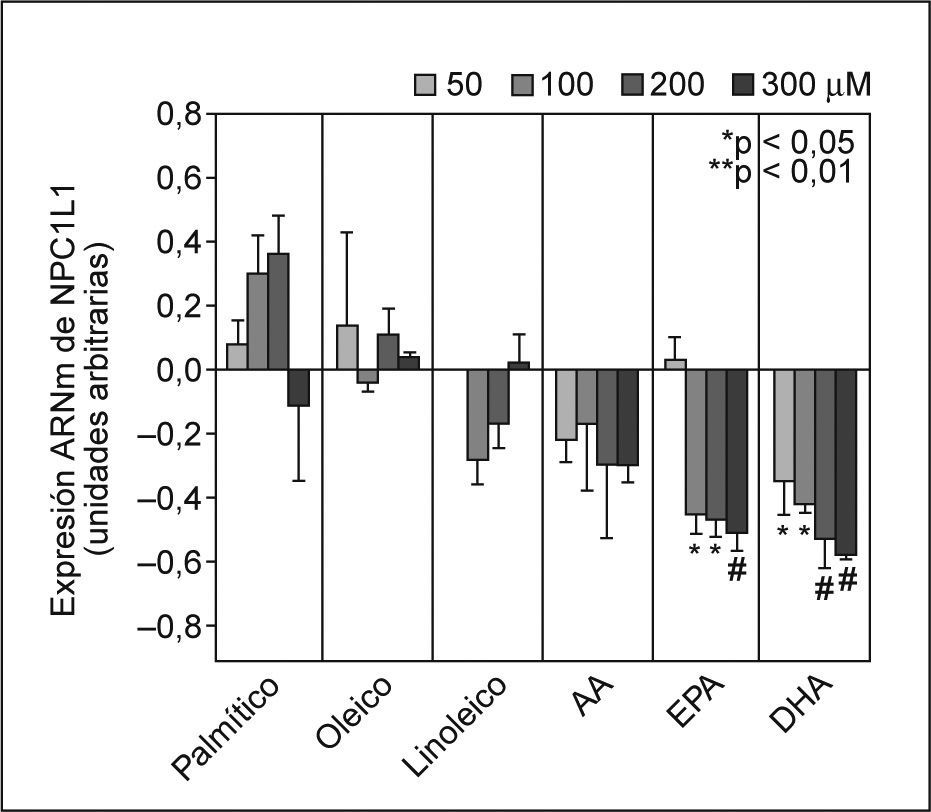
ResultadosEfecto de los ácidos grasos en los valores de ARNm de NPC1L1El tratamiento de los enterocitos Caco-2/TC-7 con los AG PA (AGS), OA (n-9 AGMI) y LA (n-6 AGPI) no afectó la expresión de NPC1L1 del ARNm (fig. 1). Cuando se realizó el experimento de forma dependiente de la dosis con AA, se observó que la expresión de NPC1L1 del ARNm tendía a disminuir observándose la máxima inhibición a 200 y 300μM. Por otro lado, los AGPI n-3 (EPA y DHA) disminuyeron de forma significativa y dependiente de la dosis los valores de ARNm de NPC1L1 desde un 20 hasta un 60%, aproximadamente. La mínima inhibición observada fue de un 45% (p < 0,05) y de un 35% (p < 0,05) a 100μM EPA y 50μM DHA, respectivamente. La máxima inhibición observada fue de un 51 (p < 0,01) y de un 58% (p < 0,01) con EPA y DHA, respectivamente, ambos a 300μM (fig. 1).
Efecto dependiente de la dosis de los ácidos grasos (AG) sobre los valores de ARNm de NPC1L1. Se incubaron enterocitos Caco-2/TC-7 con concentraciones crecientes no tóxicas de cada AG durante 24h, tal y como se describe en la figura. Los valores de expresión se normalizaron con controles endógenos y se dio valor 0 a la expresión de los controles (células no tratadas). *p < 0,05, **p < 0,01 respecto a los controles.
En todos los experimentos se comprobó que las soluciones de los ácidos grasos no estaban oxidadas y que las concentraciones utilizadas no eran tóxicas para las células (datos no mostrados).
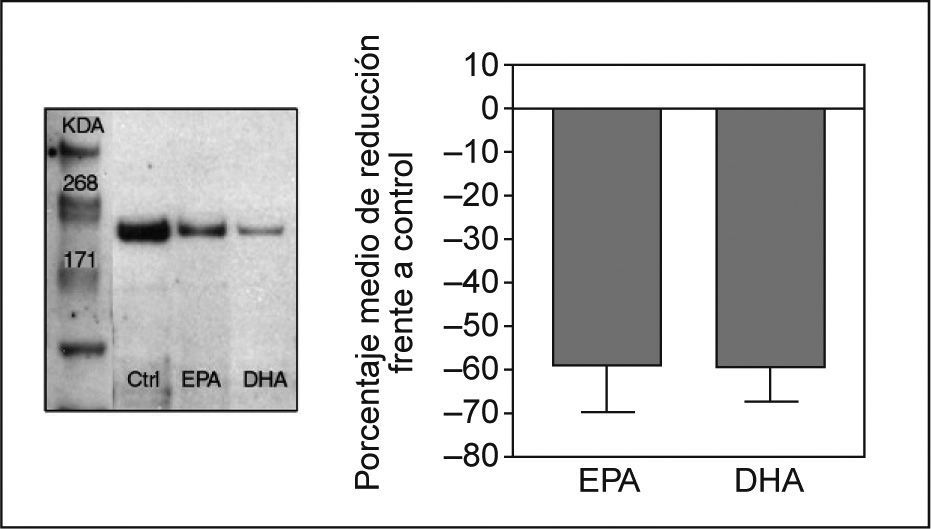
Efecto de los ácidos grasos en la expresión proteica de NPC1L1Para determinar si la inhibición en la expresión del ARNm de NPC1L1 observada con el tratamiento con AGPI n-3 se asociaba a una disminución en la expresión de la proteína, se analizó por Western blot la expresión de la proteína NPC1L1 en extractos de membrana y en lisados totales de células Caco-2/TC-7 incubadas con EPA y DHA a concentración 200μM. Después de cuantificar y normalizar las bandas, se observó una disminución en la expresión proteica del 58 y 59% en células incubadas con EPA y DHA, respectivamente, acorde con la disminución observada en los valores de ARNm de NPC1L1 (fig. 2).
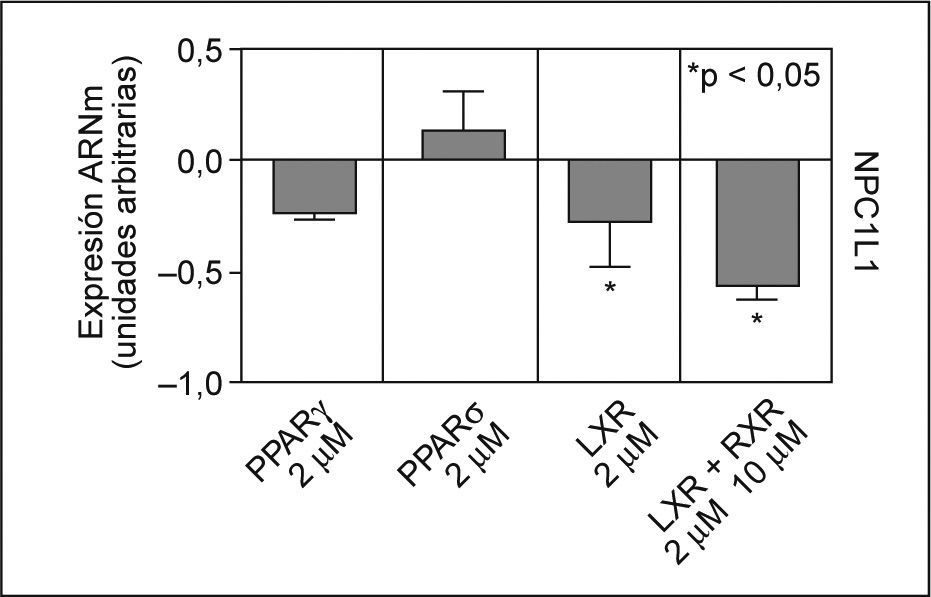
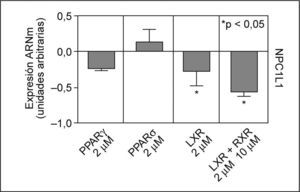
Factores de transcripción implicados en la regulación de la expresión de NPC1L1Se estudió el efecto en el ARNm de NPC1L1, de los agonistas de una serie de factores de transcripción descritos como posibles reguladores de la expresión de NPC1L135,36,42. Después de incubar los enterocitos Caco-2/TC-7 con agonistas para PPARγ, PPARδ, LXR y LXR/RXR, se observó que ninguno de los agonistas PPAR, a las concentraciones utilizadas, disminuían de forma significativa los valores de ARNm de NPC1L1. Sin embargo, el agonista para LXR, TO901317 a 2μM, produjo una inhibición en los valores de ARNm de NPC1L1 de un 28% (p < 0,05) y en combinación con el agonista para RXR, 9cRA a 10μM, el efecto inhibitorio alcanzó un 57% (p < 0,05) (fig. 3).
Efecto de los agonistas de PPARγ, PPARδ, LXR y RXR en los valores de ARNm de NPC1L1. Se incubaron durante 24h enterocitos Caco-2/TC-7 con agonistas, tal y como se ha descrito previamente. Los valores de expresión se normalizaron con controles endógenos y se dio valor 0 a la expresión de los controles (células no tratadas). *p < 0,05 respecto a los controles.
La dieta es la principal fuente de los diferentes tipos de AG con una ingesta diaria aproximada de varios gramos43. Estos AG son transportados en forma de TG y son absorbidos tras la hidrólisis de los TG37, pero se sabe poco acerca del efecto de los AG en el enterocito. En este estudio se ha evaluado el efecto de diferentes tipos de AG en la expresión génica de la proteína NPC1L1, recientemente identificada como proteína clave en la absorción intestinal de colesterol. La principal observación de este trabajo es que los AGPI n-3, EPA y DHA disminuyen el ARNm de NPC1L1 en enterocitos humanos. Además, se ha demostrado que esta inhibición está asociada a una disminución en la expresión génica de NPC1L1. Es interesante resaltar que la inhibición proteica se ha observado en la membrana de los enterocitos, donde NPC1L1 es funcional. Los AGS, AGMI y los AGPI n-6 no afectan la expresión génica de NPC1L1 a en el ARNm.
Los valores de colesterol en plasma dependen del colesterol sintetizado en el hígado y tejidos extrahepáticos y del absorbido en el intestino19. De hecho, la cantidad de colesterol absorbido está directamente relacionado con los valores de colesterol en plasma20. Nuestros resultados muestran una modulación diferente por parte de los AG sobre la expresión de NPC1L1. Así, los valores de colesterol en plasma podrían estar regulados por los AG a través del efecto que producirían sobre la absorción de colesterol, dado el efecto que provocan en la expresión de NPC1L1. En este sentido, la reducción en los valores de colesterol descrita en diferentes estudios como resultado de una ingesta elevada de AGPI procedentes de la dieta o en forma de suplemento alimenticio, se podría explicar a través del descenso de la absorción de colesterol que provocan los AGPI n-3, EPA y DHA al disminuir la expresión de NPC1L1. El efecto variable de los AGPI n-3 en los valores de colesterol descritos en otros estudios se podría explicar por diferencias en la cantidad consumida, en la vía de administración junto con el tipo de AGPI administrado, por la cantidad de grasa ingerida en la dieta habitual y por el perfil lipoproteico de los sujetos.
Los individuos considerados hiperabsorbentes, como los portadores del alelo apoE4, son hipercolesterolémicos21, y los participantes en el estudio 4S que presentaban una elevada absorción de colesterol tenían una mayor incidencia de episodios cardiovasculares22. Por tanto, nuestros resultados podrían tener implicaciones clínicas importantes.
En este trabajo también demostramos que los agonistas para LXR y LXR/RXR disminuyen los valores del ARNm de NPC1L1. Por tanto, el efecto inhibitorio de los AGPI n-3, EPA y DHA en la expresión de NPC1L1 se podría deber a un mecanismo dependiente de LXR y RXR. Utilizando aproximaciones bioinformáticas (TFexplorer 2.0, Korean Bioinformation Center), identificamos en la región promotora del gen NPC1L1 2 sitios de reconocimiento para los factores de transcripción LXR/RXR. Nuestros resultados sugieren que los factores de transcripción LXR/RXR están implicados en la disminución de la expresión de NPC1L1 en el ARNm, aunque no podemos confirmar el mecanismo exacto por el que realizan dicha inhibición. Además, estos resultados amplían las observaciones realizadas por Mathur et al44 y Duval et al45 con respecto al efecto del EPA sobre la expresión génica y proteica de NPC1L1 y la disminución de los valores de ARNm de NPC1L1 por los agonistas de LXR+RXR.
Se ha descrito en ratones que una disminución del 35% en la expresión génica de NPC1L1 se asocia a una reducción del 43% en la absorción del colesterol36. Otros autores han demostrado que en humanos el tratamiento con ezetimibe provoca una reducción del 50% en la absorción de colesterol y que está asociada a una disminución del cLDL aproximadamente de un 22%28. Además, la ingesta de 2,5g/día de fitoesteroles provoca una reducción del 36% en la absorción del colesterol asociada a una disminución del colesterol total y del cLDL en plasma de un 10 y un 14%, respectivamente46. Nuestros resultados muestran que los AGPI n-3, EPA y DHA, disminuyen la expresión génica de NPC1L1 entre un 35 y un 60%. Estos resultados pueden contribuir a explicar el putativo efecto hipolipemiante, sugiriendo que este efecto se puede deber a la disminución en la absorción de colesterol a causa de la disminución de la expresión de NPC1L1 que provocan los AGPI n-3. Aunque hemos observado importantes efectos de los AGPI en la expresión de NPC1L1, se necesitan más estudios para poder aclarar el papel de los AG sobre la absorción intestinal de colesterol y de los factores de transcripción LXR y RXR en la regulación de NPC1L1.
Todos los autores han contribuido en la aportación de ideas, diseño, análisis e interpretación de datos, así como en la redacción del artículo y en la revisión del contenido, dando su aprobación final de la versión a publicar.
Este trabajo ha sido financiado por el Fondo de Investigación Sanitaria ISCIII-FIS PI030786 y el CIBER de Diabetes y Enfermedades Metabólicas Asociadas (CIBERDEM) que es una iniciativa del ISCIII.
Una comunicación referente a esta línea de trabajo titulada “Los ácidos grasos poliinsaturados disminuyen la expression del gen Niemann-Pick C1-like 1 en enterocitos humanos Caco-2”, fue presentada en el XVIII Congreso Nacional de la SEA (A Coruña 2005) y galardonada con un accésit a la major comunicación.