Los inhibidores de la 3-HMG-CoA-reductasa (estatinas) son fármacos cuyos beneficios clínicos en la prevención de las enfermedades cardiovasculares están ampliamente demostrados. Una parte de tales beneficios, y particularmente los que pueden tener lugar de forma más inmediata, se deben a efectos que pueden ser independientes del descenso de los niveles de colesterol y de cLDL. Estos efectos se conocen como efectos pleiotrópicos.
En el presente trabajo, mediante cultivos de células implicadas en el proceso aterogénico —fibroblastos, monocitos, células endoteliales y células musculares lisas— sometidos a distintos tipos y dosis de estatinas, hemos intentado evidenciar los cambios en el comportamiento celular.
Nuestros resultados apoyan la idea de que se producen cambios subsiguientes a la adición de las estatinas en el medio de cultivo, y que afectan tanto a la adhesividad celular como a la movilidad y —en el caso de las células musculares lisas— a la contractilidad. Estos cambios pueden explicar, al menos en parte, algunos de los efectos distintos a los directamente relacionados con el efecto hipocolesterolemiante. En el fondo de tales cambios se pueden encontrar modificaciones en el metabolismo intracelular.
3-HMG-CoA-reductase inhibitors (statins) are drugs which have been widely demonstrated to have clinical benefits in the prevention of cardiovascular diseases. Some of these benefits, particularly those that may take place immediately, are due to effects that may be independent of the decrease in cholesterol and LDL-cholesterol levels. These effects are known as pleiotropic effects.
In the present study, using cultures of the cells involved in the atherogenic process: fibroblasts, monocytes, endothelial cells and smooth muscle cells submitted to different types and doses of statins, we have attempted to demonstrate the changes in cell behaviour.
Our results support the idea that subsequent changes are produced on the addition of statins into the culture medium, and which affect cell adhesiveness, as well as mobility and. in the case of smooth muscle cells, the contractility. These changes may explain, at least partly, some of the effects other than those directly related to the lipid lowering effect. Behind such changes may be found alterations in intracellular metabolism.
Las estatinas son fármacos cuyo principal efecto es la reducción del colesterol plasmático. Dicha reducción se puede situar, dependiendo del fármaco y de la dosis, entre un 10 y un 50% de la cifra basal. Su mecanismo de acción es la inhibición de la 3-hidroximetil-glutaril-coenzima A-reductasa (3-HMG-CoA-R), cuya acción enzimática es un paso limitante en la síntesis de colesterol intracelular. La principal consecuencia de este hecho es el aumento de la expresión y de la actividad del receptor para las LDL, con lo que se consigue un «aclaramiento» de dicha lipoproteína del plasma.
En los últimos años, diversas evidencias han sugerido que la reducción de la morbimortalidad cardiovascular producida por las estatinas podría ser consecuencia no solo de la reducción de las concentraciones plasmáticas de colesterol LDL (cLDL), sino también de otras acciones independientes.
De hecho, el beneficio clínico producido por las estatinas en los estudios 4S (Scandinavian Simvastatin Survival Study)1, WOSCOPS (West of Scotland Coronary Prevention Study)2, CARE (Colesterol and Recurrent Events)3 y HPS (Heart Protection Study)4 eran independientes de los valores basales o del grado de reducción de las concentraciones plasmáticas de cLDL, y superiores a la que cabría esperar según la reducción de los valores de cLDL.
En los estudios MIRACL (Myocardial Ischemia Reduction with Agressive Colesterol Lowering)5 y HPS4, realizados en pacientes con valores normales o casi normales de cLDL, las estatinas producen una reducción de los episodios coronarios similar a la observada en los pacientes con cardiopatía isquémica.
En los estudios angiográficos, la reducción de los episodios coronarios producida por las estatinas se asociaba a mínimos cambios en las dimensiones de la placa, por lo que no puede atribuirse a la regresión de esta6.
Algunos efectos protectores de la estatinas en modelos animales de hipercolesterolemia (reversión de la función endotelial) aparecen antes incluso que la reducción de los valores de cLDL7, y en el estudio MIRACL la atorvastatina reducía los episodios isquémicos a las 16 semanas de tratamiento, un intervalo demasiado corto para que pueda atribuirse a cambios en los valores de las LDL5.
Por otra parte, las estatinas disminuyen la incidencia de ictus isquémicos, a pesar de que estos no siempre se acompañan de un aumento de las concentraciones plasmáticas de colesterol6,8.
Todos estos hallazgos han llevado al convencimiento de que las estatinas tienen acciones independientes de las reducción de las concentraciones plasmáticas de cLDL, a las que denominamos acciones pleiotrópicas9,10. Las principales acciones pleiotrópicas de las estatinas incluyen la reversión de la disfunción endotelial, acciones antioxidantes, antitrombóticas, inmunomoduladoras y antiinflamatorias.
El objetivo del presente trabajo ha sido conocer los cambios en el comportamiento celular inducidos por distintas estatinas empleando cultivos de células que habitualmente se encuentran implicadas en el proceso aterogénico.
Material y métodosSe han empleado las técnicas de cultivo celular con soluciones y medios de cultivo ya señalados en trabajos precedentes como habituales en nuestro laboratorio11.
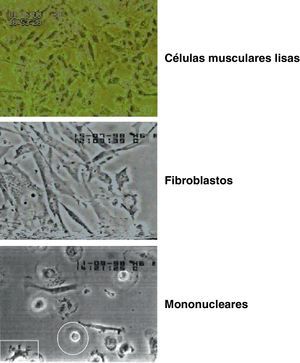
CélulasAlgunas de las líneas celulares empleadas proceden de cultivos primarios de células humanas, y otras tienen su origen en líneas celulares previamente establecidas.
Los fibroblastos humanos proceden del cultivo primario de amígdalas hipertróficas recién extirpadas, que proporciona una buena cantidad de fibroblastos. Las amígdalas extirpadas se recogieron en solución salina equilibrada de Dulbecco, suplementada con 200UI/ml de penicilina, 200μg/ml de estreptomicina, 32μg/ml de gentamicina y 40UI/ml de nistatina. Se obtenían mediante sucesivos pases con tripsina y transferencia de las suspensiones celulares a tubos de centrífuga. Finalmente se eliminaron los residuos groseros filtrando la suspensión a través de varias capas de gasa estéril. Se sedimentaron las células centrifugando 10min a 125×G a temperatura ambiente. Se descartó el sobrenadante y se suspendieron las pellas en medio R5a de Iwakata suplementado con suero bovino fetal al 10%, penicilina 100UI/ml, estreptomicina 100μg/ml, gentamicina 16μg/ml y nistatina 20UI/ml. La siembra se realizó utilizando frascos de mucha superficie a razón de 46.800 células viables por centímetro cuadrado en medio R5a de McCoy modificado por Iwakata suplementado con suero bovino fetal 10% y antibióticos. Cuando los cultivos estaban en pleno crecimiento logarítmico y en fase confluente laxa se recogieron las células, desprendiéndolas con tripsina al 0,2%, y se prepararon viales que contenían diferentes volúmenes de suspensión. Los viales para congelación se prepararon con 2,4×106 células con el medio de mantenimiento suplementado con 7% de dimetilsulfóxido. Los fibroblastos así obtenidos mantienen su capacidad proliferativa a lo largo de unos 15 pases consecutivos, y a partir de entonces las células adoptan propiedades y morfología de fibroblastos senescentes.
Los monocitos humanos de sangre periférica proceden de muestras de donantes sanos que se recogen en tubos estériles con EDTA-Na (1,5mg/ml de sangre) y siliconados para evitar la coagulación e impedir la adhesión de los monocitos a las paredes del recipiente. Se centrifugan a 125×G a temperatura ambiente durante 15min para separar y recoger los plasmas. El sedimento que contiene las células hemáticas se ajusta al volumen inicial con solución salina equilibrada sin iones Ca++ ni Mg++. Las células se purifican por centrifugación sobre lecho de polisucrosa y diatrizoato sódico ajustado a una densidad de 1,077, utilizando el sistema Accuspin. La centrifugación se realiza a temperatura ambiente a 800×G durante 15min en centrífuga IEC modelo HN. Se seleccionan por aspiración la banda de células linfomononucleares.
Las líneas celulares previamente establecidas proceden de la American Type Culture Collection (ATCC) y se han obtenido a través de la European Collection of Cell Cultures (ECACC) y de líneas establecidas en nuestro laboratorio a partir de dicho origen. Se han utilizado células humanas de endotelio vascular y células musculares lisas.
Las células humanas de endotelio vascular (HMEC-1) fueron obtenidas en 199212 a partir de endotelio vascular. Las HMEC-1 pueden crecer en ausencia de suero humano. Expresan moléculas de superficie típicamente asociadas con las células endoteliales humanas —como es el caso de las moléculas CD31 y CD36— y moléculas de adhesión como las ICAM-1. Adaptamos las células a crecer en medio R5a de Iwakata. Las células HMEC-1 son células que prosperan como cultivos semicontinuos, es decir, mantienen su capacidad proliferativa a lo largo de 95 pases sucesivos. A partir de este momento disminuye su capacidad de crecimiento y las células se mantienen en estado estacionario.
Las células musculares lisas (TG/HA-VSMC) fueron obtenidas en 199213. En nuestro laboratorio se obtuvieron a partir de la ECACC. Asimismo, adaptamos las células a crecer en medio R5a de Iwakata. Las células TG/HA-VSMC son también células normales que prosperan como cultivos semicontinuos y mantienen su capacidad proliferativa a lo largo de 30-35 pases sucesivos. A partir de ese momento disminuye su capacidad de crecimiento y las células se mantienen en estado estacionario.
Técnicas de videointervalometría y microscopia digital de intervalosEstos procedimientos se utilizan para valorar las características morfodinámicas y la cinética de crecimiento de las células control y las tratadas con las distintas estatinas. Se ha empleado un microscopio invertido Nikon modelo M y un microscopio Nikon modelo Diaphot. Ambos microscopios están diseñados para poder utilizar dos salidas de recogida de imagen; en una de ellas se adaptan el portaoculares y el tubo para la cámara de fotografía, y la otra es una salida horizontal especialmente diseñada para la adaptación de una cámara de cine o vídeo. Ambos equipos llevan incorporada una cámara de incubación que permite mantener la temperatura con una precisión±0,1°C. La temperatura se mantiene con un dispositivo de inyección de aire caliente en la cámara, regulada por un dispositivo de control que responde a las modificaciones de temperatura detectadas por un termopar que colocamos en la zona próxima al recipiente de observación.
Utilizamos óptica de contraste de fases con condensador de larga distancia focal. Esta óptica permite la visualización en las células vivas de un mayor número de estructuras.
Para las condiciones de filmación procuramos establecer las mismas condiciones de los experimentos que paralelamente se realizaron en los microcultivos en placas, con objeto de poder correlacionar los datos obtenidos en las dos condiciones. La cadencia de registro de imagen se programa en función de la duración del fenómeno a estudiar, utilizando aceleraciones comprendidas entre 4 imágenes por segundo y una imagen cada 8min, lo que nos permite, con la máxima aceleración, visionar en 1min los fenómenos que se producen en 3días.
EstatinasSe han ensayado la atorvastatina, la pravastatina, la simvastatina y la cerivastatina. Para la preparación de las soluciones concentradas de estatinas se han solubilizado los principios activos a partir de la presentación en comprimidos. Se molturan los comprimidos; las estatinas liposolubles se solubilizan inicialmente en dimetil sulfóxido añadiendo posteriormente agua a partes iguales; las hidrosolubles se solubilizan primero en agua con adición posterior de dimetil sulfóxido también a partes iguales. Las soluciones se preparan ajustadas a una concentración final de 2mg/ml de la estatina, y la solución de uso se realiza por dilución en medio de cultivo, utilizando como controles los solventes de la solución madre con el mismo factor de dilución.
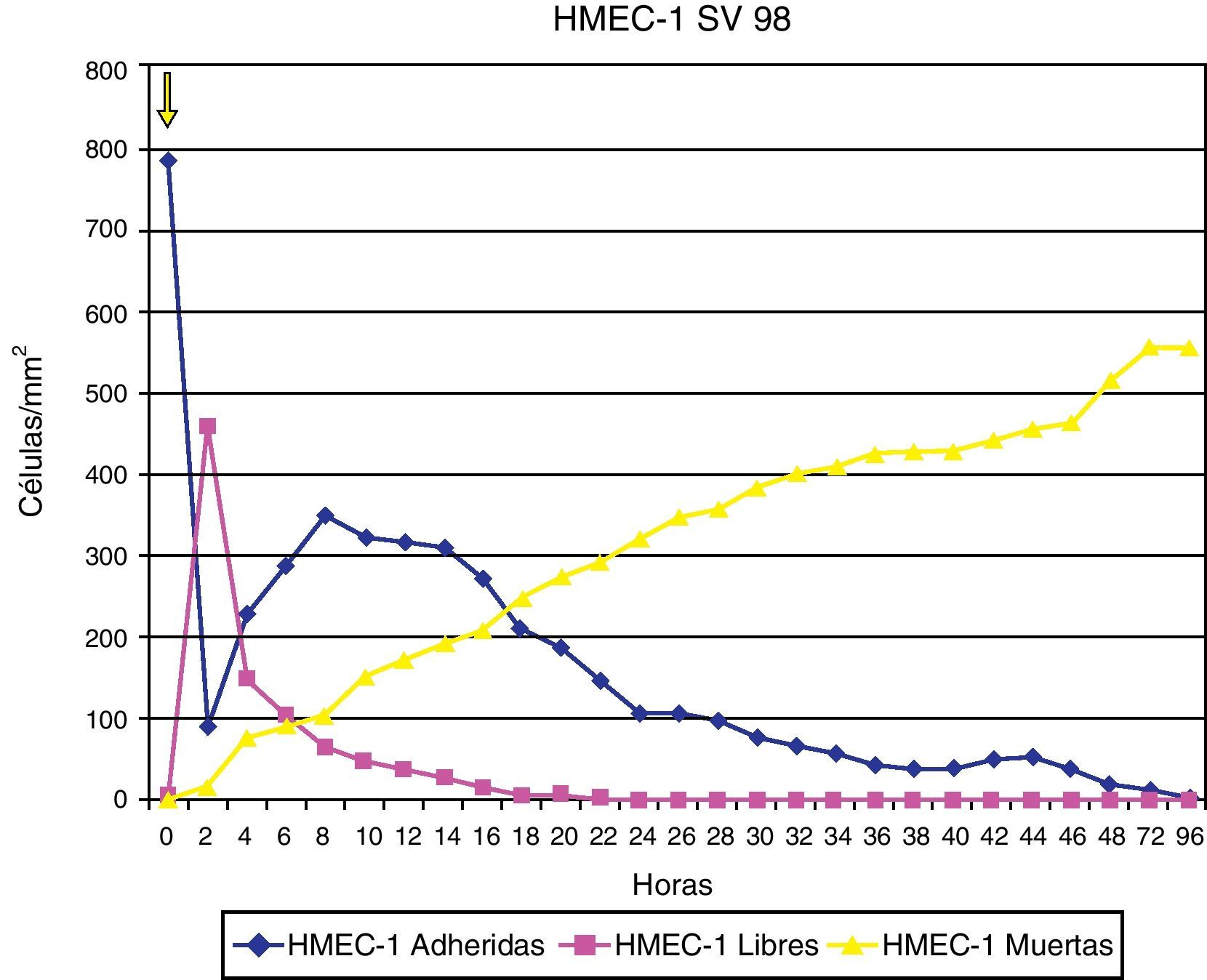
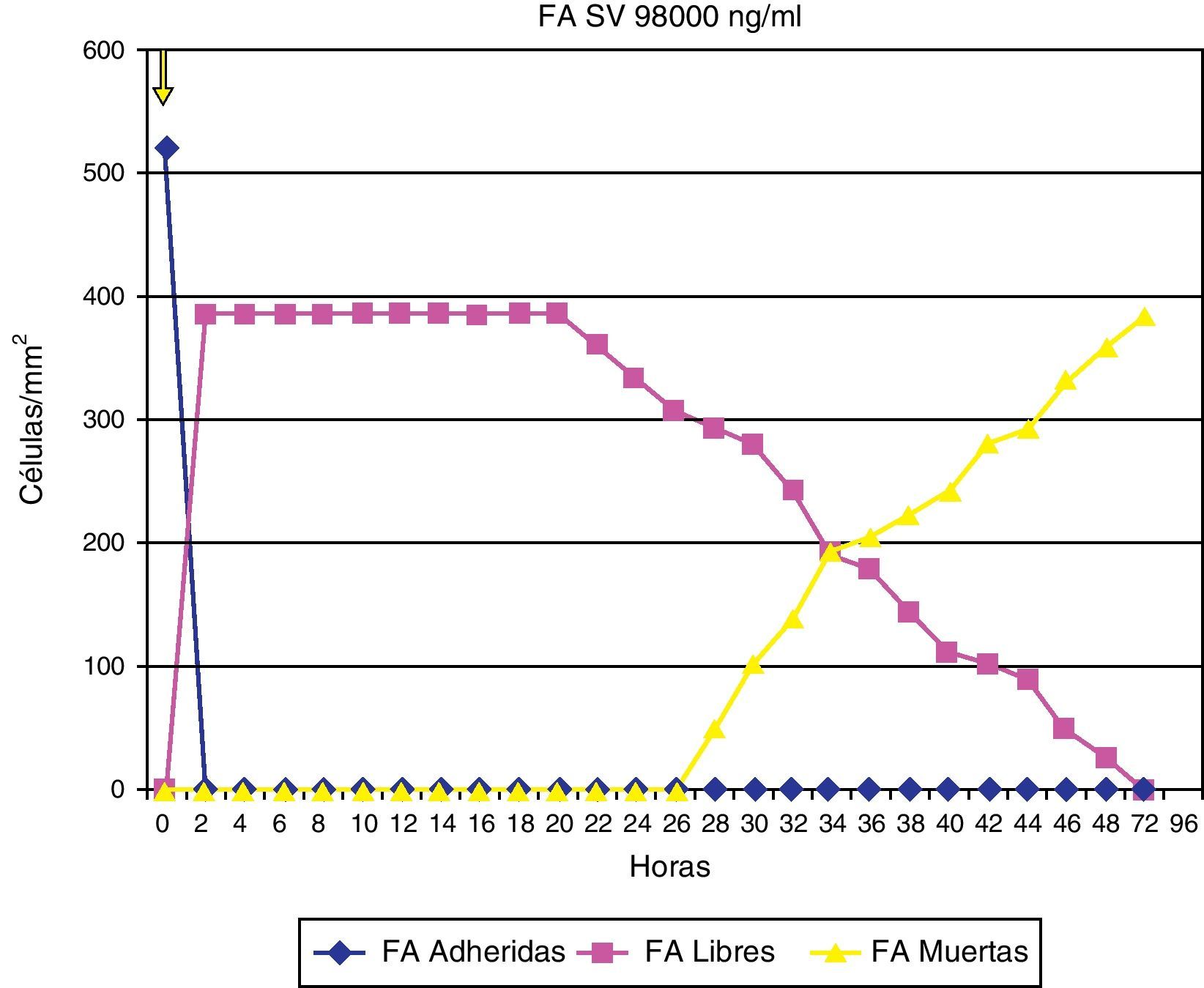
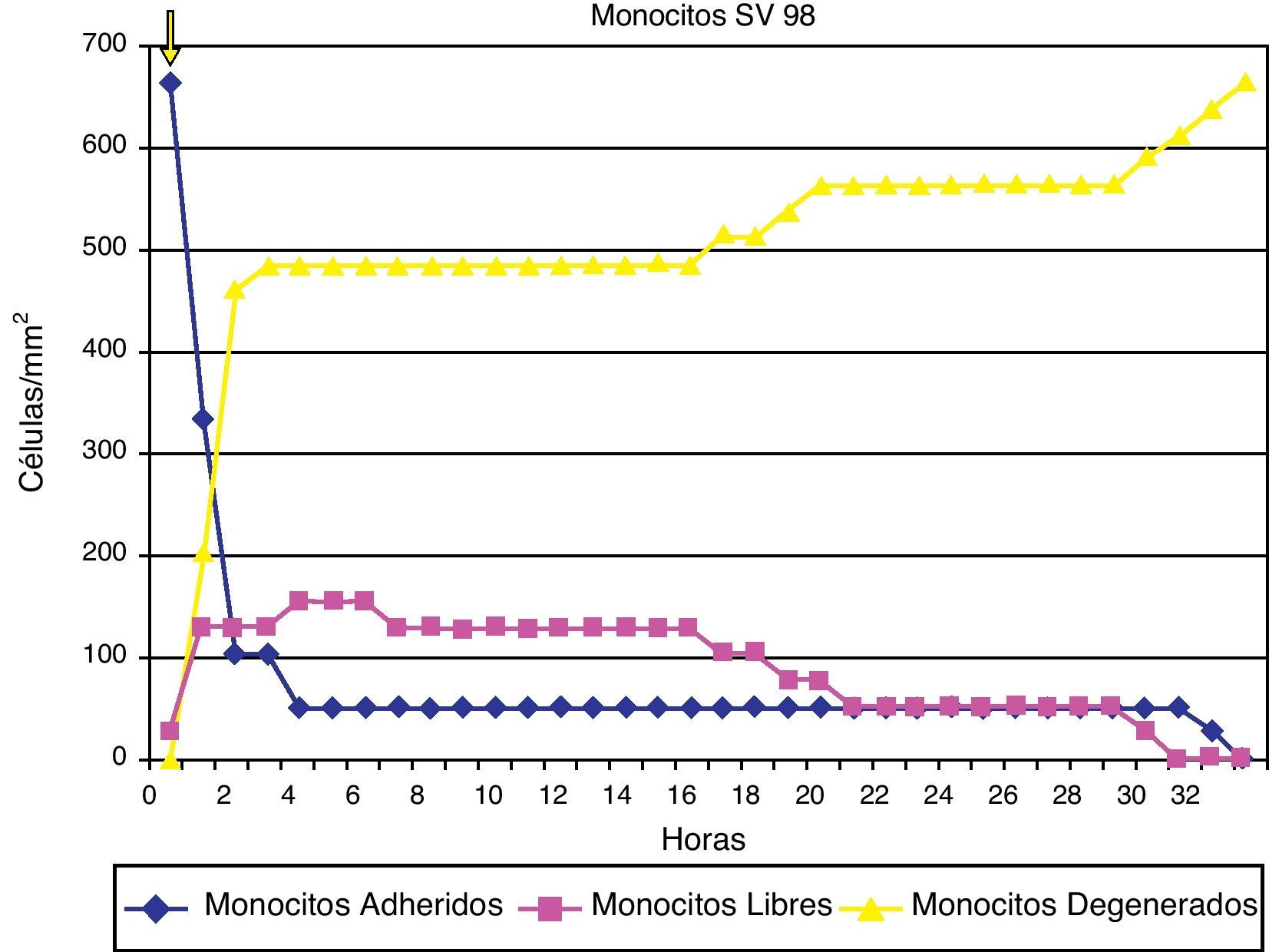
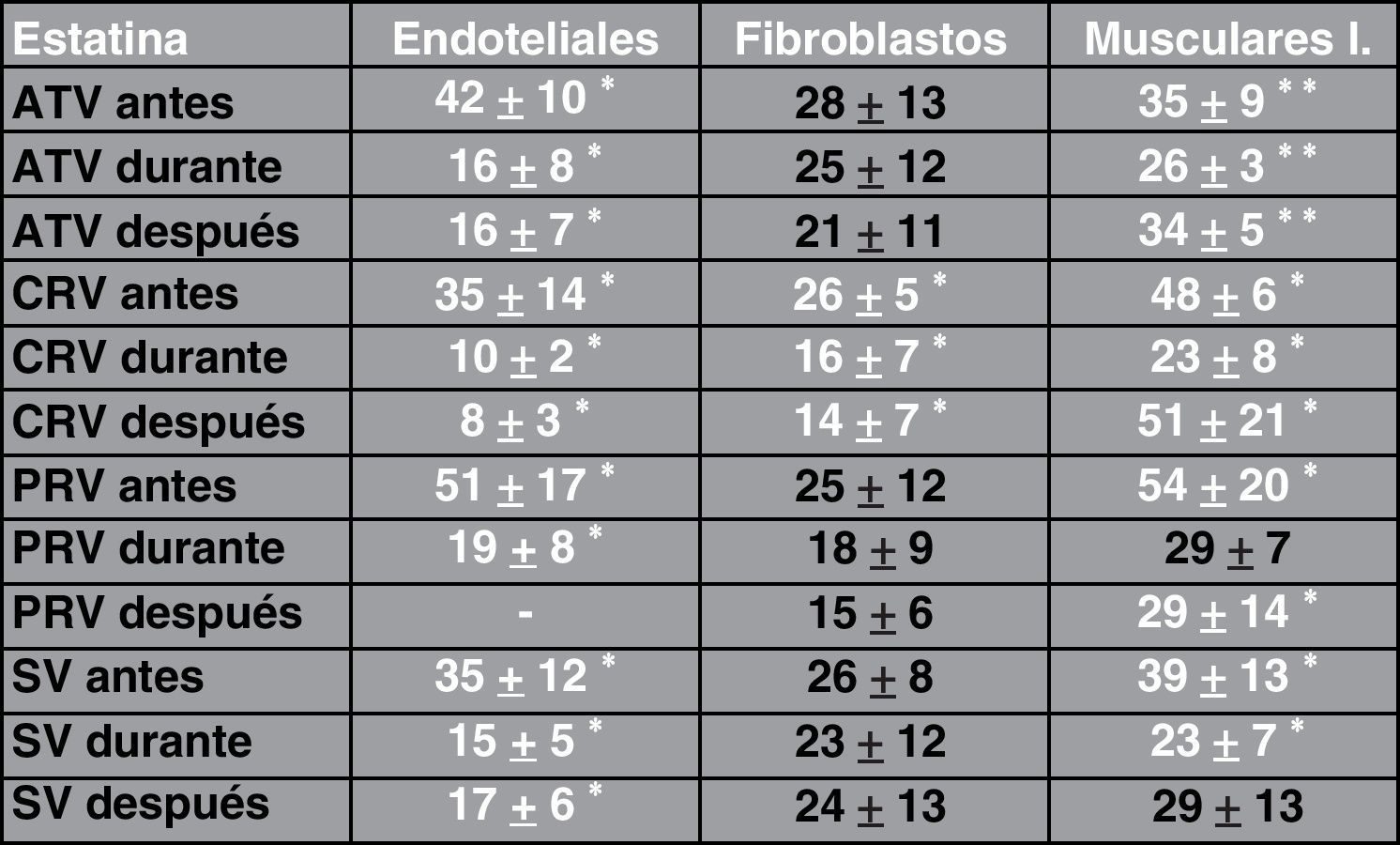
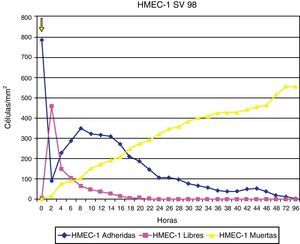
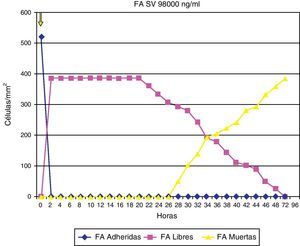
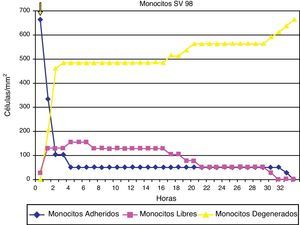
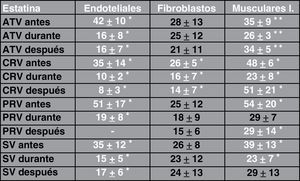
ResultadosAdherencia celularCuando se ha estudiado la adherencia al medio de las diferentes células (un ejemplo se muestra en la fig. 1), se han obtenido curvas de adherencia individualizadas para las distintas células y para las distintas estatinas a diferentes dosis.
En las figuras 2–4 se muestra una representación gráfica de las modificaciones en la adherencia celular encontradas en los cultivos de células endoteliales (fig. 2), fibroblastos (fig. 3) y células mononucleares (fig. 4). Las gráficas se refieren, en todos los casos, al cultivo en presencia de simvastatina (98μg/ml). Como se puede comprobar, existe una importante variabilidad en la respuesta celular al empleo in vitro de la estatina, de tal manera que el patrón de adherencia al medio varía de unas células a otras, a igual concentración del fármaco. Sin embargo, en términos generales se produce una pérdida brusca de adhesividad de forma inmediata, que es mucho más acusada en el caso de fibroblastos y mononucleares, y más atemperada en el caso de las células endoteliales, en las que es solo al cabo de las 72h del efecto cuando se alcanza el máximo resultado. Como queda reflejado, la pérdida de la adhesividad está condicionada, en una parte considerable, por la pérdida de viabilidad celular, aunque también es posible reconocer un efecto independiente sobre esta propiedad celular.
La movilidad de los diferentes tipos celulares ha sido estudiada en presencia de las estatinas ensayadas.
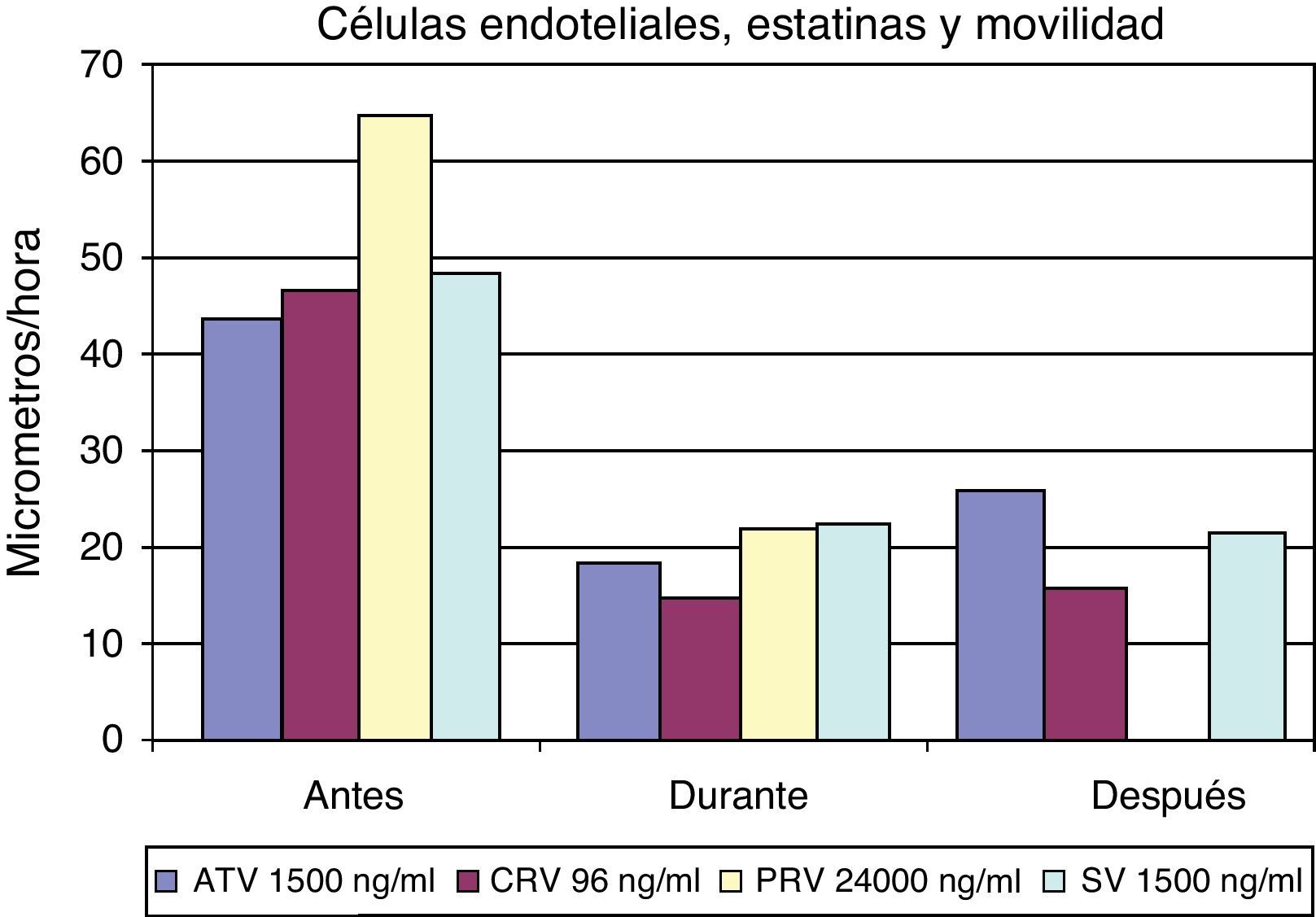
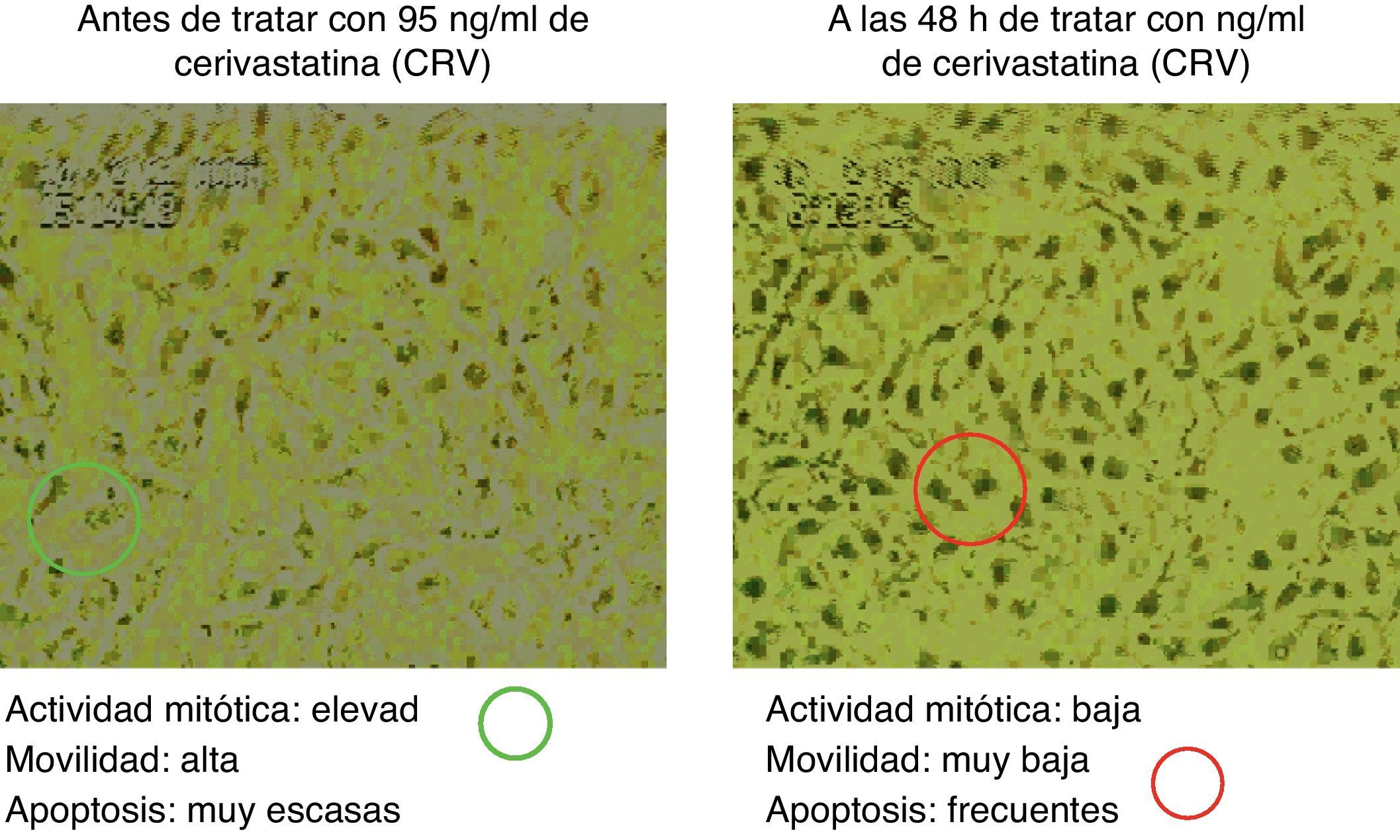
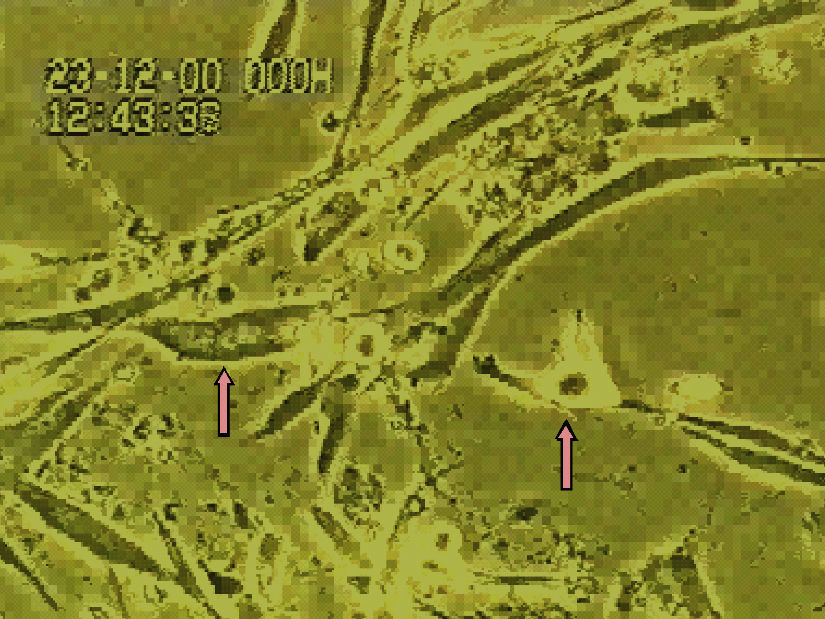
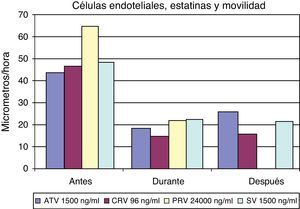
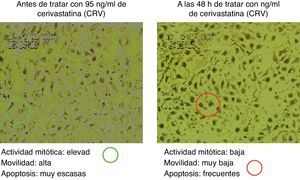
La figura 5 muestra los cambios en la movilidad inducidos en las células endoteliales por el influjo de distintas dosis de diferentes estatinas. Asimismo, en la figura 6 se muestra una secuencia concreta sobre cambios inducidos por la cerivastatina sobre células endoteliales humanas.
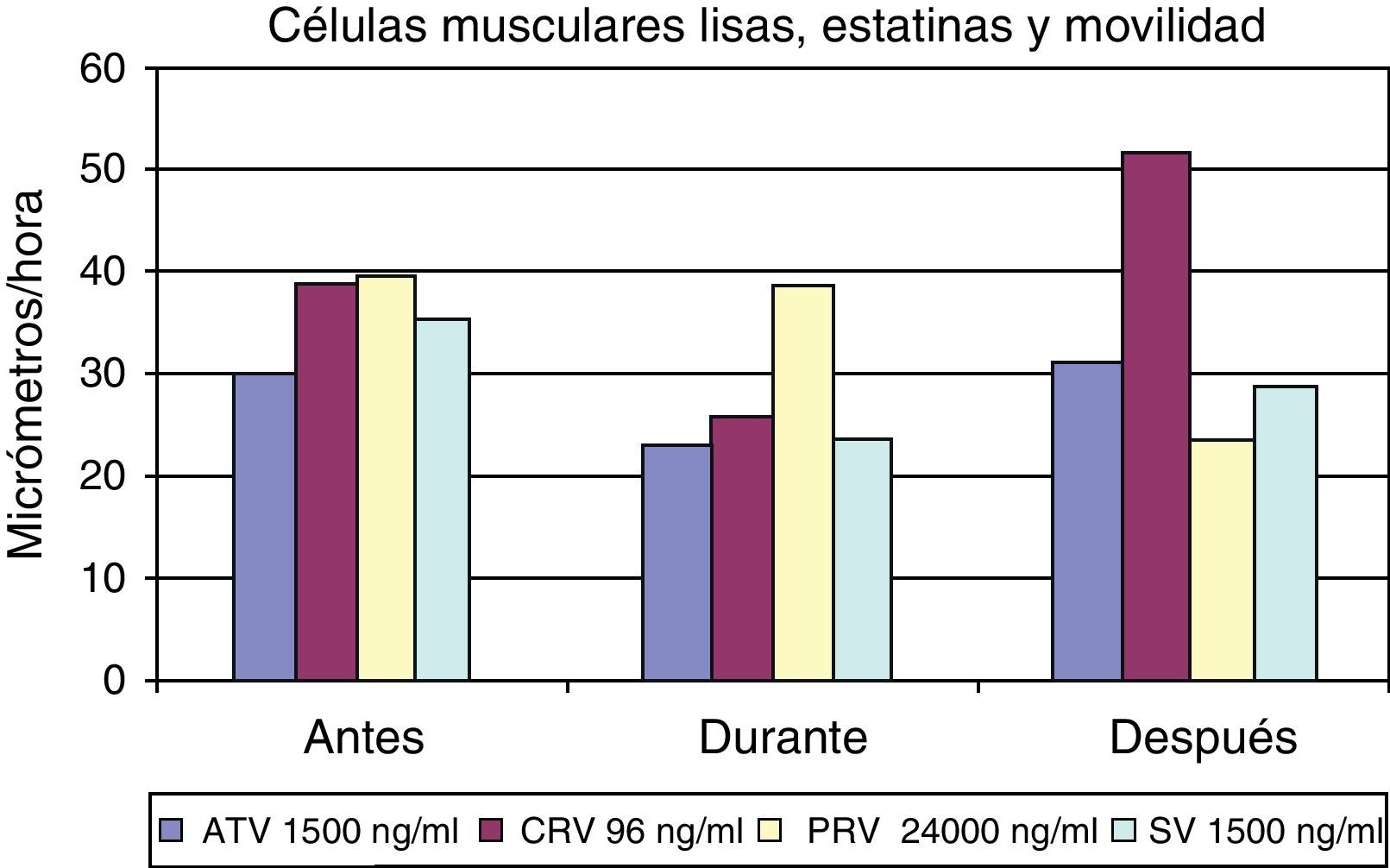
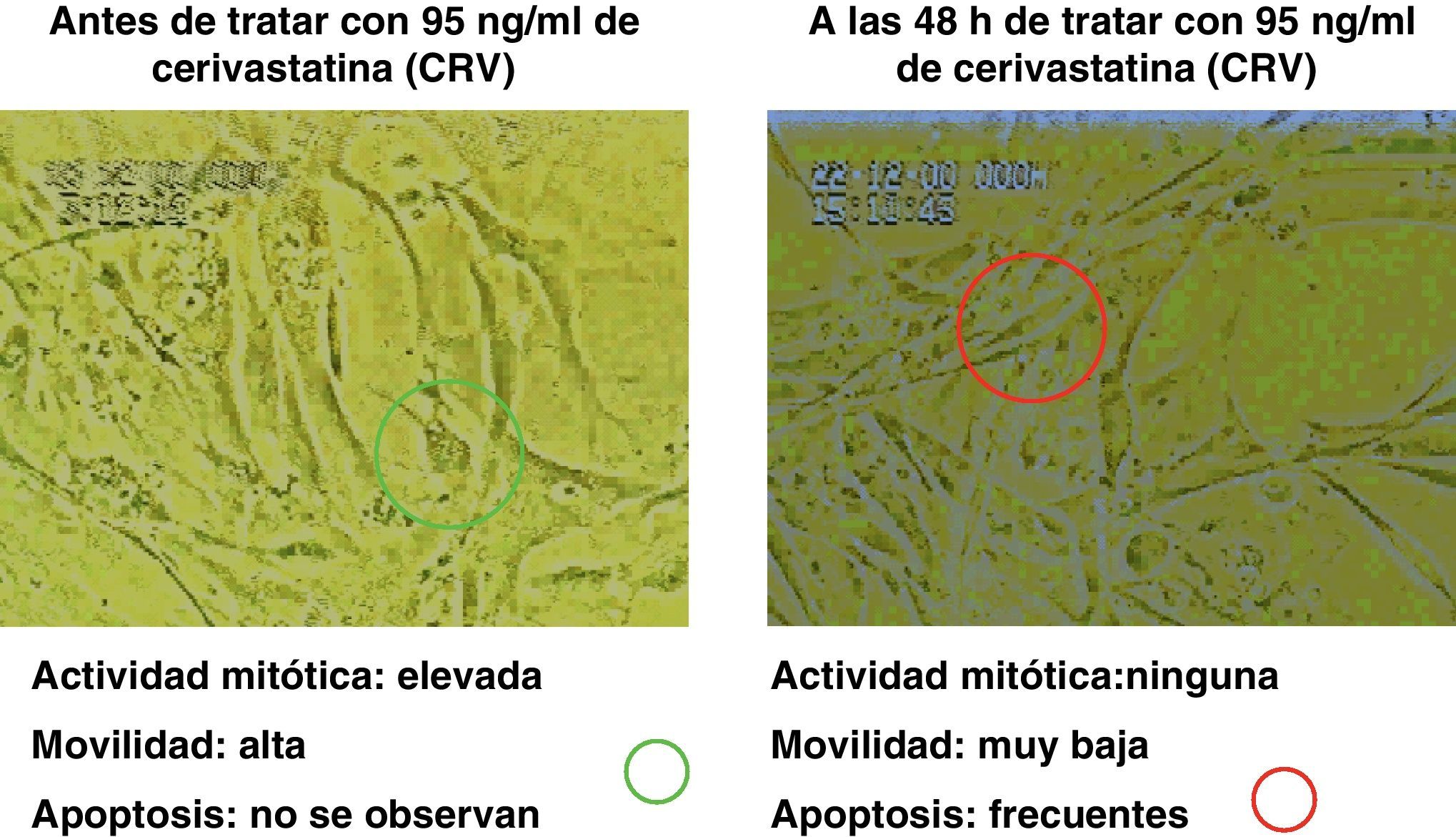
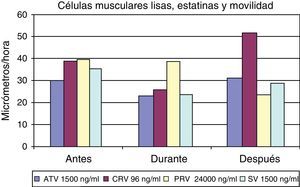
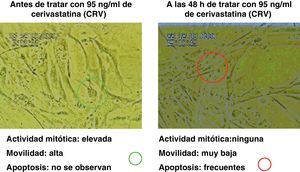
Los resultados inducidos sobre la movilidad de las células musculares lisas bajo el efecto de diferentes dosis de estatinas se muestran en la figura 7, y asimismo una secuencia específica con cerivastatina se muestra en la figura 8.
La técnica de videointervalometría permite el cálculo de la movilidad celular. Los resultados globales sobre la misma en las diferentes células, y con las distintas estatinas, se resumen en la figura 9. Del análisis de los resultados se desprende que los fibroblastos son el tipo celular cuya movilidad se encuentra menos influida por la presencia de estatinas. Por el contrario, todas las estatinas ensayadas logran inducir una disminución de la movilidad en las células endoteliales y en las células musculares lisas, si bien en estas últimas la recuperación de la movilidad normal es más rápida que en las células endoteliales.
Contractilidad de células musculares lisasLa contractilidad fue estudiada exclusivamente en las células musculares lisas, habida cuenta de la trascendencia que este proceso puede tener en los mecanismos de producción de la lesión vascular.
Se pudo observar una disminución de la contractilidad bajo el efecto de estatinas (se ensayó, por su singularidad, la cerivastatina a dosis de 96ng/ml), que se recuperó y se incrementó al suprimir el tratamiento (figura 10).
DiscusiónLas estatinas han demostrado ser uno de los medicamentos más útiles en la prevención de la arteriosclerosis y sus complicaciones. Todas tienen un mecanismo de acción común, que es el de la inhibición de la enzima 5 hidroximetil coenzima A reductasa, en un punto de la ruta metabólica que es fase limitante de la síntesis de colesterol e isoprenoides. En la clínica, su principal efecto consiste en disminuir la colesterolemia, reduciendo los niveles de LDL, aunque tienen menos (o nulo) efecto sobre otras fracciones lipídicas, como los triglicéridos o el colesterol unido a lipoproteínas de alta densidad.
La disminución de las LDL es clave para que no se produzca su paso al subendotelio y la subsiguiente modificación local de estas lipoproteínas, que se acepta como el primer acontecimiento trascendente que puede iniciar las modificaciones fisiopatológicas de la formación de la placa de ateroma y constituir un elemento patogénico decisivo.
Pero además de su actividad hipolipemiante, se han descrito para las estatinas una serie de efectos que han recibido la denominación de pleiotrópicos, y que parecen contribuir a comprender mejor otros aspectos beneficiosos del tratamiento con estos compuestos. Entre estos efectos se han descrito algunos que parecen afectar directamente al comportamiento celular (proliferación, apoptosis, adherencia, movilidad…), otros que influyen en la inducción de disfunción endotelial, la oxidación de LDL, la inflamación, la coagulación o, incluso, la osteogénesis14-16.
Las diferentes estatinas presentan, sin embargo, importantes diferencias de unas a otras por su procedencia, naturales o sintéticas, por su liposolubilidad, por su activación metabólica por la fracción del citocromo P-450, o por su propia actividad específica hipolipemiante. En consecuencia, también pueden ser distintos la intensidad y el tipo de los efectos pleiotrópicos.
El mecanismo implicado en estas acciones pleiotrópicas parece estar íntimamente unido al bloqueo de la 3-HMG-CoA-R. La inhibición de la síntesis del ácido mevalónico disminuye la formación de diversos isoprenoides que regulan distintas funciones celulares, como la isopenteniladenosina, el geranil geranilo pirofosfato y el farnesil pirofosfato. Estos dos últimos regulan la isoprenilación de dolicoles (participan en la síntesis de glucoproteínas), ubiquinona y hemo A (participan en la cadena transportadora de electrones) y diversas proteínas de señalización intracelulares (proteínas de pequeño tamaño), necesarias para la proliferación y diferenciación celular, la expresión genética, el ensamblaje del citoesqueleto, el transporte de lípidos y proteínas, y la fibrinólisis10,17-20. La ispoprenilación es un paso fundamental en la actividad de algunas proteínas (Rho), que determina su localización subcelular y su transferencia desde su localización intracelular hacia la membrana celular. Las proteínas Rho/Ras se encuentran en dos conformaciones: una forma inactiva ligada a guanosina difosfato (GDP) y una activa ligada a guanosina trifosfato (GTP). Las estatinas inhiben la prenilación y la translocación de estas proteínas, lo que conlleva cambios en la actina del citoesqueleto, disminuye la proliferación y la migración celular, y aumenta la expresión de la óxido nítrico sintetasa endotelial (NOSe)18,19.
Una gran parte de los efectos pleiotrópicos pueden tener su fundamento en estas alteraciones bioquímico-estructurales, y ello puede condicionar la modificación de la conducta y del comportamiento (características morfodinámicas) en las células que tienen un mayor protagonismo en el proceso aterogénico. En el fondo late la idea de que las estatinas pueden provocar modificaciones celulares que condicionen los cambios en la tasa de proliferación, en la muerte celular programada (apoptosis) o en su movilidad y adherencia. Y estos fenómenos pueden ser especialmente trascendentes cuando afecten al endotelio, a la fibra muscular lisa, al fibroblasto o al mononuclear, toda vez que son células directamente implicadas en el inicio y desarrollo de la aterosclerosis.
En nuestro estudio hemos comprobado que, en efecto, la adherencia celular de las distintas células, así como la movilidad y —para las células musculares lisas— la contractilidad son modificadas por el efecto de las estatinas. Es verdad que tales modificaciones dependen, en su grado e intensidad, de la estatina y de la dosis específicamente empleada, pero se puede observar fácilmente un efecto de clase, que puede ser responsable del comportamiento asociado a los conocidos como efectos pleiotrópicos.
En la práctica esto puede significar que los inhibidores de la 3-HMG-CoA-R podrían afectar de manera diferente al comportamiento celular de las distintas células implicadas en la formación de la placa de ateroma, y que estas diferencias podrían aclarar los efectos que las estatinas tienen sobre distintos aspectos que controlan la aterogénesis.
FinanciaciónTrabajo financiado por la Beca Pfizer otorgada por la Fundación Española de Arteriosclerosis-Sociedad Española de Arteriosclerosis. Convocatoria 2007.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.