La implicación de un mayor riesgo cardiovascular en algunas enfermedades dermatológicas ha sido evidenciada en las últimas décadas. Enfermedades como la psoriasis y el lupus eritematoso sistémico se encuentran actualmente incluidas en las guías de prevención de la enfermedad cardiovascular. Otras enfermedades como la alopecia androgénica, el síndrome del ovario poliquístico, la hidrosadenitis supurativa o el liquen plano disponen de numerosos estudios que apuntan a un mayor riesgo en estos pacientes, aunque todavía no han sido incluidas en estas guías. En el presente artículo se realiza una revisión de las evidencias que avalan esta asociación, con el objeto de advertir al clínico sobre la necesidad de un mayor control de los factores de riesgo cardiovascular en estos pacientes.
The increased cardiovascular risk in some dermatological diseases has been demonstrated in recent decades. Diseases such as psoriasis and systemic lupus erythematosus are currently included in the guidelines for prevention of cardiovascular disease. Other diseases such as androgenic alopecia, polycystic ovary syndrome, hidradenitis suppurativa or lichen planus have numerous studies that point to an increased risk, however, they have not been included in these guidelines. In this article we review the evidence supporting this association, in order to alert the clinician to the need for greater control in cardiovascular risk factors in these patients.
En los últimos años la implicación de diversas enfermedades dermatológicas en la presencia de un mayor riesgo cardiovascular (RCV) y su asociación con el síndrome metabólico (SM) (tabla 1) han centrado el interés de numerosos estudios. La posible relación de enfermedades como la psoriasis, el lupus eritematoso sistémico (LES), la alopecia androgénica (AA), el síndrome del ovario poliquístico (SOP), la hidrosadenitis supurativa (HS), el liquen plano (LP), la dermatitis atópica (DA) o la urticaria crónica (UC) ha sido ampliamente estudiada (tabla 2). La psoriasis y el LES ya se encuentran incluidos como factores de riesgo independientes en la última revisión de la Guía Europea para la prevención de la enfermedad cardiovascular propuesta por la European Society of Cardiology y la European Atherosclerosis Society1. Por otro lado, la utilización de fármacos sistémicos que modifican los parámetros implicados en el SM hace necesario un control cardiovascular más estricto en estos pacientes.
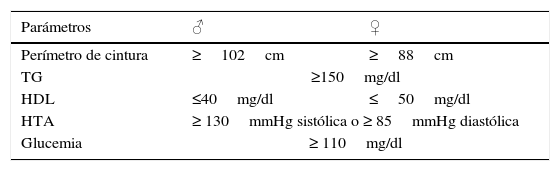
Criterios diagnósticos del síndrome metabólico132
| Parámetros | ♂ | ♀ |
|---|---|---|
| Perímetro de cintura | ≥102cm | ≥88cm |
| TG | ≥150mg/dl | |
| HDL | ≤40mg/dl | ≤50mg/dl |
| HTA | ≥ 130mmHg sistólica o ≥ 85mmHg diastólica | |
| Glucemia | ≥ 110mg/dl | |
HDL: lipoproteínas de alta densidad; HTA: hipertensión arterial; TG: triglicéridos.
Enfermedades dermatológicas con riesgo cardiovascular
| Grado de recomendación | Alteraciones | |
|---|---|---|
| Incluidas en guías RCV | ||
| Psoriasis | A | SM, DM, HTA, IAM |
| Lupus eritematoso sistémico | A | SM, ateromatosis carotídea, ECV, mortalidad CV, resistencia a la insulina, HTA, ↑TG y VLDL, disfunción endotelial, ↑marcadores proinflamatorios |
| No incluidas en guías RCV | ||
| Alopecia androgénica | A | SM, enfermedad coronaria, ateromatosis carotídea, hiperinsulinemia, ↑resistencia insulina, ↑rigidez vascular, ↑CT, ↑TG, ↑PAS y PAD |
| Síndrome del ovario poliquístico | A | SM, DM, HTA, AE subclínica, hiperinsulinemia, ↑resistencia insulina, dislipidemia, ↑marcadores proinflamatorios |
| Hidrosadenitis supurativa | B | SM, obesidad, intolerancia glucosa, ↑TG |
| Liquen plano | B (dislipidemia) | ↑TG, ↑CT, ↑LDL, ↓HDL, ↑PCR, ↑VSG, ↑fibrinógeno y homocisteína |
| Dermatitis atópica | D | DM, ↑CT, ↑LDL |
| Urticaria crónica | C | SM |
AE: arteriosclerosis; CT: colesterol total; CV: cardiovascular; DM: diabetes mellitus; ECV: episodios cardiovasculares; HDL: lipoproteínas de alta densidad; HTA: hipertensión arterial; IAM: infarto agudo de miocardio; LDL: lipoproteínas de baja densidad; PAD: presión arterial diastólica; PAS: presión arterial sistólica; PCR: proteína C reactiva; RCV: riesgo cardiovascular; TG: triglicéridos; VLDL: lipoproteínas de muy baja densidad; VSG: velocidad de sedimentación globular.
Clasificación según los grados de recomendación basados en niveles de evidencia de Sackett133. Alteraciones descritas en las distintas patologías.
Existen numerosas alteraciones cutáneas asociadas a la obesidad o la diabetes mellitus (DM) que se consideran secundarias a estas patologías. La xerosis cutánea, los fibromas péndulos y acrocordones, las estrías de distensión, la pseudoacantosis nigricans o el intertrigo son claros ejemplos de ello. Mención aparte merecen ciertas enfermedades dermatológicas a las que se ha atribuido un RCV inherente a la propia enfermedad.
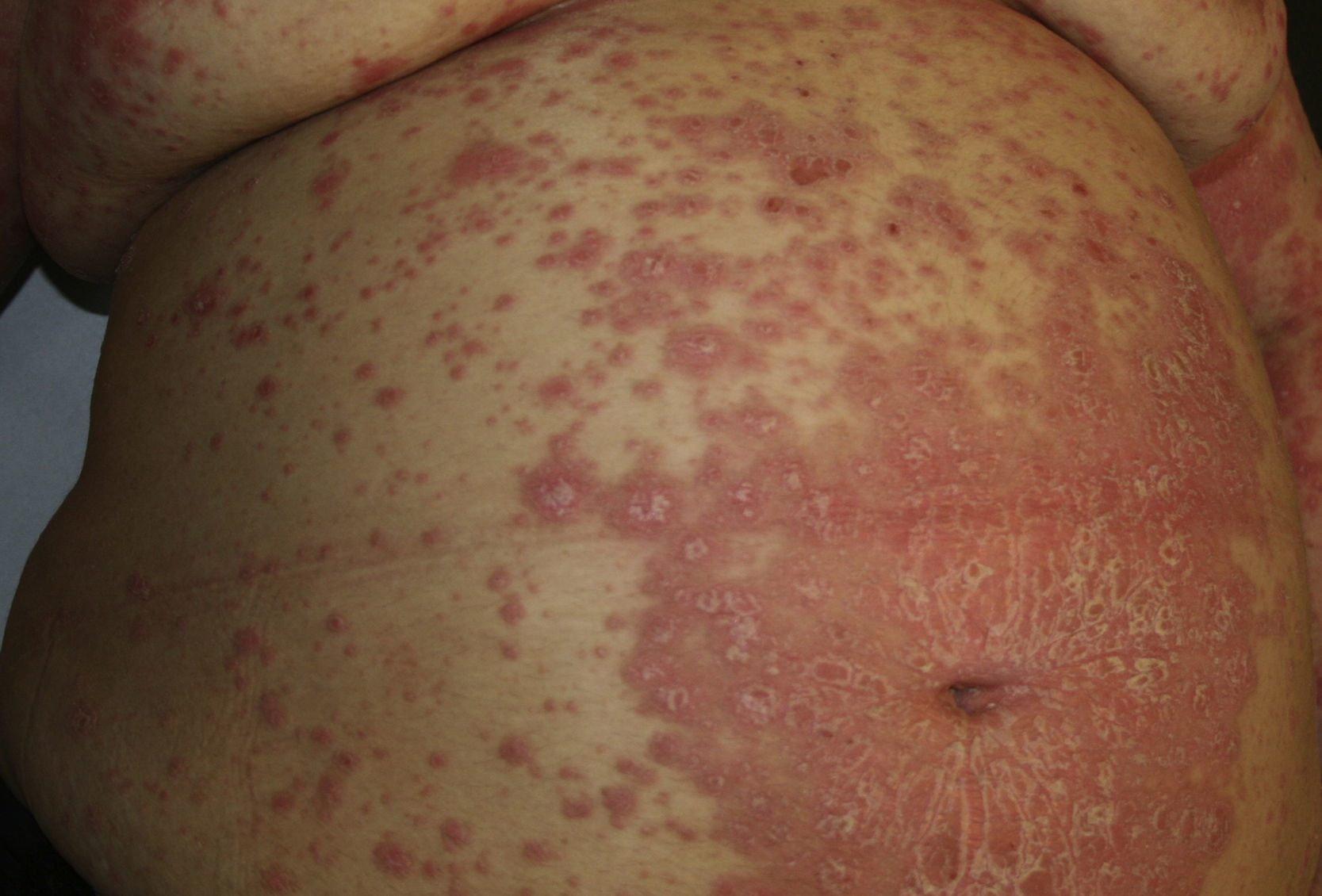
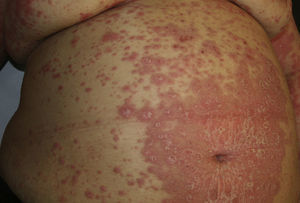
PsoriasisLa creciente evidencia epidemiológica de que la psoriasis moderada-grave constituye un factor de riesgo independiente de enfermedad y muerte cardiovascular, especialmente en pacientes jóvenes2, ha motivado su inclusión en recientes guías de prevención cardiovascular1.
La psoriasis (fig. 1) se asocia con diversos estados proinflamatorios crónicos como el SM, la DM, la hipertensión arterial (HTA) o el infarto de miocardio3. Además, otros factores de RCV independientes, como el tabaquismo o el consumo elevado de alcohol, son también más frecuentes en estos pacientes4,5.
Los pacientes con psoriasis presentan niveles elevados en sangre y piel de factor de necrosis tumoral alfa (TNF-α) y citoquinas T-helper (Th)-1 y Th-17. Estas citoquinas a su vez favorecen la resistencia a la insulina y son mediadores en la angiogénesis, adipogénesis y metabolismo lipídico. Las hormonas y las citoquinas producidas en condiciones de obesidad, diabetes o arteriosclerosis proporcionan también un ambiente proinflamatorio que favorece el desarrollo y la gravedad de la psoriasis5.
Se ha evidenciado que el adecuado control y tratamiento de la psoriasis moderada-grave puede reducir el riesgo de enfermedad cardiovascular2. El empleo de metotrexato y fármacos anti-TNF-α ha mostrado una disminución en el número de episodios cardiovasculares6. Otros tratamientos, como el acitretino o la ciclosporina, pueden empeorar el perfil lipídico, la HTA o la resistencia a la insulina6,7, aunque no se hayan asociado a un mayor RCV global.
Lupus y síndrome antifosfolípidoEl LES y el síndrome antifosfolípido son patologías dermatológicas con una relación claramente establecida con un mayor RCV y presentes en las guías de prevención de enfermedad cardiovascular1. Dado que han sido tratadas en publicaciones recientes de esta revista, no nos extenderemos mucho en este punto, pero es importante recordar su asociación con un riesgo de enfermedad cardiovascular entre 7,5-17 veces superior al de la población general (incluso ajustándolo por los factores de riesgo Framingham)8.
El LES se caracteriza por una elevación de los marcadores inflamatorios sistémicos, mayor riesgo de rigidez arterial y disfunción endotelial, arteriosclerosis carotídea, SM, HTA9-20 y el llamado patrón lipídico del lupus, que se caracteriza por elevados niveles de VLDL y triglicéridos con niveles normales o bajos de HDL y LDL21. El RCV se ha mostrado mayor cuando se presenta la asociación de lupus eritematoso con síndrome antifosfolípido22.
Alopecia androgénicaLa AA se considera un factor de riesgo independiente para enfermedad coronaria (OR=1,22; IC95%: 1,07-1,39), ateromatosis carotídea (OR=5,5; IC95%: 1,4-21,9), hiperinsulinemia (OR=1,97; IC95%: 1,20-3,21), resistencia a la insulina (OR=4,88; IC95%: 2,05-11,64) y SM (OR=4,49; IC95%: 2,36-8,53)23,24. Además, los individuos con AA tienen mayor rigidez vascular (medida mediante el cardio-ankle vascular index [CAVI])25, niveles más elevados de colesterol sérico (OR=1,60; IC95%: 1,17-2,21), triglicéridos (OR=2,07; IC95%: 1,32-3,25), presiones sistólicas (OR =1,73; IC95%: 1,29-2,33) y diastólicas (OR=1,59; IC95%: 1,16-2,18)23,24,26-30. Los altos niveles de aldosterona27,31 podrían también justificar alteraciones en la presión arterial en estos pacientes.
Aunque mayoritariamente los estudios son en varones24,26,30,32-35, recientemente numerosas publicaciones reflejan alteraciones similares del perfil lipídico28,33, resistencia a la insulina34, HTA e hiperaldosteronismo27,31, factores proinflamatorios27 y SM27 en mujeres con AA, asociando mayor riesgo de enfermedad coronaria36,37. El riesgo parece además mayor en pacientes con una mayor gravedad clínica23,29,32 e inicio precoz de la AA27,29.
El mecanismo etiopatogénico común aún no ha sido esclarecido. Algunos autores apuntan a la alopecia como un signo de envejecimiento prematuro23. Dada la elevada tasa de AA en varones jóvenes y la presencia de un mayor riesgo en aquellos con inicio precoz, parece poco probable que esta sea la única causa. Otros autores apuntan a la alteración de factores (perfil lipídico, perímetro de cintura, HTA, hiperinsulinemia y resistencia a la insulina) que conllevarían la formación de la placa de ateroma28 y vasoconstricción, generando a su vez un déficit nutricional y miniaturización del folículo piloso38. Además, el aumento de la sensibilidad vascular periférica a los andrógenos de la AA39 podría afectar a los vasos coronarios, estimulando la producción de músculo liso en la pared vascular40 y favoreciendo la ateromatosis y la HTA.
Actualmente la AA no se encuentra incluida en las guías de prevención de RCV, aunque la mayor parte de los estudios y metaanálisis recomiendan el cribado y tratamiento precoz de factores de riesgo en aquellos pacientes con AA con un grado iii o superior en la escala de gravedad de Ebling para varones o de ii-iii en la escala de Ludwig41 para mujeres.
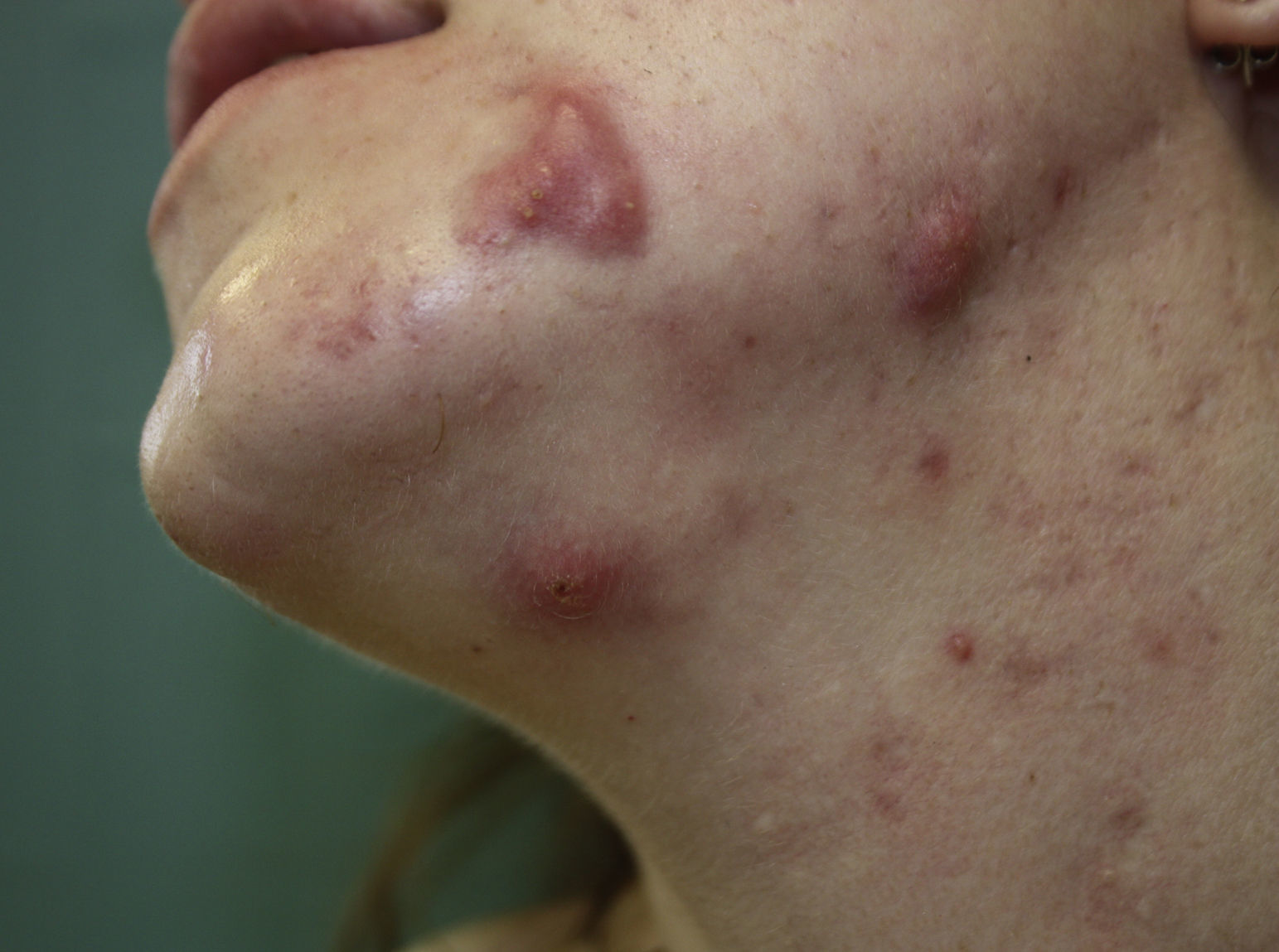
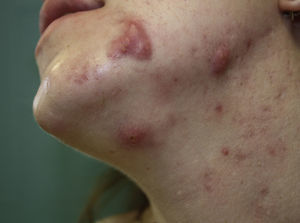
Síndrome del ovario poliquísticoEl SOP es una enfermedad muy frecuente, estimándose una prevalencia de 6-20% en la mujer en edad reproductiva42,43. Se caracteriza por la presencia de hiperandrogenismo y anovulación crónica, que se manifiesta clínicamente como acné, hirsutismo, irregularidades menstruales e infertilidad (fig. 2). Numerosos estudios avalan su asociación con obesidad, resistencia a la insulina, hiperinsulinemia y mayor riesgo de SM, DM tipo2 (DM2), arteriosclerosis subclínica, dislipidemia, HTA y elevación de marcadores inflamatorios43-51. Los criterios diagnósticos propuestos en el Consenso de Rotterdam52 incluyen al menos 2 de los siguientes: a)hiperandrogenismo clínico o analítico; b)oligomenorrea o anovulación, y c)imágenes de ovario poliquístico ecográfico. Parece claro que, entre los distintos fenotipos, las pacientes con predominio del hiperandrogenismo presentan un mayor riesgo de alteraciones metabólicas53,54.
En el SOP la hiperinsulinemia parece desempeñar un papel fundamental en el daño vascular. La disminución de la producción y liberación de óxido nítrico en las células endoteliales, sumada a la producción de agentes vasoconstrictores, aumenta la rigidez vascular y disminuye la capacidad vasodilatadora55. Además, el efecto de la hiperinsulinemia como hipertrofiante del endotelio y del músculo liso vascular condiciona una disfunción vasculoendotelial significativa en estas pacientes56.
Recientes consensos de la Androgen Excess y Polycystic Ovary Syndrome (AE-PCOS) Society estipulan un control regular mediante test de tolerancia oral a glucosa en pacientes con SOP>40años con antecedente de diabetes gestacional o antecedente familiar de DM2, sin estar indicado realizar controles de insulina sérica57,58. En estas pacientes el tratamiento activo con metformina ha mostrado mejorar la sensibilidad hepática y de tejidos periféricos a la insulina, efectos directos sobre la esteroidogénesis ovárica y mejoría de los marcadores aterogénicos59,60, aunque no es un tratamiento efectivo sobre la clínica cutánea42. Parece fundamental la prevención primaria encaminada a modificar los hábitos y el estilo de vida61,62, siendo un objetivo prioritario en estas pacientes para reducir el RCV, especialmente si hay un uso concomitante de anticonceptivos orales.
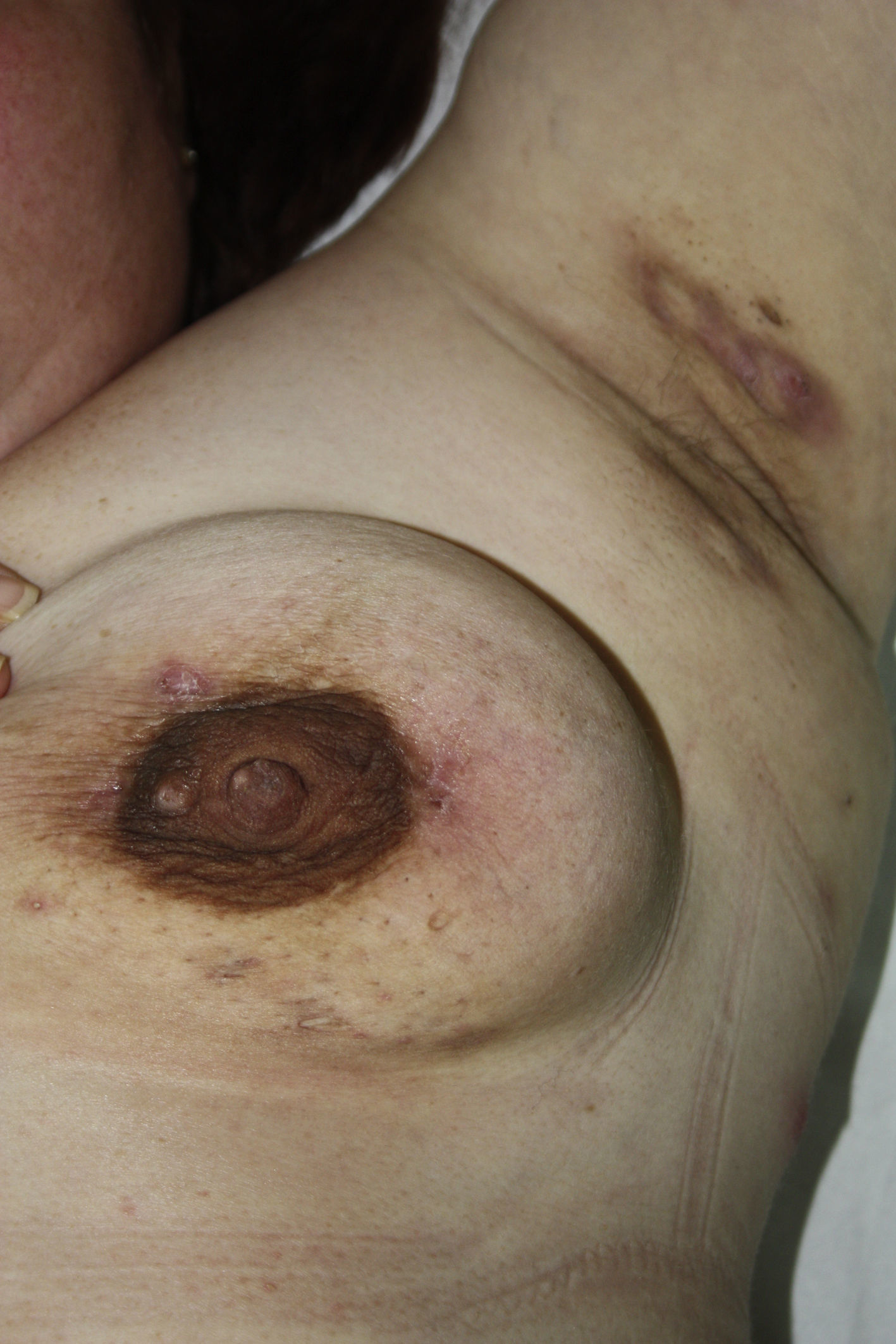
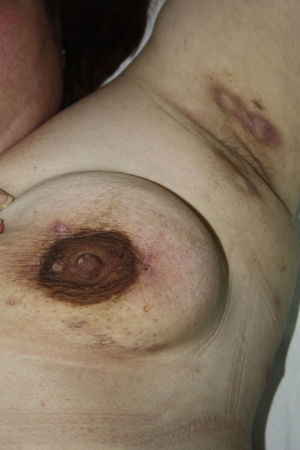
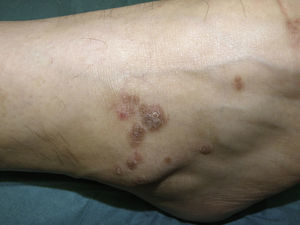
Hidrosadenitis supurativaLa HS, o acné inversa, es una enfermedad inflamatoria crónica caracterizada por lesiones abscesiformes, cicatrices y trayectos fistulosos de predominio en zonas intertriginosas (fig. 3). Tanto el tabaco como la obesidad son factores de riesgo para su desarrollo y empeoramiento63-65. Recientes estudios evidencian su asociación con un mayor riesgo de SM66,67 (OR=2,37; IC95%: 1,62-3,47), hipertrigliceridemia (OR=2,4; IC95%: 1,6-3,6)66,67, obesidad (OR=3,6; IC95%: 2,2-5,6)66-68 e intolerancia a la glucosa (OR=2,0; IC95%: 1,3-2,9)66,67, con valores ajustados por sexo y edad. La asociación con bajos niveles de HDL o HTA ha mostrado resultados variables según los estudios66-68.
A diferencia de lo que sucede con la psoriasis, el riesgo de padecer SM no se encuentra claramente asociado con la gravedad ni con la duración de la enfermedad66,67. La prevalencia de SM parece ser también superior a la hallada en psoriasis, afectando además con frecuencia a poblaciones más jóvenes66.
La etiopatogenia de esta relación no solo se basa en el estado proinflamatorio, sino que parece haber alteraciones inmunes específicas comunes. La HS se caracteriza por una expresión anómala de péptidos antimicrobianos, deficiencia de IL-20 e IL-22 y niveles elevados de IL-1069-71. Al igual que en la psoriasis, se ha demostrado la presencia de altos niveles de IL-12 e IL-23 debido a una inflamación mediada por células Th-1 y Th-1772. La respuesta de la enfermedad a tratamientos como los anti-TNF-α y anti-IL-12/23 confirmaría dicha asociación73-76. Estas anomalías inmunológicas han sido implicadas además en la alteración del metabolismo lipídico, la resistencia a la insulina y la adipogénesis77; de hecho, el uso de la metformina ha mostrado utilidad en el tratamiento de la HS78. En una publicación reciente se muestra una disminución significativa de las células progenitoras endoteliales circulantes79 en pacientes con HS, reduciendo la capacidad de reparación endotelial y contribuyendo así a la disfunción del endotelio vascular. Queda por dilucidar en nuevos estudios si la HS es la causa o la propia consecuencia del SM, aunque parece clara la necesidad de control de factores de riesgo en estos pacientes.
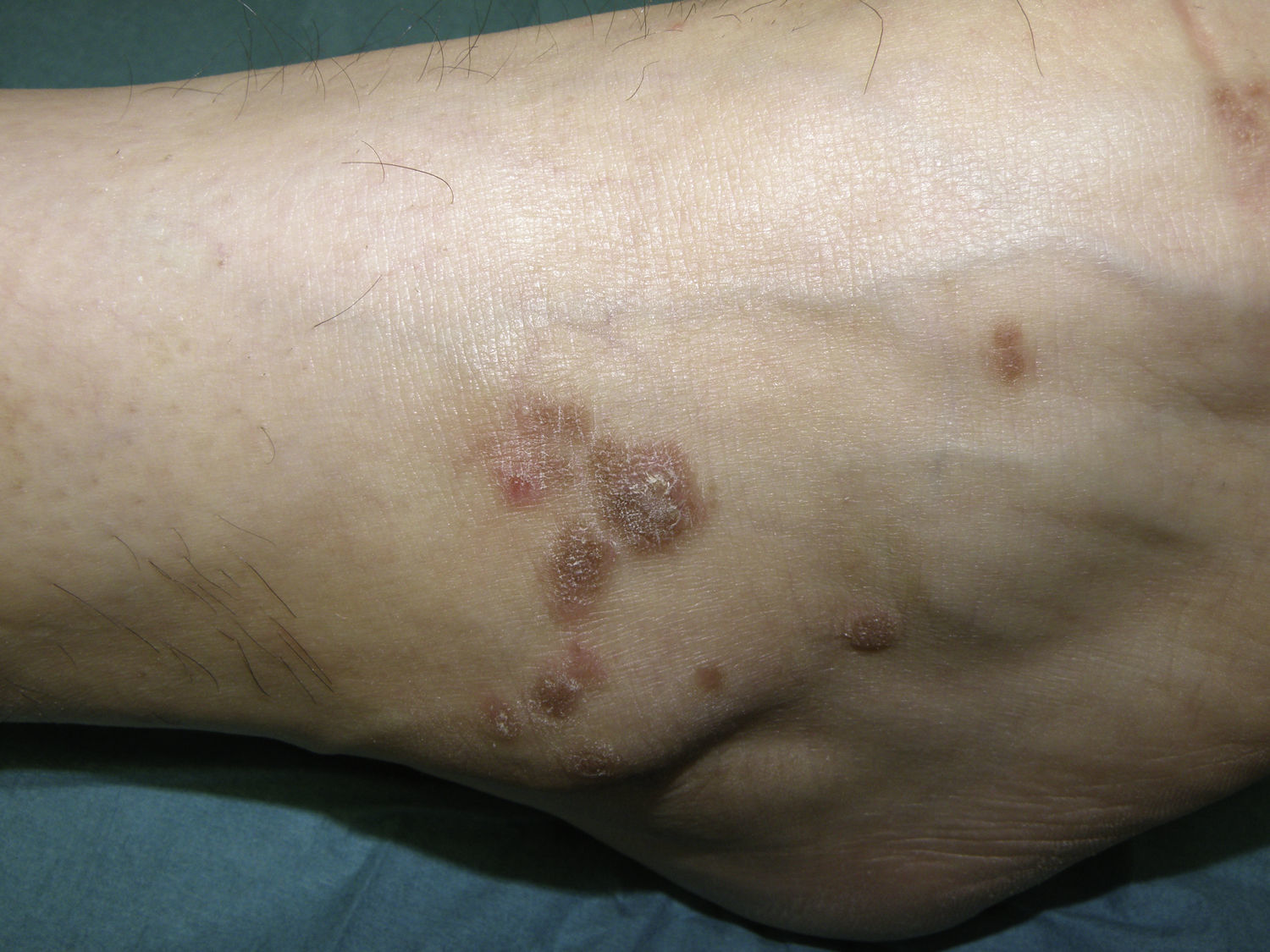
Liquen planoEl LP es una enfermedad inflamatoria crónica de etiología desconocida que puede afectar a la piel, el folículo piloso, la uña y la mucosa oral o genital (fig. 4). Existen numerosas variantes clínicas, entre ellas la erosiva, las reacciones liquenoides a fármacos y la reacción liquenoide injerto contra huésped.
Recientes estudios de casos y controles, incluyendo uno con 4.333 pacientes80, muestran la presencia de un mayor riesgo de siendo entre 1,21-3,03 veces superior según los estudios80-82. Las alteraciones asociadas con más frecuencia son hipertrigliceridemia, colesterol total y colesterol LDL elevados, con bajos niveles de colesterol HDL81. Estos hallazgos son similares a los objetivados en el LP oral83,84. Es frecuente también la elevación de marcadores inflamatorios como la proteína C reactiva (PCR), la velocidad de sedimentación globular (VSG), el fibrinógeno y la homocisteína82,85. Aunque estudios previos mostraron una posible asociación del LP y LP oral con diabetes86,87, publicaciones más recientes no encuentran una relación estadísticamente significativa82. Su asociación con el SM es también controvertida, variando los resultados según los estudios82,85. No se ha establecido relación significativa con la HTA, la obesidad centroabdominal y los episodios cardiovasculares82.
Es importante tener en cuenta en la lectura crítica de estos estudios la distinción entre LP y erupción liquenoide. Las erupciones liquenoides pueden producirse por algunos fármacos utilizados en el tratamiento de la, la HTA y la hiperuricemia (p.ej., alopurinol, inhibidores de la enzima conversora de angiotensina, diuréticos, betabloqueantes, estatinas…). También algunos fármacos utilizados en el tratamiento del LP (p.ej., corticosteroides, metotrexato, ácido retinoico) pueden producir alteraciones metabólicas. Son pocos los estudios que excluyen o analizan de forma separada a estos pacientes81-84.
La etiopatogenia de las alteraciones metabólicas no se encuentra aún establecida, lo cual es lógico teniendo en cuenta que la propia etiopatogenia del liquen es aún parcialmente desconocida. Algunas de las alteraciones subyacentes en esta enfermedad, como son el predominio de linfocitos Th-1, la elevación del TNF-α, y las IL-6, IL-10 e IL-4, podrían explicar parcialmente este proceso80-82,88.
Dermatitis atópicaLa DA es la enfermedad inflamatoria crónica más común en la infancia, afectando en torno al 15-20% de la población pediátrica89. La prevalencia en la población adulta es significativamente menor (3%), aunque estos pacientes suelen presentar fenotipos más graves y resistentes a tratamientos. Se considera la manifestación más precoz de la llamada atopia o «marcha atópica», constituida por la DA, la rinitis alérgica, la alergia alimentaria y el asma alérgica. La disfunción de la barrera epidérmica y las alteraciones inmunes desempeñan un papel fundamental en esta enfermedad, donde la xerosis cutánea, el prurito y la sobreinfección de las lesiones forman la clínica cardinal.
Existe un predominio inflamatorio de eosinófilos y linfocitos Th-2 con sobreexpresión de IL-4, IL-13 y receptores de IgE89. Además, la asociación con mutaciones en el gen de la filagrina (FLG), localizado en el cromosoma 1q2190, ha sido ampliamente descrita, lo que explicaría la elevada frecuencia de antecedentes familiares de atopia o DA.
La DA se ha asociado con numerosas enfermedades sistémicas, como la gastroenteritis eosinofílica y enfermedades inflamatorias intestinales91,92, la tiroiditis autoinmune93 y el síndrome nefrótico idiopático94. En un estudio en pacientes escolares la atopia se asoció a niveles séricos elevados de colesterol total y LDL95. Otras investigaciones han relacionado la obesidad con una mayor gravedad y peor control de pacientes asmáticos96. Se han detectado además niveles elevados de IgE en pacientes con enfermedad coronaria97, así como tras la realización de un bypass98 o la colocación de un stent coronario99, sugiriendo que se trata de una reacción específica al daño coronario o miocárdico. Sin embargo, la mortalidad de los pacientes atópicos no parece deberse a enfermedades cardiovasculares o metabólicas100,101.
Más recientemente, un estudio danés ha evidenciado la asociación entre DM2 y mutaciones en FLG, indicando que dichas mutaciones serían un factor de riesgo para el desarrollo de DM2 en pacientes con bajo índice de masa corporal102. La descripción reciente en pacientes con DM2 de polimorfismos en el cromosoma 1q21-25103 (en el mismo locus que FLG) podría explicar una alteración genética común en ambas enfermedades104. Actualmente no existen estudios en humanos que asocien la DM2 con la DA, aunque la posible alteración común en FLG abre un nuevo campo de estudio.
Por el momento no queda establecida una clara asociación de alteraciones metabólicas en los pacientes con DA, si bien el uso frecuente y continuado de corticosteroides y otros fármacos inmunosupresores sistémicos en estos pacientes los convierte en una población de riesgo.
Urticaria crónicaLa relación de la UC con el SM ha sido recientemente planteada105. Los autores hallan una prevalencia del SM en pacientes con UC del 29,8%, frente al 17,8% en el grupo control (p=0,001), siendo mayor en aquellos pacientes con mayor gravedad y falta de control de la UC. Más estudios son necesarios en este campo para establecer una asociación, aunque el tratamiento con antihistamínicos no cardiotóxicos106 debe ser considerado en estos pacientes.
Por otro lado, el síndrome de Kounis es una rara patología definida por la presencia de una reacción alérgica a fármacos o factores ambientales junto a un síndrome coronario que puede progresar a un infarto agudo de miocardio107. Las reacciones alérgicas descritas son variables: urticaria, asma, alergias alimentarias o mastocitosis101. La etiopatogenia parece estar relacionada con el vasoespasmo o la rotura de placas de ateroma coronarias debidas a la liberación de mediadores alérgicos inflamatorios por parte de los mastocitos. La presencia de clínica coronaria en pacientes con lesiones urticariformes hace obligatorio descartar esta entidad.
Tratamientos dermatológicos y riesgo cardiovascularCorticosteroidesLa administración tópica, intralesional o sistémica es ampliamente utilizada en dermatología. La prescripción tópica, ajustando correctamente su potencia, vehículo, área de aplicación y duración de tratamiento, no suele conllevar efectos secundarios, pero en otras circunstancias puede producirse absorción sistémica. La administración mantenida de prednisona oral a dosis ≥7,5mg/día se asocia con mayor tasa de mortalidad general, infarto de miocardio, ictus y fallo cardíaco108. El desarrollo de síndrome de Cushing parece ser un marcador de RCV frente a pacientes tratados con dosis similares pero que no presentan esta iatrogenia (RR=15,1; IC95%: 11,8-18,4 vs RR=6,4; IC95%: 5,5-7,7)109. Se han asociado además con mayor riesgo de desarrollar fibrilación auricular y flutter110. Su efecto sobre el metabolismo lipídico no está claro. Los glucocorticoides producen hiperglucemias y exacerbaciones de DM preexistentes por un mecanismo multifactorial, pero es raro que produzcan una DM de novo en pacientes con tolerancia normal a la glucosa. Sí puede presentarse, de forma transitoria o permanente, en los pacientes con antecedentes familiares de DM, DM gestacional, edad avanzada y obesidad, especialmente cuando la dosis de prednisona diaria supera los 30mg/día111.
AntihistamínicosLa terfenadina y la mizolastina son fármacos con mayor potencial arritmogénico. Se recomienda su uso con precaución en los pacientes con alargamiento del intervalo QT, enfermedades cardiovasculares, hipocaliemia, ancianos y en asociación con fármacos inhibidores de la isoenzima CYP3A4 (macrólidos, ketoconazol e itraconazol). La cetirizina, la desloratadina y la bilastina no presentan riesgo de interacción, siendo los de perfil cardiovascular más seguro106.
Retinoides sistémicosEl acitretino ha demostrado reducir significativamente los niveles de resistina tras 3meses de tratamiento en un estudio con 10 pacientes7. El aumento de los niveles séricos de triglicéridos y del colesterol depende de la dosis, pudiendo revertirse con hipolipemiantes y medidas dietéticas. Pese a ello, no se ha observado un mayor RCV tras su uso continuado en más de 1.000 pacientes con psoriasis112.
La isotretinoína no ha mostrado una asociación estadísticamente significativa con un mayor riesgo de episodios cardiovasculares, cerebrovasculares o tromboembólicos en un trabajo retrospectivo de 30.496 casos113.
MetotrexatoEn un estudio retrospectivo que incluía 7.615 pacientes con psoriasis y 6.707 pacientes con artritis reumatoide se demostró que su uso se asociaba a un descenso estadísticamente significativo del riesgo de episodios cardiovasculares mayores (MACE) y de arteriosclerosis (RR=0,7; IC95%: 0,55-0,98)114. Además, en una cohorte de 6.902 pacientes con psoriasis con distintas modalidades terapéuticas fue el tratamiento antiinflamatorio sistémico con menor tasa de episodios cardiovasculares tras 5años115. En pacientes con artritis psoriásica el efecto protector parece ser menor116.
CiclosporinaInhibe la angiogénesis y promueve la muerte celular miocárdica6. Es bien conocido que su uso continuado produce un aumento de la presión arterial dependiente de la dosis. En pacientes psoriásicos, tras 2 semanas de tratamiento se observa un incremento mantenido de triglicéridos y de colesterol total6.
FototerapiaAlgunos estudios prospectivos con bajo tamaño muestral apoyan que la fototerapia, principalmente la terapia PUVA, puede disminuir marcadores serológicos como la PCR, IL-6, IL-17, IL-22, IL-23, TNF-α o resistina y mejorar los niveles de adiponectina6,117,118, aunque existen trabajos con UVB-BE que muestran una ausencia de efecto en estos parámetros119. La irradiación UVA durante 20min en 24 voluntarios sanos demostró un descenso de la presión arterial media por un efecto vasodilatador periférico2. Aun así, los resultados son preliminares y contradictorios, por lo que se necesitan más estudios al respecto.
Anti-TNF-αSon los fármacos que más claramente reducen el riesgo de infarto agudo de miocardio, y tras ellos, el metotrexato120. Los anti-TNF-α han demostrado reducir significativamente los niveles séricos de PCR, VSG, VEGF y favorecen el aumento de marcadores protectores como la adiponectina120. No existen estudios que evalúen su efecto en el riesgo de ictus, pero se ha observado una mejoría en el grosor íntima-media carotídea y braquial tras 6meses de tratamiento en monoterapia118. Según un estudio retrospectivo de 121.280 pacientes con psoriasis y artritis reumatoide, el desarrollo de DM2 de nuevo inicio fue significativamente menor en los pacientes tratados con anti-TNF-α que en los tratados con metotrexato121. También parece demostrado su efecto beneficioso sobre la función de las células beta y la resistencia a la insulina. Respecto a sus efectos sobre la glucemia, los resultados son contradictorios. Se han descrito casos de hiper e hipoglucemia con estos fármacos, por lo que deben extremarse las precauciones e informarse en pacientes con DM.
Anti IL-12/IL-23 (ustekinumab)Su papel cardioprotector (resultados disponibles a 4años de seguimiento), a diferencia de los anti-TNF-α, está más discutido. Aunque en un metaanálisis se señalaba un aumento del riesgo de MACE en comparación con placebo (OR=4,23; IC95%: 1,07-16,75)122, la mayor parte de los estudios coinciden en que parecen no influir en el desarrollo de MACE123-126. Serán necesarios estudios posteriores para dilucidar este punto.
Anti IL-17A (secukinumab)En un análisis agrupado de seguridad que incluía 2.700 pacientes tratados con secukinumab se objetivó una tasa de incidencia de MACE comparable a las del placebo y etanercept a las 52semanas de tratamiento. Del mismo modo, el metaanálisis de MACE a través de los estudios fase ii y iii no mostró diferencia en el riesgo127,128.
Otros fármacos de reciente introducción en dermatologíaLa pioglitazona ha sido estudiada en pacientes con psoriasis. Su uso diario (30mg) durante 10semanas apreció una mejoría clínica no significativa de la psoriasis frente a placebo, con mejoría del SM129. Administrada durante periodos más largos podría tener un efecto beneficioso sobre el perfil lipídico y los niveles de insulina.
La metformina es un coadyuvante en varones con psoriasis con alto índice de masa corporal y SM que reciben tratamiento con metotrexato130. Presenta un efecto antiinflamatorio añadido y reduce la hepatotoxicidad relacionada con el metotrexato.
La simvastatina, a dosis de 40mg/día como coadyuvante al tratamiento estándar de úlceras venosas, consigue una mayor y más rápida tasa de curaciones comparada con placebo. Esto podría explicarse por su efecto favorable sobre la epitelización, unido a una inhibición de los linfocitos Th-1131.
ConclusionesExisten numerosas enfermedades dermatológicas que se asocian a un aumento del RCV. La psoriasis y el lupus sistémico se consideran actualmente factores de riesgo independientes y se encuentran incluidos en las guías. Otras enfermedades, como la AA, el SOP y la HS, han mostrado evidencia suficiente como para plantear su futura inclusión. El control del perfil lipídico en pacientes con LP parece justificado, aunque tanto para esta patología como para otras, como la DA y la UC, son necesarios más estudios para establecer claras directrices.
Debemos tener en cuenta que el tratamiento sistémico de estas enfermedades incluye fármacos con repercusión en los factores de riesgo. La ciclosporina, los retinoides orales, los antihistamínicos y los corticosteroides empeoran distintos parámetros de RCV. Los fármacos anti-TNF-α y el metotrexato parecen tener un efecto cardioprotector, mientras que en los anti-IL12/23 y anti-IL17 no parece demostrado. Recientes fármacos de uso habitual en el SM, como la metformina, la pioglitazona o la simvastatina, se han mostrado de utilidad en el tratamiento de enfermedades dermatológicas.
El conocimiento por parte del clínico de estas asociaciones es fundamental para realizar una correcta detección y un tratamiento precoz de los pacientes de riesgo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónNinguna.
Conflicto de interesesLos autores declaran la ausencia de potenciales conflictos de intereses.