La prevalencia de la obesidad ha aumentado de manera exponencial en las últimas décadas, convirtiéndose en un problema de salud pública de primer orden. La dislipemia de la obesidad, caracterizada por niveles bajos de colesterol de las lipoproteínas de alta densidad (HDL), hipertrigliceridemia y partículas pequeñas y densas de lipoproteínas de baja densidad (LDL), es responsable en parte del elevado riesgo cardiovascular residual de esta situación clínica.
Por otro lado, la cirugía bariátrica (CB) es el tratamiento más eficaz para la obesidad; con ella se obtiene una mayor pérdida ponderal que con el tratamiento médico convencional y favorece la mejoría o remisión de las comorbilidades asociadas. Las técnicas de CB más utilizadas en la actualidad son el bypass gástrico laparoscópico en Y de Roux (BGYRL) y la gastrectomía tubular laparoscópica (GTL). Estas han obtenido resultados similares tanto en cuanto a la pérdida de peso como a la remisión de ciertas comorbilidades como la diabetes mellitus tipo2 o la hipertensión arterial.
Un rasgo diferencial entre ambas técnicas podría ser el diferente impacto sobre el perfil lipoproteico. Así, estudios previos con seguimiento a corto y a medio plazo han objetivado una superioridad del BGYRL frente a la GTL en la reducción del colesterol total y del colesterol LDL. Existen resultados discordantes en cuanto a la evolución del colesterol HDL y los triglicéridos. Por todo ello, hemos considerado de interés revisar los efectos de la CB a corto y a medio plazo en el perfil lipoproteico, así como las tasas de remisión de las diferentes alteraciones lipídicas y los posibles factores relacionados.
Obesity prevalence has presented an exponential increase in the last decades, becoming a first order public health issue. Dyslipidemia of obesity, characterized by low levels of high density lipoprotein (HDL) cholesterol, hypertriglyceridemia and small and dense low-density lipoprotein (LDL) particles, is partly responsible for the high residual cardiovascular risk of this clinical situation.
On the other hand, bariatric surgery (BS) is the most effective treatment for obesity, obtaining a greater weight loss than achieved with conventional medical therapy and favoring the improvement or remission of associated comorbidities. The most commonly used BS techniques nowadays are laparoscopic Roux-en-Y gastric bypass (LRYGB) and laparoscopic sleeve gastrectomy (LSG). Both of these procedures have obtained similar results in terms of weight loss and comorbidity remission such as type2 diabetes mellitus or hypertension.
A differential feature between both techniques could be the different impact on the lipoprotein profile. In this respect, previous studies with short and mid-term follow-up have proved LRYGB to be superior to LSG in total and LDL cholesterol reduction. Results regarding triglycerides and HDL cholesterol are contradictory. Therefore, we consider of interest to review the effects of BS at short and mid-term follow-up on lipoprotein profile, as well as the remission rates of the different lipid abnormalities and the possible related factors.
La obesidad es una enfermedad metabólica crónica de origen multifactorial definida como el exceso de peso por la acumulación de grasa corporal. Se clasifica en función del índice de masa corporal (IMC) de cada individuo, considerando obesidad grave cuando el IMC supera los 40kg/m21.
Su prevalencia ha aumentado de manera exponencial en los últimos años, convirtiéndose en un problema de salud pública de primer orden. Se estima que hasta 1,6 billones de personas en el mundo presentan sobrepeso y 400 millones obesidad, con el consiguiente incremento de la morbimortalidad cardiovascular2.
En España, dos recientes estudios transversales han reflejado tasas similares de obesidad. Así, el estudio ENRICA3 en población mayor de 18años objetivó una prevalencia de obesidad próxima al 23%, y en el estudio ENPE4 en población no institucionalizada de 25 a 64años la frecuencia de obesidad fue aproximadamente del 22%.
Frecuentemente la obesidad suele presentar comorbilidades asociadas, como la diabetes mellitus tipo2 (DM2), la hipertensión arterial, la dislipemia y el síndrome de las apneas obstructivas del sueño, que justificarían el aumento del riesgo cardiovascular, confiriendo una mayor mortalidad5. Asimismo, en los últimos años se ha observado una clara asociación entre la obesidad y el riesgo de ciertas neoplasias, entre las que cabe destacar las de colon y recto, de mama en mujeres posmenopáusicas, así como de endometrio, riñón, esófago y páncreas6.
Alteraciones del perfil lipídico asociadas a la obesidadLa dislipemia de la obesidad se caracteriza por alteraciones lipoproteicas cuantitativas y cualitativas7. En este sentido las alteraciones del perfil lipídico en pacientes con IMC elevado son similares a las que encontramos en los pacientes con DM2 y resistencia a la insulina. La capacidad reducida de la insulina para inhibir la producción de glucosa a nivel hepático, así como para favorecer el uso de glucosa a nivel muscular, conduce a un estado de hiperglucemia e hiperinsulinemia. La insulina tampoco es capaz de inhibir la lipólisis de los triglicéridos por la lipoproteína lipasa en el tejido adiposo, por lo que el flujo de ácidos grasos libres del adipocito al hígado aumenta, conllevando un incremento de la grasa visceral8.
El aumento de los ácidos grasos, principalmente a nivel hepático y muscular, con una disminución en la captación periférica de los mismos, conlleva un aumento de la síntesis hepática de lipoproteínas de muy baja densidad (VLDL)9. Finalmente, el estado de hiperinsulinemia e hiperglucemia también estimula, mediante la activación de la proteína SREBP-1, la lipogénesis de novo.
Todos estos cambios fisiopatológicos conducen al perfil lipídico característico de los pacientes con obesidad consistente en una disminución del colesterol de las lipoproteínas de alta densidad (HDL), hipertrigliceridemia así como un aumento del número de partículas de lipoproteínas de baja densidad (LDL) pequeñas y densas conocida como dislipemia aterogénica (DA)10.
Riesgo cardiovascular asociado a la dislipemia aterogénicaEl colesterol LDL no es solo un factor de riesgo cardiovascular, sino que se le considera un factor causal de la aterosclerosis. Por dicho motivo, es la principal diana terapéutica en las guías de prevención cardiovascular. Estas basan sus recomendaciones principalmente en los objetivos de colesterol LDL11 o el tratamiento con estatinas12, consideradas como el tratamiento farmacológico de primera línea en los pacientes con hipercolesterolemia.
No obstante, parece que los pacientes con obesidad, incluso con niveles de colesterol LDL en objetivos terapéuticos, presentan un riesgo cardiovascular residual entre el 65 y el 80%13. Este riesgo residual se puede explicar, al menos en parte, por la DA característica en este grupo de pacientes. Por otro lado, las partículas LDL pequeñas y densas, componentes también de la DA, desempeñan un importante papel en el inicio y la progresión de la aterosclerosis14.
A pesar de la estrecha relación entre la obesidad y este perfil aterogénico, la DA es una condición frecuentemente infradiagnosticada, infratratada y en consecuencia infracontrolada. En las unidades de lípidos de nuestro medio, de un total de 1.649 pacientes, el 36,6% presentaban cifras elevadas de triglicéridos y el 36,1% de colesterol HDL bajo, el 18% ambas alteraciones, pero solo el 16% de los pacientes alcanzaban los objetivos terapéuticos, siendo los factores predictivos de éxito la normalización del peso y el perfil glucémico15. Esto en parte se explicaría por la priorización de los objetivos terapéuticos de colesterol LDL en la prevención cardiovascular, dejando en segundo plano el perfil de la DA.
Cirugía bariátricaLa cirugía bariátrica (CB) es considerada el tratamiento más efectivo para los pacientes con obesidad mórbida, obteniendo una pérdida ponderal que puede superar el 30% y que se mantiene a largo plazo16. Este porcentaje es muy superior al conseguido con el tratamiento médico que incide en cambios en el estilo de vida, donde se consigue una pérdida de peso del 5 al 10% pero normalmente con una ganancia ponderal progresiva en uno o dos años. En el estudio LOOK AHEAD17, basado en analizar el efecto de una estrategia terapéutica centrada en la modificación del estilo de vida, únicamente un 34,5% del grupo de intervención perdió un 10% del peso en el primer año, y solo un 42,4% de los que habían presentado una respuesta inicial satisfactoria mantuvo esta pérdida 4años después. Por otra parte, el tratamiento farmacológico para la obesidad consigue pérdidas ponderales de entre el 4 y el 11%; por tanto, menores que la CB.
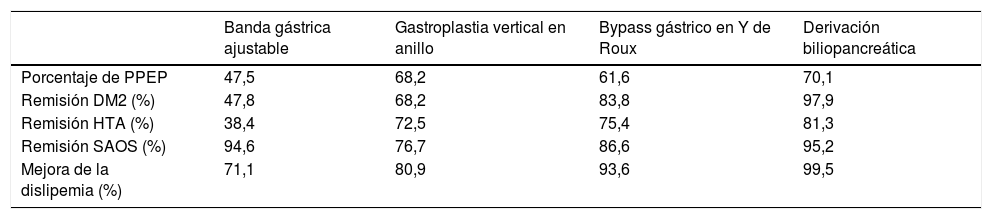
Resulta imprescindible remarcar que el papel de la CB va más allá de la mencionada pérdida ponderal. En este sentido, se ha demostrado también una mejoría o remisión de las diferentes comorbilidades después de la cirugía. Así, en el metaanálisis de Buchwald et al.18 de 2004 se incluyeron datos de 136 estudios con un total de 22.094 pacientes. El 72,6% de los pacientes eran mujeres, con una edad media de 39años (16-64años) y un IMC de 46,9kg/m2 (32,3 a 68,8kg/m2). Se observó una pérdida de peso significativa en los pacientes con obesidad sometidos CB, con una mejoría o resolución de 86 y del 70% en la DM2 y la dislipemia, respectivamente (tabla 1).
Resultados principales del metaanálisis de Buchwald et al
| Banda gástrica ajustable | Gastroplastia vertical en anillo | Bypass gástrico en Y de Roux | Derivación biliopancreática | |
|---|---|---|---|---|
| Porcentaje de PPEP | 47,5 | 68,2 | 61,6 | 70,1 |
| Remisión DM2 (%) | 47,8 | 68,2 | 83,8 | 97,9 |
| Remisión HTA (%) | 38,4 | 72,5 | 75,4 | 81,3 |
| Remisión SAOS (%) | 94,6 | 76,7 | 86,6 | 95,2 |
| Mejora de la dislipemia (%) | 71,1 | 80,9 | 93,6 | 99,5 |
DM2: diabetes mellitus tipo 2; HTA: hipertensión arterial; PPEP: porcentaje de pérdida del exceso de peso; SAOS: síndrome de las apneas obstructivas del sueño.
Fuente: Buchwald et al.18.
Todos estos efectos beneficiosos de la CB conllevan una disminución de la mortalidad de casi el 30% a los 10años16, posiblemente por una disminución en el riesgo cardiovascular.
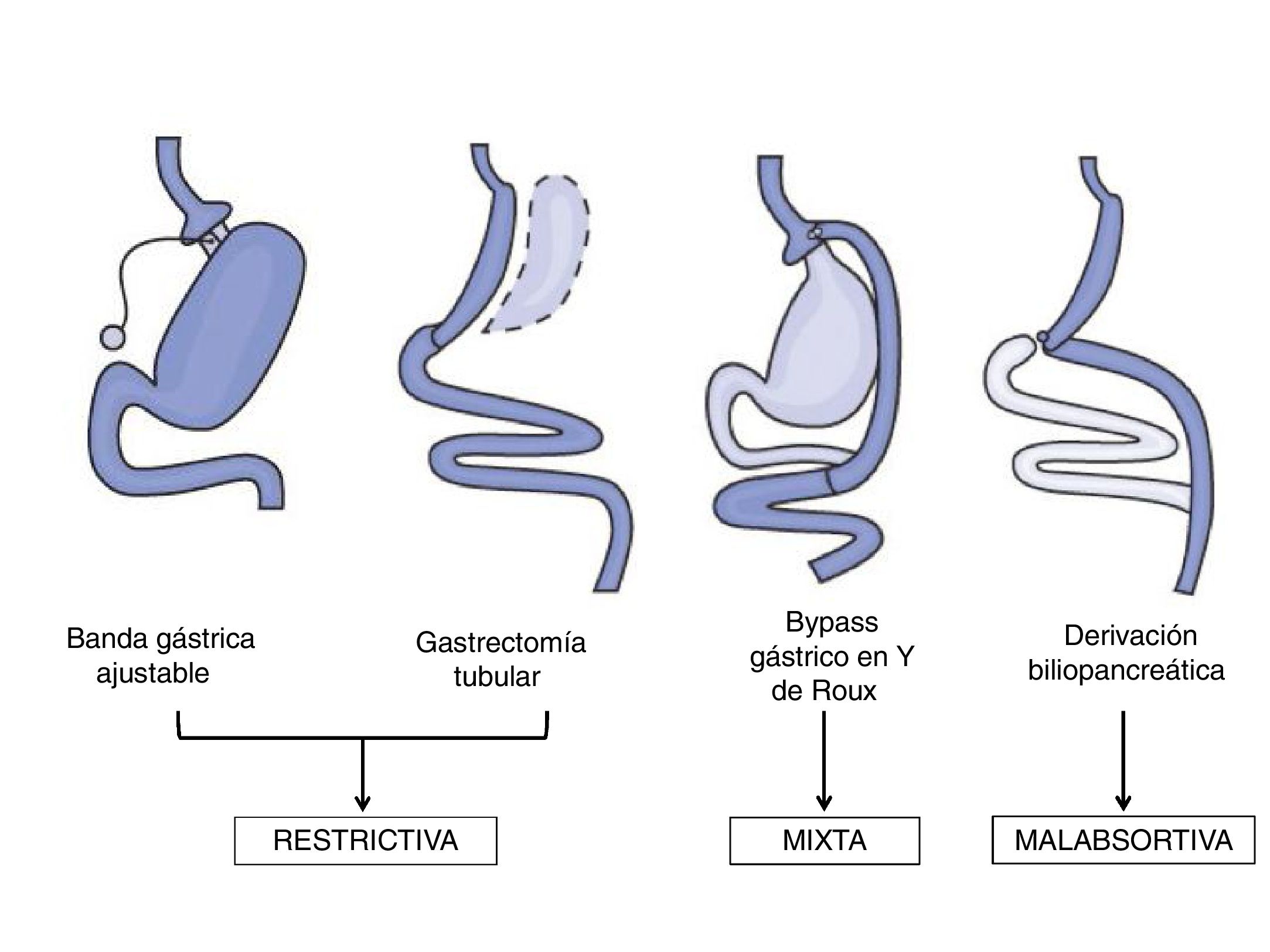
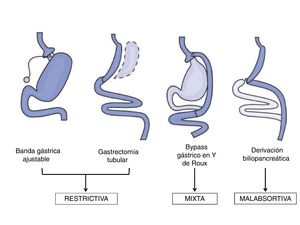
Técnicas de cirugía bariátricaLas técnicas quirúrgicas utilizadas en el campo de la CB se pueden clasificar en malabsortivas, restrictivas y mixtas (fig. 1). Las técnicas malabsortivas, como la derivación biliopancreática, disminuyen la longitud intestinal con la consiguiente disminución en la absorción de nutrientes. Estas técnicas, a pesar de obtener la mayor pérdida de peso a largo plazo, se utilizan con menor frecuencia en la actualidad por el riesgo de déficits nutricionales y por la mayor morbimortalidad asociada al procedimiento. Por otra parte, las técnicas puramente restrictivas, como la banda gástrica ajustable o la gastroplastia vertical anillada, tienen un uso limitado dado sus resultados en cuanto a la pérdida de peso o la remisión de comorbilidades19.
A día de hoy, las técnicas más utilizadas son el bypass gástrico laparoscópico en Y de Roux (BGYRL) y la gastrectomía tubular laparoscópica (GTL) en base a sus resultados a corto plazo concernientes a la pérdida de peso y a la resolución de las comorbilidades asociadas a la obesidad18. El BGYRL es una técnica mixta que combina una exclusión parcial del estómago mediante una gastroplastia junto a un bypass del duodeno con el yeyuno proximal, con el consiguiente efecto de malabsorción. Durante muchos años ha sido considerada la técnica de elección fruto de los buenos resultados obtenidos, con un mejor equilibrio entre eficacia y efectos adversos18. Parece además que esta eficacia viene determinada por otros mecanismos que van más allá de la pérdida ponderal observada después del procedimiento quirúrgico20.
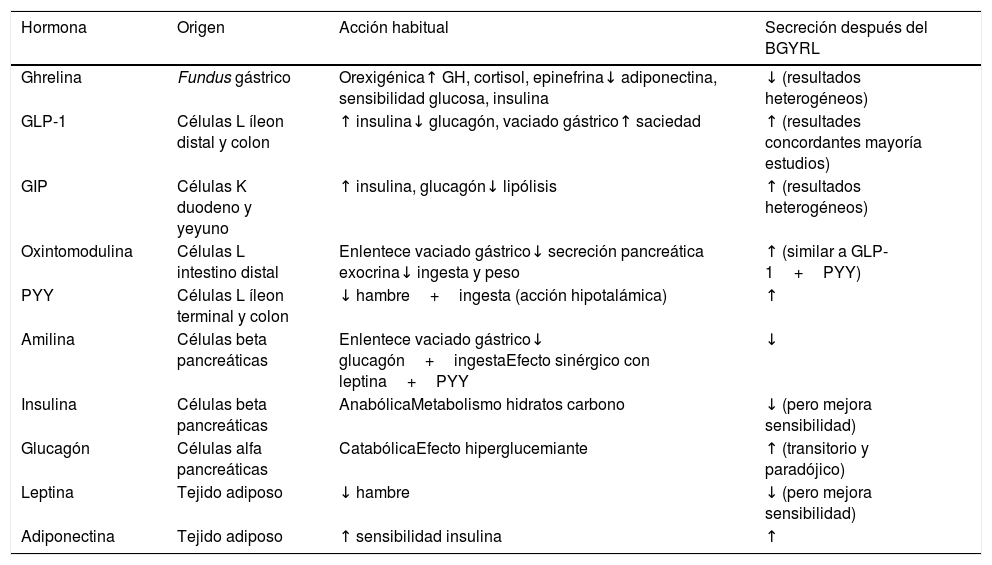
Se han descrito diferentes alteraciones de hormonas gastrointestinales relacionadas con la saciedad y la ingesta después del BGYRL. Por un lado, existe un incremento de hormonas con efecto incretínico como el péptido similar al glucagón tipo1 (GLP-1) y el péptidoYY (PYY) a corto plazo después de la cirugía, manteniéndose elevadas a largo plazo21. Las hormonas incretínicas, entre otras funciones, favorecen la secreción de insulina y retrasan el vaciado gástrico, contribuyendo de forma positiva a la pérdida de peso y a la mejora del metabolismo hidrocarbonado. Existen otras hormonas que se ven modificadas después del BGYRL, tal y como se detalla en la tabla 2.
Resumen de las principales acciones de las hormonas que se encuentran alteradas después del BGYRL
| Hormona | Origen | Acción habitual | Secreción después del BGYRL |
|---|---|---|---|
| Ghrelina | Fundus gástrico | Orexigénica↑ GH, cortisol, epinefrina↓ adiponectina, sensibilidad glucosa, insulina | ↓ (resultados heterogéneos) |
| GLP-1 | Células L íleon distal y colon | ↑ insulina↓ glucagón, vaciado gástrico↑ saciedad | ↑ (resultades concordantes mayoría estudios) |
| GIP | Células K duodeno y yeyuno | ↑ insulina, glucagón↓ lipólisis | ↑ (resultados heterogéneos) |
| Oxintomodulina | Células L intestino distal | Enlentece vaciado gástrico↓ secreción pancreática exocrina↓ ingesta y peso | ↑ (similar a GLP-1+PYY) |
| PYY | Células L íleon terminal y colon | ↓ hambre+ingesta (acción hipotalámica) | ↑ |
| Amilina | Células beta pancreáticas | Enlentece vaciado gástrico↓ glucagón+ingestaEfecto sinérgico con leptina+PYY | ↓ |
| Insulina | Células beta pancreáticas | AnabólicaMetabolismo hidratos carbono | ↓ (pero mejora sensibilidad) |
| Glucagón | Células alfa pancreáticas | CatabólicaEfecto hiperglucemiante | ↑ (transitorio y paradójico) |
| Leptina | Tejido adiposo | ↓ hambre | ↓ (pero mejora sensibilidad) |
| Adiponectina | Tejido adiposo | ↑ sensibilidad insulina | ↑ |
BGYRL: bypass gástrico en Y de Roux laparoscópico; GIP: péptido inhibidor gástrico; GLP-1: péptido similar al glucagón tipo1; PYY: péptido YY.
Adaptado de Ramos Leví AM, Rubio Herrera MA. Cirugía metabólica. En: Bellido D, et al. Sobrepeso y obesidad. Sociedad Española para el estudio de la obesidad. Madrid; 2015. pp. 603-620.
La concentración de ácidos biliares también aumenta después del BGYRL22, y por otro lado se han descrito, principalmente en modelos animales, alteraciones en la microbiota intestinal después la cirugía23.
La GTL es una técnica que se realizó por primera vez en 1988 como una variante de la derivación biliopancreática con switch duodenal24. Posteriormente, al inicio del sigloXXI, su uso se basó en una cirugía de primer paso antes de una técnica malabsortiva en pacientes con obesidad extrema (IMC>50kg/m2)25. Una segunda cirugía era innecesaria en la mayoría de los pacientes, dados los buenos resultados en cuanto a la pérdida de peso. Por tanto, la GTL pasó a ser una cirugía en muchos casos definitiva26. La GTL consiste en una gastrectomía subtotal vertical con preservación del píloro, incluyendo una resección longitudinal del fundus, del cuerpo y del antro gástrico. La resección compromete aproximadamente un 80% del estómago, con un remanente gástrico >100ml. Es considerada una técnica quirúrgica más sencilla comparada con otras, como el BGYRL, al requerir menos anastomosis y presentar una menor tasa de complicaciones.
La GTL, aun siendo una técnica restrictiva, ha obtenido resultados superiores a otras técnicas restrictivas y similares al BGYRL en cuanto a pérdida de peso y remisión a corto plazo de algunas comorbilidades27. Esto podría atribuirse a diferentes mecanismos que van más allá del componente restrictivo. Algunos factores descritos, de manera similar al BGYRL, guardan relación con modificaciones en la motilidad intestinal, mecanismos hormonales y alteraciones de los ácidos biliares o de la microbiota intestinal28.
En la actualidad, la GTL es considerada mucho más que una técnica restrictiva, superando en 2014 al BGYRL como la técnica más utilizada en todo el mundo29. En España, la GTL ha pasado de representar el 0,8% de todos los casos de CB a ser la segunda más utilizada, con el 39,6%, solo superada por el BGYRL30. Sin embargo, aunque los resultados a medio y a largo plazo tras el BGYRL son bien conocidos, no sucede lo mismo con la GTL, al tratarse de una técnica relativamente «joven», por lo que no está confirmado si estas técnicas son equivalentes en un seguimiento clínico más prolongado.
Efectos de la cirugía bariátrica sobre la evolución del perfil lipídicoEstá globalmente establecida la superioridad de la CB respecto al tratamiento médico conservador en cuanto a la pérdida de peso y la remisión de varias comorbilidades, con una consecuente disminución del riesgo cardiovascular.
En el caso de la dislipemia, en el metaanálisis de Buchwald et al.18 se observó una mejora o resolución del 70%, resultados similares a estudios previos que evaluaban la remisión global de la dislipemia31,32. Esto conlleva ciertas limitaciones, ya que en primer lugar no existe un consenso unánime para definir la remisión de la dislipemia, por lo que los resultados entre estudios no siempre son comparables. En segundo lugar, el hecho de valorar la dislipemia en conjunto hace que no se tenga en cuenta la evolución de las diferentes fracciones lipídicas.
Por otra parte, y como ya se ha expuesto anteriormente, la alteración lipídica característica en los pacientes con obesidad se compone de niveles disminuidos de colesterolHDL con hipertrigliceridemia. La evaluación de este perfil aterogénico tras la CB resulta imprescindible, ya que podría explicar la reducción del riesgo cardiovascular residual que presentan estos pacientes33. En esta línea, estudios previos han observado un descenso del 30 al 63% y un incremento de 12 al 39% de los triglicéridos y del colesterolHDL, respectivamente, después de la CB34,35. En esta misma línea, un estudio de nuestro grupo valoró la remisión de la DA un año después del BGYRL y la GTL36. La DA estaba presente en 81 de los 356 pacientes (22,8%), presentando una remisión del 74,1% a los 3meses, del 90,1% a los 6meses y del 96,3%a los 12meses de la intervención. Asimismo, el colesterol HDL presentó un ascenso a partir de los 6meses de la CB en ambos grupos (con y sin DA), siendo el incremento significativamente superior en el grupo con el perfil aterogénico (47,6±31,6 versus 24,1±23,2%, respectivamente; p<0,001). Los triglicéridos también presentaron una mejora ya evidente en los tres primeros meses de la cirugía en ambos grupos, con un descenso significativamente mayor en el grupo con DA durante todo el seguimiento (49,3±21,3 versus 21,2±53,0%, respectivamente; p<0,001).
Diferencias entre el BGYRL y la GTL en cuanto a la evolución del perfil lipídicoEn referencia a las distintas técnicas de CB, el BGYRL y la GTL han obtenido resultados comparables tanto en cuanto a la pérdida de peso como a la remisión de las diversas enfermedades asociadas a corto y a medio plazo en la mayoría de los estudios37-40.
Parece que el rasgo diferencial entre ambas técnicas quirúrgicas podría encontrarse en el efecto sobre el perfil lipídico. Así, en estudios con seguimiento a corto plazo se ha descrito una superioridad del BGYRL respecto la GTL en cuanto a la mejoría de las concentraciones de colesterol total y colesterolLDL41,42. Sin embargo, los resultados a corto plazo en cuanto a la evolución de los triglicéridos y del colesterol HDL son contradictorios43,44. En un estudio de nuestro grupo45 con un año de seguimiento se incluyeron 51 pacientes sometidos a BGYRL y 51 a GTL. Los resultados concluyeron que la técnica mixta mejoraba todas las fracciones lipídicas, mientras que la técnica restrictiva, pese a no tener efecto en los niveles de colesterolLDL, tenía un efecto igual o superior al de las técnicas malabsortivas respecto al incremento de colesterolHDL. En cambio, en el estudio de Vix et al.46, que incluyó 45 pacientes en el grupo BGYRL y 55 en el de GTL con un año de seguimiento, el primero fue superior en cuanto al descenso del colesterol total y LDL y el ascenso del HDL, sin diferencias entre técnicas por lo que respecta a la trigliceridemia. Dada la heterogeneidad en los resultados a corto plazo comparando el BGYRL respecto a la GTL en cuanto a la evolución del perfil lipídico, nuestro grupo decidió contrastar los diferentes estudios publicados hasta el momento con un metaanálisis47. Se incluyeron un total de 17 artículos (4 ensayos clínicos aleatorizados, 6 estudios de cohortes y 7 casos control). La remisión de la hipercolesterolemia al año fue superior después del BGYRL respecto a la GTL (riego relativo: 1,43; IC95%: 1,27-1,61), sin hallar diferencias entre ambas técnicas quirúrgicas en cuanto a la evolución de la hipertrigliceridemia (riesgo relativo: 1,11; IC95%: 1,00-1,23) o el colesterolHDL bajo (riesgo relativo: 0,96; IC95%: 0,02-57,28). Asimismo, se valoró el cambio de concentración de las diferentes fracciones lipídicas. El BGYRL fue superior a la GTL en cuanto al descenso de colesterol total (diferencia media: 19,77mg/dl; IC95%: 11,84-27,69). En cuanto al colesterolLDL, también se observó un mayor descenso después del BGYRL respecto a la GTL (diferencia media: 19,29mg/dl; IC95%: 11,93-26,64). El cambio de triglicéridos fue similar en ambas técnicas quirúrgicas (diferencia media: −1,19mg/dl; IC95%: −10,99-8,60), así como el ascenso en la concentración de colesterolHDL (diferencia media: 0,47mg/dl, IC95%: −1,43-2,37).
Yendo un paso más allá, existen pocos estudios que comparen el BGYRL y la GTL a 5años centrándose en la evolución del perfil lipídico48,49. La mayoría han valorado la remisión global de la dislipemia, como es el caso de Zhang et al.50, con una remisión del 92,3 y del 84,6% a los 5años tras el BGYRL y la GTL, respectivamente, pero sin diferencias significativas. Otros han evaluado también el cambio de concentración de las diferentes fracciones lipídicas después de la CB. En este sentido, el recientemente publicado ensayo clínico aleatorizado SLEEVEPASS51 (119 pacientes sometidos a BGYRL y 121 a GTL) observó niveles inferiores de colesterolLDL 5años después del BGYRL en comparación con la GTL (96,5mg/dl versus 104,3mg/dl; p=0, 02). Asimismo, el estudio SM-BOSS52 (con 110 pacientes intervenidos de BGYRL y 107 de GTL), siguiendo la misma línea, también objetivó un mayor descenso del colesterolLDL después de la técnica mixta en comparación con la técnica restrictiva (101,1mg/dl versus 116,1mg/dl; p=0,008). En cambio, en ninguno de los dos estudios se hallaron diferencias entre técnicas respecto a las otras fracciones lipídicas.
Finalmente, en un reciente estudio de nuestro grupo53 se compararon los resultados a 5años después del BGYRL y la GTL, pero en este caso valorando el cambio de concentración, así como la remisión de la hipercolesterolemia, hipertrigliceridemia y colesterolHDL bajo. Ciento cincuenta y uno de los 259 (58,3%) completaron 5años de seguimiento, 103 (68,2%) de los cuales se sometieron a BGYRL y 48 (31,8%) a GTL. La remisión de la hipercolesterolemia (26/58 [44,8%] versus 6/26 [23,1%]; p=0,047) así como del colesterolLDL elevado (30/49 [61,2%] versus 6/23 [26,1%]; p=0,005) a los 5años fue superior después del BGYRL respecto a la GTL. Sin embargo, el número de pacientes que alcanzaron niveles normales de colesterolHDL a los 5años tras la cirugía fue similar con ambas técnicas (39/47 [83,0%] y 18/23 [78,3%] después del BGYRL y la GTL, respectivamente; p=0,633). La remisión de la hipertrigliceridemia a los 5años fue superior después del BGYRL respecto a la GTL (23/25 [92,0%] versus 10/15 [66,7%]; p=0,041). Sin embargo, la GTL presentó una mayor tasa de recidiva durante el seguimiento.
Factores asociados a la remisión de las alteraciones del perfil lipídicoFinalmente, son poco conocidos los factores relacionados con los cambios en el perfil lipídico después de la CB. En este sentido y con seguimiento a un año, en un estudio de nuestro grupo45 se observó que una edad menor, las concentraciones de colesterol total y el BGYRL estaban asociados a la mejoría de colesterol total, siendo los mismos para el descenso de colesterolLDL (excepto la edad). En cuanto al colesterolHDL, su ascenso después de la CB estaba asociado a una edad mayor, a niveles iniciales de colesterolHDL y a la técnica de GTL. La disminución de los niveles de triglicéridos se asoció con los niveles basales de triglicéridos y la HbA1c.
En otro estudio también de nuestro grupo mencionado previamente53 se valoraron los factores asociados a la remisión de las diferentes alteraciones del perfil lipídico a los 5años. Así, los factores asociados a la remisión de la hipercolesterolemia fueron el sexo masculino, el BGYRL y la ausencia de tratamiento inicial con estatinas. La ausencia de tratamiento inicial con fibratos y el porcentaje de pérdida de peso a los 60meses se asociaron a la remisión de la hipertrigliceridemia, y este último fue el único factor asociado a la remisión del colesterolHDL bajo.
ConclusionesLos pacientes con obesidad presentan diversas comorbilidades asociadas, entre ellas la DA, responsable del elevado riesgo cardiovascular residual de estos pacientes.
Por otro lado, la CB ha demostrado ser el tratamiento más eficaz de la obesidad, siendo el BGYRL y la GTL las técnicas más utilizadas en la actualidad. Ambas técnicas han obtenido resultados similares en cuanto a la pérdida de peso y la remisión de diversas comorbilidades. Sin embargo, y centrándonos en el perfil lipídico, parece que el BGYRL es superior a la GTL en cuanto a la evolución de las concentraciones plasmáticas de colesterol total y colesterolLDL. No obstante, los resultados en cuanto al colesterolHDL y a los triglicéridos son contradictorios.
En este sentido, son necesarios futuros estudios aleatorizados y con mayor seguimiento clínico para confirmar los resultados preliminares obtenidos y así resaltar las posibles diferencias entre ambos procedimientos quirúrgicos en cuanto a la evolución del perfil lipídico.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesNinguno.