En esta revisión se valora la contribución del tejido adiposo marrón y perivascular a la fisiopatología de las complicaciones metabólicas y vasculares asociadas a la obesidad. Para poder combatir la obesidad y sus complicaciones metabólicas y vasculares asociadas, además de los tratamientos establecidos, hay que avanzar en el conocimiento del tejido adiposo marrón y su prometedor potencial terapéutico. Dada la capacidad del tejido adiposo marrón en el gasto energético y los efectos sobre el metabolismo lipídico y glucídico, así como su potencial resistencia a la inflamación junto con el tejido adiposo perivascular, las nuevas perspectivas del tratamiento de la obesidad podrían centrarse en el diseño de nuevos fármacos o distintos regímenes o terapias que incrementen la cantidad y la función del tejido adiposo marrón no solo para luchar contra la obesidad sino también para prevenir la diabetes tipo2 y otros trastornos metabólicos y vasculares asociados.
The contribution of brown and perivascular adipose tissues to the pathophysiology of metabolic and vascular complications associated with obesity are analysed in this review. To combat obesity and prevent its highly prevalent metabolic and vascular complications, a new insight on our knowledge of the role of the thermogenic function of brown adipose tissue and its promising therapeutic potential in humans is needed in addition to conventional treatments. Owing to the impact of brown adipose tissue on energy expenditure related to lipid and glucose metabolism, as well as its potential resistance against inflammation along with perivascular adipose tissue, new perspectives in the treatment of obesity treatment could be focused on the design of new drugs, or different regimens or therapies, that increase the amount and activity of brown adipose tissue. These new treatments not only may contribute to combat obesity, but also prevent complications such as type2 diabetes and other associated metabolic and vascular changes.
La obesidad es una enfermedad crónica de origen multifactorial que en las últimas décadas ha aumentado de forma considerable en los países desarrollados, siendo en la actualidad una epidemia mundial1. La Organización Mundial de la Salud (OMS) considera obesas a las personas que tengan un índice de masa corporal (IMC) superior a 30kg/m2, y ha estimado que en 2015 habrá 2.300 millones de adultos con sobrepeso y 700 millones de obesos. Además está aumentando de forma preocupante la obesidad infantil: en 2010, alrededor de 40 millones de niños menores de 5 años tenían sobrepeso2,3. La obesidad se ha convertido en un problema de salud pública no solo por el aumento de la estigmatización social, el problema económico que supone o el fallo en la calidad de vida, sino también por el riesgo asociado que presentan dichos pacientes de desarrollar otras patologías como la diabetes tipo24, dislipidemias, hígado graso, aterosclerosis, enfermedad cardiovascular4, enfermedad de Alzheimer, enfermedades óseas y con frecuencia algunos tipos de cánceres, especialmente digestivos. Esto ocurre, al menos en parte, como resultado de la resistencia a la insulina inducida por la obesidad y el hecho de que el tejido adiposo no solo sirve como reservorio de energía sino como un órgano endocrino secretor de hormonas, citoquinas y proteínas que afectan a la funcionalidad de las células y tejidos a lo largo de todo el organismo5.
Una de las alteraciones metabólicas más deletéreas de la obesidad es la dislipidemia que con frecuencia la acompaña y que resulta altamente aterogénica6. Su patrón fenotípico habitual es la hipertrigliceridemia preprandial, la hiperlipidemia no HDL posprandial, el aumento real en la producción de partículas densas y pequeñas de LDL, así como la baja producción de colesterol HDL.
En los mamíferos, el tejido adiposo está compuesto al menos por 2 tipos muy distintos de grasas, como son el tejido adiposo blanco (WAT) y el tejido adiposo marrón o pardo (BAT), que presentan diferencias en cuanto a su morfología, distribución, genes y función. El WAT es el principal reservorio de energía y libera un gran número de hormonas y citoquinas que modulan el metabolismo del organismo y la resistencia a la insulina7-10. El desarrollo de la obesidad no solo depende del balance entre la ingesta y el gasto energético, sino también del balance entre el WAT, como principal reservorio energético, y el BAT, especializado en el gasto energético en forma de termogénesis mediante la proteína mitocondrial desacoplante 1 (UCP-1). Además, el BAT podría afectar al metabolismo del organismo y alterar la sensibilidad a la insulina11,12, así como modificar la susceptibilidad a desarrollar obesidad13.
Papel del tejido adiposo marrón en la obesidad y sus complicaciones metabólicas y vasculares asociadasMorfología y distribución del tejido adiposo marrónEl BAT está formado por adipocitos marrones y células progenitoras de adipocitos. Así, el adipocito marrón tiene una forma poligonal con un núcleo oval y centrado en un citoplasma grande que contiene múltiples y pequeñas gotas lipídicas. Posee un gran número de mitocondrias y un retículo endoplasmático poco desarrollado. Además, se encuentra altamente vascularizado e inervado14. Originalmente, se pensó que el BAT estaba presente en los seres humanos solo durante el período neonatal. Sin embargo, datos recientes han demostrado que los adultos conservan algunos depósitos metabólicamente activos de BAT que responden al frío y a la activación simpática del sistema nervioso. Dichos depósitos son UCP-1 positivos y son detectados por tomografía por emisión de positrones (PET). Actualmente, en humanos, el BAT se ha descrito que está localizado en depósitos de la región cervical, supraclavicular, paravertebral, mediastinal, paraaórtica y suprarrenal9. Además, también se han localizado pequeños grupos de adipocitos marrones en el interior del músculo esquelético en adultos humanos13. Por otro lado, recientes datos han mostrado que los adipocitos marrones encontrados en el interior de otros depósitos de WAT no son derivados del linaje myf5, como son los clásicos adipocitos marrones del tejido interescapular de los roedores, y se denominan células beige15. Dichas células son positivas para UCP-1, con alta capacidad respiratoria, con características de WAT y BAT y con una alta sensibilidad a la hormona polipeptídica irisina16. En este sentido, se habría mostrado previamente que la irisina secretada por el músculo esquelético, y que se incrementa con el ejercicio, induce la «marronización» del WAT subcutáneo. Sin embargo, esta proteína tiene poco efecto en los clásicos adipocitos marrones aislados del depósito interescapular17. Todo ello sugiere que la respuesta a la irisina podría ser una característica selectiva de las células beige localizadas en el interior de los depósitos de WAT subcutáneo.
Además de estar implicado en la termogénesis, recientes estudios han demostrado que el BAT pudiera estar implicado en la liberación de triglicéridos y en la utilización de glucosa, además de servir como fuente de adipoquinas y poseer distinta función inflamatoria comparada con el WAT.
Relación del tejido adiposo marrón con la obesidad y sus complicaciones vasculares y metabólicasLa activación del BAT reduce la adiposidad y protege al ratón de la obesidad inducida por la dieta rica en grasas18,19. Así, la pérdida de la masa del BAT11, como puede ser una lipoatrofia marrón severa por una deleción del receptor de la insulina en ese tejido20,21, o la pérdida de UCP-122 confieren susceptibilidad a desarrollar obesidad en ratones. En los últimos años se ha descrito que la cantidad de BAT estaba inversamente correlacionada con el índice de masa corporal en humanos, especialmente en personas de avanzada edad23. Además, se ha demostrado recientemente que el BAT podría proteger frente a múltiples enfermedades relacionadas con el envejecimiento14. Así, individuos con depósitos de BAT más pequeños son más susceptibles a acumular WAT y aumentar su peso corporal y tener un mayor riesgo de desarrollar enfermedades metabólicas y vasculares asociadas a dicha obesidad18,24.
El tejido adiposo marrón y la termogénesisUna de la principales funciones del BAT es la activación de la termogénesis mediante la activación de la proteína desacoplante 1 (UCP-1), generando calor a partir de los ácidos grasos25. En la termogénesis, el BAT utiliza, en primer lugar, los lípidos almacenados como sustrato para generar calor. Esta fase temprana de la termogénesis corresponde con la liberación de noradrenalina del sistema nervioso simpático activando la liberación de ácidos grasos de las gotas de triglicéridos. Algunos de estos ácidos grasos activan a UCP-1. Los ácidos grasos remanentes son importados a la mitocondria y allí se realiza la termogénesis con la disipación de energía en forma de calor debido a la acción de UCP-1. Como el BAT es un pequeño porcentaje del total del peso corporal, para mantener una termogénesis sostenida es necesario importar y quemar triglicéridos circulantes26.
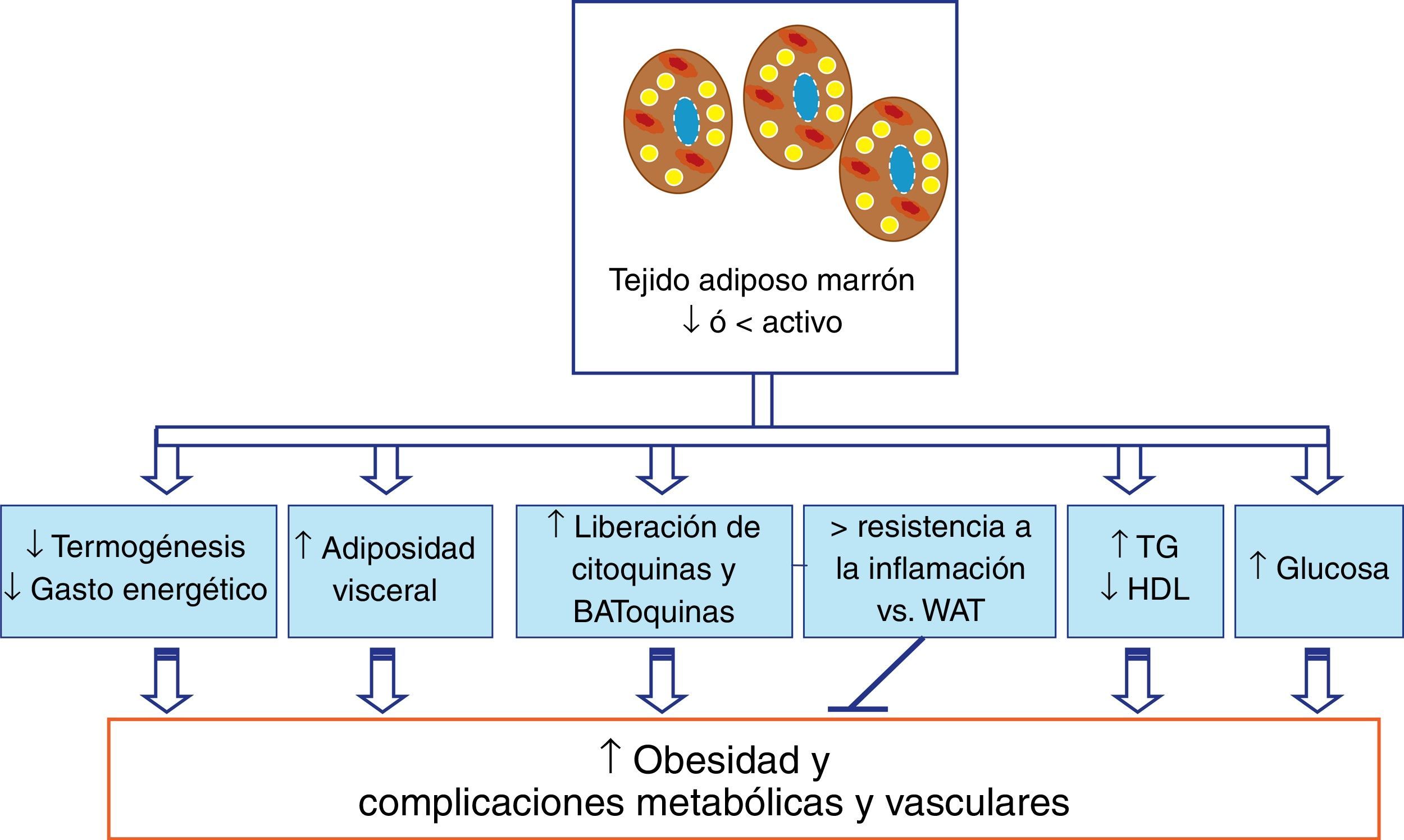
El tejido adiposo marrón y el metabolismo lipídico y glucídicoRecientes trabajos han demostrado que el BAT, además de estar implicado en la termogénesis, podría tener un papel destacado en el metabolismo lipídico y glucídico (fig. 1). En primer lugar, el BAT podría estar implicado en la eliminación de triglicéridos. Así, las lipoproteínas ricas en triglicéridos (TRL) transportan lípidos en la circulación, donde una porción de los ácidos grasos puede ser liberada por la lipoproteína lipasa (LPL)27. Otros órganos periféricos, como el WAT y el músculo esquelético, captan ácidos grasos, mientras que las partículas remanentes ricas en colesterol son eliminadas por el hígado28. Además, niveles elevados de triglicéridos y de partículas remanentes ricas en colesterol, como ocurre en la dislipidemia diabética, representan factores de riesgo para desarrollar enfermedades cardiovasculares29-30. Se ha descrito que el aumento de la actividad del BAT por exposiciones cortas al frío podría controlar el metabolismo de las TRL en el ratón, regulando la eliminación de dichas lipoproteínas y el exceso de lípidos circulantes26 y disminuyendo de este modo los niveles de triglicéridos y aumentado ligeramente los niveles de HDL (fig. 1). Así, los ácidos grasos son eficientemente introducidos en el propio BAT debido a un programa metabólico que empuja a las TRL a una captación muy eficiente de los ácidos grasos. Este proceso, asociado con un aumento de la expresión del factor de crecimiento endotelial vascular (VEGF)31, conduce a un incremento de la permeabilidad para las lipoproteínas, permitiendo que los triglicéridos salgan de los capilares. La activación del BAT por noradrenalina no solo activa la liberación de los ácidos grasos de los triglicéridos dentro del propio BAT junto con una mayor producción de VEGF, sino que también aumenta la expresión de la LPL26,32. Por tanto, la LPL degrada los triglicéridos y permite que los ácidos grasos puedan estar disponibles a través de transportadores de membrana plasmática como el CD36. Además, se ha demostrado en humanos que la activación de BAT por exposición al frío incrementa su metabolismo oxidativo, reduciendo el contenido de triglicéridos y contribuyendo de forma decisiva al gasto energético33. Por tanto, la activación de BAT sería capaz de corregir las hiperlipidemias y mejorar los efectos deletéreos de la obesidad y la dislipidemia, como pueden ser la resistencia a la insulina o el proceso aterogénico. Recientemente se ha descrito que el tejido adiposo epicárdico podría ser un depósito de BAT activo que es capaz de modificar los niveles de lípidos circulantes alterados, aumentado los niveles de HDL y disminuyendo los niveles de triglicéridos34.
Contribución del tejido adiposo marrón (BAT) a la obesidad y las complicaciones metabólicas y vasculares asociadas. Una de las posibles causas que inducen el desarrollo de la obesidad podría ser una disminución de la cantidad y de la actividad del BAT. En esta situación se produciría una alteración de funciones que realiza el BAT en el metabolismo lipídico y en el glucídico, así como el perfil de expresión de citoquinas y adipoquinas, favoreciéndose la obesidad y las complicaciones metabólicas y vasculares asociadas a ella.
Por otro lado, se ha descrito que el BAT podría también estar regulando el metabolismo glucídico26. Dicho tejido tiene una alta captación de glucosa debido probablemente a una intensa combustión de glucosa en la mitocondria, más que por acción de la insulina. La mitocondria del tejido marrón utiliza el piruvato para la combustión siempre que UCP-1 esté activo por los ácidos grasos35. Asimismo, los transportadores de glucosa, GLUT-1 y GLUT-4, podrían estar implicados en la captación de glucosa por parte del BAT, ya que la actividad y la expresión de ambos transportadores están aumentadas tanto por el frío como por la noradrenalina26,36,37.
El tejido adiposo marrón como órgano endocrinoEl BAT es un órgano endocrino al igual que el WAT. Secreta distintas citoquinas, hormonas y otros factores, como TNF-α, adiponectina y leptina, al igual que el WAT. Sin embargo, hay un gran número de moléculas que son exclusivamente secretadas por el BAT, las llamadas BAToquinas (adipoquinas derivadas de BAT). Muchas de estas BAToquinas, incluida el factor de crecimiento fibroblástico (FGF21), son requeridas en la adaptación al frío y en la estimulación adrenérgica38-40. Además, el FGF21 puede actuar también de forma directa sobre el BAT, independientemente del control adrenérgico, lo que permitirá abrir nuevas vías para explorar mecanismos de control de la grasa corporal40. Otras proteínas secretadas también por el BAT, como la adipsina, el FGF2, el IGF-1, las prostaglandinas y la adenosina, desempeñan también funciones autocrinas.
Además, el BAT secreta otros factores, como IL-6, y factores neurotróficos, como el BDNF y el factor de crecimiento nervioso (NGF), los cuales podrían tener papeles únicos en el BAT con respecto al WAT41-44. La secreción de NGF se produce principalmente por la proliferación de preadipocitos marrones, que promueve la inervación simpática del tejido y, a su vez, permite una mayor estimulación por noradrenalina en los adipocitos marrones. Otros factores paracrinos, además de los neurotróficos, sintetizados por el BAT son el VEGF, el angiotensinógeno y el óxido nítrico. La expresión de VEGF con sus receptores, FLK-1 y FLK-4, es alta en la proliferación y en la madurez de adipocitos marrones, manteniendo alto el nivel de vascularización de este tejido. Tanto la noradrenalina como la exposición al frío inducen un aumento de la expresión de VEGF en BAT45. Por otro lado, tanto la sintasa óxido nítrico inducible (iNOS) como la endotelial (eNOS) se expresan en el BAT, y la noradrenalina induce un aumento en la producción de óxido nítrico sintasa inducible (NO) que inhibe la oxidación mitocondrial y promueve un rápido aumento en el flujo sanguíneo46.
A diferencia del WAT, que es rápidamente infiltrado por células inflamatorias en respuesta a la obesidad inducida por dieta grasa, el BAT no parece acumular tanto infiltrado de macrófagos47 (fig. 1). Esto puede deberse a que el BAT tiene un mayor número de mitocondrias que le permite metabolizar los ácidos grasos a través de la β-oxidación. Sin embargo, en el WAT, la capacidad para metabolizar los lípidos estaría superada, teniendo efectos lipotóxicos y desencadenando la respuesta inflamatoria y facilitando el infiltrado de macrófagos y células inmunes. En este sentido, otro grupo reciente ha demostrado que los macrófagos del BAT no tienen el mismo perfil de expresión de citoquinas y quimioquinas que los macrófagos del WAT48.
Papel del tejido adiposo perivascular en la obesidad y sus complicaciones metabólicas y vasculares asociadasMorfología y distribución del tejido adiposo perivascularEl tejido adiposo perivascular (PVAT) se encuentra rodeando la arteria coronaria (o tejido adiposo epicárdico), la aorta (tejido adiposo periaórtico) y otros vasos sistémicos, así como el lecho microcirculatorio de las mesentéricas, músculo, riñón y tejido adiposo, a excepción de la circulación cerebral49. Se une al exterior de la capa adventicia sin ninguna estructura laminar o barrera organizada que separe a las dos. Dependiendo del lecho vascular, el PVAT puede tener más o menos características de WAT o BAT. Así, se ha descrito que el PVAT de la arteria abdominal sería prácticamente WAT, el PVAT de las arterias coronarias humanas tendría un fenotipo intermedio entre adiposo blanco y marrón, y el PVAT de la arteria aórtica torácica sería muy similar al BAT25,50. La vascularización y la inervación del PVAT también varían de forma considerable con la localización y podrían ayudar a explicar las distintas características funcionales del PVAT.
Papel del tejido adiposo perivascular en la obesidad y en las complicaciones vasculares asociadasEl PVAT está constituido por los adipocitos, fibroblastos, células madre, células que penetran los vasa vasorum y células inflamatorias infiltradas como macrófagos y linfocitos T, pudiendo ser estas últimas relevantes en determinadas situaciones patológicas49.
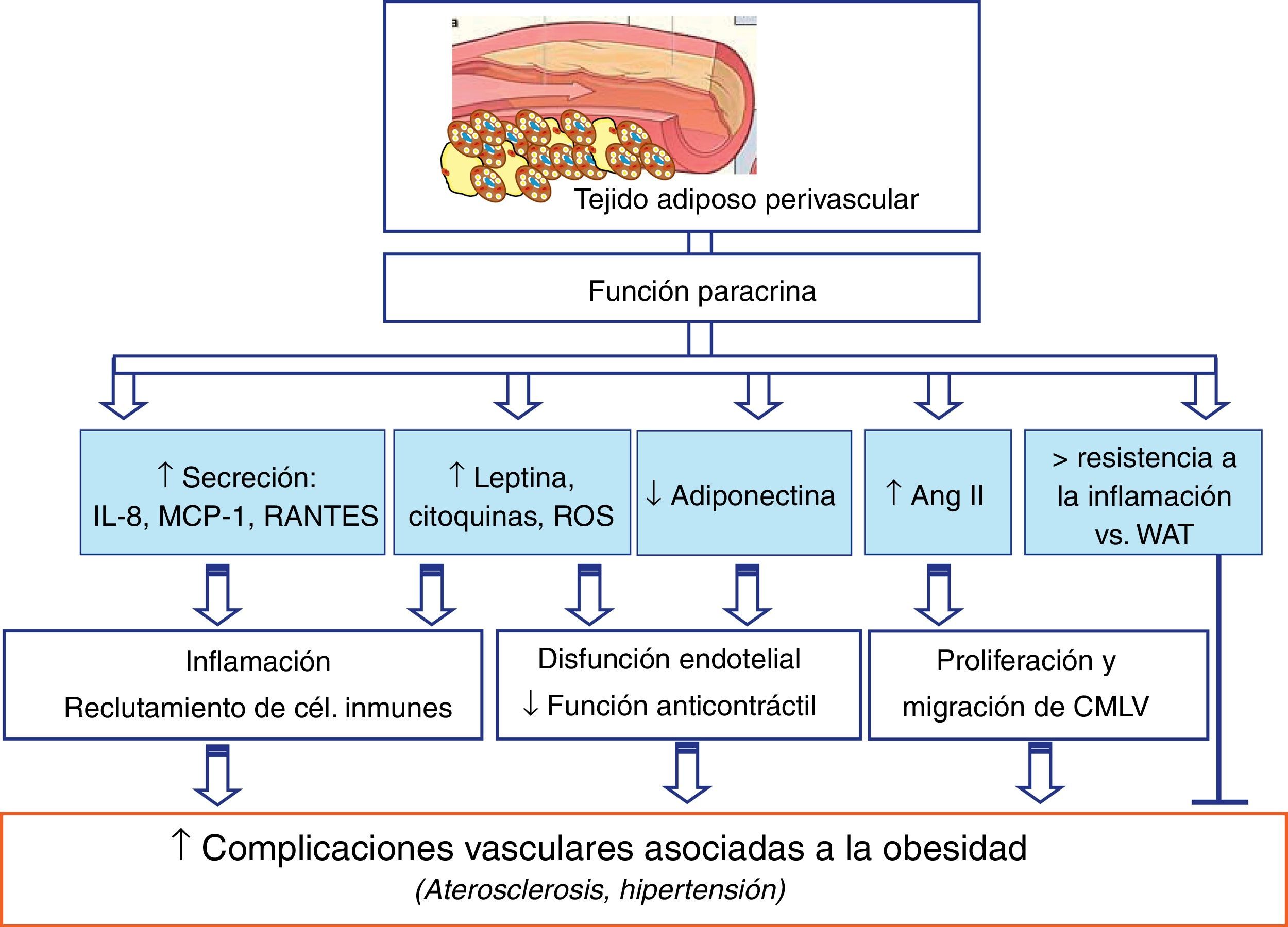
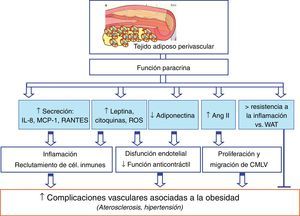
El PVAT que se extiende desde la capa adventicia es un modulador clave de la función vascular tanto en sujetos delgados como en animales delgados de experimentación. Sin embargo, en una situación de obesidad, el tejido perivascular aumenta su tamaño, creando un entorno de hipoxia que podría disminuir la producción de adiponectina que tiene efectos protectores frente a la aterogénesis y otras complicaciones vasculares50 (fig. 2). Además, tanto en la obesidad como en el síndrome metabólico el PVAT pierde su capacidad vasorreguladora porque hay una menor liberación de adipoquinas vasodilatoras y simultáneamente se liberan más factores que promueven la vasoconstricción51. Así, el PVAT tiene propiedades anticontráctiles, y algunos estudios encuentran que estas se pierden en la obesidad49 (fig. 2). También se ha descrito que el aumento del PVAT podría estar correlacionado positivamente con la cantidad de tejido adiposo intraabdominal52. Por tanto, en una situación de obesidad y aterosclerosis, el PVAT, además de expandirse, puede ser infiltrado por células inmunes, como macrófagos y linfocitos T47,53. La acumulación de linfocitos T favorecería la expansión del tejido adiposo debido a la estimulación de la adipogénesis por producción de 15d-PGJ2 y activación de PPAR-γ54. Sin embargo, los macrófagos no afectan a la expansión del PVAT, pero producen citoquinas que alteran la secreción de adipoquinas de dicho tejido55. Así, la producción de leptina56,57, de citoquinas y de quimioquinas proinflamatorias58,59, además de especies libres de oxígeno49,60 y ácidos grasos no esterificados61, está aumentada en el PVAT de pacientes obesos y de animales de experimentación obesos (fig. 2).
Contribución del tejido adiposo perivascular (PVAT) a las complicaciones vasculares asociadas a la obesidad. El PVAT interacciona con el endotelio, las células de músculo liso vascular y las células inmunes. Igualmente, se producen ciertos mediadores que estarían implicados en las posibles alteraciones vasculares asociadas a la obesidad, tales como la hipertensión y la aterogénesis.
Sin embargo, se ha descrito que las propiedades inflamatorias del tejido adiposo epicárdico son independientes de la obesidad62. En este sentido, estudios recientes también han demostrado que el PVAT que está alrededor de la arteria aorta torácica es muy similar al BAT en cuanto a su morfología y al perfil de expresión genético en ratones47. Además, el PVAT de la aorta torácica y el BAT son más resistentes a la inflamación inducida por un dieta rica en grasas en un modelo murino47 (fig. 2). Sería interesante comprobar si el PVAT en pacientes obesos con y sin enfermedad cardiovascular tiene una morfología y un perfil genético parecido también al BAT, como ocurre en los modelos murinos estudiados. Así, podría resultar beneficiosa la activación del fenotipo BAT en el PVAT con el fin de prevenir enfermedades vasculares asociadas a la obesidad, como la hipertensión y la aterogénesis.
Nuevas perspectivas en el tratamiento de la obesidadLas primeras indicaciones para el tratamiento de la obesidad, junto con la restricción calórica, es el ejercicio físico de manera dosificada y con cargas adecuadas a la condición física de cada paciente obeso. Existen considerables evidencias de que la restricción calórica aumenta la esperanza de vida63 y reduce el riesgo de desarrollar diabetes, enfermedad cardiovascular, trastornos degenerativos y algunos tipos de cáncer63,64. Los dos mecanismos principales que estarían implicados en los efectos «anti-envejecimiento» y «anti-obesidad» de la restricción calórica, serían: a)una menor producción de radicales libres mitocondriales65, y b)un aumento de la producción de proteínas resistentes al estrés celular66. Además de la restricción calórica, hay evidencias que muestran que un balance energético mantenido durante varios meses, en el que se incluye un aumento del gasto energético, suele resultar efectivo en la disminución de la adiposidad. Esta reducción se produce principalmente en la grasa visceral, que es la que posee receptores y actividad lipolítica mayor que el tejido adiposo de otras regiones67. Además, personas con un buen estado físico tienen la lipólisis en reposo mayor que los inactivos68. Otro aspecto que mejora el ejercicio físico en pacientes obesos es el perfil lipídico. En primer lugar, eleva las HDL y, por tanto, disminuye el cociente LDL/HDL y el riesgo cardiovascular69. Además, el ejercicio aumenta el tamaño de las partículas de LDL y HDL, resultando un perfil lipídico menos aterogénico que las partículas pequeñas de LDL y HDL, propias de los pacientes obesos69. Asimismo, el ejercicio físico regula también disminuyendo los niveles de triglicéridos en los individuos con valores inicialmente altos, gracias a una mejora en la sensibilidad a la insulina70,71. También el ejercicio físico produce distintas adaptaciones metabólicas que pueden resultar beneficiosas para el tratamiento de la obesidad. Se produce un aumento del potencial oxidativo, y así se favorece que se metabolicen más lípidos e hidratos de carbono de forma aeróbica, produciendo adaptaciones periféricas muy deseables. Por tanto, el ejercicio físico normaliza el perfil metabólico y permite la disminución de la morbimortalidad por estas causas72,73.
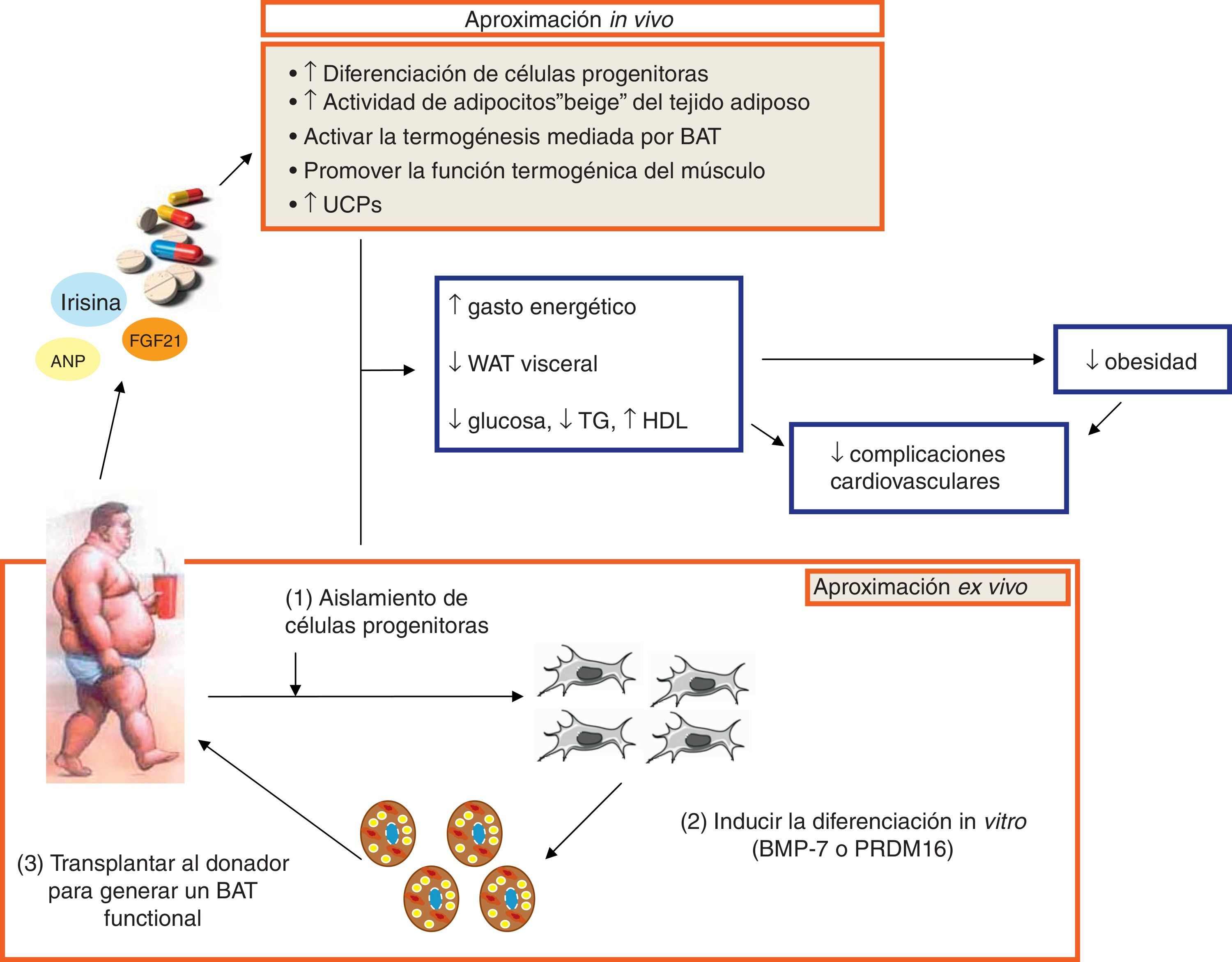
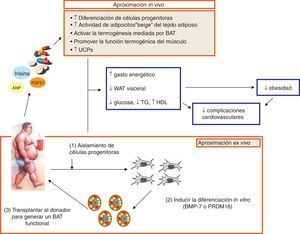
Para poder combatir esta epidemia mundial que es la obesidad y evitar así las complicaciones metabólicas y vasculares que está continuamente creciendo, además de los tratamientos establecidos, tanto la restricción calórica, el ejercicio, los distintos fármacos o la cirugía, hay que aunar esfuerzos para avanzar en el conocimiento del BAT y su prometedor potencial terapéutico frente a la obesidad y las complicaciones asociadas74-76. Se ha descrito que la respuesta adaptativa del BAT a un moderado e intermitente estrés a través de la activación simpática podría aumentar la proliferación y la diferenciación de células progenitoras de adipocitos marrones, además de incrementar la masa mitocondrial y la expresión de UCP-1 en el BAT77. Todos estos efectos, junto con la estimulación del BAT en los depósitos de WAT o en el músculo esquelético78,79, podrían aumentar el gasto energético y reducir el estrés oxidativo y la adiposidad visceral y, en consecuencia, una mayor resistencia a desarrollar obesidad y enfermedades metabólicas y vasculares asociadas a ella. Curiosamente, el trasplante de BAT (0,1-0,4g) a la cavidad visceral de un ratón es capaz de prevenir la ganancia de peso y mejorar la homeostasis glucídica en el ratón obeso sometido a dieta grasa79. Por otro lado, se ha identificado que los depósitos de BAT en humanos están compuestos por adipocitos beige16, y estos resultados podrían abrir nuevas vías de investigación para determinar si este tipo de células podrían tener cierto potencial terapéutico. Así, la irisina, que es una molécula circulante endógena y media algunos beneficios que produce el ejercicio y además activa a los adipocitos beige en roedores, podría representar uno de los caminos aplicables a humanos. Finalmente, dada la capacidad del BAT en el gasto energético y los efectos sobre el metabolismo lipídico y glucídico, así como su potencial resistencia a la inflamación junto con el PVAT, las nuevas perspectivas del tratamiento de la obesidad podrían centrarse en el diseño de nuevos fármacos o distintos regímenes o terapias que incrementen la cantidad y la función del BAT no solo para luchar contra la obesidad sino también para prevenir la diabetes tipo2 y otros trastornos metabólicos y vasculares asociados a ella (fig. 3).
Nuevas perspectivas en el tratamiento de la obesidad, basándose en los conocimientos actuales y en futuras aproximaciones tanto in vivo como ex vivo para el tratamiento de la obesidad. Todas ellas están destinadas a producir la activación del tejido adiposo marrón (BAT) o la diferenciación de células progenitoras o beiges en adipocitos marrones o promover la termogénesis en el músculo con el fin de favorecer la termogénesis, el gasto energético y la reducción de la adiposidad visceral, así como un mejor control de la glucosa y del perfil lipídico, todo ello reduciendo la obesidad y las complicaciones vasculares asociadas.
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.