El tratamiento convencional de la obesidad con dieta y ejercicio así como la cirugía bariátrica tienen sus limitaciones, por lo que es necesario disponer de fármacos para su tratamiento. En el pasado se comercializaron diferentes fármacos que fueron retirados por problemas de seguridad. Actualmente existen 3 fármacos aprobados por la Agencia Europea del Medicamento (EMA) y la Food and Drug Administration (FDA) para el tratamiento de la obesidad (orlistat, combinación de bupropión y naltrexona de liberación retardada y liraglutida) y 2 más solo autorizados por la FDA (lorcaserina y la combinación de fentermina y topiramato de liberación prolongada). Se aconseja su uso como segunda línea terapéutica y su elección debe individualizarse teniendo en cuenta múltiples aspectos como la pérdida de peso esperada, la vía de administración, su perfil de seguridad y el coste. Por otra parte, actualmente existen varios fármacos en vías de desarrollo que actúan sobre diferentes dianas terapéuticas.
Conventional treatment for obesity with diet, exercise and bariatric surgery has limitations; thus, it is necessary to have pharmacological tools. In the past, different drugs were marketed that were withdrawn due to safety problems. There are currently 3 drugs approved by the European Medicines Agency (EMA) and the Food and Drug Administration (FDA) for obesity therapy (orlistat, combination of bupropion and delayed-release naltrexone and liraglutide) and two more only authorized by FDA (lorcaserin and the combination of phentermine and extended release topiramate). It is recommended to use as a second therapeutic line and its choice should be individualized taking into account multiple aspects such as expected weight loss, route of administration, safety profile and cost. Currently there are several drugs under development that act on different therapeutic targets.
La incidencia de obesidad está aumentando de forma alarmante los últimos años en todo el mundo hasta el punto de que actualmente sea considerada la epidemia del sigloXXI1. En España, según el estudio ENRICA, un 16,5% de la población tiene sobrepeso (índice de masa corporal [IMC] 25-30kg/m2), un 21,7% presenta obesidad leve o moderada (IMC 30-40kg/m2), y un 1,2% obesidad grave o mórbida (IMC >40kg/m2). Además, es una enfermedad que está asociada a un mayor riesgo de comorbilidades como la hipertensión arterial, la dislipidemia o la diabetes mellitus tipo 2 y a una disminución de la esperanza de vida2-4.
El abordaje terapéutico clásico consiste en instaurar cambios de estilo de vida a la mayoría de los sujetos con obesidad y restringir la cirugía bariátrica para aquellos casos más graves. Ambos tratamientos presentan sus pros y sus contras. Por una parte, el tratamiento convencional con dieta y ejercicio tiene su principal limitación en la escasa eficacia a corto plazo, con una significativa pérdida de efectividad a largo plazo. Así, en el estudio LOOK Ahead, paradigma de intervención nutricional no asumible en la práctica diaria al tratarse de intervenciones semanales durante los primeros 6 meses, únicamente un 46% de los sujetos consiguieron perder más de un 5% de su peso al año. Posteriormente, un 60% de estos pacientes con buena respuesta inicial recuperaron el peso perdido o superaron el peso inicial durante los 3 años siguientes5. Por otra parte, la cirugía bariátrica es el tratamiento más eficaz para tratar la obesidad. Con ella se consiguen pérdidas ponderales que pueden superar el 30% y que se mantienen a largo plazo. Además, puede conseguir la remisión de las comorbilidades asociadas a la obesidad en una alto porcentaje de casos y se asocia con una disminución de la mortalidad6,7. A pesar de esto, hay que tener en cuenta que la cirugía bariátrica no está exenta de potenciales complicaciones. Actualmente con las técnicas laparoscópicas la mortalidad peroperatoria es baja, pero son frecuentes complicaciones peroperatorias como los sangrados, las infecciones o los fallos de sutura y complicaciones tardías como el síndrome de dumping8. Por otra parte, hay que considerar que no puede indicarse a todas las personas con obesidad. En el año 1991, el National Institutes of Health limitó la indicación de cirugía bariátrica para aquellos sujetos con un edad de entre 18 y 60 años con obesidad grave (IMC >40kg/m2) u obesidad moderada (IMC >35kg/m2) con comorbilidades asociadas9.
Recientemente, en el año 2016, se han comercializado en España 2 nuevos fármacos para tratar la obesidad: la liraglutida y la combinación de naltrexona/bupropión de liberación retardada (Nal/Bup). Ambos fármacos ya se encontraban comercializados en Estados Unidos anteriormente junto con la lorcaserina y la combinación de fentermina y topiramato de liberación prolongada (Fen/Top). Teniendo en cuenta las limitaciones del tratamiento convencional y de la cirugía bariátrica, la farmacoterapia puede jugar un papel importante como tratamiento de la obesidad. En esta situación, hemos considerado oportuno revisar los fármacos utilizados clásicamente para el tratamiento de la obesidad, los disponibles en la actualidad y aquellos en vías de desarrollo.
Dianas terapéuticasLa fisiopatología de la obesidad es altamente compleja e intervienen en ella diversos factores. De una forma simplista se puede explicar con el símil de la balanza. Cuando existe un mayor aporte energético que gasto calórico, se produce un balance energético positivo que inhibe la lipólisis y activa el acúmulo de triglicéridos en los adipocitos (lipogénesis). Este desbalance mantenido durante años puede llevar a la obesidad. Si profundizamos más en la fisiopatología de la obesidad, varios factores pueden influir en cada lado de la balanza. Por una parte, la regulación de la ingesta a nivel de sistema nervioso central y factores relacionados con la dieta pueden ser causantes de un aumento de la ingesta calórica. Por otra parte, el gasto energético viene condicionado por el metabolismo basal, la termogénesis en tejido adiposo marrón y el ejercicio físico. De estos 5 factores, ni los factores ambientales relacionados con la alimentación y el ejercicio físico, ni el metabolismo basal son potencialmente modificables con tratamientos farmacológicos. De esta forma, las dianas terapéuticas pueden ir dirigidas básicamente hacia la regulación de la ingesta y la activación de la termogénesis en tejido adiposo marrón.
Asimismo, hay que tener en cuenta que la fisiopatología de la obesidad es aún más compleja. En ella intervienen factores genéticos o epigenéticos y diferentes órganos y tejidos como el intestino. En el tubo digestivo es donde se produce la absorción de los lípidos y otros nutrientes. Además, se producen toda una serie de hormonas como el péptido similar al glucagón tipo 1 (GLP-1), el péptido inhibidor gástrico (GIP), el péptido YY (PYY) o ghrelina que tienen efecto importante a nivel de regulación de la ingesta10. Por último, la microbiota intestinal podría tener un papel destacado en el desarrollo de la obesidad11.
El estímulo del tejido adiposo marrón es una diana terapéutica atractiva para el tratamiento de la obesidad. Este es capaz de producir calor y consumir energía mediante la expresión de la proteína desacoplante-1 (UCP-1)12. A pesar de esto, ninguno de los fármacos comercializados en la actualidad actúa sobre este tejido. La principal diana terapéutica es la regulación de la ingesta a nivel de sistema nervioso central, que se produce principalmente en el núcleo arcuato del hipotálamo. Allí existen 2 tipos de neuronas que son clave en la regulación de la ingesta. Por una parte, las neuronas que expresan el péptido agouti-relacionado (AgRP) y el neuropéptido Y (NPY) que estimulan la ingesta y, por otra parte, otras células que expresan proopiomelanocortina (POMC) que inhiben la ingesta calórica. La actividad de estas poblaciones neuronales está regulada por múltiples estímulos, como neurotransmisores cerebrales o varios estímulos periféricos indicativos del balance energético como la glucosa, la insulina, la leptina o las hormonas intestinales especificadas anteriormente13.
Pasado de la farmacoterapia de la obesidadAntes del 1990Durante todo el sigloXX se utilizaron diferentes fármacos para tratar la obesidad sin estudios que avalaran su eficacia. Varios de ellos fueron retirados del mercado por efectos secundarios graves, como el dinitrofenol, un desacoplador de las cadenas respiratorias que producía hipertermias fatales14, o las anfetaminas, que además de adicción pueden producir intoxicaciones agudas, trastornos psicóticos o toxicidad cardiovascular. Por su parte, la combinación de fenfluramina (un inhibidor de la recaptación de serotonina) y fentermina (un simpaticomimético) demostró en diversos ensayos clínicos que producía pérdidas de peso mantenidas15. Sin embargo, fue también retirada del mercado en Estados Unidos en 1997 por aumento de valvulopatías atribuidas a la fenfluramina16.
1990-2010Durante las décadas de 1990 a 2010 se comercializaron en estados Unidos y Europa 3 fármacos para tratar la obesidad: la sibutramina en 1997, el orlistat en 1999 y el rimonabant en 2006. La sibutramina era un inhibidor de la recaptación de noradrenalina y serotonina que producía una pérdida de peso un 4,2% superior a placebo17. Fue retirada del mercado en 2010 por un aumento de efectos adversos cardiovasculares, que se producían principalmente en pacientes con alto riesgo cardiovascular18. El rimonabant era un agonista inverso y antagonista del receptor canabinoide1, con pérdida de peso sustraída a placebo del 4,7%17. En este caso fue suspendida su comercialización en 2008 por aumento de trastornos psiquiátricos y riesgo de suicidio19. De ellos, el único superviviente es el orlistat.
El orlistatEl orlistat es un inhibidor de la lipasa intestinal que reduce hasta un 30% la absorción de lípidos. Para conseguir este efecto se recomienda tomar 120mg justo antes, durante o después de las 3 comidas principales. En un metaanálisis que incluyó 10.631 sujetos con un IMC medio de 36,3kg/m2, el orlistat se asoció a una pérdida de peso de 2,9kg más que placebo20. A esta disminución del peso se añade además una mejoría de los parámetros cardiometabólicos. En este sentido, en el estudio XENDOS, el tratamiento con orlistat disminuyó la incidencia de diabetes tipo 2 en un 37,3% a 4 años21.
Aunque es un fármaco sin efectos adversos graves, su principal limitación es su baja tolerabilidad que hace que muchos pacientes abandonen el tratamiento. El bloqueo en la absorción de grasas produce como efecto adverso deposiciones grasientas, diarrea, flatulencia o urgencia defecacional. Estos efectos adversos se presentan en un 15-30% de los sujetos y son más evidentes en los pacientes que siguen consumiendo una dieta rica en grasas20. También puede producir una disminución en la absorción de vitaminas liposolubles, por lo que se aconseja su suplementación.
Presente de la farmacoterapia de la obesidadDurante la última década han aparecido 4 nuevas alternativas farmacológicas para el tratamiento de la obesidad. Dos de ellas fueron aprobadas en los Estados Unidos por la Food and Drug Administration (FDA) en 2012 y de momento no han visto la aprobación de la Agencia Europea del Medicamento (EMA): la lorcaserina y Fen/Top. Los otros dos, la liraglutida y Nal/Bup, han sido aprobados por la FDA en 2014 y posteriormente por la EMA en 2015 y actualmente están disponibles en España.
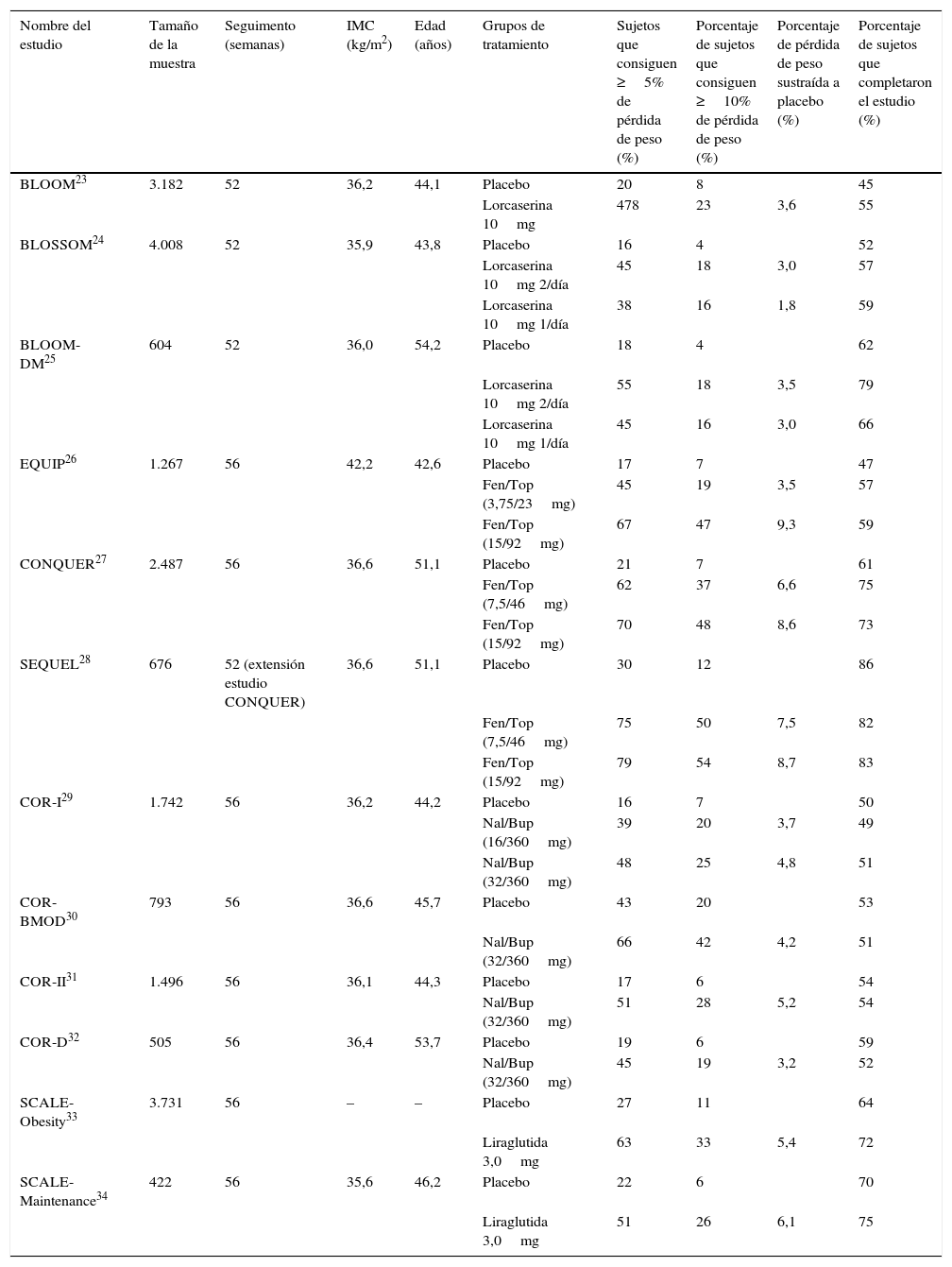
LorcaserinaLa lorcaserina es un agonista selectivo de los receptores 2C de serotonina que actúa en el hipotálamo aumentando la saciedad22. Se administra a dosis de 10mg 2 veces al día. Su aprobación por la FDA se basó en 3 estudios clínicos de faseIII: el BLOOM, el BLOSSOM y el BLOOM-DM23-25. La pérdida de peso a un año y con la dosis recomendada es un 3-3,5% superior a placebo (tabla 1). En el estudio BLOOM-DM, en el que se incluyeron pacientes con diabetes mellitus tipo 2, el tratamiento con lorcaserina produjo un descenso de la HbA1c del 0,5% respecto a placebo25. En general es un fármaco bien tolerado, como se desprende del hecho que finalizan los estudios más pacientes en el grupo de intervención que en el grupo placebo. Los principales efectos adversos acostumbran a ser síntomas serotoninérgicos como la cefalea, náuseas, boca seca, astenia o estreñimiento35. Está contraindicado su uso con fármacos con acción serotoninérgica como los inhibidores selectivos de la recaptación de serotonina o los inhibidores de la recaptación de serotonina y noradrenalina por el riesgo de causar un síndrome serotoninérgico. A diferencia de la fenfluramina, que no tenía una acción selectiva sobre la serotonina, no se ha detectado un aumento de defectos valvulares en pacientes tratados con lorcaserina36.
Eficacia clínica de los fármacos aprobados para el tratamiento de la obesidad en estudios fase III
| Nombre del estudio | Tamaño de la muestra | Seguimento (semanas) | IMC (kg/m2) | Edad (años) | Grupos de tratamiento | Sujetos que consiguen ≥5% de pérdida de peso (%) | Porcentaje de sujetos que consiguen ≥10% de pérdida de peso (%) | Porcentaje de pérdida de peso sustraída a placebo (%) | Porcentaje de sujetos que completaron el estudio (%) |
|---|---|---|---|---|---|---|---|---|---|
| BLOOM23 | 3.182 | 52 | 36,2 | 44,1 | Placebo | 20 | 8 | 45 | |
| Lorcaserina 10mg | 478 | 23 | 3,6 | 55 | |||||
| BLOSSOM24 | 4.008 | 52 | 35,9 | 43,8 | Placebo | 16 | 4 | 52 | |
| Lorcaserina 10mg 2/día | 45 | 18 | 3,0 | 57 | |||||
| Lorcaserina 10mg 1/día | 38 | 16 | 1,8 | 59 | |||||
| BLOOM-DM25 | 604 | 52 | 36,0 | 54,2 | Placebo | 18 | 4 | 62 | |
| Lorcaserina 10mg 2/día | 55 | 18 | 3,5 | 79 | |||||
| Lorcaserina 10mg 1/día | 45 | 16 | 3,0 | 66 | |||||
| EQUIP26 | 1.267 | 56 | 42,2 | 42,6 | Placebo | 17 | 7 | 47 | |
| Fen/Top (3,75/23mg) | 45 | 19 | 3,5 | 57 | |||||
| Fen/Top (15/92mg) | 67 | 47 | 9,3 | 59 | |||||
| CONQUER27 | 2.487 | 56 | 36,6 | 51,1 | Placebo | 21 | 7 | 61 | |
| Fen/Top (7,5/46mg) | 62 | 37 | 6,6 | 75 | |||||
| Fen/Top (15/92mg) | 70 | 48 | 8,6 | 73 | |||||
| SEQUEL28 | 676 | 52 (extensión estudio CONQUER) | 36,6 | 51,1 | Placebo | 30 | 12 | 86 | |
| Fen/Top (7,5/46mg) | 75 | 50 | 7,5 | 82 | |||||
| Fen/Top (15/92mg) | 79 | 54 | 8,7 | 83 | |||||
| COR-I29 | 1.742 | 56 | 36,2 | 44,2 | Placebo | 16 | 7 | 50 | |
| Nal/Bup (16/360mg) | 39 | 20 | 3,7 | 49 | |||||
| Nal/Bup (32/360mg) | 48 | 25 | 4,8 | 51 | |||||
| COR-BMOD30 | 793 | 56 | 36,6 | 45,7 | Placebo | 43 | 20 | 53 | |
| Nal/Bup (32/360mg) | 66 | 42 | 4,2 | 51 | |||||
| COR-II31 | 1.496 | 56 | 36,1 | 44,3 | Placebo | 17 | 6 | 54 | |
| Nal/Bup (32/360mg) | 51 | 28 | 5,2 | 54 | |||||
| COR-D32 | 505 | 56 | 36,4 | 53,7 | Placebo | 19 | 6 | 59 | |
| Nal/Bup (32/360mg) | 45 | 19 | 3,2 | 52 | |||||
| SCALE-Obesity33 | 3.731 | 56 | – | – | Placebo | 27 | 11 | 64 | |
| Liraglutida 3,0mg | 63 | 33 | 5,4 | 72 | |||||
| SCALE-Maintenance34 | 422 | 56 | 35,6 | 46,2 | Placebo | 22 | 6 | 70 | |
| Liraglutida 3,0mg | 51 | 26 | 6,1 | 75 |
Fen/Top: combinación de fentermina y topiramato; IMC: índice de masa corporal; Nal/Bup: combinación de naltrexona y bupropión.
La fentermina es una amina simpaticomimética con un efecto inhibidor del apetito con una acción similar a las anfetaminas15. El topiramato es un fármaco neuroestabilizador que se viene utilizando desde hace años para el tratamiento de la epilepsia y las migrañas; sin embargo, a dosis más altas de las usadas para el tratamiento de la obesidad37. Su efecto inhibidor del apetito se consigue por la inhibición del efecto orexígeno del glutamato a nivel central38. Con la combinación de ambos fármacos se logra un efecto sinérgico en la pérdida de peso39. El actuar sobre mecanismos diferentes puede tener como ventajas, por una parte, evitar mecanismos compensatorios y, por otra, conseguir un efecto sinérgico con dosis más bajas que permiten a la vez mejorar su perfil de seguridad. Existen 4 presentaciones de la combinación de Fen/Top. La dosis de inicio es de 3,75mg de fentermina y 23mg de topiramato, siendo la dosis habitual de mantenimiento de 7,5mg de fentermina y 46mg de topiramato, pudiéndose aumentar hasta una dosis máxima de 15mg de fentermina y 92mg de topiramato.
Los estudios fase III precomercialización fueron el EQUIP y el CONQUER26,27. En ellos se observó una pérdida de peso sustraída a placebo del 6,6% para la dosis de 7,5mg de fentermina/46mg de topiramato y de 8,4-8,6% para la dosis máxima de 15mg de fentermina/92mg de topiramato (tabla 1). Además, el ensayo SEQUEL, extensión del estudio CONQUER, mostró que las pérdidas de peso conseguidas a un año se mantenían a 2 años28. Se trata de un fármaco con unas tasas de adherencia en los estudios faseIII superiores a placebo. Los efectos secundarios más frecuentes son las parestesias, mareos, cefalea, disgeusia, insomnio, estreñimiento y boca seca; son dosis-dependientes y mejoran al año de tratamiento35. Debido al efecto teratógeno del topiramato sobre la hendidura orofacial, la FDA exige una prueba de embarazo antes del inicio del tratamiento y mensualmente mientras se mantenga el tratamiento. Está clasificada por la FDA como una sustancia con grado de controlIV y solo está disponible bajo control por el programa Risk Evaluation and Mitigation Strategy (REMS).
Combinación de naltrexona/bupropión de liberación sostenidaLa naltrexona es un agonista de los receptores opioides, que ha sido utilizado para el tratamiento de la dependencia al alcohol y los opioides40,41. El bupropión es un inhibidor de la recaptación de noradrenalina y dopamina con un efecto conocido antitabaco y antidepresivo42,43. La dosis diaria de Nal/Bup es de 8mg/90mg 2 veces al día, con un aumento progresivo de la dosis durante 4 semanas. Al igual que con Fen/Top, se ha observado un efecto sinérgico con su combinación y un efecto dosis-dependiente tanto en términos de supresión del apetito como en términos de pérdida de peso44.
Los estudios faseIII precomercialización fueron los estudios COR-I, COR-BMOD y COR-II (tabla 1)29-31. Estos se realizaron en sujetos con sobrepeso u obesidad y la pérdida de peso fue un 4-6% mejor que placebo a un año. Por otra parte, el estudio COR-D realizado en sujetos con diabetes mellitus tipo 232 mostró que probablemente la pérdida de peso en sujetos diabéticos es ligeramente inferior (3% superior a placebo). Además el tratamiento se asoció con un descenso de la HbA1c de 0,5% respecto a placebo. Los efectos adversos más frecuentes son náuseas, cefalea, mareos, insomnio y vómitos. Aunque estos son leves y en algunos casos transitorios, son causa de abandono de la medicación por algunos pacientes. De hecho, este es el único de los 4 tratamientos con unas tasas de abandono superior a placebo en los estudios faseIII (tabla 1). El tratamiento con Nal/Bup se ha relacionado con un aumento de los efectos adversos relacionados con la presión arterial. Así, en el estudio COR-D la tasa de efectos adversos relacionados con la presión arterial fue superior que en el grupo placebo (12% vs. 6,5%)32. Esto fue el principal motivo por el que la FDA declinó su aprobación en 2011. A pesar de ello, los resultados preliminares del estudio de seguridad cardiovascular (estudio Light) hicieron que finalmente se aprobara su comercialización en Estados Unidos45. Por esto se requiere una monitorización de la presión arterial con este tratamiento. Por otra parte, no se ha detectado un aumento de efectos adversos neuropsiquiátricos graves, ni tampoco del riesgo de suicidio, que se han descrito para el bupropión cuando se utiliza a dosis más altas para el tratamiento del cese del tabaquismo35.
La liraglutidaLa liraglutida es un análogo de GLP-1, una familia de fármacos que se llevan usando desde hace años para el tratamiento de la diabetes mellitus tipo 246. Estos fármacos además de mejorar el control glucémico producen pérdidas de peso superiores al resto de terapias para la diabetes47. Esto fue el motivo para que se investigara su potencial uso como fármaco de la obesidad a dosis superiores a las usadas para diabetes. Los mecanismos de la pérdida de peso parecen estar relacionados, por una parte, con el enlentecimiento del vaciado gástrico que causa saciedad precoz y, por otra parte, con un efecto anorexígeno sobre el hipotálamo48. Este fármaco se administra diariamente por vía subcutánea con un aumento semanal progresivo de la dosis hasta llegar a los 3mg/día.
Los estudio fase III que demostraron la eficacia de 3mg de liraglutida en pacientes obesos sin diabetes fueron los estudios SCALE-Obesity y SCALE-Maintenance (tabla 1)33,34. En ellos la pérdida de peso fue un 5,4-6,1% superior a placebo. Además de la pérdida ponderal, la liraglutida se asoció a un mayor descenso de los niveles de HbA1c sin aumento de las hipoglucemias, y a una mejoría de otros parámetros de riesgo cardiovascular como la presión arterial o el perfil lipídico.
La liraglutida es un fármaco bien tolerado. Sus efectos adversos más frecuentes son las náuseas y los vómitos, que suelen ser transitorios y que pueden contribuir a la pérdida de peso49. La posible asociación entre los análogos de GLP-1 y el desarrollo de pancreatitis agudas es actualmente no concluyente, como notificaron la FDA y la EMA en 201450. Se desaconseja el uso de análogos de GLP-1 en sujetos con antecedentes personales o familiares de carcinoma medular de tiroides o neoplasia endocrina múltiple tipo 2, por haberse observado en modelos animales en ratones un aumento de tumores de células C tiroideas51.
Aunque no existen datos específicos de los posibles beneficios cardiovasculares de la liraglutida 3mg en sujetos con obesidad, un amplio estudio realizado en diabetes tipo 2 con las dosis utilizadas en esta enfermedad (1,2mg) ha demostrado una disminución de episodios cardiovasculares en pacientes de alto riesgo cardiovascular52.
Utilidad en la práctica diariaSegún ficha técnica, el uso de estos fármacos está indicado en combinación con una dieta baja en calorías y un aumento de la actividad física en personas con obesidad (IMC >30kg/m2) o en sujetos con sobrepeso (IMC 27-30kg/m2) que presenten además enfermedades concomitantes relacionadas con el exceso de peso como, por ejemplo, diabetes tipo 2, dislipidemia o hipertensión arterial. A partir de aquí, la primera pregunta que nos debemos hacer es en qué momento de la historia natural de la enfermedad vamos a indicar el tratamiento farmacológico. En este sentido, la Endocrine Society en colaboración con la European Society of Endocrinology y The Obesity Society recomiendan el tratamiento farmacológico en aquellos sujetos con historia de incapacidad para perder peso o mantener el peso perdido con el tratamiento convencional, pero nunca como una primera opción terapéutica53.
Otra cuestión a plantearse es cuál de los 5 tratamientos escogeremos. A la hora de hacer comparaciones entre los fármacos tenemos que tener en cuenta varias circunstancias. La primera de todas es que no existen estudios cara a cara entre ellos y las comparaciones en términos de pérdida de peso y tolerabilidad deben hacerse con cautela. Además, los estudios faseIII incluyen una intervención dietética intensiva que hace que la pérdida de peso en la práctica clínica sea en general inferior a la observada en estos estudios. Otras circunstancias que tendremos en cuenta son la pérdida de peso deseada, la tolerabilidad, la vía de administración, las comorbilidades del paciente y el coste (tabla 2). El aspecto económico gana cierta relevancia al ser fármacos no financiados por el Sistema Nacional de Salud.
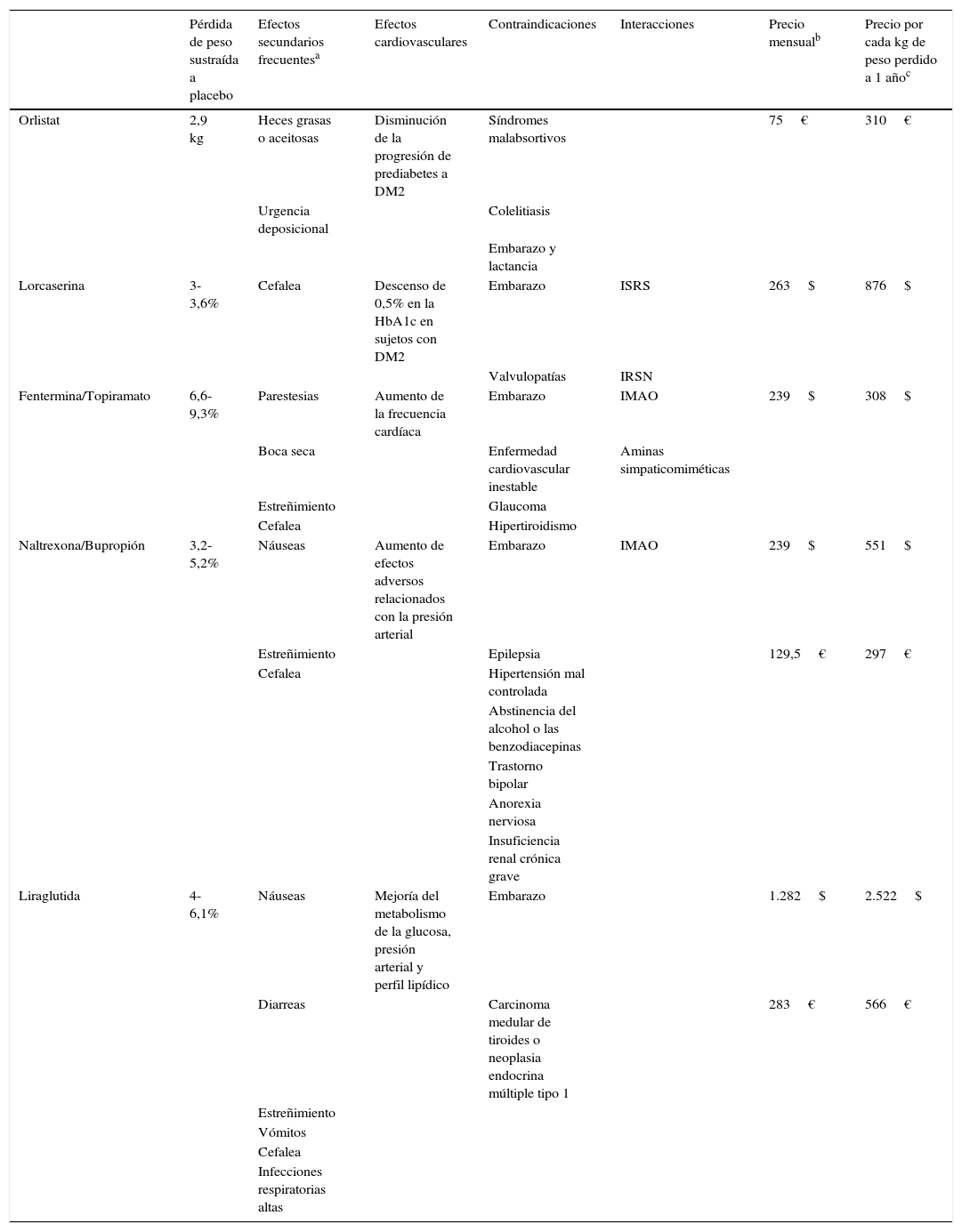
Características de los fármacos aprobados para el tratamiento de la obesidad
| Pérdida de peso sustraída a placebo | Efectos secundarios frecuentesa | Efectos cardiovasculares | Contraindicaciones | Interacciones | Precio mensualb | Precio por cada kg de peso perdido a 1 añoc | |
|---|---|---|---|---|---|---|---|
| Orlistat | 2,9 kg | Heces grasas o aceitosas | Disminución de la progresión de prediabetes a DM2 | Síndromes malabsortivos | 75€ | 310€ | |
| Urgencia deposicional | Colelitiasis | ||||||
| Embarazo y lactancia | |||||||
| Lorcaserina | 3-3,6% | Cefalea | Descenso de 0,5% en la HbA1c en sujetos con DM2 | Embarazo | ISRS | 263$ | 876$ |
| Valvulopatías | IRSN | ||||||
| Fentermina/Topiramato | 6,6-9,3% | Parestesias | Aumento de la frecuencia cardíaca | Embarazo | IMAO | 239$ | 308$ |
| Boca seca | Enfermedad cardiovascular inestable | Aminas simpaticomiméticas | |||||
| Estreñimiento | Glaucoma | ||||||
| Cefalea | Hipertiroidismo | ||||||
| Naltrexona/Bupropión | 3,2-5,2% | Náuseas | Aumento de efectos adversos relacionados con la presión arterial | Embarazo | IMAO | 239$ | 551$ |
| Estreñimiento | Epilepsia | 129,5€ | 297€ | ||||
| Cefalea | Hipertensión mal controlada | ||||||
| Abstinencia del alcohol o las benzodiacepinas | |||||||
| Trastorno bipolar | |||||||
| Anorexia nerviosa | |||||||
| Insuficiencia renal crónica grave | |||||||
| Liraglutida | 4-6,1% | Náuseas | Mejoría del metabolismo de la glucosa, presión arterial y perfil lipídico | Embarazo | 1.282$ | 2.522$ | |
| Diarreas | Carcinoma medular de tiroides o neoplasia endocrina múltiple tipo 1 | 283€ | 566€ | ||||
| Estreñimiento | |||||||
| Vómitos | |||||||
| Cefalea | |||||||
| Infecciones respiratorias altas |
DM2: diabetes mellitus tipo 2; IMAO: inhibidores de la monoaminoxidasa; IRSN: inhibidores de la recaptación de norepinefrina y serotonina; ISRS: inhibidores selectivos de la recaptación de serotonina.
De los 5 fármacos, solo 3 están disponibles actualmente en España, reduciéndose el abanico de opciones. De los no comercializados en nuestro país, la lorcaserina es un fármaco con un buen perfil de tolerabilidad, pero probablemente es de los menos eficaces en pérdida de peso conjuntamente con el orlistat. Por otra parte, Fen/Top es el fármaco con mayor potencial de pérdida de peso y en general bien tolerado. Su principal inconveniente es su teratogenicidad y efecto simpaticomimético que lo hacen desaconsejable en pacientes con enfermedad cardiovascular.
De los fármacos disponibles en España, el orlistat es el más antiguo. Su uso en la práctica clínica se ve limitado sobre todo por su baja tolerancia y eficacia. Los otros 2 fármacos, Nal/Bup y liraglutida, producen pérdidas de peso similares entre ellos. La liraglutida presenta una buena tolerabilidad y además puede tener efectos beneficiosos sobre los factores de riesgo cardiovascular que lo podrían hacer preferible en sujetos con prediabetes, hipertensión o hipercolesterolemia. En cambio, Nal/Bup es peor tolerado y debe usarse con precaución en sujetos con hipertensión. Los principales inconvenientes de la liraglutida son que requiere una administración subcutánea y su mayor coste.
La última pregunta que nos podemos hacer es cómo usar estos fármacos. Se recomienda monitorizar el peso y los efectos adversos mensualmente durante los primeros 3 meses y posteriormente cada 3 meses. Su uso se debe interrumpir cuando no se consigue superar el 5% de pérdida de peso durante los 3 primeros meses o si existe intolerancia53.
Futuro en el tratamiento farmacológico de la obesidadLa epidemia de la obesidad hace que sea muy atractivo para las compañías farmacéuticas investigar sobre nuevas dianas en el tratamiento de la obesidad. Una estrategia atractiva podría ser la de combinar, por su diferente mecanismo de acción, la liraglutida con alguno de los 3 fármacos que actúan a nivel central. Otra diana interesante son fármacos que puedan actuar aumentando el gasto energético. El mirabegrón es un agonista beta 3 que se testó como fármaco para tratar la vejiga hiperactiva. Este fármaco es capaz de activar la termogénesis en tejido adiposo marrón, aumentando el gasto energético en 40cal/día54. El beloranib es un inhibidor de la metionina aminopeptidasaII que reduce la síntesis hepática de ácidos grasos y estimula su degradación. Es una medicación inyectada, actualmente en investigación en sujetos con síndrome de Prader-Willi, en los que produce pérdidas de peso de 1kg a la semana55. Por último, otra potencial diana terapéutica son los fármacos que actúan sobre otras hormonas gastrointestinales, como podrían ser los análogos de GIP, el PYY o inhibidores de la ghrelina.
ConclusionesActualmente se dispone en España de 3 fármacos indicados para el tratamiento de la obesidad. Al orlistat se han unido la combinación de naltrexona con bupropión y la liraglutida. La reciente aprobación de estos nuevos agentes farmacológicos para el tratamiento de la obesidad ha aumentado las opciones en el manejo de esta enfermedad. Estos están indicados como segunda línea de tratamiento en aquellos sujetos con sobrepeso u obesidad en quienes ha fracasado el tratamiento convencional. La elección del tratamiento se debe basar en factores como las comorbilidades asociadas, el perfil de tolerabilidad y el coste.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
AutoríaTodos los autores han colaborado en la redacción de esta revisión y han aprobado la versión final a publicar.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.