La enfermedad arterial periférica (EAP) puede considerarse un predictor de mortalidad cardiovascular. Como otras enfermedades provocadas por la arteriosclerosis aparece como consecuencia de la interacción entre numerosos factores ambientales y genéticos. A pesar del impacto en la salud y la prevalencia de la EAP, especialmente elevada en diabéticos, se conoce poco acerca de las variantes genéticas que confieren susceptibilidad a esta enfermedad.
ObjetivoEstudiar la asociación entre el polimorfismo –250G/A del promotor del gen de lipasa hepática (LIPC) y la presencia de enfermedad arterial periférica en individuos con diabetes tipo 2.
Pacientes y métodosSe han estudiado 78 personas sin diabetes ni EAP y 138 pacientes diabéticos tipo 2 en los que se ha diagnosticado la presencia de EAP mediante el índice tobillo-brazo. El polimorfismo –250G/A se ha analizado mediante PCR y restricción. Para demostrar la asociación entre la presencia del alelo -250A y la EAP se ha realizado un análisis de regresión logística.
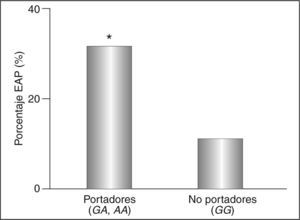
ResultadosSegún el análisis de regresión logística por pasos hacia delante, la presencia del alelo –250A (odds ratio: 2,80; intervalo de confianza del 95%, 1,06-7,40; p<0,05) se asocia independientemente con la EAP, incluyendo las variables edad, sexo, hipertensión, hábito de fumar, tiempo de diagnóstico de la diabetes, hemoglobina glucosilada (HbA1c), índice de masa corporal, triglicéridos, colesterol unido a lipoproteínas de alta densidad y colesterol unido a lipoproteínas de baja densidad en el modelo. La prevalencia de EAP en los portadores del alelo fue del 31,3% y sólo del 13,3% en no portadores (p<0,05).
ConclusiónNuestro estudio muestra que el alelo menos frecuente del polimorfismo –250G/A del promotor de LIPC se asocia independientemente con la presencia de EAP en pacientes diabéticos tipo 2.
Peripheral arterial disease (PAD) is considered a significant predictor of cardiovascular mortality. Similar to other atherosclerotic diseases, PAD appears as consequence of the interaction between multiple environmental and genetic factors. Despite its health impact and its prevalence, especially high in diabetic patients, the genetic factors underlying susceptibility to PAD are not well known.
ObjectiveTo investigate the association between the –250G/A promoter polymorphism in the hepatic lipase (LIPC) gene and the presence of peripheral arterial disease in persons with type 2 diabetes.
Patients and methodsWe evaluated 78 subjects without diabetes nor PAD and 138 type 2 diabetics and identified those with peripheral arterial disease according to the ankle-arm index. The –250G/A polymorphism in the promoter of the LIPC gene was studied by PCR-restriction. A logistic regression analysis was performed to determine the association between the rare allele and peripheral arterial disease.
ResultsThe –250A allele (OR 2.80; 95% CI: 1.06- 7.40; p<0.05) was significantly associated with PAD in the logistic regression analysis including age, sex, waist-to-hip ratio, body-mass index, duration of diabetes, hypertension, smoking, glycated hemoglobin, triglycerides, HDL-C and LDL-C in the model. Prevalence of PAD in diabetics patientes carriers of the –250A allele was 31.3% but only 13.3% in non carriers (p<0.05).
ConclusionsPatients with type 2 diabetes who are carriers of the less frequent –250A allele in the promoter of the hepatic lipase gene are susceptible to peripheral arterial disease.
La enfermedad arterial periférica (EAP) se caracteriza por un flujo sanguíneo reducido en las extremidades inferiores provocado, en la mayoría de los casos, por la arteriosclerosis. La prevalencia de la enfermedad varía según el tipo de población: en un estudio nacional multicéntrico se obtuvo una prevalencia del 27% en pacientes con diabetes tipo 21. Aunque habitualmente cursa de forma asintomática2, la EAP se asocia a un aumento del riesgo de infarto y muerte3. Entre los diabéticos, algunos de los factores de riesgo clásicos predisponen a la EAP, como el hábito de fumar, haber tenido un episodio coronario y tener unos triglicéridos en ayunas > 2,5mmol/l4.
Puesto que, a pesar de la concurrencia de estos factores de riesgo, la aparición de la EAP es variable, es lógico pensar en la presencia de factores genéticos que expliquen parte de la susceptibilidad a la enfermedad, si bien el conocimiento actual de las bases genéticas de la EAP es muy limitado.
La implicación en el desarrollo de arteriosclerosis de los polimorfismos comunes –250G/A, –514C/T, -710T/C y −763 A/G localizados en la región promotora del gen de lipasa hepática (LIPC)5, está ampliamente descrita en la bibliografía, aunque con resultados controvertidos. Dada la gran variedad de procesos en los que la enzima lipasa hepática está implicada es posible encontrar estudios que la consideran proaterogénica o lo contrario6. Así, se ha descrito que la presencia de los alelos menos frecuentes de los polimorfismos citados se asocian a la presencia de cardiopatía isquémica7, a pesar de estar demostrado que estas variantes se asocian a una reducción de la actividad de la enzima que se traduce en un ligero aumento de las concentraciones de lipoproteínas de alta densidad (HDL)8.
Por otra parte, Eller et al9 han demostrado, en 400 sujetos con EAP estudiados en una unidad de angiología y comparados con 400 sujetos sin EAP, que la frecuencia del alelo –250A del gen LIPC fue mucho mayor en casos que en controles. El objetivo de nuestro trabajo es conocer si la presencia de este alelo predispone igualmente a EAP en pacientes diabéticos.
Pacientes y métodosSe ha estudiado un grupo de 138 pacientes diabéticos tipo 2 y 78 personas no diabéticas recogidas para un estudio previo acerca de la relación entre la lipemia posprandial y la arteriosclerosis10.
Los criterios de inclusión para los pacientes diabéticos fueron: comienzo de la diabetes con más de 40 años de edad, en ambos sexos, tratados con dieta y/o antidiabéticos orales y con una hemoglobina glucosilada < 8%. Se excluyeron los pacientes de más de 70 años de edad, los tratados con insulina, los que tomaban hipolipemiantes al menos 6 semanas antes del estudio y los casos con enfermedades graves concomitantes (cáncer) o recientes (cardiopatía isquémica), antecedentes de pancreatitis lipémica, triglicéridos en ayunas > 500mg/dl en la analítica más reciente o a 1.000mg/dl en alguna analítica anterior.
Para el presente trabajo se excluyeron, además, 15 pacientes diabéticos que habían tenido algún episodio coronario o cerebrovascular previo, ya que la arteriosclerosis sintomática se asocia con la EAP clínica y subclínica11.
La presencia de EAP en todos los participantes del estudio (sujetos con y sin diabetes) se determinó de acuerdo con la guía ACC/AHA para el seguimiento de la EAP midiendo el índice tobillo-brazo (ITB)12. Las medidas del ITB se realizaron con un aparato Angiolab 2 (SPEAD-Doppler-Systeme, Vertriebs GmBH, Alemania), los valores normales son entre 0,9 y 1,30. Entre los 123 pacientes diabéticos seleccionados 25 tuvieron un ITB < 0,9 y de ellos sólo 4 presentaban claudicación intermitente. No se incluyó ningún sujeto sin diabetes con un ITB < 0,9. Ninguno de los pacientes presentó un ITB > 1,30.
Todos los participantes firmaron un consentimiento informado y el protocolo de estudio fue aprobado por el comité ético del Hospital Universitario Virgen de la Victoria de Málaga.
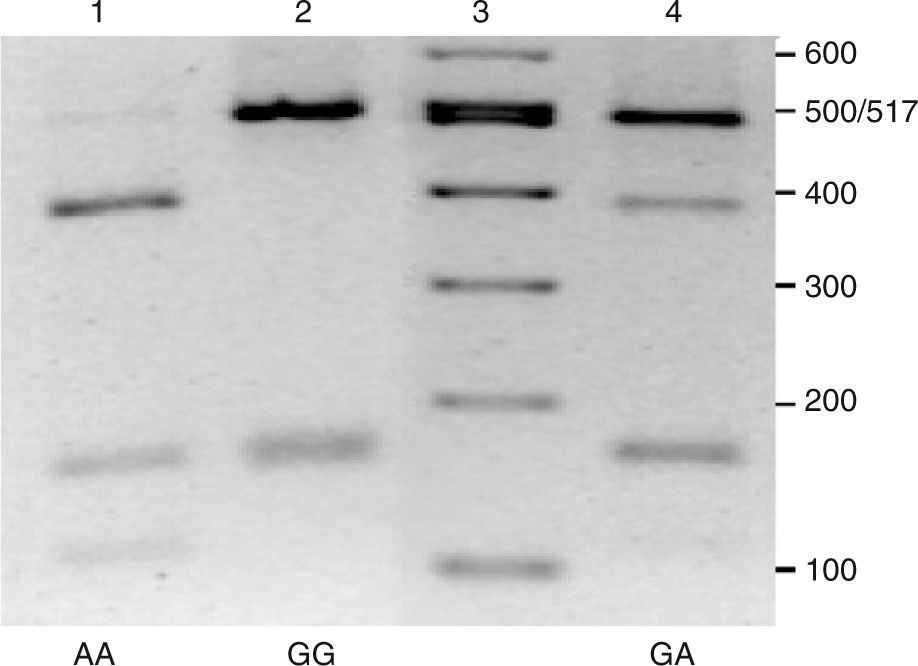
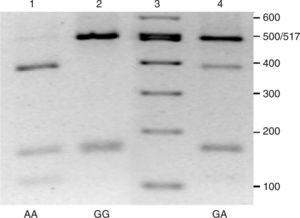
Para los análisis bioquímicos se recogieron muestras de sangre en ayunas, de las que se obtuvo plasma mediante centrifugación a 4°C, 3.000rpm durante 15min. Las concentraciones de lípidos plasmáticos se determinaron mediante ensayos enzimáticos en un autoanalizador Cobas Integra (Roche, Suiza) en el Hospital Universitario Virgen de la Victoria. El ADN genómico se aisló a partir de sangre congelada utilizando columnas de purificación QIAamp® DNA Blood (QIAGEN, Alemania). La genotipificación de las muestras se realizó amplificando por PCR un fragmento de 668 pb mediante cebadores ya descritos13. Las reacciones de amplificación se realizaron en un termociclador iCycler iQ™ (BioRad, EE.UU.), en un volumen final de 25 pl, utilizando la mezcla de reacción iQTM SYBR Green Supermix (BioRad, EE.UU.) y siguiendo un protocolo térmico que consistió en una etapa de desnaturalización a 95°C durante 5min y 40 ciclos con 3 etapas a 95°C 30s, 66°C 30s y 72°C 30s. Los productos de amplificación fueron digeridos con la enzima de restricción Dra I (New England Biolabs, Reino Unido) siguiendo las especificaciones del fabricante. Los fragmentos obtenidos se separaron en geles de agarosa al 2,5% (fig. 1). Los diferentes genotipos se diferencian por la visualización de una banda de 501 pb, específica del genotipo –250GG, una banda de 387 pb en el caso del genotipo –250AA o ambas bandas en los heterocigotos –250GA (fig. 1). Además, se genera un fragmento de 167 pb, común a todos los genotipos, y otro de 114 pb cuando está presente el alelo –250A.
El análisis estadístico se realizó con el programa SPSS versión 11.5 para Windows. Para evaluar las diferencias de medias entre los grupos de sujetos no diabéticos (controles), diabéticos sin EAP (DM2 sin EAP) y diabéticos con EAP (DM2 con EAP), se empleó la prueba de ANOVA o bien la prueba de la t de Student para la comparación entre los grupos de diabéticos portadores (homocigotos para el alelo menos frecuente, –250AA, y heterocigotos, –250GA) y los no portadores (−250GG). En ambos casos las variables que no seguían una distribución normal se transformaron logarítmicamente. La influencia de la presencia del alelo –250A en las variables analizadas ajustando para las covariables oportunas se analizó aplicando un modelo lineal general. Se realizó un análisis de regresión logística por pasos hacia delante para comprobar la asociación entre la presencia del alelo y la EAP. Para verificar el equilibrio Hardy-Weinberg y el resto de variables cualitativas se empleó la prueba de la χ2. Se consideró estadísticamente significativo un valor de p < 0,05.
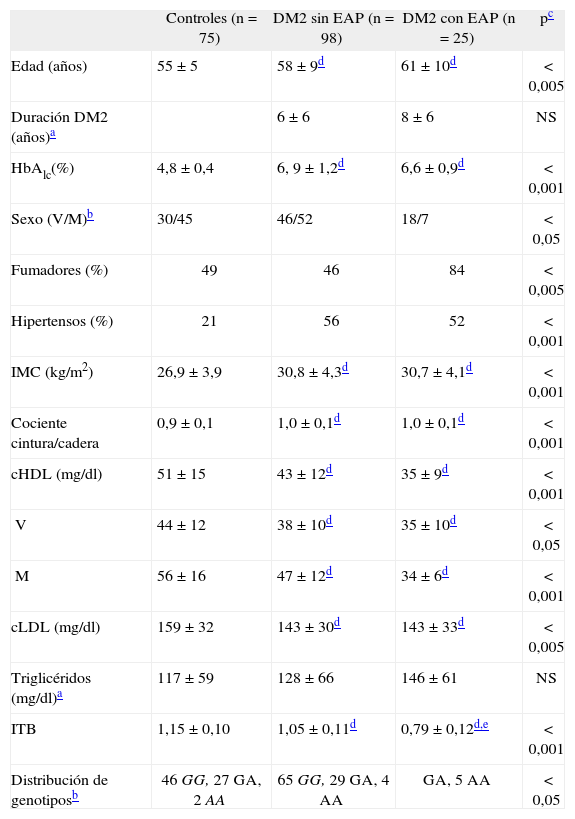
ResultadosDe los 123 pacientes diabéticos estudiados, 25 tenían EAP (4 sintomática y 21 asintomática). Las características clínicas y bioquímicas de los sujetos controles (sin EAP ni DM2), diabéticos sin EAP y diabéticos con EAP se reflejan en la tabla 1. Los sujetos del grupo control presentan las diferencias esperadas respecto a los pacientes diabéticos (menor HbA1c (%), menor índice de masa corporal (IMC) y cociente cintura-cadera, menor prevalencia de hipertensión y mayor concentración de colesterol HDL); por otra parte, la media de edad fue inferior a la de los diabéticos, mostraron valores de colesterol unido a lipoproteínas de baja densidad (cLDL) superiores y no hubo diferencias significativas en las concentraciones de triglicéridos.
Características clínicas y bioquímicas de los sujetos estudiados
| Controles (n = 75) | DM2 sin EAP (n = 98) | DM2 con EAP (n = 25) | pc | |
| Edad (años) | 55 ± 5 | 58 ± 9d | 61 ± 10d | < 0,005 |
| Duración DM2 (años)a | 6 ± 6 | 8 ± 6 | NS | |
| HbAlc(%) | 4,8 ± 0,4 | 6, 9 ± 1,2d | 6,6 ± 0,9d | < 0,001 |
| Sexo (V/M)b | 30/45 | 46/52 | 18/7 | < 0,05 |
| Fumadores (%) | 49 | 46 | 84 | < 0,005 |
| Hipertensos (%) | 21 | 56 | 52 | < 0,001 |
| IMC (kg/m2) | 26,9 ± 3,9 | 30,8 ± 4,3d | 30,7 ± 4,1d | < 0,001 |
| Cociente cintura/cadera | 0,9 ± 0,1 | 1,0 ± 0,1d | 1,0 ± 0,1d | < 0,001 |
| cHDL (mg/dl) | 51 ± 15 | 43 ± 12d | 35 ± 9d | < 0,001 |
| V | 44 ± 12 | 38 ± 10d | 35 ± 10d | < 0,05 |
| M | 56 ± 16 | 47 ± 12d | 34 ± 6d | < 0,001 |
| cLDL (mg/dl) | 159 ± 32 | 143 ± 30d | 143 ± 33d | < 0,005 |
| Triglicéridos (mg/dl)a | 117 ± 59 | 128 ± 66 | 146 ± 61 | NS |
| ITB | 1,15 ± 0,10 | 1,05 ± 0,11d | 0,79 ± 0,12d,e | < 0,001 |
| Distribución de genotiposb | 46 GG, 27 GA, 2 AA | 65 GG, 29 GA, 4 AA | GA, 5 AA | < 0,05 |
DM2: diabetes mellitus tipo 2; cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; EAP: enfermedad arterial periférica; HbA1c: hemoglobina glucosilada; IMC: índice de masa corporal; ITB: índice tobillo-brazo; M: mujeres; NS: no significativo; V: varones.
Los datos se expresan como medias ± DE. Se consideran fumadores las personas que fuman actualmente y exfumadores.
El valor medio del ITB de los controles es superior al de los pacientes diabéticos sin EAP y superior al de los diabéticos con EAP, que presentan un ITB medio < 0,9, que es el valor considerado como criterio diagnóstico. La frecuencia de fumadores fue especialmente alta en el grupo de DM2 con EAP, de los que el 72% fueron varones, lo que explica las diferencias en la distribución de sexos entre los grupos. Los pacientes diabéticos con y sin EAP no se diferencian entre sí respecto a la edad, duración de la diabetes, HbA1c (%), IMC, cociente cintura cadera, prevalencia de hipertensión, valores de cLDL y de triglicéridos.
La distribución de genotipos en los grupos control y diabéticos se especifica en la tabla 1. Para ambos se verificó el equilibrio Hardy-Weinberg. La frecuencia del alelo –250A calculada es 0,206 en los sujetos controles, 0,188 en los diabéticos sin EAP y 0,400 en los diabéticos con EAP (p < 0,05).
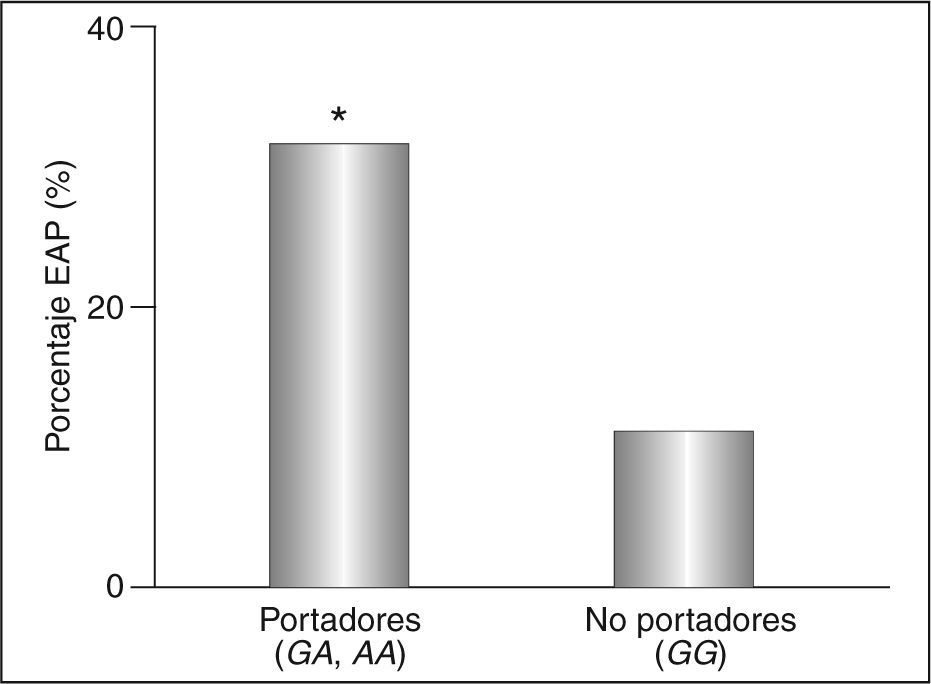
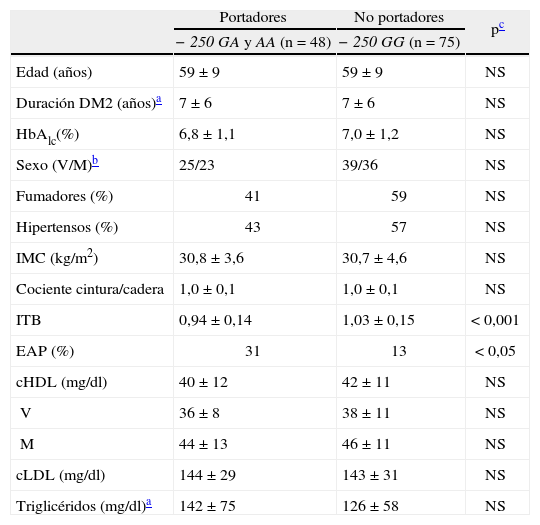
Los pacientes diabéticos portadores del alelo –250A difieren de los no portadores sólo en los valores del ITB (tabla 2), que es inferior en los primeros aun ajustando por las covariables edad, sexo, hábito de fumar, tiempo de diagnóstico de la diabetes, hipertensión, HbA1c, IMC, cociente cintura-cadera, triglicéridos, colesterol unido a HDL (cHDL) y cLDL (p < 0,001). De esta forma, la prevalencia de la EAP en los portadores fue del 31%, y sólo del 13% en los no portadores (p < 0,05) (fig. 2). Estas diferencias aumentaron al incluir en el análisis a los pacientes con episodios coronarios o cerebrovasculares previos (datos no mostrados).
Características clínicas y bioquímicas de los pacientes diabéticos (con y sin enfermedad arterial periférica) según la presencia o no del alelo -250A
| Portadores | No portadores | pc | |
| −250 GA y AA (n = 48) | −250 GG (n = 75) | ||
| Edad (años) | 59 ±9 | 59 ±9 | NS |
| Duración DM2 (años)a | 7 ±6 | 7 ±6 | NS |
| HbAlc(%) | 6,8 ± 1,1 | 7,0 ± 1,2 | NS |
| Sexo (V/M)b | 25/23 | 39/36 | NS |
| Fumadores (%) | 41 | 59 | NS |
| Hipertensos (%) | 43 | 57 | NS |
| IMC (kg/m2) | 30,8 ± 3,6 | 30,7 ± 4,6 | NS |
| Cociente cintura/cadera | 1,0 ±0,1 | 1,0 ±0,1 | NS |
| ITB | 0,94 ± 0,14 | 1,03 ± 0,15 | < 0,001 |
| EAP (%) | 31 | 13 | < 0,05 |
| cHDL (mg/dl) | 40 ± 12 | 42 ± 11 | NS |
| V | 36 ± 8 | 38 ± 11 | NS |
| M | 44 ± 13 | 46 ± 11 | NS |
| cLDL (mg/dl) | 144 ± 29 | 143 ± 31 | NS |
| Triglicéridos (mg/dl)a | 142 ± 75 | 126 ±58 | NS |
DM2: diabetes mellitus tipo 2; cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; EAP: enfermedad arterial periférica; HbA1c: hemoglobina glucosilada; IMC: índice de masa corporal; ITB: índice tobillo-brazo; M: mujeres; NS: no significativo; V: varones.
Los datos se expresan como medias ± DE. Se considera fumadoras a las personas que fuman actualmente y ex fumadoras.
Los resultados obtenidos al aplicar un modelo de regresión logística por pasos hacia delante muestran que el alelo –250A se asocia de forma significativa con la enfermedad arterial periférica (odds ratio [OR]: 2,80; intervalo de confianza [IC] del 95%, 1,06-7,40; p < 0,05), junto con el hábito de fumar (OR: 8,54; IC del 95%, 2,35-31,05; p < 0,005), incluyendo en el modelo las covariables enumeradas en el párrafo anterior.
DiscusiónLos datos de nuestro estudio indican que la presencia del alelo menos frecuente del polimorfismo –250G/A del promotor del gen LIPC confiere susceptibilidad para presentar EAP en pacientes con diabetes tipo 2. El hecho de encontrar esta asociación en DM2 es novedoso. En el estudio de Eller et al9 se demuestra la asociación entre el polimorfismo y la EAP en una población que difiere notablemente de la nuestra: se excluyeron diabéticos, se analizaron sujetos con claudicación intermitente de moderada a severa o con isquémica crítica, y un 47% de la muestra tenía síntomas de afectación vascular en territorio coronario o cerebrovascular. Por el contrario, nuestra serie incluye pacientes diabéticos, con formas leves de EAP, en su mayor parte asintomáticos y en los que habíamos excluido la presencia clínica de enfermedad coronaria o cerebrovascular. Aunque la presencia de DM2 es de por sí un factor de riesgo para EAP y, de hecho, los pacientes diabéticos presentan valores del ITB inferiores a los controles analizados en nuestro estudio, nuestros datos también muestran una asociación independiente entre la presencia del alelo –250A y la enfermedad arterial periférica de los pacientes diabéticos.
Está demostrado que el efecto de los polimorfismos que aparecen en el promotor del gen LIPC en los valores de lípidos plasmáticos, es consecuencia de una reducción en la actividad de la enzima, que se traduce en un aumento del cHDL8. En nuestro grupo de pacientes, la asociación entre la enfermedad arterial y el alelo –250A es clara, pero no puede explicarse por un efecto en las variables lipídicas que se han estudiado, ya que no hallamos diferencias en los valores de cHDL cuando se compararon portadores y no portadores. Esto está de acuerdo con otras publicaciones en sujetos con diabetes14. Es interesante señalar que la dieta, lamentablemente no controlada en nuestro estudio, y otros factores pueden modular el efecto de las variantes genéticas en los valores de HDL15. Por otra parte, los polimorfismos del promotor de LIPC se han asociado con una mayor magnitud de la lipemia posprandial16, cuya relación con la arteriosclerosis se ha estudiado por nuestro grupo10. Además, es necesario considerar que la lipasa hepática desempeña un papel central en distintas etapas del transporte reverso de colesterol y en el remodelado de gran variedad de lipoproteínas aterogénicas, funciones que pueden verse afectadas por la reducción de la actividad de la enzima sin que tenga reflejo en los valores basales de lípidos.
De este modo, el efecto pro o antiaterogénico de los polimorfismos del promotor de LIPC es controvertido y puede depender del grupo étnico analizado así como de posibles sesgos de selección de la muestra. Así, en individuos brasileños, la presencia del alelo –250G fue más frecuente en pacientes coronarios que en controles17. En individuos escandinavos, seleccionados por unos valores de HDL < 1,1mmol/ l, no se encontró ninguna asociación entre el mencionado polimorfismo y la enfermedad vascular18. Sin embargo, en otros estudios prospectivos y de casos y controles, la presencia del alelo -514T del promotor de LIPC predispone claramente a enfermedad coronaria arteriosclerótica19,20, estos últimos resultados son congruentes con los de nuestro estudio.
En el contexo de nuestro trabajo, que incluye pacientes con DM2, es interesante discutir la importancia de la intolerancia a la glucosa en el desarrollo de la arteriosclerosis. En el estudio de Eller et al9, en población no diabética, la HbA1c se asoció con la presencia de EAP. Por otra parte, se ha descrito que el alelo –250A se asocia a la conversión de intolerancia a la glucosa a diabetes tipo 2 en poblaciones del centro y sur de Europa (entre ellas la española)21, aunque no en población finesa21,22. Considerando estos estudios, los sujetos portadores del polimorfismo heredarían una mayor predisposición a pesentar EAP a través de cambios de actividad de la lipasa hepática y, además, por la predisposición a presentar diabetes tipo 2.
Finalmente, es necesario considerar las limitaciones de nuestro estudio: pequeño número de sujetos analizados, tanto diabéticos como controles; ausencia de individuos diabéticos de edad avanzada; con más tiempo de duración de la enfermedad, y en tratamiento con insulina. Estos factores ambientales, en conjunto, podrían modificar la asociación entre el alelo –250A y la presencia de EAP.
En resumen, nuestros datos extienden a la población diabética la noción de que el polimorfismo –250A del promotor de LIPC aumenta la susceptibilidad a desarrollar enfermedad arterial periférica.
Los autores agraden a Carmen Moreno (RN) y Josefa González (RN) por su colaboración en la medición del índice tobillo-brazo y extracción de las muestras de sangre. Agradecemos su colaboración a Rafael Gómez-Medialdea, MD, Jefe de Angiología y Cirugía Vascular del Hospital Universitario Virgen de la Victoria.
Una comunicación referente a esta línea de trabajo, titulada “Asociación del polimorfismo –250G/A del promotor del gen de lipasa hepática con el riesgo de padecer enfermedad arterial periférica en pacientes con diabetes mellitus tipo 2” se presentó en el XIX Congreso Nacional de la SEA (Santander, 2006) y fue galardonada con una Mención Especial.