Los productos avanzados de oxidación proteica (PAOP) son un marcador para estimar estrés oxidativo en proteínas plasmáticas. El estrés oxidativo se considera un factor de riesgo cardiovascular (FRCV), relacionado con el aumento de presión arterial y la dislipidemia. Este trabajo tuvo por objetivo evaluar la asociación entre las concentraciones plasmáticas de PAOP y los FRCV en adultos jóvenes aparentemente sanos.
MétodosEstudio transversal comparativo prospectivo en 120 estudiantes de la Facultad de Químico Farmacobiología de la UMSNH, a los que se les determinó IMC, presión arterial, así como PAOP, glucosa, colesterol total, lipoproteínas (de alta, baja y muy baja densidad) y triglicéridos.
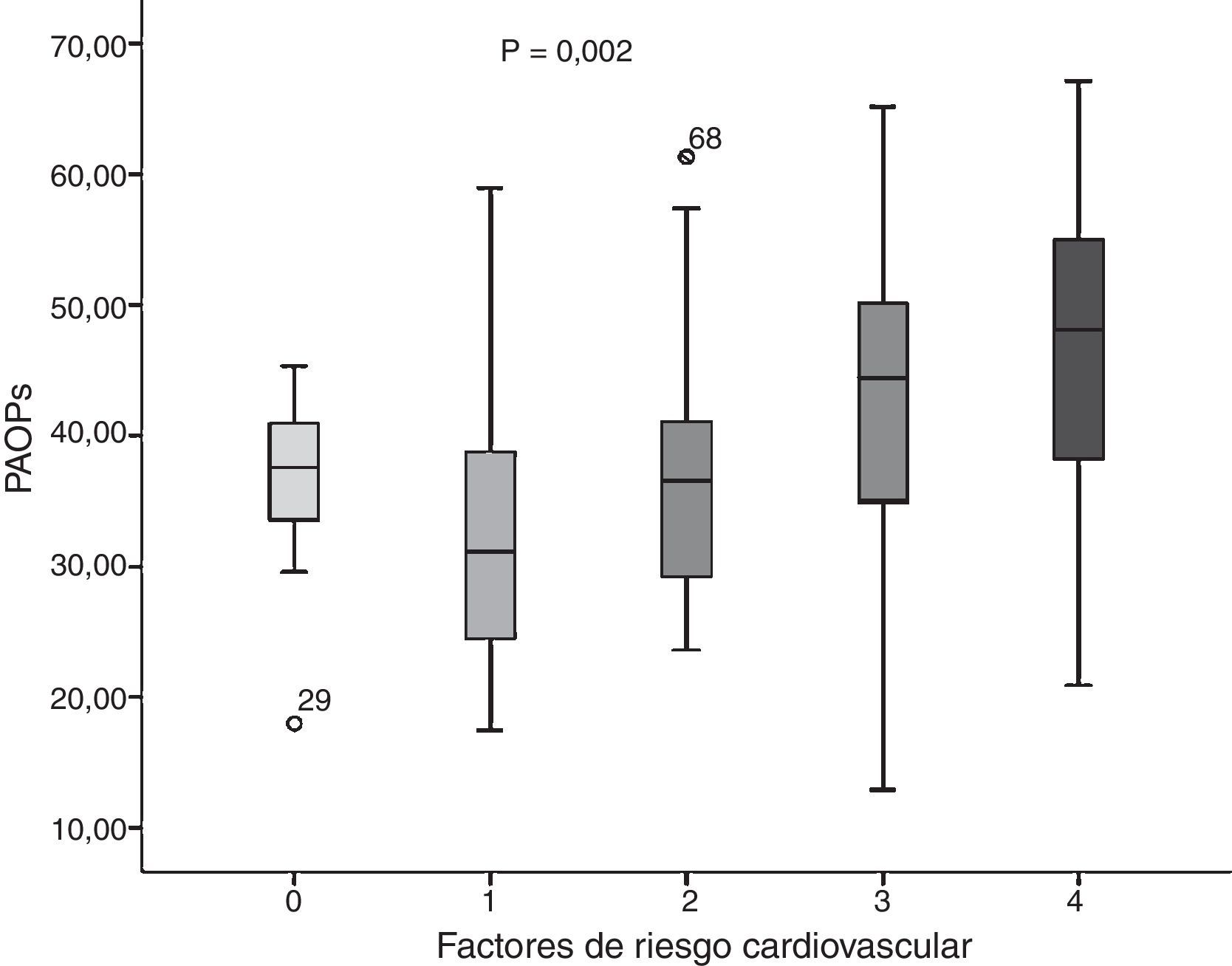
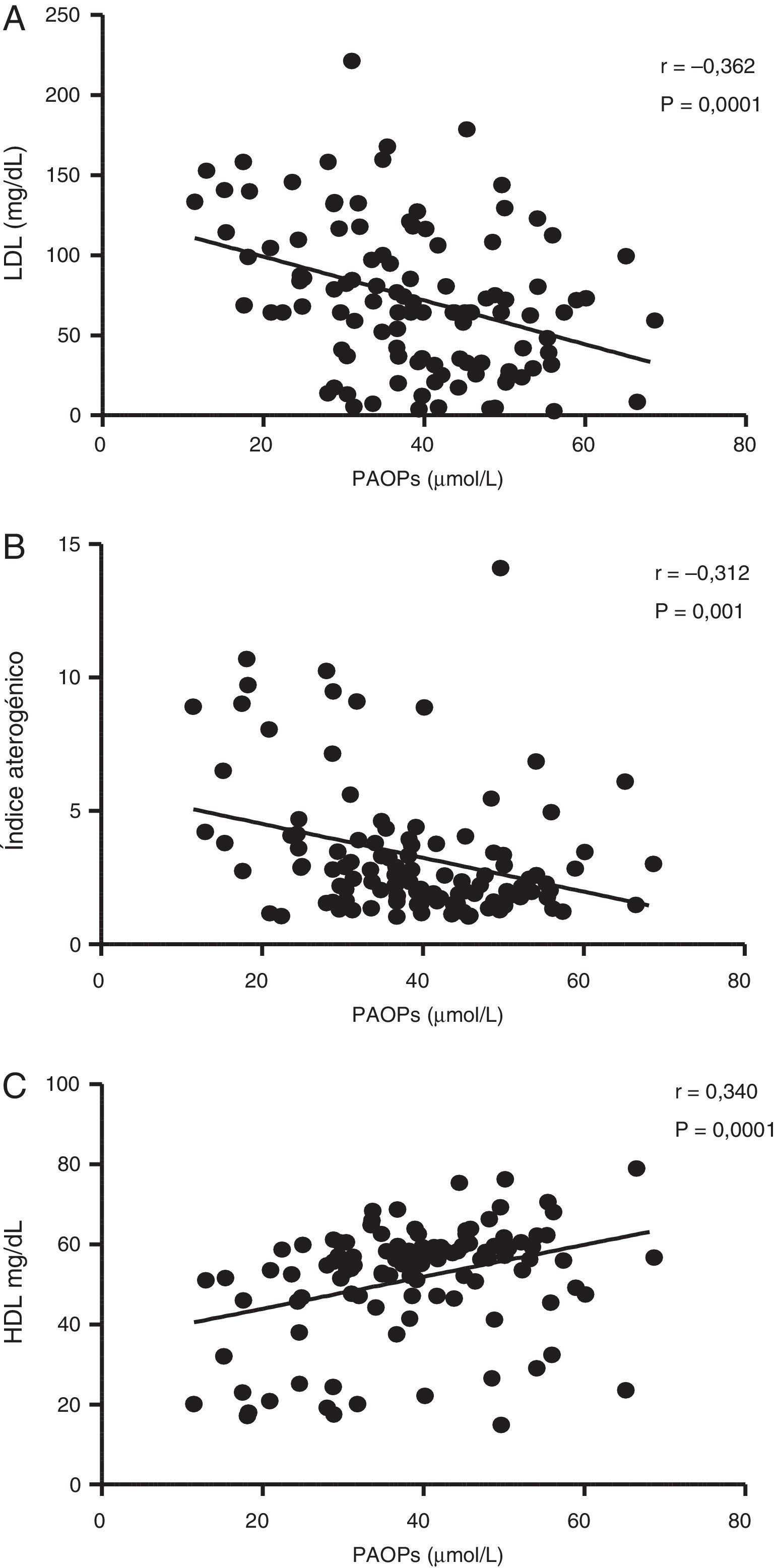
ResultadosLos grupos de jóvenes con y sin FRCV presentaron diferencias significativas respecto a IMC, cintura, grasa corporal (p<0,05) y perfil lipídico (p<0,0001). Se presentaron cifras más altas de PAOP en el grupo de jóvenes con 3 y 4 FRCV (F: 4,651; p=0,002). Los PAOP correlacionaron negativamente con el colesterol LDL (r=–0,364; p=0,0001).
ConclusionesSe identificó que las concentraciones de PAOP se ven incrementadas conforme aumentan los FRCV en los jóvenes, por lo que estos podrían considerarse un factor importante de riesgo debido a que su depósito en la placa de ateroma favorece el proceso aterogénico y así el desarrollo de enfermedades cardiovasculares. La cuantificación de PAOP contribuye a la determinación indirecta del estado oxidativo en el organismo. El estudio del estado metabólico y oxidativo de jóvenes de aspecto saludable es de importancia en la prevención de enfermedades cardiovasculares en etapas posteriores de la vida, sin embargo, se requieren estudios longitudinales para estudiar su evolución.
Advanced oxidation protein products (AOPPs) are used as a marker to estimate oxidative stress in plasma proteins. Oxidative stress is considered a factor of cardiovascular risk (CVRF) related to increased blood pressure, and dyslipidaemia. The aim of this study was to evaluate the association between plasma AOPPs and CVRF in apparently healthy young adults.
MethodsA prospective cross-sectional study was conducted on 120 students of the Faculty of Chemical-Pharmacobiology of the UMSNH. Body mass index (BMI) and blood pressure were determined. A blood specimen was also collected to quantify AOPPs, glucose, total cholesterol, lipoproteins (high, low, and very low density), and triglycerides.
ResultsDifferences were observed in the groups with and without CVRF, with significant differences in BMI, waist, body fat (P<.05), and lipid profile (P<.0001). AOPPs were higher in the group of young people with three and four CVRF (F: 4.651; P=.002). A negatively correlation was found between AOPPs and LDL cholesterol (r=–0.364; P=.0001).
ConclusionsIt was observed that AOPPs concentrations are increased as CVRF increase in young adults. Thus, this could be considered an important risk factor, because their deposition in the atherosclerotic plaque favours the atherogenic process, and thus the development of cardiovascular disease. Quantification of AOPPs contributes to the indirect determination of oxidative status in the body. The study of metabolic and oxidative state of apparently healthy young adults is important in the prevention of cardiovascular disease in later life. More longitudinal studies are required to study its evolution.
En la última década las enfermedades cardiovasculares (ECV) se han incrementado alarmantemente, constituyendo la primera causa de mortalidad en México1. La ECV tiene un origen multifactorial claramente establecido en el que se ha descrito el papel de diversos factores de riesgo cardiovascular (FRCV), entre los que se encuentran la hipertensión arterial (HTA), hipercolesterolemia, altas concentraciones de lipoproteínas de baja densidad-colesterol (LDL-c), bajas concentraciones de lipoproteínas de alta densidad-colesterol (HDL-c), tabaquismo y diabetes, además de los que se han comprobado más recientemente como la hipertrigliceridemia y la obesidad, que tienen también un papel relevante2.
Mediados por las comunicaciones masivas que invitan a las nuevas generaciones a llevar estilos de vida y alimentación no saludables3, la cuantificación de FRCV en una población de adultos jóvenes ha adquirido especial relevancia para desarrollar estrategias de prevención, ya que estos constituyen un grupo más susceptible de cambiar conductas y establecer hábitos de vida más saludables4.
Por otra parte, es bien sabido que el estrés oxidativo se origina a partir del desbalance entre las especies reactivas de oxígeno generadas en los procesos metabólicos del organismo y la deficiencia de los sistemas antioxidantes5,6. Diversos estudios prospectivos han permitido establecer una asociación entre este y las ECV, planteando que el estrés oxidativo es un evento temprano en el desarrollo de la placa aterosclerótica6, y de la subsecuente ECV, ya que durante los estados iniciales de aterogénesis, favorece las modificaciones oxidativas de las LDL-c atrapadas en el espacio subendotelial7. El estrés oxidativo tiene además un efecto adverso en las macromoléculas celulares, y debido a que las proteínas conforman el mayor grupo de estas moléculas, la probabilidad de oxidación proteica está aumentada. En un estado de estrés oxidativo, las especies reactivas de oxígeno, además de los oxidantes cloraminados —principalmente el ácido hipocloroso (HOCl)—, ocasionan daño oxidativo en las proteínas plasmáticas, causando entrecruzamiento ditirosínico y dando origen a los productos avanzados de oxidación proteica (PAOP). Witko-Sarsat et al.8 desarrollaron un ensayo espectrofotométrico que a la fecha permite detectar la formación plasmática de PAOP, y propusieron su medida como marcador confiable para estimar el daño oxidativo en las proteínas.
El objetivo del presente estudio fue evaluar la asociación existente entre las concentraciones plasmáticas de PAOP y los FRCV en una población de adultos jóvenes aparentemente sanos, así como estimar la frecuencia de dislipidemia y prediabetes en esta población.
Material/pacientes y métodosPacientesSe realizó un estudio transversal comparativo donde se estudiaron 120 adultos jóvenes aparentemente sanos, estudiantes de la Facultad de Químico Farmacobiología de la Universidad Michoacana de San Nicolás de Hidalgo (UMSNH), en Morelia, México. Se incluyeron jóvenes de ambos sexos, con edades comprendidas entre los 18 y 30 años, que dieron su consentimiento informado por escrito y que no se encontraban ingiriendo fármacos que pudiesen comprometer los resultados del estudio, tales como hipoglucemiantes orales, antihipertensivos, hipolipemiantes o medicamentos indicados para la pérdida de peso. Fueron excluidos aquellos jóvenes con diagnóstico previo de diabetes, hipertensión, hipotiroidismo, o jóvenes embarazadas.
A cada paciente se le realizó un interrogatorio dirigido a la investigación de los FRCV, antecedentes heredofamiliares de enfermedades crónicas tales como diabetes tipo 2, hipertensión y enfermedad renal, así como hábitos de actividad física y tabaquismo. Además se les midió la presión arterial (PA) con un baumanómetro de mercurio calibrado, estando sentado, sin haber ingerido bebidas ricas en cafeína o fumado en los 30min previos al estudio. La PA elevada se determinó con valores de PA sistólica (PAS) ≥130mmHg, o PA diastólica (PAD) ≥85mmHg, de acuerdo con las guías para el manejo de hipertensión arterial de la European Society of Hypertension (ESH) y la European Society of Cardiology (ESC)9.
Se les realizó impedancia bioeléctrica (Tanita® TBF 300 GS, Tokyo, Japón) para determinar su peso, talla, IMC y porcentaje de grasa corporal (%GC). Se establecieron los puntos de corte para sobrepeso (≥25kg/m2) y obesidad (≥30kg/m2) de acuerdo con las cifras establecidas por la OMS. Se midió la circunferencia de la cintura (CC) en el punto medio entre el borde inferior de la costilla y la cresta iliaca. Se consideró obesidad abdominal siempre que la CC fuese ≥102cm en el caso de los hombres y CC ≥88cm en las mujeres10.
Determinaciones analíticasLos pacientes fueron citados previo ayuno de 12h. Se obtuvieron 10ml de sangre por venopunción, de los cuales 7ml se destinaron a la determinación sérica de glucosa y perfil lipídico, mientras que los 3ml restantes se utilizaron para la cuantificación plasmática de PAOP. Tanto el suero como el plasma fueron obtenidos centrifugando la muestra a 3.000rpm durante 15min, las alícuotas fueron almacenadas a –30°C hasta su posterior utilización en un plazo no mayor de 3 meses. Las concentraciones séricas de glucosa, triglicéridos, colesterol total y ligado a lipoproteínas (de alta y baja densidad) fueron determinadas en un equipo de química clínica automatizado (Vitros 5.1 Ortho Clínical Diagnostics®).
Se consideraron jóvenes con glucosa basal alterada aquellos que presentaron concentraciones de glucosa en ayuno ≥100mg/dl (de acuerdo con las cifras establecidas por la American Diabetes Association [ADA]11), y con dislipoproteinemia según el Adult Treatment Panel III (ATP-III) (valores de triglicéridos ≥150mg/dl, colesterol total ≥200mg/dl, LDL-c ≥100mg/dl y HDL-c <40mg/dl en hombres y <50mg/dl en mujeres)12. Se calculó el índice aterogénico (IA) de Castelli13 con base en los valores de colesterol total y HDL-c. Los jóvenes en estudio fueron agrupados de acuerdo con el número de FRCV.
Las concentraciones plasmáticas de PAOP fueron determinadas de acuerdo con el ensayo espectofotométrico descrito por Witko-Sarsat et al.8; la concentración de PAOP se expresó en micromoles por litro (μmol/l) de equivalentes de cloramina T y, dado que no existe un punto de corte para establecer cifras elevadas, se tomó el valor del percentil 75 a concentraciones de 48μmol/l. Los coeficientes de variación (CV) intra e interensayo obtenidos con este método en nuestro laboratorio fueron menores del 5%.
Análisis estadísticoLos datos fueron recolectados y analizados con ayuda del paquete estadístico SPSS versión 23.0 (SPSS Inc. Chicago, Illinois, EE.UU.). Se realizó la prueba de Kolmogorov-Smirnov para evaluar la normalidad de la distribución de los parámetros investigados. Los datos fueron expresados como media±desviación estándar. Se realizó un ANOVA de un factor para la comparación de las variables respecto al número de FRCV. Además, se calculó la correlación de Pearson para determinar la asociación entre variables numéricas continuas. Se realizó el análisis de regresión lineal por el método de pasos consecutivos para evaluar la asociación de los FRCV y los PAOP como variable dependiente. Fueron consideradas significativas todas aquellas diferencias con p<0,05.
ResultadosSe analizaron 120 adultos jóvenes aparentemente sanos estudiantes de la Universidad Michoacana de San Nicolás de Hidalgo, de los cuales 46 fueron hombres y 74 mujeres, que se dividieron en 5 grupos, clasificados de acuerdo con el número de FRCV presentados.
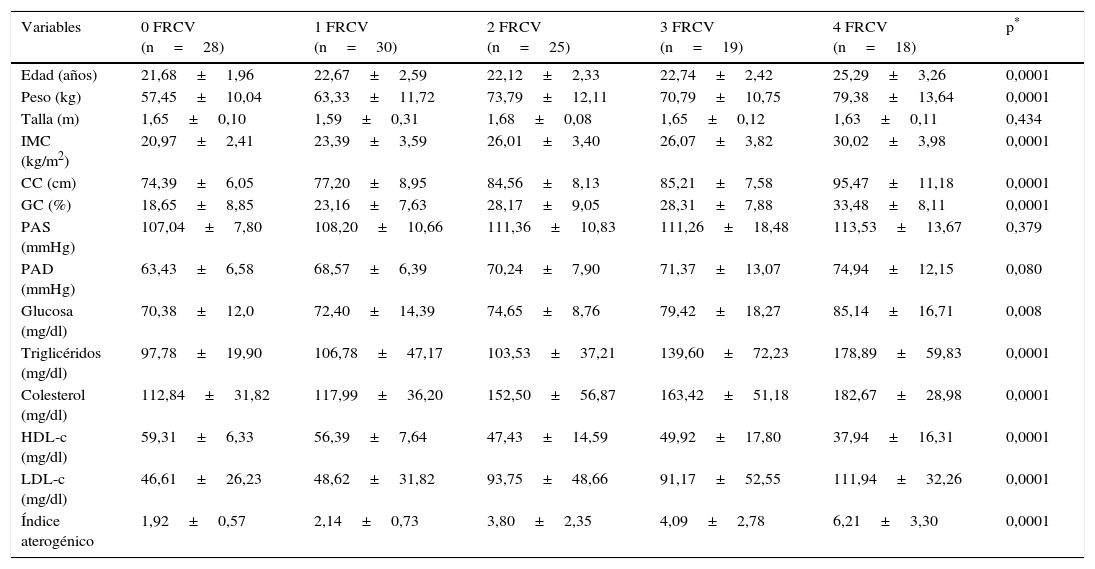
En la tabla 1 se muestran las características generales (clínicas, antropométricas y bioquímicas) de los jóvenes aparentemente sanos de acuerdo con el número de FRCV. Se observa que presentaron un comportamiento semejante en talla y PA (p>0,05). Sin embargo, destacaron las diferencias significativas en los indicadores de obesidad, tanto abdominal como IMC y %GC (p<0,0001). Importantes diferencias fueron también encontradas al analizar los parámetros bioquímicos, tanto en el caso de la glucosa (p=0,008) como en el perfil lipídico e IA (p=0,0001). En el grupo de sujetos que presentaron 2 (n=25) y 3 (n=19) FRCV se observaron valores promedio de IMC (26,01±3,40 y 26,07±3,82kg/m2, respectivamente) indicativos de sobrepeso, mientras que en el grupo de sujetos con 4 FRCV (n=18) se presentaron valores de IMC (30,02±3,98kg/m2) correspondientes a obesidad, con altas cifras de IA (6,21±3,30) y LDL-c (111,94±32,26mg/dl) y bajas concentraciones de HDL-c (37,94±16,31mg/dl). No se encontraron jóvenes con 5 FRCV.
Características generales de jóvenes de acuerdo con el número de factores de riesgo cardiovascular
| Variables | 0 FRCV (n=28) | 1 FRCV (n=30) | 2 FRCV (n=25) | 3 FRCV (n=19) | 4 FRCV (n=18) | p* |
|---|---|---|---|---|---|---|
| Edad (años) | 21,68±1,96 | 22,67±2,59 | 22,12±2,33 | 22,74±2,42 | 25,29±3,26 | 0,0001 |
| Peso (kg) | 57,45±10,04 | 63,33±11,72 | 73,79±12,11 | 70,79±10,75 | 79,38±13,64 | 0,0001 |
| Talla (m) | 1,65±0,10 | 1,59±0,31 | 1,68±0,08 | 1,65±0,12 | 1,63±0,11 | 0,434 |
| IMC (kg/m2) | 20,97±2,41 | 23,39±3,59 | 26,01±3,40 | 26,07±3,82 | 30,02±3,98 | 0,0001 |
| CC (cm) | 74,39±6,05 | 77,20±8,95 | 84,56±8,13 | 85,21±7,58 | 95,47±11,18 | 0,0001 |
| GC (%) | 18,65±8,85 | 23,16±7,63 | 28,17±9,05 | 28,31±7,88 | 33,48±8,11 | 0,0001 |
| PAS (mmHg) | 107,04±7,80 | 108,20±10,66 | 111,36±10,83 | 111,26±18,48 | 113,53±13,67 | 0,379 |
| PAD (mmHg) | 63,43±6,58 | 68,57±6,39 | 70,24±7,90 | 71,37±13,07 | 74,94±12,15 | 0,080 |
| Glucosa (mg/dl) | 70,38±12,0 | 72,40±14,39 | 74,65±8,76 | 79,42±18,27 | 85,14±16,71 | 0,008 |
| Triglicéridos (mg/dl) | 97,78±19,90 | 106,78±47,17 | 103,53±37,21 | 139,60±72,23 | 178,89±59,83 | 0,0001 |
| Colesterol (mg/dl) | 112,84±31,82 | 117,99±36,20 | 152,50±56,87 | 163,42±51,18 | 182,67±28,98 | 0,0001 |
| HDL-c (mg/dl) | 59,31±6,33 | 56,39±7,64 | 47,43±14,59 | 49,92±17,80 | 37,94±16,31 | 0,0001 |
| LDL-c (mg/dl) | 46,61±26,23 | 48,62±31,82 | 93,75±48,66 | 91,17±52,55 | 111,94±32,26 | 0,0001 |
| Índice aterogénico | 1,92±0,57 | 2,14±0,73 | 3,80±2,35 | 4,09±2,78 | 6,21±3,30 | 0,0001 |
Los datos se muestran en promedio±desviación estándar. Prueba ANOVA.
CC: circunferencia de cintura; FRCV: factores de riesgo cardiovascular; GC: grasa corporal; HDL-c: colesterol unido a lipoproteínas de alta densidad; IMC: índice de masa corporal; LDL-c: colesterol unido a lipoproteínas de baja densidad; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
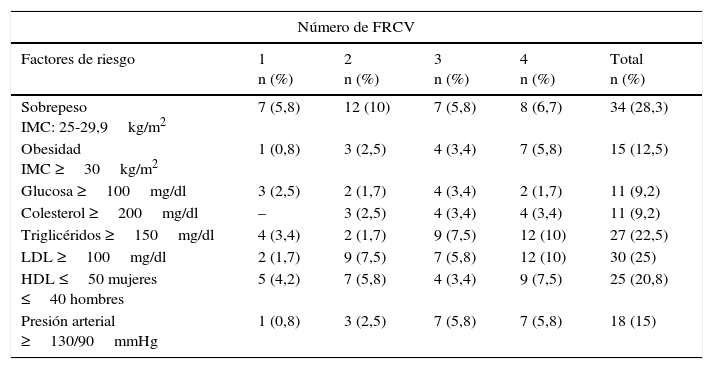
La frecuencia de los FRCV en los jóvenes en estudio se muestra en la tabla 2. El sobrepeso y la obesidad se encontraron en el 40,8%, seguido de las LDL ≥100mg/dl (25%), hipertrigliceridemia (22,5%) y bajas concentraciones de HDL (20,8%).
Frecuencia de los factores de riesgo cardiovascular en los jóvenes aparentemente sanos
| Número de FRCV | |||||
|---|---|---|---|---|---|
| Factores de riesgo | 1 n (%) | 2 n (%) | 3 n (%) | 4 n (%) | Total n (%) |
| Sobrepeso IMC: 25-29,9kg/m2 | 7 (5,8) | 12 (10) | 7 (5,8) | 8 (6,7) | 34 (28,3) |
| Obesidad IMC ≥30kg/m2 | 1 (0,8) | 3 (2,5) | 4 (3,4) | 7 (5,8) | 15 (12,5) |
| Glucosa ≥100mg/dl | 3 (2,5) | 2 (1,7) | 4 (3,4) | 2 (1,7) | 11 (9,2) |
| Colesterol ≥200mg/dl | – | 3 (2,5) | 4 (3,4) | 4 (3,4) | 11 (9,2) |
| Triglicéridos ≥150mg/dl | 4 (3,4) | 2 (1,7) | 9 (7,5) | 12 (10) | 27 (22,5) |
| LDL ≥100mg/dl | 2 (1,7) | 9 (7,5) | 7 (5,8) | 12 (10) | 30 (25) |
| HDL ≤50 mujeres ≤40 hombres | 5 (4,2) | 7 (5,8) | 4 (3,4) | 9 (7,5) | 25 (20,8) |
| Presión arterial ≥130/90mmHg | 1 (0,8) | 3 (2,5) | 7 (5,8) | 7 (5,8) | 18 (15) |
HDL-c: colesterol unido a lipoproteínas de alta densidad; IMC: índice de masa corporal; LDL-c: colesterol unido a lipoproteínas de baja densidad.
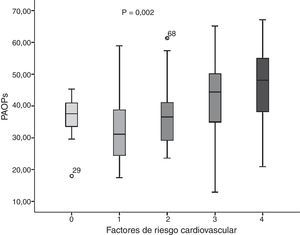
La concentración promedio de los PAOP en los jóvenes resultó de 37,89±11,19μmol/l. Al realizar la comparación por factores de riesgo (figura 1), se encontró que en el grupo sin FRCV el promedio fue de 36,90±5,94μmol/l; un FRCV: 32,84±10,62μmol/l; 2 FRCV: 36,55±10,14μmol/l; 3 FRCV: 42,11±14,70μmol/l, y 4 FRCV: 45,47±11,80μmol/l (F=4,651; p=0,002), sin embargo, se presentaron cifras más altas en el grupo de jóvenes con 3 y 4 FRCV.
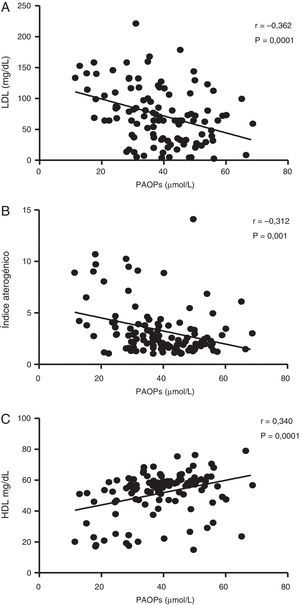
En la figura 2 se muestran las correlaciones entre las concentraciones plasmáticas de PAOP y LDL-c (r=–0,362; p=0,0001), IA (r=–0,312; p=0,001) y HDL (r=0,340; p=0,0001). No se encontró correlación significativa entre los PAOP y las concentraciones séricas de glucosa (r=–0,065; p=0,494), ácido úrico (r=0,035; p=0,714), triglicéridos (r=0,079; p=0,405), IMC (r=–0,015; p=0,878) y CC (r=0,014; p=0,884).
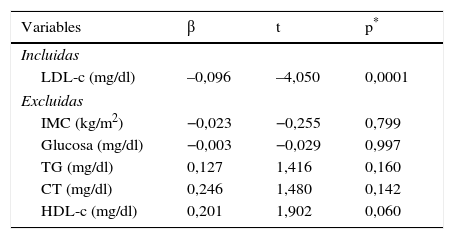
En la tabla 3 se muestra el modelo de regresión lineal de las variables que explican las concentraciones de PAOP. Dicho análisis se ajustó por edad y género; la variable que más explica la concentración de PAOP fue LDL-c (R2=0,131, F=16,405; p=0,0001). Las variables excluidas del modelo fueron: IMC, glucosa, colesterol total, triglicéridos y HDL-c.
Análisis de regresión de los factores de riesgo cardiovascular que predicen las concentraciones de PAOP
| Variables | β | t | p* |
|---|---|---|---|
| Incluidas | |||
| LDL-c (mg/dl) | –0,096 | –4,050 | 0,0001 |
| Excluidas | |||
| IMC (kg/m2) | −0,023 | −0,255 | 0,799 |
| Glucosa (mg/dl) | −0,003 | −0,029 | 0,997 |
| TG (mg/dl) | 0,127 | 1,416 | 0,160 |
| CT (mg/dl) | 0,246 | 1,480 | 0,142 |
| HDL-c (mg/dl) | 0,201 | 1,902 | 0,060 |
CT: colesterol total; HDL-c: colesterol unido a lipoproteínas de alta densidad; IMC: índice de masa corporal; LDL-c: colesterol unido a lipoproteínas de baja densidad; PAOP: productos avanzados de oxidación proteica; TG: triglicéridos.
En este estudio se reportan las concentraciones de PAOP en jóvenes aparentemente sanos, su incremento conforme aumenta el número de FRCV y se confirma la asociación entre las concentraciones plasmáticas de PAOP y las LDL-c como FRCV en los jóvenes aparentemente sanos.
En las últimas décadas han ido cambiando los estilos de vida en los jóvenes, con lo que se han incrementado los FRCV en esta población. En este estudio se reporta que en conjunto el sobrepeso y la obesidad fueron los factores de riesgo presentes con mayor frecuencia (40,8%) en los jóvenes aparentemente sanos, seguidos de las altas concentraciones de LDL-c (25%) que se asocian al desarrollo de aterosclerosis14-16 y que a futuro podrían llevar al desarrollo de ECV.
Los PAOP han sido descritos como marcadores ultrasensibles de estrés oxidativo además de ser una nueva clase de mediadores inflamatorios17, ya que activan neutrófilos, monocitos y linfocitos T18; es bien sabido que la sobreproducción de especies reactivas de oxígeno bajo condiciones patológicas compromete las funciones endoteliales, considerándose como un factor causal de disfunción vascular19,20, la cual es importante en la fisiopatología de varias ECV incluyendo la arteriosclerosis21,22 y algunas otras como la diabetes mellitus23. En este estudio se demuestra que a mayor número de FRCV presentes en los jóvenes aparentemente sanos, las concentraciones de PAOP se ven incrementadas, lo que podría considerarse como un factor adicional de riesgo para que a futuro los jóvenes desarrollen ECV. Hasta nuestro conocimiento este es el primer estudio donde se reportan las concentraciones de PAOP en jóvenes aparentemente sanos en relación con los FRCV.
A pesar de tener una alta frecuencia de sobrepeso y obesidad en este estudio, no se encontró correlación entre los PAOP y el IMC o la CC. Este resultado concuerda con el estudio realizado por Codoñer-Franch et al. en niños con obesidad24, donde no se encontró correlación entre los PAOP y las mediciones antropométricas (IMC, CC) y se explicó que esto fue debido al rango tan estrecho en los valores de la CC; sin embargo, en el presente estudio tuvimos un rango amplio tanto de IMC como de CC sin correlación aparente.
Por otra parte, la hiperlipidemia se asocia con el estrés oxidativo y la inflamación25, que son considerados FRCV26. Es bien sabido que el LDL-c elevado en los adultos jóvenes predice la aparición de ECV en fases posteriores de la vida27; en este estudio se reporta en los jóvenes una frecuencia del 25% de LDL-c alto, quizá favorecido por un plan de alimentación rico en grasas saturadas e hidratos de carbono sumado al sedentarismo. Una limitación en este estudio es que no se realizó un recordatorio de al menos 24h para estimar la ingesta de macronutrientes en la muestra de estudio.
Liu et al.28 han reportado que los PAOP son un importante componente de la compleja interacción entre inflamación y estrés oxidativo con el proceso aterogénico. La formación de PAOP es mediada por el ácido hipocloroso (HOCl) proveniente de la acción de la mieloperoxidasa, el mismo compuesto que favorece la oxidación de las LDL-c (LDL-ox)29, y es bien conocido que una vez oxidadas, son transportadas al espacio subendotelial de las paredes arteriales desencadenando así la formación de la placa aterosclerótica. Además, Liu et al. reportan la acumulación de PAOP en la placa de ateroma, lo que favorece el entorno oxidativo y sugiere su participación en la formación de mayores cantidades de LDL-ox. Sin embargo, una limitante de este estudio fue no haber cuantificado directamente la concentración de LDL-ox.
En nuestro estudio se muestra una asociación negativa entre el LDL-c y los PAOP, que puede atribuirse a que los PAOP se ven incrementados como consecuencia de alteraciones metabólicas tales como sobrepeso, obesidad, hipertrigliceridemia, o un conjunto de las anteriores. Además, es conocido que las LDL-c son las encargadas de transportar el colesterol a los tejidos, de tal forma que al presentarse una baja frecuencia de hipercolesterolemia en estos adultos jóvenes aparentemente sanos, no encontramos cifras elevadas de las mismas.
Pirinccioglu et al.30 realizaron un estudio en sujetos con hipercolesterolemia familiar y reportaron una correlación entre el LDL-c y altos niveles de proteínas carboniladas, además de un mayor grosor de la íntima media carotídea; sin embargo, los jóvenes incluidos en este estudio mencionaron desconocer si tenían el antecedente de hipercolesterolemia familiar, el cual se vería reflejado en un incremento del riesgo cardiovascular.
En conclusión, se identificó que las concentraciones de PAOP se ven incrementadas conforme aumentan los FRCV en los jóvenes, por lo que estos podrían considerarse un factor importante de riesgo debido a que su depósito en la placa de ateroma favorece el proceso aterogénico y así el desarrollo de ECV.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste estudio no recibió financiamiento directo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
AgradecimientosDamos las gracias al Centro de Investigación Biomédica de Michoacán del Instituto Mexicano del Seguro Social por las facilidades otorgadas para este estudio.