La quemerina fue descrita inicialmente como una proteína con una función compleja en el sistema inmune. Recientemente la quemerina ha sido identificada como una nueva adipoquina que regula el desarrollo y la función metabólica del adipocito al igual que el metabolismo glucídico en el hígado y en el músculo esquelético. Varias líneas de investigación señalan que los valores de quemerina en plasma están elevados en pacientes con obesidad y que además éstos se correlacionan con varios aspectos del síndrome metabólico. Así, este doble papel de la quemerina en la inflamación y en el metabolismo puede aportar un vínculo de unión entre la inflamación crónica y la obesidad, y también con otras patologías asociadas a la obesidad tales como la diabetes tipo 2 y la enfermedad cardiovascular.
Chemerin was initially described as a protein with a complex function in the immune system. This protein has recently been identified as a new adipokine that regulates the development and metabolic function of adipocytes as well as glucose metabolism in the liver and skeletal muscle. Several research lines indicate that chemerin levels in plasma are elevated in obese patients and, moreover, that these levels are correlated with various components of the metabolic syndrome. Thus, this double role of chemerin in inflammation and metabolism may provide a link between chronic inflammation and obesity, and well as with other obesity-associated diseases such as type 2 diabetes and cardiovascular disease.
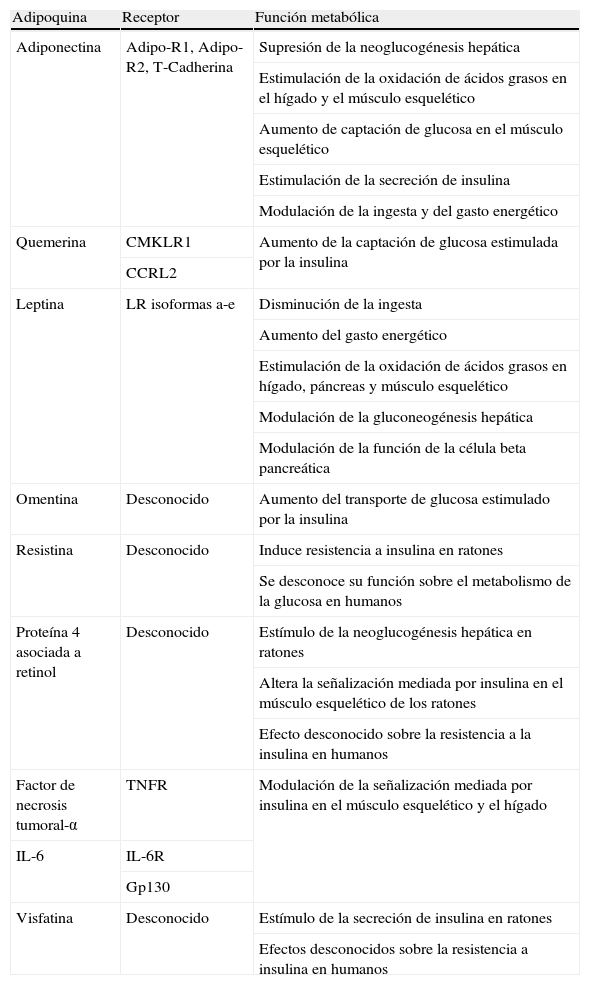
El tejido adiposo blanco, además de desempeñar un importante papel en el metabolismo, es un órgano endocrino activo que secreta una serie de péptidos señalizadores, las adipoquinas, con diversas funciones biológicas1–3. Estas adipoquinas juegan un papel primordial en la regulación del metabolismo lipídico y la homeostasis de la glucosa a través de acciones endocrinas/sistémicas en el cerebro, en el hígado y en el músculo4–11 (tabla 1). La secreción y la concentración sérica de varias adipoquinas dependen en gran parte del grado de adiposidad, hecho que ha conducido a la hipótesis de la disregulación de las adipoquinas proinflamatorias y antiinflamatorias en la obesidad como vínculo patogénico con la diabetes tipo 2 y la enfermedad cardiovascular12,13.
Acciones endocrinas/sistémicas de las adipoquinas
| Adipoquina | Receptor | Función metabólica |
| Adiponectina | Adipo-R1, Adipo-R2, T-Cadherina | Supresión de la neoglucogénesis hepática |
| Estimulación de la oxidación de ácidos grasos en el hígado y el músculo esquelético | ||
| Aumento de captación de glucosa en el músculo esquelético | ||
| Estimulación de la secreción de insulina | ||
| Modulación de la ingesta y del gasto energético | ||
| Quemerina | CMKLR1 | Aumento de la captación de glucosa estimulada por la insulina |
| CCRL2 | ||
| Leptina | LR isoformas a-e | Disminución de la ingesta |
| Aumento del gasto energético | ||
| Estimulación de la oxidación de ácidos grasos en hígado, páncreas y músculo esquelético | ||
| Modulación de la gluconeogénesis hepática | ||
| Modulación de la función de la célula beta pancreática | ||
| Omentina | Desconocido | Aumento del transporte de glucosa estimulado por la insulina |
| Resistina | Desconocido | Induce resistencia a insulina en ratones |
| Se desconoce su función sobre el metabolismo de la glucosa en humanos | ||
| Proteína 4 asociada a retinol | Desconocido | Estímulo de la neoglucogénesis hepática en ratones |
| Altera la señalización mediada por insulina en el músculo esquelético de los ratones | ||
| Efecto desconocido sobre la resistencia a la insulina en humanos | ||
| Factor de necrosis tumoral-α | TNFR | Modulación de la señalización mediada por insulina en el músculo esquelético y el hígado |
| IL-6 | IL-6R | |
| Gp130 | ||
| Visfatina | Desconocido | Estímulo de la secreción de insulina en ratones |
| Efectos desconocidos sobre la resistencia a insulina en humanos |
AdipoR1: receptor de adiponectina 1; AdipoR2: receptor de adiponectina 2; CMKLR1: chemoquine like receptor-1; IL-6R: receptor de la interleucina-6; IRS-1: sustrato del receptor de insulina-1; LR: receptor de la leptina; TNFR: receptor del factor de necrosis tumoral-α.
La quemerina es una proteína quimiotáctica de reciente descubrimiento que sirve de ligando al receptor acoplado a la proteína G CMKLR1 (ChemR23 o DEZ) y tiene un papel complejo, pero bien establecido, en la inmunidad tanto innata como adquirida14–20. Distintas líneas de investigación sugieren que la quemerina regula el desarrollo del adipocito y su función metabólica, así como el metabolismo glucídico en el hígado y el músculo esquelético21–23. Numerosas evidencias señalan que los valores séricos de quemerina están elevados en la obesidad y se asocian con varios componentes del síndrome metabólico21–24. Por tanto, el doble papel de la quemerina en la inflamación y el metabolismo puede aportar una conexión entre la inflamación crónica y la obesidad, así como con enfermedades asociadas, como la diabetes tipo 2 y la enfermedad cardiovascular.
Descubrimiento y unión a receptoresEl gen de la quemerina, también llamado tazarotene-induced gene 2 (TIG2) o respondedor al receptor del ácido retinoico 2 (RARRES2), fue inicialmente reconocido como un nuevo gen respondedor al retinol en lesiones dérmicas de la psoriasis14. La primera demostración de la función biológica de la quemerina fue su identificación como ligando del receptor huérfano acoplado a la proteína G, CMKLR117. La unión de la quemerina a CMKLR1 provoca por un lado un aumento en la concentración de calcio intracelular que activa al factor nuclear kappa B y las vías MAPK en monocitos, macrófagos y células dendríticas inmaduras, y por otro induce la migración celular25.
Varias estirpes celulares involucradas en la inmunidad innata y adquirida expresan CMKLR1, donde la quemerina actúa como un quimiotáctico que promueve el reclutamiento de estas células en los órganos linfoides y sitios de lesión tisular17–20. Así, por ejemplo, y acorde con sus propiedades proinflamatorias, la quemerina activa se encuentra en importantes concentraciones en el líquido ascítico de las pacientes con neoplasia de ovario y en el líquido sinovial de los pacientes con artritis reumatoide17.
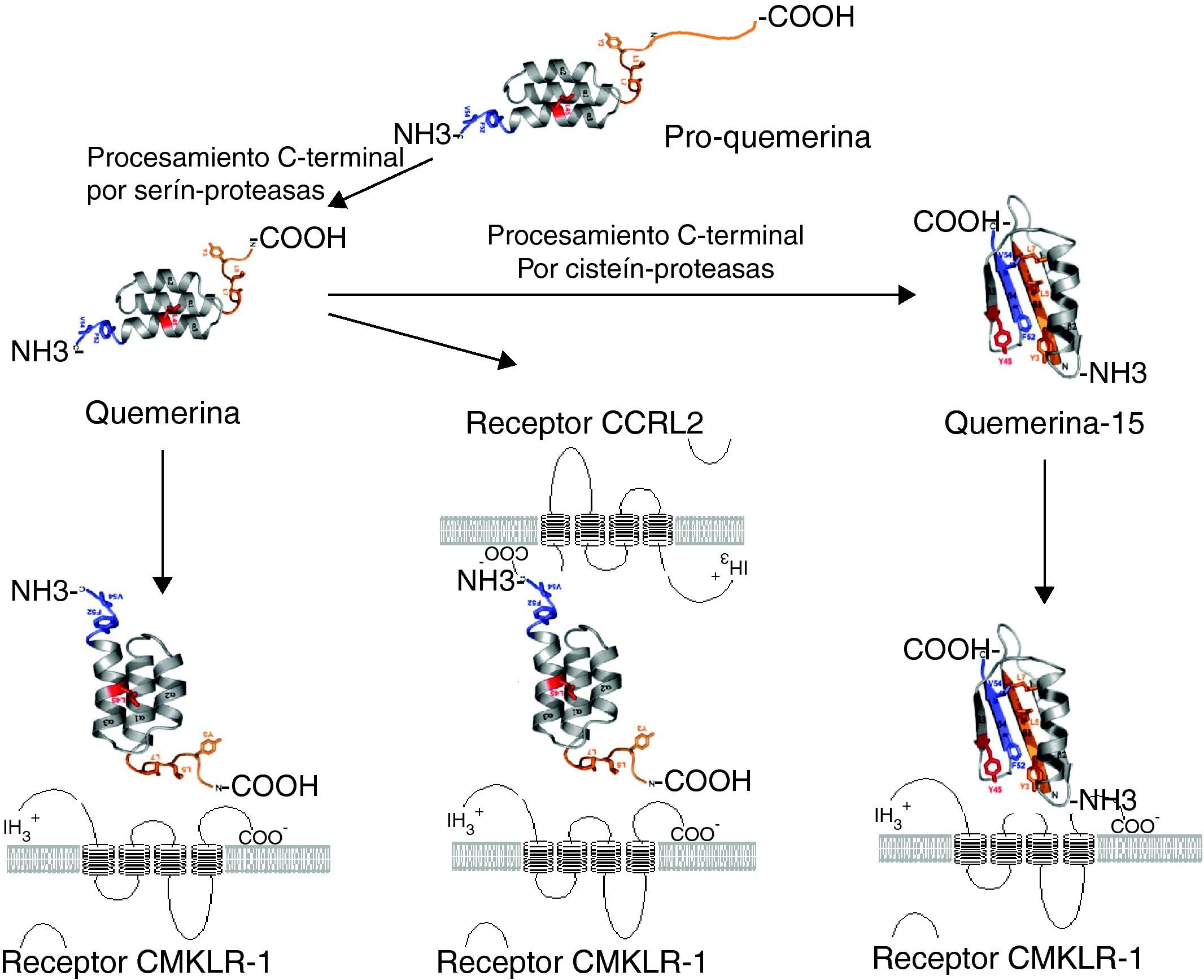
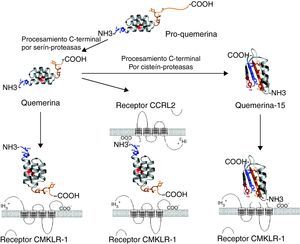
Estudios ulteriores han indicado que la quemerina también sirve de ligando para al menos dos receptores adicionales, como el chemokine receptor like (CCRL2) y la G-protein-coupled receptor 1 (GPR-1)26,27. El CCRL2 podría estar implicado en una amplificación de la respuesta inflamatoria, concentrando la quemerina y facilitando su presentación a CMKLR1 en las células adyacentes26. La quemerina se uniría por su extremo N-terminal, lo que hace que su extremo C-terminal, parte fundamental en la señalización celular, quede expuesto a las células vecinas para su unión a CMKLR1 (fig. 1).
Procesamiento proteolítico de la pro-quemerina y la quemerina. La quemerina activa se genera a partir de la pro-quemerina mediante procesamiento proteolítico de su extremo c-terminal por serín-proteasas. 1. La quemerina activa se une al receptor celular CMKLR1 activando la migración celular y el aumento de calcio intracelular. 2. La quemerina activa también se une a CCRL2 mediante su extremo n-terminal y expone su extremo c-terminal al receptor CMKLR1 expresado en las células vecinas. 3. El procesamiento proteolítico de la quemerina por cisteína-proteasas genera el péptido inhibitorio quemerina 15, que se une al receptor CMKLR1 e inhibe la generación de mediadores proinflamatorios en respuesta a IFN-γ.
La quemerina se secreta como una pro-proteína inactiva de 18kDa, que a través de la acción de serín-proteasas a nivel extracelular en la porción C-terminal de la proteína genera la forma activa de la quemerina de 16 kDa, presente en plasma, suero y hemofiltrado16–19. La concentración estimada de quemerina activa en plasma y suero es de 3 y 4,4nM en humanos18. Diferentes enzimas pueden realizar la proteólisis del extremo c-terminal de la quemerina para generar la forma activa. En función del tipo de proteasa que procesa la pro-quemerina o la quemerina, se generan péptidos que pueden tener una actividad biológica distinta19,28. Parece, pues, que la actividad biológica de la quemerina depende principalmente de estos fragmentos peptídicos del extremo C-terminal, y queda por dilucidar la posible función del extremo N-terminal de la proteína, que puede estar relacionado con la formación de complejos multiméricos de quemerina o en la interacción con GPR1 y CCRL2 (fig. 1)26. Además, la fragmentación proteolítica está implicada en la inactivación de la quemerina, proceso regulador clave que puede determinar las concentraciones tanto locales como sistémicas de la quemerina activa.
Funciones de la quemerina (fig. 2)Sistema inmuneLa primera función descrita de la quemerina, mediada a través de CMKLR1, es la de promover la quimiotaxis de células dendríticas inmaduras y de macrófagos. Se conoce que el CMKLR1 se expresa en varias células inmunes, tales como células dendríticas plasmocitoides inmaduras, células dendríticas mieloides, macrófagos y natural killer16–19. Además, los valores séricos de quemerinas se correlacionan con las concentraciones de las citoquinas proinflamatorias TNF-alfa, IL-6 y proteína C reactiva. A nivel histopatológico, la quemerina se expresa en las lesiones dérmicas de la psoriasis, y varias células inmunes implicadas en el desarrollo de la lesión psoriásica expresan receptores CMKLR111. Se especula que la expresión de la quemerina es un marcador de la fase temprana de lesiones en desarrollo, y que promueve el reclutamiento y la activación de las células dendríticas plasmocitoides. Estos hallazgos sugieren que la quemerina y el CMKLR1 están implicados en el reclutamiento de células inmunes en el lugar de la lesión, y que pueden afectar las vías de comunicación entre distintos tipos celulares responsables de la regulación del inicio y el progreso de la inflamación psoriásica20,29.
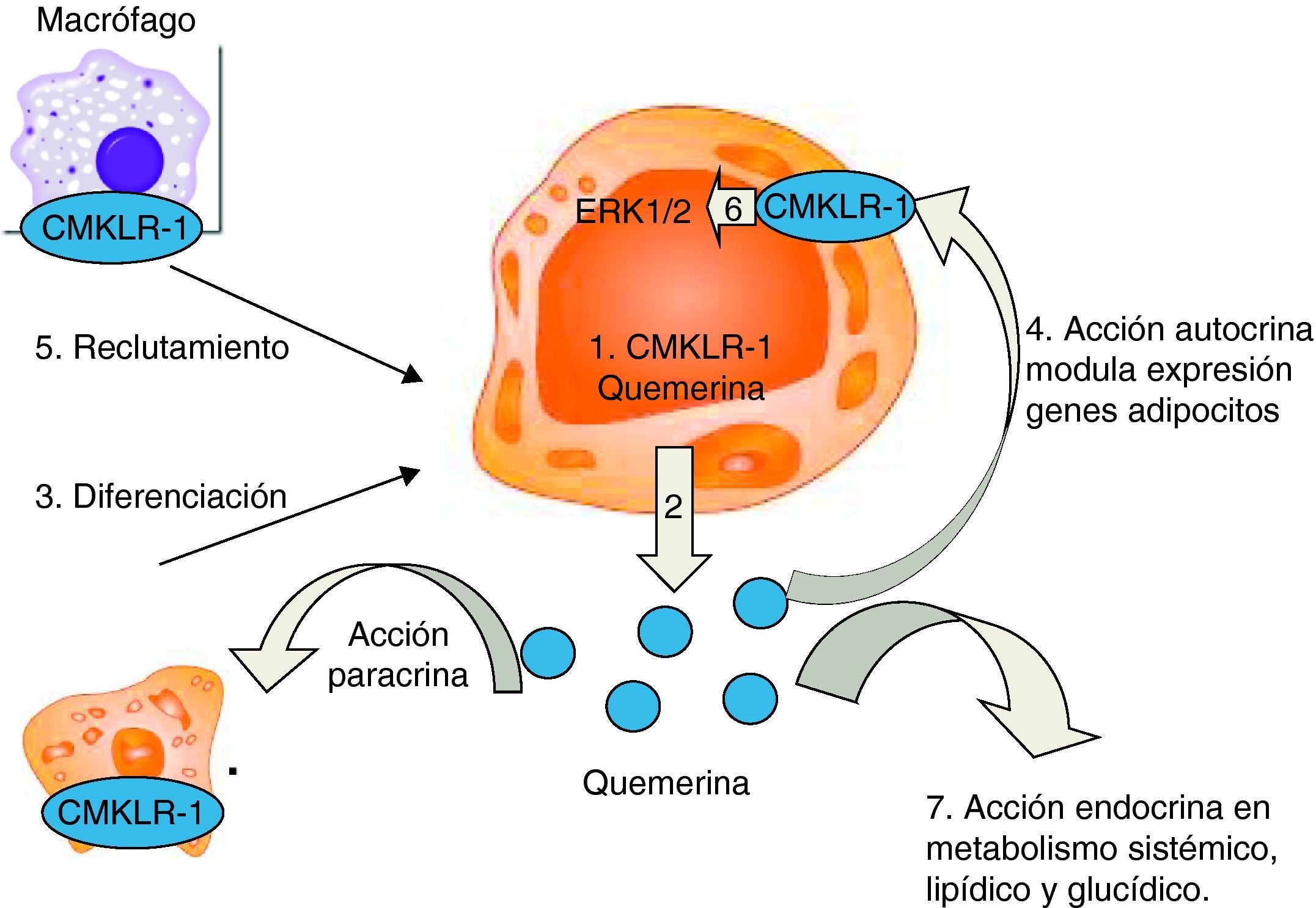
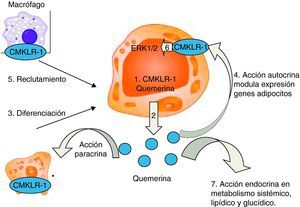
Papel de la quemerina y su receptor CMKLR1 en la biología del tejido adiposo. La quemerina y su receptor CMKLR1 se expresan intensamente en el adipocito (paso 1). La quemerina se secreta tanto en su forma activa o se activa rápidamente mediante procesamiento proteolítico extracelular (paso 2). La quemerina y el CMKLR1 son necesarios para la diferenciación del pre-adipocito (paso 3) y ambos genes tienen efectos reguladores en la expresión de genes implicados en el metabolismo lipídico y glucídico (paso 4). La quemerina secretada también media el reclutamiento de células que expresan CMKLR1 (p. ej., macrófagos) hacia el tejido adiposo. La quemerina también tiene una acción autocrina/paracrina y activa la señalización intracelular ERK1/2 (paso 6). Los resultados de varios estudios apuntan a la posibilidad de que la quemerina pueda tener también efectos en el metabolismo sistémico y la homeostasis lipídica (paso 7).
A pesar de que la quemerina fue descrita inicialmente como un agente proinflamatorio, Cash et al28 afirman que la fragmentación proteolítica de la quemerina mediada por cisteín-proteasas genera un péptido con una potente actividad antiinflamatoria, la quemerina 15, que también utiliza el receptor CMKLR1 y suprime la inflamación a concentraciones picomolares. Así pues, dependiendo de la clase de proteasa que procesa la pro-quemerina o la quemerina, los péptidos resultantes que se unen a CMKLR1 podrían tener un efecto proinflamatorio o antiinflamatorio y competir por la unión al receptor. De esta manera, mientras que las serín-proteasas liberadas por los neutrófilos generan péptidos proinflamatorios30, los macrófagos activados liberan cisteín-proteasas que generan péptidos antiinflamatorios28. Dado que los neutrófilos son las primeras células del sistema inmune en alcanzar el área de inflamación, es posible que la producción de péptidos proinflamatorios preceda a la generación de péptidos con actividad antiinflamatoria, facilitando así el control de la intensidad de la respuesta inflamatoria.
Tejido adiposoEn 2007 se descubrió por primera vez que el tejido adiposo blanco expresa altos niveles de quemerina y de su receptor CMKLR1 en ratones y en adipocitos humanos, identificando la quemerina como una nueva adipoquina con potenciales funciones autocrinas y paracrinas21,22. Además de este alto nivel de expresión, el tejido adiposo blanco probablemente también posee capacidad para bioactivar la quemerina. En este sentido, una potente área de investigación está centrada en la identificación de las diferentes formas de quemerina que origina el tejido adiposo y las alteraciones que comporta la obesidad.
La expresión y la secreción de quemerina aumentan de forma importante en la adipogénesis22. La pérdida de la expresión de la quemerina o de CMKLR1 en pre-adipocitos afecta gravemente al proceso de diferenciación a adipocitos maduros y modifica la expresión de genes cardinales en el metabolismo de la glucosa y los lípidos, como GLUT4, DGAT2, leptina y adiponectina21,22. Así pues, la quemerina parece desempeñar una función fundamental en la adipogénesis y en la homeostasis metabólica de los adipocitos. Dado que el incremento en el número de adipocitos es primordial para el aumento de la masa adiposa, estos resultados indican que la quemerina y el CMKLR1 pueden jugar un papel crucial en la formación del tejido adiposo, que ocurre tanto durante el desarrollo normal como en estados patológicos como la obesidad.
Aparte de esta función autocrina en adipocitos, la señalización quemerina/CMKLR1 puede tener también funciones paracrinas dentro del tejido adiposo. La quemerina funciona como un quimiotáctico para varios tipos de células inmunes y puede así contribuir a la inflamación del tejido adiposo en la obesidad17–20. Además, el tejido adiposo está ampliamente vascularizado y la inhibición de la angiogénesis ha demostrado evitar el crecimiento del tejido adiposo y el desarrollo de obesidad, de diabetes y de enfermedad cardiovascular31–33. El CMKLR1 se expresa en células endoteliales humanas y se regula al alza por citoquinas proinflamatorias como TNF-alfa, IL-6 y IL1-beta25. Varios estudios han demostrado que la quemerina activa vías angiogénicas elementales e induce la angiogénesis in vitro25–34. Así pues, las elevadas expresión y secreción de quemerina durante la adipogénesis podrían facilitar el crecimiento del tejido adiposo al inducir la angiogénesis y amplificar la vascularización del tejido adiposo.
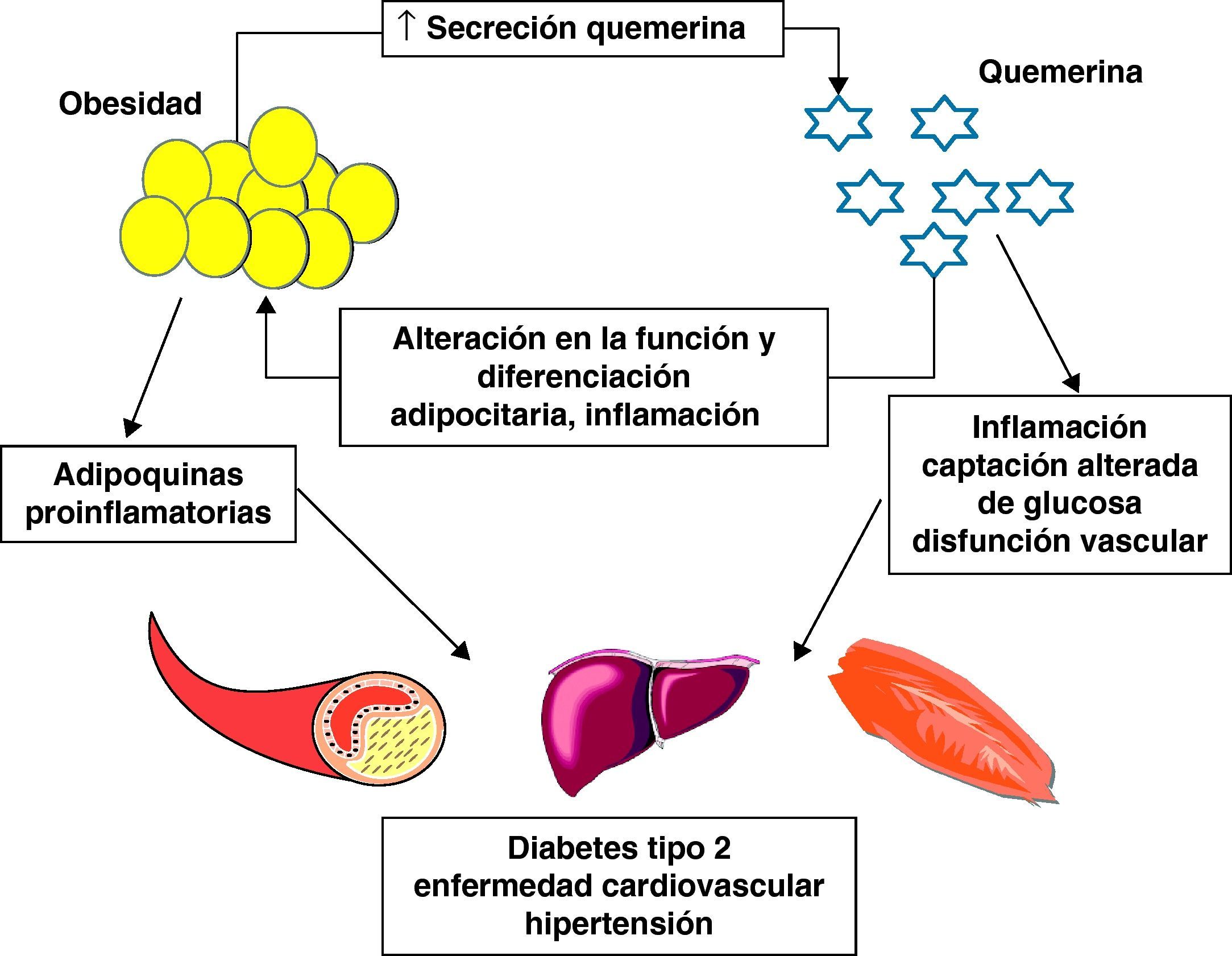
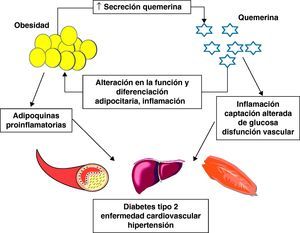
Asociación entre quemerina, obesidad y síndrome metabólico (fig. 3)En los últimos años ha quedado patente que la obesidad se asocia con una inflamación crónica del tejido adiposo. Los niveles plasmáticos de los marcadores de inflamación TNF-alfa, IL-6 y PCR están elevados en pacientes obesos y el tejido adiposo parece ser una fuente importante de estas citoquinas35,36. Más aún, la obesidad se relaciona con un aumento significativo de la infiltración por macrófagos del tejido adiposo blanco37–39, que secretan otras citoquinas proinflamatorias como TNF-alfa e IL-6. Estas citoquinas pueden actuar de forma paracrina alterando la sensibilidad a la insulina de los adipocitos o de forma endocrina alterando a la sensibilidad a la insulina en los tejidos periféricos, como el músculo esquelético o el hígado21.
Obesidad, inflamación y quemerina. La secreción de quemerina por el tejido adiposo blanco está aumentada en la obesidad. La quemerina procedente del tejido adiposo blanco promueve la diferenciación de los adipocitos, altera la función adipocitaria y puede desempeñar un papel en la angiogénesis. La quemerina es también un adipoquina proinflamatoria que incrementa la secreción de otras adipoquinas proinflamatorias y prodiabéticas, con el consiguiente deterioro de la función metabólica del tejido adiposo y efectos sistémicos negativos, como la alteración de la sensibilidad a la insulina con la consiguiente repercusión sobre el metabolismo glucídico y lipídico, así como una disfunción vascular en otros tejidos. Este doble papel de la quemerina en la inflamación y el metabolismo sugiere que está involucrada en la respuesta inflamatoria y el metabolismo de la obesidad. Los cambios resultantes en la homeostasis metabólica y la función vascular podrían sentar las bases para el desarrollo de la diabetes tipo 2, las enfermedades cardiovasculares y la hipertensión.
Los datos obtenidos en humanos respaldan la asociación entre quemerina, obesidad y síndrome metabólico. En un estudio realizado por Bozaoglu et al21,25,40 en sujetos con tolerancia normal a la glucosa, los niveles circulantes de quemerina se asociaron con componentes del síndrome metabólico como la trigliceridemia, la presión arterial, la resistencia a la insulina y la grasa corporal, resultados corroborados por otros estudios. Incluso se ha señalado una concentración de quemerina plasmática de 240μg/l como punto de corte para identificar el síndrome metabólico con una sensibilidad del 75% y una especificidad del 67%41. Asimismo, se han referido niveles de quemerina todavía más elevados en pacientes con DM2 y obesidad, así como una relación positiva entre los niveles de quemerina y leptina, resistina, proteína C reactiva, TNF-alfa e IL-624,42.
Sell et al43 demostraron que la quemerina en pacientes con obesidad mórbida, además de correlacionarse con la resistencia a la insulina, se asociaba con la esteatosis y con parámetros de inflamación hepática. La pérdida ponderal y de tejido graso conseguida tras someter estos pacientes a cirugía bariátrica se acompañó de un descenso de los valores de quemerina más prolongado que el de otras adipoquinas, incluida la leptina.
Por otra parte, la variabilidad en las concentraciones plasmáticas de quemerina viene determinada en un 25% por factores genéticos o hereditarios25. Además, se ha descrito que el polimorfismo nucleótido simple que muestra una potente asociación con los niveles plasmáticos de quemerina está localizado en el gen EDIL3, que tiene un reconocido papel en la angiogénesis. Más aún, estudios in vitro han comprobado que el tratamiento con quemerina recombinante induce la formación de estructuras similares a capilares mediante la estimulación de la longitud de los túbulos, aumentando el número de ramificaciones y el número total de microtúbulos25. Así pues, dado que la quemerina está aumentada en estados de obesidad, plantean la hipótesis de que la función de la quemerina puede ser la de promover la formación de vasos sanguíneos entre la masa de tejido adiposo en expansión que se da en la obesidad.
A pesar de la asociación entre los niveles plasmáticos de quemerina y la obesidad, el hecho que la quemerina también se exprese en otros tejidos, principalmente el hígado, hace que sea necesario establecer cuál es la fuente principal de los niveles elevados de quemerina. Un análisis reciente de valores de quemerina plasmáticos en la circulación portal, hepática y sistémica en humanos mostró concentraciones similares en la vena portal y sistémica, sugiriendo que el tejido adiposo visceral no contribuye de forma especial a los niveles de quemerina. Sin embargo, los valores de quemerina son más elevados en muestras de la vena hepática, lo que indica que la quemerina se sintetiza y se secreta en el hígado41. Dado que son varios los estudios que han establecido una correlación positiva entre los valores plasmáticos de quemerina y la obesidad21,22,41–43, a pesar de que no hay evidencias inequívocas, se puede apuntar que la quemerina se secreta tanto en el hígado como en el tejido adiposo, pero que este último es una fuente de quemerina dinámica y modificable en la obesidad.
Asociación entre quemerina y resistencia a la insulinaLa obesidad abdominal es un reconocido factor de riesgo para la resistencia a la insulina y la diabetes tipo 2, y por tanto las alteraciones en la secreción de adipoquinas que acontecen en la obesidad juegan un papel importante en el desarrollo de estas alteraciones metabólicas. Aunque está probado que los valores de quemerina están elevados en la obesidad, los mecanismos que regulan la expresión de la quemerina continúan sin estar aclarados.
Los miocitos no expresan quemerina, pero sí su receptor CMKLR144. En estudios in vitro, la administración de quemerina a células del músculo esquelético provoca una disminución en la captación de glucosa dependiente de la insulina44. Además, en estudios in vitro e in vivo la insulina aumenta la secreción de quemerina en el tejido adiposo de forma dependiente del tiempo y de la dosis45. Las IL-1beta y TNF-alfa, citoquinas proinflamatorias asociadas a la resistencia a la insulina, inducen la expresión del ARNm de quemerina y su secreción de forma dependiente de la dosis en adipocitos derivados de 3T3-L146. Estos hallazgos están sustentados por el hecho de que la hiperinsulinemia y los valores elevados de citoquinas proinflamatorias se asocian frecuentemente a la obesidad.
Otros estudios han examinado la relación entre la activación de los PPAR-gamma (peroxisome proliferator-activated receptor) por las tiazolidinedionas y la expresión de quemerinas. Sin embargo, aunque algunos sugieren que la activación del PPAR-gamma se asocia a una expresión aumentada de quemerinas23, otros señalan que la activación del PPAR-gamma en adipocitos maduros reduce su expresión47,48.
En mujeres con síndrome del ovario poliquístico, que frecuentemente se acompaña de resistencia a insulina, se ha objetivado un aumento en la expresión de quemerina y de los valores de la proteína en plasma y tejido adiposo subcutáneo45. Además, en este estudio se confirmó el potente efecto positivo de la insulina sobre los valores de quemerina y se demostró que el tratamiento con metformina disminuye de forma significativa las concentraciones de quemerina45.
Estos hallazgos apuntan a que el músculo esquelético es una diana tisular para la quemerina y que ésta puede estar implicada en una comunicación negativa entre el tejido adiposo y el músculo esquelético. Sin embargo, el posible papel de la quemerina como puente entre la obesidad y la diabetes requiere ser establecido en estudios futuros, ya que otros tipos celulares secretan esta citoquina y pueden contribuir a este efecto sobre las células del músculo esquelético.
En definitiva, los datos clínicos muestran que los valores de quemerina plasmática se correlacionan con la grasa corporal, con el metabolismo glucídico y lipídico, y con la inflamación, sugiriendo que esta adipoquina juega un papel destacado en la fisiopatología de la obesidad y del síndrome metabólico. A pesar de que los estudios desarrollados aportan mucha información, no han conseguido determinar la función exacta de la quemerina en la obesidad y el síndrome metabólico, o determinar si el exceso de quemerina aumenta la adiposidad e interrumpe la función metabólica, o si los niveles elevados de quemerina son una consecuencia o una respuesta compensadora durante y tras el desarrollo de obesidad y sus comorbilidades. Así pues, la quemerina ha dado respuesta a un número no despreciable de cuestiones, pero ha abierto nuevos interrogantes generadores de más hipótesis.
ConclusionesLa evidencia experimental sustenta la función de la quemerina en aspectos de la fisiología/fisiopatología humana que incluyen la obesidad, la inflamación y la resistencia a la insulina. Los datos en humanos indican que la quemerina está incrementada en la obesidad, y que la principal fuente es el tejido adiposo. Sin embargo, el papel concreto de la quemerina en estos trastornos sigue sin estar aclarado. En este sentido, faltan estudios que evalúen el efecto de la quemerina sobre la infiltración por macrófagos y linfocitos en el tejido adiposo. Dado que existen varias formas de quemerina con distinta actividad biológica, es necesario realizar estudios que valoren la capacidad del tejido adiposo para generar estas diferentes formas bioactivas de quemerina. También es necesario aclarar si los valores elevados de quemerina son simplemente un reflejo o contribuyen al aumento del tejido graso y de las consecuencias indeseables de la obesidad.