La apolipoproteína A-I Zaragoza (apo A-I Z, mutación L144R) es una variante de la apolipoproteína A-I cuyos portadores tienen muy baja concentración de colesterol-HDL (c-HDL) pero, aunque presenten factores de riesgo aterogénicos adicionales, paradójicamente no muestran signos de aterosclerosis a nivel subclínico. Estudios metabólicos in vivo realizados en los portadores heterocigotos de esta variante de apo A-I revelaron que tiene una tasa de catabolismo que duplica la de la proteína nativa sugiriendo la posibilidad de que tuviera un efecto favorable sobre el proceso global de transporte reverso de colesterol.
ObjetivoEstablecer un sistema de expresión y purificación de apo A-I nativa y apo A-I Z recombinantes de alto rendimiento y elevada pureza con el fin de comparar sus propiedades en distintos aspectos relativos al transporte reverso de colesterol, así como otras características antiaterogénicas de la apo A-I.
MetodologíaPartiendo del cDNA de apo A-I nativa se amplificó mediante PCR de la secuencia de la apo A-I madura y se diseñaron los oligonucleótidos cebadores que permitieron el clonaje en un plásmido de expresión inducible pET-45 que incorpora una cola de Histidinas en la posición N-terminal del péptido expresado. Mediante mutagénesis dirigida se introdujo la mutación L144R en la secuencia madura de apo A-I para expresarla con el mismo sistema. Bacterias E. coli de la cepa BL21(DE3) fueron transformadas con los plásmidos preparados, la expresión de las correspondientes proteínas fue inducida y su purificación realizada en condiciones no desnaturalizantes mediante cromatografía de afinidad en columnas de níquel.
ResultadosLa expresión y la purificación de las dos proteínas se realizó con éxito y fue comprobada mediante SDS-PAGE y técnicas inmunoquímicas. Se obtuvieron rendimientos medios superiores a 30mg de proteína purificada por litro de cultivo con un grado de pureza del 94% para la proteína nativa y 93% para la mutante.
ConclusionesSe ha conseguido un sistema de expresión y purificación para apo A-I nativa y apo A-I Z de alto rendimiento y pureza adecuados que constituye la base para su posterior caracterización estructural y funcional de las propiedades antiaterogénicas de esta variante de la apo A-I.
Apolipoprotein A-I Zaragoza (apo A-I Z, L144R mutation) is an apolipoprotein A-I variant whose carriers have low HDL-cholesterol (HDL-c) concentrations but, paradoxically, no atherosclerotic symptoms despite the presence of additional atherogenic risks. In vivo metabolic studies performed on heterozygous carriers of this apo A-I variant revealed a two-fold increased fractional catabolic rate compared to the wild type protein, suggesting an enhanced effect on the overall reverse cholesterol transport process.
ObjectivesTo establish an expression and purification system of recombinant wild type apo A-I and apo A-I Z with high yield and purity in order to compare their properties related to reverse cholesterol transport as well as other anti-atherogenic characteristics.
MethodsA cDNA clone of wild type apo A-I was used as a PCR template to amplify the mature peptide sequence. Specially designed primers allowed the cloning of the sequence into an inducible expression pET-45 plasmid adding a Histidine tag in the N-terminal expressed peptide. Site directed mutagenesis was used to produce the L144R mutation in the apo A-I sequence to be expressed in the same system. E. coli BL21(DE3) were transformed with the prepared plasmids, peptide expression was induced and purification was performed in non-denaturing conditions by nickel affinity chromatography.
ResultsExpression and purification of both proteins was achieved and verified by SDS-PAGE and immunochemical procedures. Actual yields were over 30mg of purified protein per litre of culture and a 94% purity grade for the wild type protein and 93% for the mutant protein were obtained.
ConclusionsA system for the expression and purification of wild type apo A-I and apo A-I Z with high yield and purity grade has been set up. This will be the basis for future structural and functional characterization of the L144R apo A-I mutant allowing the study of its anti-atherogenic properties.
La relación inversa existente entre la concentración plasmática de colesterol HDL (c-HDL) y el desarrollo de enfermedad cardiovascular ha quedado demostrada desde perspectivas epidemiológicas y fisiológicas1–4. El papel ateroprotector que tienen las partículas HDL se atribuye principalmente al rol que desempeñan en el proceso de transporte reverso de colesterol, que permite la extracción del exceso de colesterol en tejidos periféricos y su vehiculización hacia rutas dirigidas a su catabolismo hepático5,6. La apolipoproteína A-I (apo A-I) es el principal componente proteico de las partículas HDL donde, aparte de su función estructural, actúa como cofactor de la enzima lecitin:colesterol acetiltransferasa (LCAT)7,8 y como ligando de los receptores scavenger clase B tipo I o el transportador ABCA19,10.
La apolipoproteína A-I está formada por 243 amino ácidos (aa) y tiene un peso molecular de 28kDa. En su estructura secundaria hay ocho repeticiones de hélices alfa de carácter anfipático con 11 y 22 aa de longitud separadas por segmentos ricos en Prolina7,11. Esta estructura es fundamental para la formación y estabilización de la partícula de HDL.
La mayoría de mutaciones en apo A-I descritas producen una pérdida de función y están asociadas a concentraciones plasmáticas bajas de c-HDL (hipoalfalipoproteinemia) afectando negativamente el transporte reverso de colesterol, lo cual constituye un elevado riesgo para el desarrollo precoz de aterosclerosis12–16.
Sin embargo existen casos paradójicos que, pese a estar asociados a concentraciones bajas de c-HDL, dan lugar a una ganancia de función y a un efecto cardioprotector. Uno de los casos mejor estudiados es el de la apo A-I Milano17. Esta variante (R173C) fue descrita por primera vez en 1980 en una familia del norte de Italia cuyos portadores presentaban un marcado déficit en los niveles plasmáticos de c-HDL pero una ausencia total de enfermedad vascular aterosclerótica. Estudios posteriores revelaron que esta mutación favorecía la unión de lípidos y que el catabolismo de las partículas HDL en estos individuos estaba acelerado, lo que explicaría su menor concentración en plasma pero una mayor eficacia en su función y la consiguiente disminución del riesgo de aterosclerosis.
Estudios en animales demostraron que la administración de apo A-I Milano recombinante disminuía las lesiones ateroscleróticas y en general producía un beneficioso efecto antiaterogénico18,19. Posteriormente también se llevaron a cabo estudios en humanos con resultados que indican que la apo A-I Milano es capaz de revertir la placa de ateroma20,21. Estos trabajos constituyen la base para la utilización de la variante apo A-I Milano como tratamiento farmacológico en situaciones de enfermedad cardiovascular que está siendo desarrollado por distintas compañías.
En el año 2000 nuestro grupo descubrió otra mutación puntual en el gen de la apo A-I que fue denominada apo A-I Zaragoza. La mutación está situada en el exón 4 del gen y da lugar al cambio de amino ácido Leucina por Arginina en posición 144 (L144R). Los portadores heterocigotos de esta mutación mostraban muy baja concentración de c-HDL, pero, de manera similar a lo que ocurre con la apo A-I Milano, no presentan evidencias de aterosclerosis subclínica. Estudios metabólicos en individuos portadores presentaron una velocidad de secreción ligeramente elevada y una velocidad de catabolismo que duplica la de la apo A-I normal22, este hecho sugiere que el proceso de transporte reverso de colesterol puede verse favorecido por la variante apo A-I Z.
Los mecanismos por los que la apo A-I Z pudiera mejorar el proceso de transporte reverso de colesterol o ejercer otros efectos antiaterogénicos no han sido determinados, pero la profundización en su estudio y esclarecimiento puede aportar información que posibilite la utilización terapéutica de la apo A-I Z de una manera análoga a lo que ha ocurrido con la apo A-I Milano.
En este artículo describimos el desarrollo de un sistema eficaz para la producción tanto de apo A-I nativa como de apo A-I Z recombinantes y su purificación por métodos de afinidad. Éste es el primer paso para obtener una fuente de material de calidad que permita la caracterización de sus potenciales propiedades antiaterogénicas.
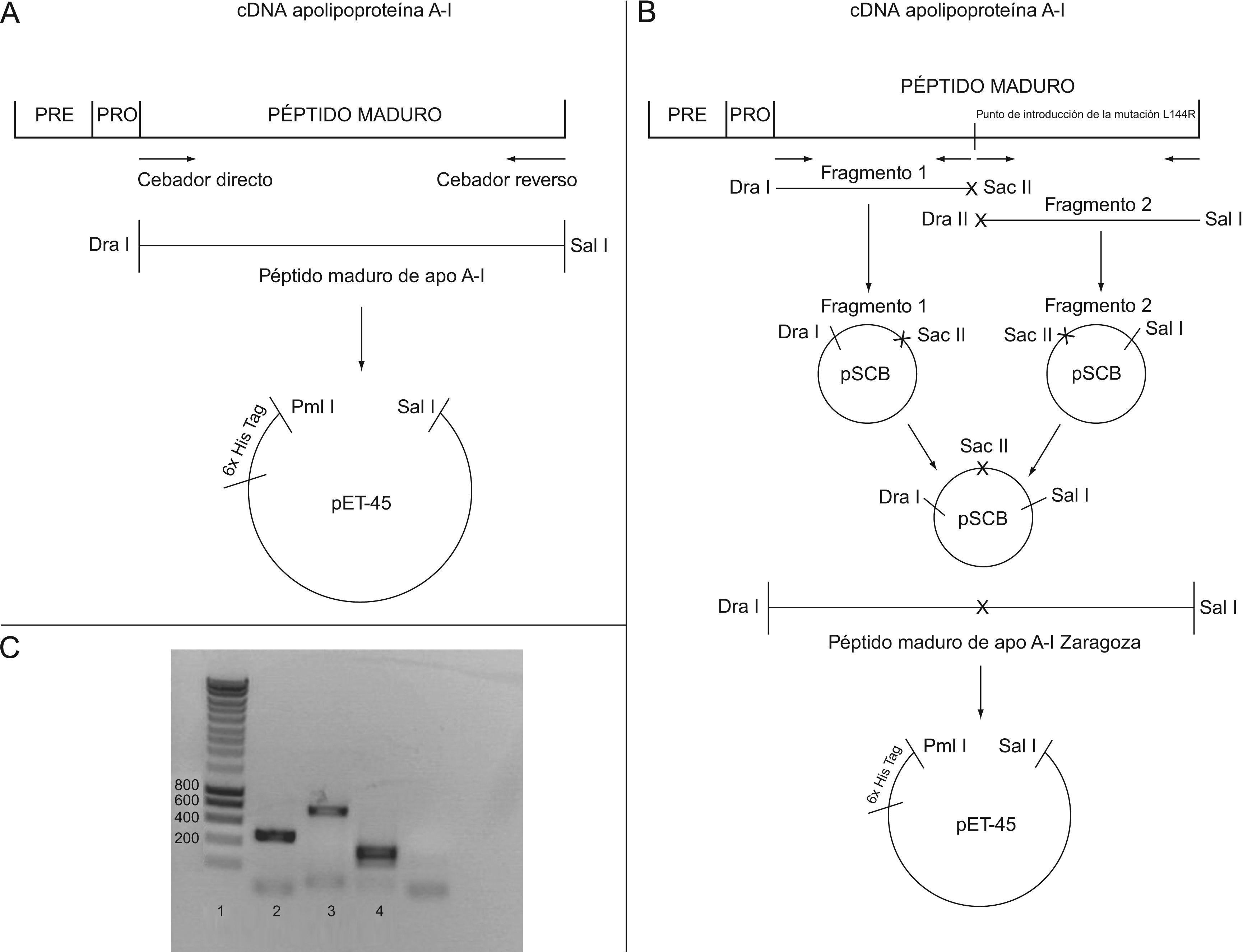
Materiales y métodosConstrucción del plásmido de expresión de apo A-I nativaSe utilizó un cDNA de apolipoproteína A-I humana clonado en un plásmido pUC18 (cedido por la Dra. Delia Recalde, Instituto Pasteur, París) como molde para realizar una amplificación por PCR de alta fidelidad utilizando los oligonucleótidos cebadores 5′-CGGCATTTCTGGTTTAAAGATGAACCGCCGCAGAGCCCGTGG-3′ (primer A) y 5′-GAGAGGCGTCGACCAACTTACTGGGTGTTGAGCTTCTTAGTG-3′ (primer D). Se utilizó la enzima DNA polimerasa Pwo SuperYield (Roche, Basel [Suiza]) y un programa de termociclación tipo «touchdown» consistente en [95°C 2min, seguido de 10ciclos de 94°C 15seg 67°C 30seg 72°C 1min con disminución de 1°C la temperatura de annealing por ciclo, y finalmente 30ciclos de 94°C 15seg 62°C 30seg 72°C 1min seguido de 6min a 72°C] en un equipo GeneAmp PCR System 9700 (Applied Biosystems, Foster City, CA [Estados Unidos]). Los oligonucleótidos cebadores utilizados fueron diseñados para obtener la amplificación de la secuencia de DNA codificante para el péptido de apo A-I maduro flanqueada por los sitios de restricción DraI y SalI que permitieron su introducción en un plásmido pET-45 (Novagen, Darmstadt [Alemania]) mediante técnicas básicas de biología molecular (fig. 1A y C). La secuencia introducida en el vector de expresión fue comprobada mediante secuenciación de DNA utilizando la técnica de terminadores dideoxi en un sistema MEGABACE (GE Healthcare, Piscataway, NJ [Estados Unidos]). Este plásmido es un vector de expresión heteróloga de proteínas inducible por análogos de la lactosa en Escherichia coli que incorpora una cola de Histidina (6xHis) en posición N-terminal del péptido expresado, posibilitando un procedimiento de purificación mediante cromatografía de afinidad. En el diseño del oligonucleótido cebador directo se sustituyeron los codones para Prolina en posiciones 3, 4 y 7 (CCC) por el codón CCG para el cual existe un marcado sesgo de uso en E. coli23 con el objetivo de incrementar el rendimiento en la expresión del polipéptido.
A) Esquema de la construcción del plásmido de expresión de apo A-I nativa. B) Esquema de la construcción del plásmido de expresión de apo A-I Z (mutagénesis). C) Gel de agarosa al 1% teñido con bromuro de etidio. Carriles: 1. Marcador 2. Fragmento de mutagénesis 1 3. Apo A-I nat 4. Fragmento de mutagénesis 2.
En paralelo a la construcción del plásmido de expresión para apo A-I nativa se construyó un plásmido de expresión para apo A-I Zaragoza en el mismo vector pET-45. Para ello se utilizó una estrategia de mutagénesis dirigida consistente en la realización de dos amplificaciones de DNA mediante PCR utilizando los oligonucleótidos cebadores primer A y 5′-CGCATCTCCTCGCCGCGGGGGCTCAGCTTC-3′ (primer B) para producir el fragmento de mutagenesis 1 (464pb), y 5′-GAAGCTGAGCCCCCGCGGCGAGGAGATGCGCG -3′ (primer C) y primer D para producir el fragmento de mutagenesis 2 (334pb). Se utilizó la enzima DNA polimerasa Pwo SuperYield (Roche, Basel [Suiza]) en un termociclador GeneAmp PCR System 9700 (Applied Biosystems, Foster City, CA [Estados Unidos]) y las condiciones de amplificación fueron las mismas descritas en el apartado anterior. Los oligonucleótidos B y C fueron diseñados de tal manera que se introdujo la mutación L144R y el sitio de restricción SacII sobre la posición donde se localiza la mutación. Cada fragmento de mutagenesis fue subclonado en un plásmido pSCB utilizando el kit Blunt PCR Cloning Kit (Stratagene, La Jolla, CA [Estados Unidos]) para clonaje de productos de PCR de extremos romos y la secuencia de cada plásmido (pSCB-M1, pSCB-M2) comprobada mediante secuenciación de DNA de la forma descrita anteriormente. Posteriormente se extrajo la secuencia DraI-SacII del fragmento de mutagenesis 1 del plasmido pSCB-M1 y se subclonó en el plásmido pSCB-M2 dando lugar a la secuencia codificante del péptido maduro de la apo A-I humana con la mutación L144R. Finalmente esta secuencia se subclonó en el vector de expresión pET-45 (Novagen, Darmstadt [Alemania]) de manera similar a lo descrito anteriormente y el resultado comprobado mediante secuenciación de DNA de la forma descrita anteriormente (fig. 1B y C).
Expresión y purificación de apo A-I nativa y apo A-I ZBacterias Escherichia coli de la cepa BL21(DE3) fueron transformadas con los plásmidos pET-45 con las secuencias de la apo A-I nativa o mutada y sometidas a condiciones de cultivo estándar. Se realizó una curva de crecimiento de las bacterias transformadas para estimar el mejor momento para iniciar la inducción de la expresión de proteína quedando fijada en una densidad óptica a 620nm de 0,4. Se utilizó isopropil-β-D-tiogalactósido (IPTG) a una concentración final 1mmol/l y se optimizó el tiempo de inducción para maximizar el rendimiento de producción de proteína. El nivel de expresión de las proteínas de interés en extractos totales de cultivos inducidos durante diferentes periodos de tiempo fue evaluado mediante electroforesis en geles de poliacrilamida con SDS y tinción con Coomassie como se describe en un apartado posterior y resultó ser óptimo a los 120min.
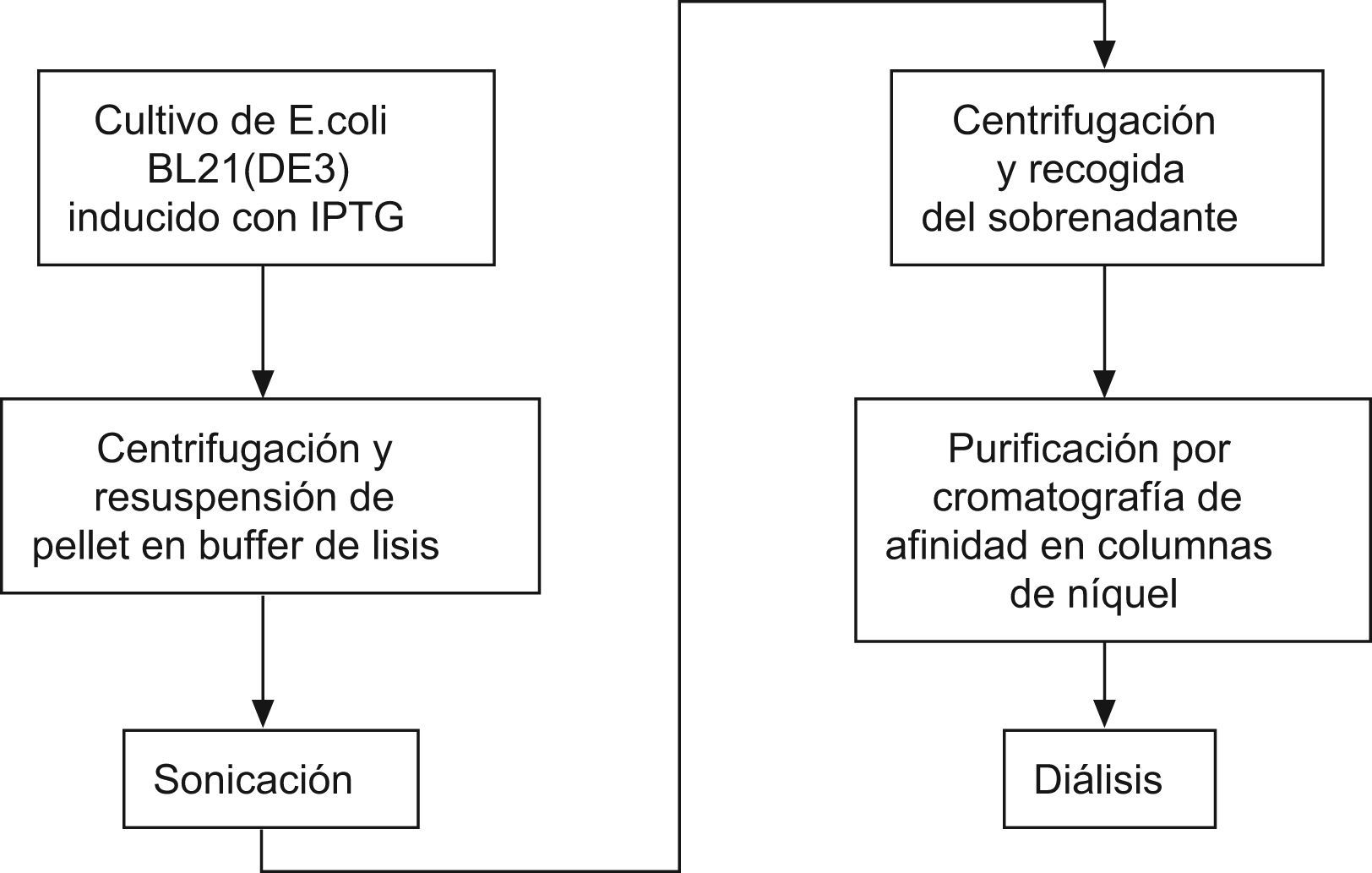
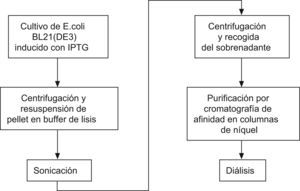
La purificación de las proteínas apo A-I nativa y apo A-I Z a partir de cultivos de E. coli inducidos se realizó utilizando un protocolo no desnaturalizante mediante cromatografía de afinidad en columnas de níquel (fig. 2). Brevemente, las cultivos fueron recogidos y centrifugados a 5400×g y 4°C durante 10min, y los pellets de bacterias resuspendidos en solución de lisis (LEW buffer 1×(50mM NaH2PO4, 300mM NaCl, pH 8.0), con 1mg/ml Lisozima (Sigma, St. Louis, MO [Estados Unidos]) y un cóctel de inhibidores de proteasas Complete Mini EDTA-free Protease Inhibitor Tablets (Roche, Basel [Suiza]) y sometidos a sonicación en un SONOPULS HD 2200 (Bandelin, Berlin [Alemania]) en 10 tandas de 15seg con tiempos de descanso intermedios de 30seg. Las muestras sonicadas se centrifugaron a 10.000×g a 4°C durante 30min. Los sobrenadantes fueron aplicados a columnas de afinidad de níquel Protino Ni-TED (Macherey-Nagel, Düren [Alemania]) y, tras su paso por la matriz y dos lavados con tampón LEW 1×(50mM NaH2PO4, 300mM NaCl, pH 8.0), las proteínas retenidas en la columna fueron eluídas con el tampón de elución (50mM NaH2PO4, 300mM NaCl, 8M Urea, 250mM imidazol, pH 8.0). Finalmente la proteína eluída de la columna fue sometida a diálisis exhaustiva frente a tampón fosfato salino (PBS). La concentración de proteína obtenida tras la purificación se realizó mediante medida espectrofotométrica directa a 280nm utilizando una aproximación de 1 unidad de absorbancia equivalente a 1mg/ml en el aparato Nanodrop 1000 (Thermo Scientific, Waltham, [MA Estados Unidos]), exceptuando el caso de las muestras dializadas donde se utilizó un coeficiente de extinción molar para apo A-I de 32350M−1cm−1 para calcular la concentración exacta24.
SDS-PAGE y Western blotSe realizó electroforesis desnaturalizante (SDS-PAGE) y tinción con Bio-Safe Coomassie (Bio-Rad, Hercules, CA [Estados Unidos]) para visualizar el nivel de expresión de las proteínas inducido por IPTG y para evaluar el resultado de la purificación por cromatografía de afinidad. Se utilizaron de manera habitual geles con una concentración de acrilamida del 15%. Como marcador de pesos moleculares se usó Protein Marker, Broad Range (2–212kDa) (New England BioLabs, Ipswich, MA [Estados Unidos]). A partir de las imágenes de los geles se aplicó un protocolo de densitometría que permitió estimar la pureza de las preparaciones de proteína obtenidas.
Para confirmar la identidad de las proteínas cuya expresión era inducida y que eran obtenidas tras purificación se realizó un procedimiento de Western blot. Para ello se transfirieron las proteínas separadas en SDS-PAGE a membrana de nitrocelulosa Trans-Blot Transfer Médium [Bio-Rad, Hercules, CA [Estados Unidos]) y se empleó un protocolo estándar utilizando como anticuerpo primario un anticuerpo policlonal contra apo A-I humana (ab7613, Abcam Cambridge, MA [Estados Unidos]) y como anticuerpo secundario un IgG de cabra (ab6741, Abcam Cambridge, [MA Estados Unidos]) marcado con HRP. La visualización se realizó utilizando los reactivos del kit ECL Western Blotting detection reagents (GE Healthcare, Piscataway, [NJ Estados Unidos]) y el equipo F-ChemiBIS 6.0 Pro DNR (Bio-Imaging Systems, Jerusalem, [Israel]).
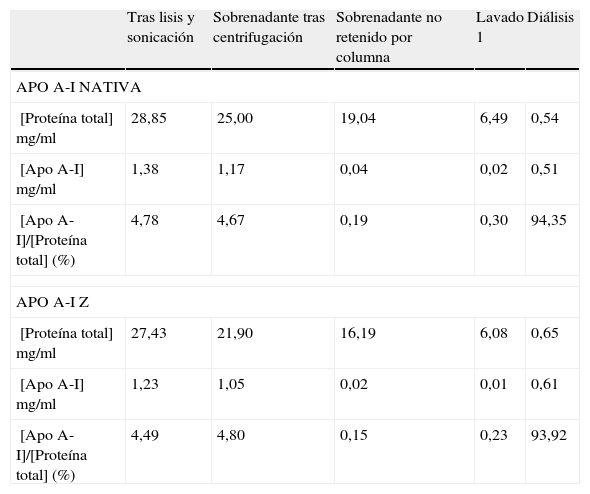
ElisaSe analizó la concentración de apo A-I a lo largo de las diferentes etapas de producción utilizando un kit ELISA comercial (Mabtech [Suecia]) siguiendo las indicaciones del fabricante. El protocolo del analisis utilizado usa como anticuerpo de captura un anticuerpo monoclonal contra apo A-I y como anticuerpo secundario otro anticuerpo monoclonal biotinilado, que es detectado mediante la actividad de una enzima peroxidasa de rabano conjugada con estreptavidina en presencia de un sustrato colorimétrico. El resultado fue adquirido con un equipo de lectura placas multipocillo Model 680 XR (Biorad, Hercules, CA [Estados Unidos]) a 450nm y los datos obtenidos analizados con el programa Excel (Microsoft). Estos datos en combinación con las concentraciones de proteína total obtenida en cada paso de la producción y purificación de las proteínas permitieron elaborar una tabla de purificación para el proceso.
ResultadosEn el desarrollo del presente trabajo en primer lugar se obtuvieron con éxito vectores de expresión en procariotas para la obtención recombinante tanto de apolipoproteína A-I nativa como de la variante apo A-I Zaragoza. Para ello se utilizaron técnicas básicas de biología molecular que permitieron introducir una secuencia de DNA codificante del péptido maduro de apo A-I en el vector pET-45, así como la producción de la variante correspondiente a apo A-I Zaragoza, con la sustitución del codón CTG a CGC que da lugar al cambio L144R. Adicionalmente se sustituyeron los codones CCC para Pro en posiciones 3, 4 y 7 del péptido maduro por CCG para favorecer la expresión de los péptidos expresados. La comprobación de los vectores producidos mediante secuenciación de DNA permitió verificar que las secuencias introducidas eran correctas.
La inducción de la expresión de proteínas en el sistema elegido está promovida por compuestos estructuralmente análogos a la lactosa, como el IPTG. Tras un tiempo suficiente de inducción se analizaron los lisados bacterianos mediante SDS-PAGE. La aparición de una banda de proteína con un tamaño aproximado de 29kDa coincidió con el tamaño esperado de las proteínas que se pretendían expresar (tanto apo A-I nativa como apo A-I Zaragoza). La identidad de la proteína cuya expresión era inducida se confirmó mediante Western blot con anticuerpos contra apo A-I humana.
En las pruebas realizadas se determinó que el tiempo óptimo de inducción era de 120min. El escalado a mayores volúmenes de cultivo para inducir la expresión proteica se realizó sin ser necesarias variaciones respecto a las condiciones de crecimiento y tiempo de inducción previamente utilizadas.
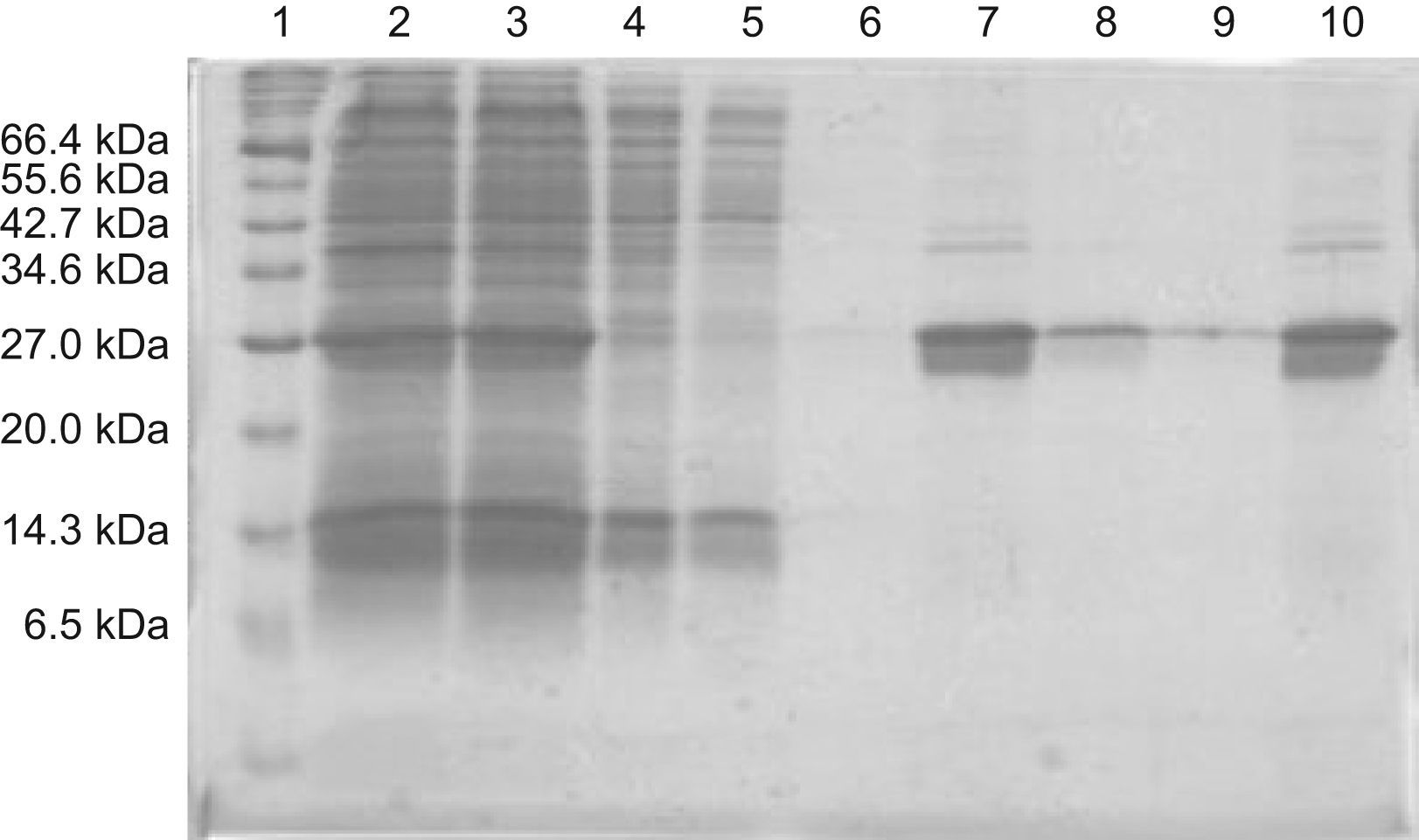
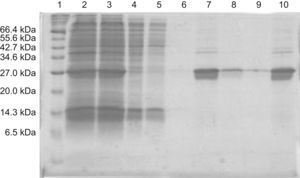
Las proteínas expresadas a partir de los vectores construidos fueron purificadas en un solo paso mediante cromatografía de afinidad en una matriz con níquel y la proteína eluída de la columna fue sometida a diálisis frente a PBS para su uso posterior o almacenamiento. La comprobación del resultado de la purificación se hizo en SDS-PAGE observándose débiles bandas de mayor peso molecular (entre 35–40kDa) que la proteína expresada en la fracción purificada (fig. 3). Aplicando un protocolo de densitometría se pudo determinar que la pureza de las preparaciones estaba en torno al 94% tanto para la apo A-I nat como para la apo A-I Z.
La pureza de la proteína purificada se comprobó en una electroforesis en gel de poliacrilamida (15%) desnaturalizante con SDS. Las muestras se sometieron a una electroforesis a 50V durante 40min y después a 100V 1h y 30min. La utilización de un marcador de peso molecular permitió identificar la proteína de interés que tiene un peso molecular aproximado de 29kDa. Carriles: 1. Marcador 2. Post sonicación 3. Sobrenadante tras centrifugación 4. Sobrenadante no retenido por columna 5. Lavado 1 6. Lavado 2 7. Elución 1 8. Elución 2 9. Elución 3 10. Elución 1+Elución 2 dializado.
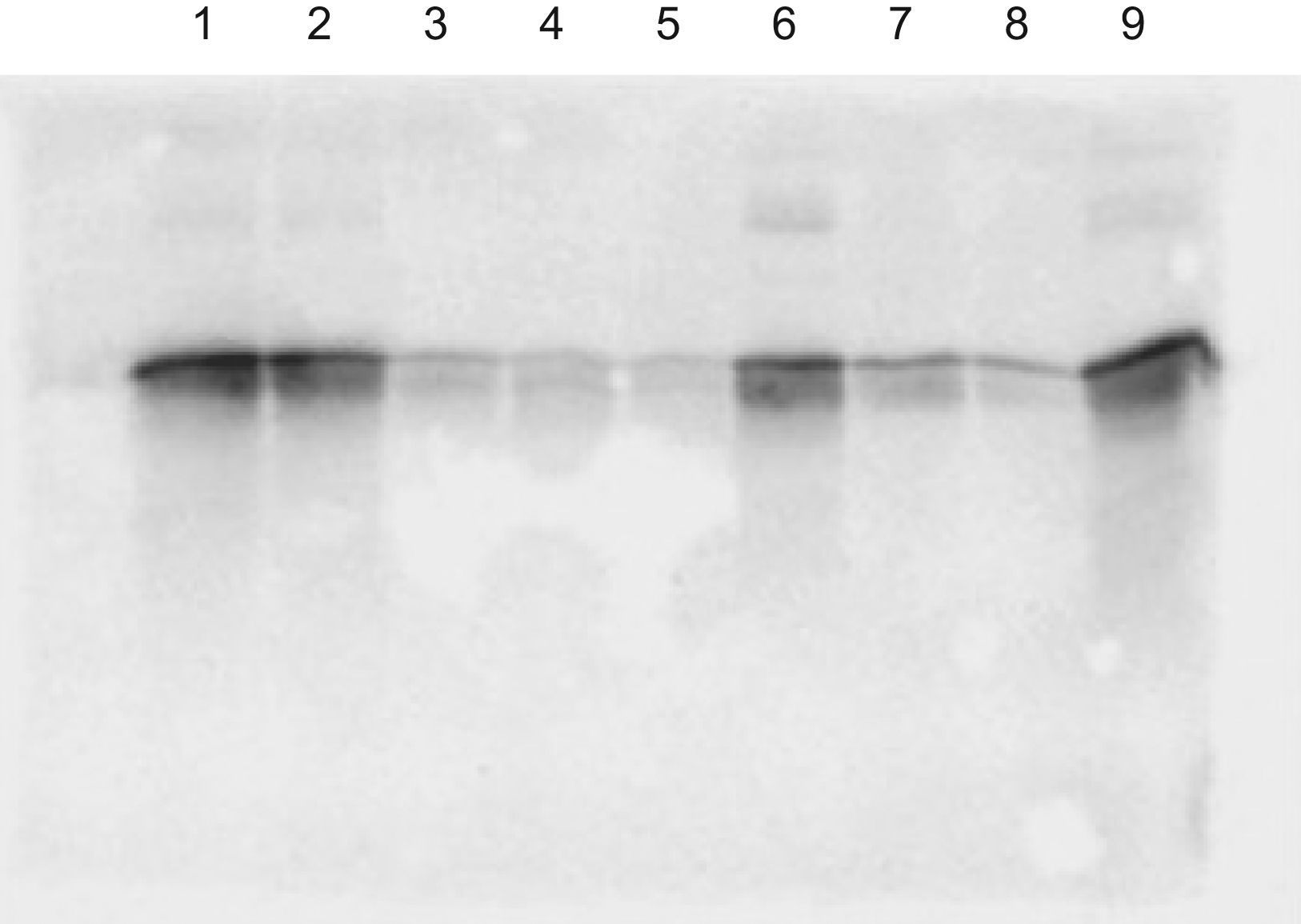
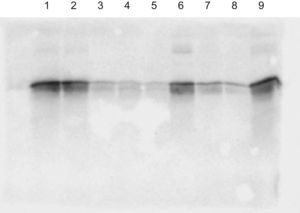
Mediante Western blot se confirmó que la proteína obtenida en la purificación era apo A-I (fig. 4) y se apreció la presencia de débiles bandas de mayor peso molecular, no coincidentes con las bandas suplementarias observadas en SDS-PAGE teñido con Coomassie, que resultaban mucho más aparentes en la fracción correspondiente al lisado total y al eluato de la columna de afinidad que en la proteína purificada y dializada en PBS. Dados los pesos moleculares aproximados de estas débiles bandas reconocidas por los anticuerpos contra apo A-I (55–60kDa, y 80–90kDa), cabe la posibilidad de que se trate de dímeros y trímeros de la proteína expresada que no son disgregados en las condiciones de desnaturalización utilizadas.
Con objeto de realizar un seguimiento de las etapas de la purificación se usó un analisis por ELISA que permitió determinar la concentración de apo A-I a lo largo de las etapas de purificación. Se utilizó el porcentaje de la cantidad de apo A-I respecto a la cantidad de proteína total como parámetro para valorar el transcurso de la purificación (tabla 1). Del análisis de los datos obtenidos se puede estimar que tras el tiempo óptimo de inducción alrededor del 4,5% de la proteína total en el cultivo es apo A-I, de toda esta apo A-I expresada un 85% se recupera en la fracción soluble del lisado bacteriano y tras la purificación mediante cromatografía de afinidad y la posterior diálisis en PBS se obtiene aproximadamente un 55% de la proteína en forma soluble (correspondiente aproximadamente al 45% de la apo AI producida en el cultivo). El análisis mediante Western blot de la fracción no retenida en la columna y a los lavados de la columna mostró la presencia de apo A-I, lo cual explicaría la pérdida observada. El rendimiento final típico obtenido es de alrededor de 30mg de apo A-I por litro de cultivo con una pureza superior al 90% como se ha indicado anteriormente. No se observaron diferencias en los parámetros de purificación ni el rendimiento final entre la apo A-I nativa y la apo A-I Zaragoza.
Tabla de purificación de apo A-I nat y apo A-I Z a partir de cultivos de 100ml inducidos con IPTG
| Tras lisis y sonicación | Sobrenadante tras centrifugación | Sobrenadante no retenido por columna | Lavado 1 | Diálisis | |
| APO A-I NATIVA | |||||
| [Proteína total] mg/ml | 28,85 | 25,00 | 19,04 | 6,49 | 0,54 |
| [Apo A-I] mg/ml | 1,38 | 1,17 | 0,04 | 0,02 | 0,51 |
| [Apo A-I]/[Proteína total] (%) | 4,78 | 4,67 | 0,19 | 0,30 | 94,35 |
| APO A-I Z | |||||
| [Proteína total] mg/ml | 27,43 | 21,90 | 16,19 | 6,08 | 0,65 |
| [Apo A-I] mg/ml | 1,23 | 1,05 | 0,02 | 0,01 | 0,61 |
| [Apo A-I]/[Proteína total] (%) | 4,49 | 4,80 | 0,15 | 0,23 | 93,92 |
En este trabajo hemos diseñado y desarrollado un sistema novedoso de producción de la apo A-I nativa recombinante además de generar por primera vez la apo A-I Z completa recombinante.
El primer punto a tratar en el diseño fue la elección del sistema de expresión adecuada. La bibliografía presentaba varios posibles sistemas de expresión entre los que destacan sistemas procariotas, principalmente E. coli25,26, levaduras (Pichia pastoris)27 y en algunos casos células eucariotas, en concreto células de ovario de ratón chino (CHO)28. Cada uno de estos sistemas presentan ventajas y desventajas. Los sistemas de células eurcariotas produciran la proteína más parecida a la humana, pudiéndose realizar procesos de maduración dentro de la célula, pero presenta el inconveniente de la dificultad de manipulación y un rendimiento no muy elevado.
La producción en levaduras al igual que el sistema de eucariotas da lugar a una proteína procesada de forma parecida a la humana, pero la necesidad de fermentadores de gran escala para obtener buenos rendimientos hace que no sea el sistema más apropiado para nuestro estudio.
El sistema de expresión más utilizado es el de E.coli, debido a su eficacia y facilidad de manipulación. Dado que la apo A-I no necesita modificaciones post-traduccionales, hace posible su expresión en células procariotas aunque se debe tener en cuenta que al no producirse la proteolisis de la pre-pro-proteina, es necesario trabajar exclusivamente con la secuencia madura de la apo A-I. Un hecho importante a tener en cuenta es que la eliminación de estos amino ácidos del segmento pre y pro hace que la expresión de la proteína baje notablemente. Para rectificar esto alteramos ciertos codones por otros degenerados de uso más frecuente en E.coli, ayudando asi a recuperar los niveles de expresión26.
La incorporación de una cola de histidina a la proteína recombinante facilita mucho su purificación permitiendo el uso de cromatografía de afinidad en columnas de níquel para separar la proteína del extracto crudo. Pero también presenta el inconveniente de que la proteína recombinante lleva en un extremo 6 histidinas adicionales que no forma parte de su estructura original y que potencialmente pudieran afectar a su estructura y función. Para rectificar esto es necesario tener un proceso de eliminación de la cola de histidina, siendo el procedimiento más empleado el de hidrólisis enzimática. Sin embargo, uno de los problemas más comunes en la manipulación de apo A-I es que a lo largo de su secuencia es susceptible a la digestión enzimática por numerosas enzimas (factor X, enterokinasa.… etc).
Distintos estudios encontraron estrategias variadas para solucionar este problema; creando un sitio de corte para la proteasa de la Ig A (de Neisseria gonorrhoeae) o «Igase»25 que no corta en apo A-I, creando un enlace adicional en el extremo amino terminal que fuera ácido-lábil26 o lipidando la proteína antes de usar la enzima7,12,29. De esta forma la enzima no puede atacar a la proteína ya que los lípidos unidos a él protegen los posibles sitios de corte. No obstante, estudios previos han demostrado que los 43 aminoácidos del extremo N-terminal no están involucrados en la asociación a lípidos30. Dado que la cola de histidinas de nuestras proteínas recombinantes están en dicho extremo, pensamos que no se vería afectada la función de la proteína. Pero en caso de querer eliminar la cola de histidinas, se puede utilizar la enzima exoproteolítica Tagzyme de Qiagen, enzima capaz de eliminar las histidinas desde el extremo amino terminal de una proteína.
En términos de purificación y rendimiento nuestro sistema ha obtenido un rendimiento de al menos 30mg/l de cultivo en fracción soluble de ambas proteínas recombinantes. Esta cifra seria aun mayor si se tuviera en cuenta la cantidad de proteína retenida en la fracción insoluble. Posiblemente se podría intentar recuperar la proteína de esta fracción aunque presenta mayores problemas de manipulación que la fracción soluble además de correr el riesgo de que la proteína se haya agregado o degradado.
La pureza de ambas proteínas es elevada, entorno a 94–93% respectivamente.
Comparando estas cifras con las de otros estudios podemos observar que el rendimiento es bueno, sobre todo teniendo en cuenta la facilidad de manipulación. Sin duda el sistema con el mejor rendimiento es el de la levadura Pichia pastoris, pero requiere una instrumentación especializada (p.ej. fermentadores) a las que no tenemos acceso, además de emplear un protocolo más largo y laborioso.
El rendimiento de algunos sistemas de E.coli también es superior a la nuestra pero como consecuencia de la manipulación genética de numerosos codones, favoreciendo su producción. La manipulación genética adicional requerida para hacer esto hace que el proceso no sea tan rápido ni eficaz como nuestro protocolo.
En resumen, hemos optimizado la producción y mutagénesis de la apo A-I nativa y apo A-I Zaragoza, para su posterior caracterización estructural y funcional. Para ello hemos introducido varias mutaciones silenciosas en la secuencia codificante de la apo A-I para aumentar la proporción de codones más representativos en E.coli. De esta forma favorecemos la mayor producción de proteína. También hemos elegido un sistema de purificación sencillo utilizando una cola de histidinas y cromatografia de afinidad en columnas de níquel. Con el rendimiento y pureza obtenida con ambas proteínas podemos proceder a realizar ensayos tanto de funcionalidad como de estructura para profundizar más en el efecto que tiene la mutacion L144R en la apolipoproteína A-I. Por otra parte, el procedimiento y tecnología utilizado en este estudio puede servir de modelo para la producción y purificación de otras proteínas de interés biológico.
FinanciaciónEste estudio ha sido desarrollado en parte con fondos: FIS 06/1238, FIS 09/00665, FIS 06/1402.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo recibió una Mención Especial en el XXI Congreso Nacional de la Sociedad Española de Arteriosclerosis celebrado en Madrid en 2008.
Agradecemos a la Dr. Delia Recalde el plásmido con el cDNA de la apo A-I humana.