El adecuado control lipídico tras un síndrome coronario agudo (SCA) es una estrategia de prevención secundaria crucial para disminuir el riesgo de reinfarto y muerte cardiovascular. Existen tablas que predicen la dosificación necesaria del tratamiento hipolipidemiante según el colesterol LDL (cLDL) inicial pero no han sido probadas en el SCA. Analizamos los factores asociados al control del cLDL tras un SCA y la utilidad de las tablas de Masana y Plana en este contexto.
MétodosEntre enero de 2015 y mayo de 2016 se incluyeron 326 pacientes con SCA. Se registraron las concentraciones basales de cLDL y el tratamiento hipolipidemiante al alta. Se analizaron las variables asociadas a un adecuado control del cLDL (<70mg/dL) en el seguimiento.
ResultadosLa edad media fue 66±13 años, el 72% varones. El tratamiento hipolipidemiante al alta se ajustó a las recomendaciones de Masana en 196 (60%) pacientes. Tras 122 [66-184] días, en 148 (45%) se alcanzó el objetivo de cLDL, siendo este porcentaje mayor (109/196 –56%– vs. 39/130 –30%– pacientes) cuando el tratamiento fue planificado según las tablas de Masana y Plana (p<0,001). En el análisis multivariante, el género masculino (p<0,001), la ausencia de dislipidemia previa (p<0,001) y la aplicación de las tablas de Masana y Plana (p=0,007) fueron predictores independientes para alcanzar el cLDL objetivo.
ConclusionesEl control lipídico adecuado tras un SCA se alcanza en menos de la mitad de casos. La dosificación de la terapia hipolipidemiante según las tablas de Masanay Plana mejora la consecución de este crucial objetivo terapéutico.
Adequate LDL cholesterol (LDLc) control after an acute coronary syndrome (ACS) is a crucial secondary prevention strategy to minimize the incidence of recurrent myocardial infarction and cardiovascular death. There are tables that predict the necessary dosage of lipid-lowering treatment from the initial LDLc but have not been tested in ACS. Variables associated with optimal LDLc after an ACS were analyzed and the therapeutic yield of the use of Masana's recommendations in this setting.
MethodsA total number of 326 ACS-patients were included between January-2015 and May-2016. Baseline LDLc concentration and prescribed hypolipemiant treatment at hospital discharge were registered. We analyzed the variables associated with optimal LDLc levels (<70mg/dL) control during follow-up.
ResultsAmong our patient population (72% male, age 66±13 years), the hypolipemiant treatment at hospital discharge fulfilled the Masana's recommendations in 196 (60%) patients. After a follow-up period of 122 [66-184] days the targeted LDLc levels were achieved in 148 (45%) patients, being this percentage greater among those in whom the Masana's recommendations were fulfilled (109/196, 56%), as compared with the remaining (39/130, 30%; P<.001). The male gender (P<.001), the absence of prior history of dyslipemia (P<.001) and the adherence to Masana's recommendations (P=.007) were independent predictors for the achievement of targeted LDLc levels during follow-up.
ConclusionsIn less than half of ACS-patients adequate mid-term LDLc control is obtained. The dosage of the lipid-lowering therapy according to Masana's recommendations helps to achieve this important therapeutic goal.
La enfermedad cardiovascular es responsable de 3,9 millones de defunciones en Europa cada año, un 20-30% se asocian al infracontrol de la dislipidemia1. Diversos estudios han demostrado la importancia de la reducción del colesterol unido a lipoproteínas de baja densidad (cLDL) para reducir la morbimortalidad cardiovascular2–5. Sin embargo, el grado de control del cLDL en la vida real arroja resultados desalentadores, especialmente en prevención secundaria6–9.
La inercia terapéutica, las dosis de fármacos insuficientes, la falta de titulación en las visitas sucesivas, la ausencia de combinaciones de fármacos hipolipidemiantes y la baja adherencia de los pacientes a la medicación7,9,10 son algunos de los factores relacionados con el control inadecuado del cLDL.
En los pacientes de muy alto riesgo cardiovascular tiene relevancia no solo la consecución del objetivo terapéutico, sino también el tiempo en alcanzarlo4,11,12. Para ello, es crucial la planificación de la intervención farmacológica hipolipidemiante.
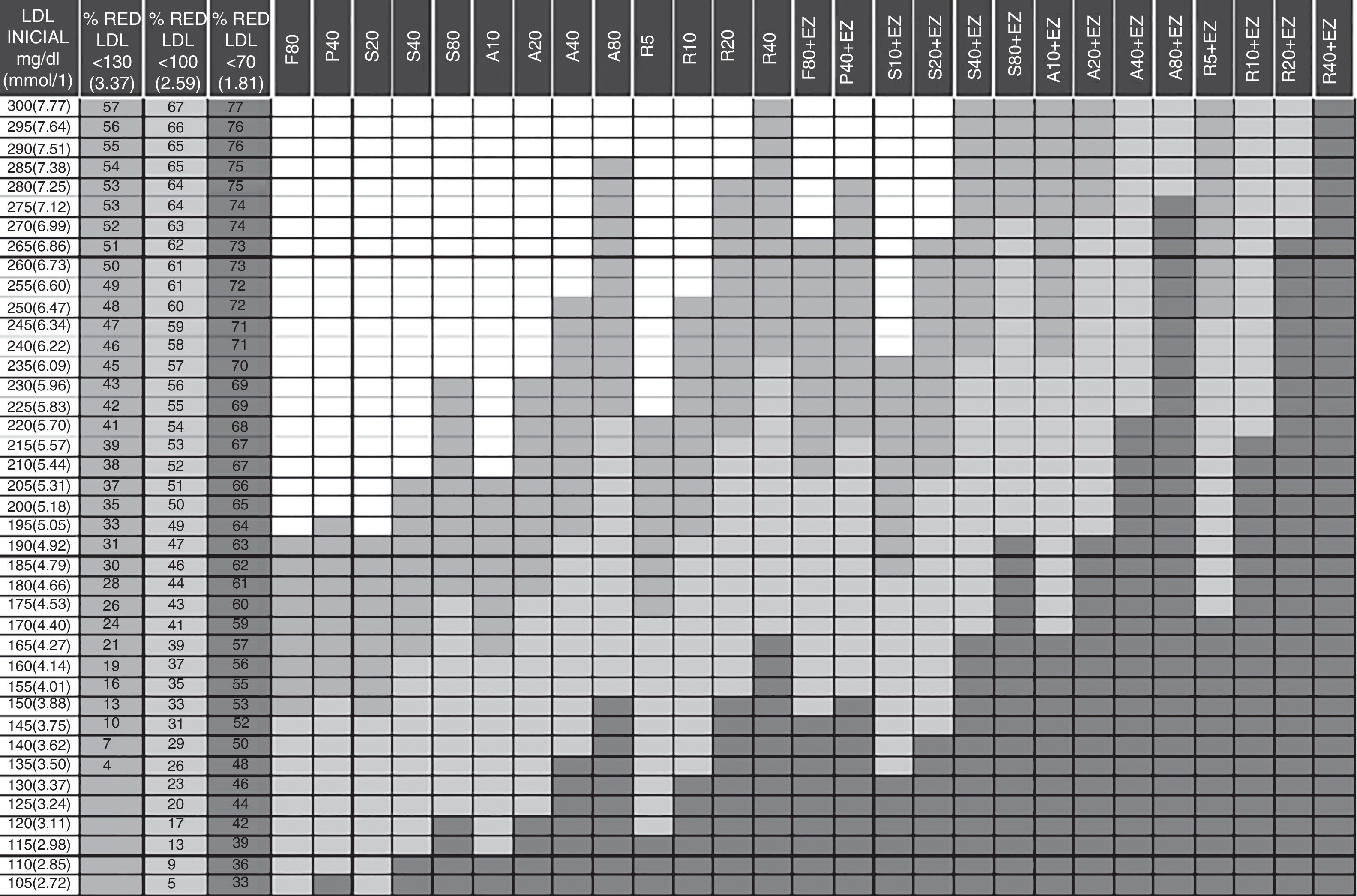
Entre las herramientas disponibles destacan las tablas de planificación terapéutica de Masana y Plana13 diseñadas en el año 2005 y actualizadas en 2010 y en 201514,15 que están basadas en la concentración basal de cLDL, el cLDL objetivo según el riesgo cardiovascular y la potencia teórica de los fármacos hipolipidemiantes16,17. En función de estos parámetros establecen el tipo y dosis de estatina y/o la necesidad de añadir ezetimiba para lograr el objetivo terapéutico en cada paciente.
A pesar de su fácil utilización y de su amplia difusión en guías de práctica clínica de atención primaria18, hay poca evidencia de su eficacia. Hasta la fecha solo se han publicado los resultados de una versión informatizada (HTE-DLP)19 en 77 pacientes ambulatorios con alto riesgo cardiovascular. La aplicabilidad y el rendimiento terapéutico no han sido establecidos en el síndrome coronario agudo (SCA).
Los objetivos del presente estudio fueron evaluar el control del cLDL después de un SCA y analizar si la prescripción del tratamiento hipolipidemiante según las tablas de planificación terapéutica de Masana y Plana mejora la consecución del objetivo terapéutico en esta población.
Pacientes y métodosPoblación a estudioSe incluyeron los pacientes que ingresaron consecutivamente en nuestro centro entre enero de 2015 y mayo de 2016 por un SCA en los que se pudiera realizar un seguimiento clínico adecuado. Se excluyeron los pacientes que fallecieron los primeros tres meses y aquellos que no disponían de un perfil lipídico en el primer año de seguimiento.
El estudio fue diseñado según los principios éticos establecidos según la Declaración de Helsinki y fue aprobado por el Comité de Ética e Investigación Clínica de nuestro centro.
Tablas de planificación terapéutica de Masana y PlanaEn el presente estudio utilizamos las tablas de Masana y Plana en su versión actualizada del año 201014 (fig. 1). Para aplicar las tablas se debe conocer la concentración basal de cLDL (primera columna de la tabla). En aquellos pacientes que ya reciben tratamiento hipolipidemiante se asume que el cLDL basal teórico es un 30% superior al cLDL observado bajo tratamiento. En base a la concentración basal de cLDL y, según el riesgo cardiovascular, se establece el cLDL objetivo. En las siguientes columnas se definen el fármaco y dosis o combinación de fármacos hipolipidemiantes recomendados según el objetivo. Las celdas en gris oscuro reflejan las distintas opciones terapéuticas para conseguir objetivos en prevención secundaria tras un SCA (cLDL<70mg/dL).
Guía para la prescripción del tratamiento hipolipidemiante orientado a la obtención de objetivos terapéuticos. A: atorvastatina; cLDL: colesterol ligado a lipoproteínas de baja densidad; EZ: ezetimiba; F: fluvastatina; P: pravastatina; R: rosuvastatina; S: simvastatina; %RED: porcentaje de reducción.
• Columna 1: valor de lipoproteínas de baja densidad (LDL) inicial del paciente que se va a tratar.
• Columnas 2, 3 y 4: porcentaje de LDL que debe reducirse para alcanzar los objetivos terapéuticos en prevención primaria (columna 2) y en prevención secundaria, diabetes, síndrome metabólico y riesgo cardiovascular global alto (columna 3). Columna 4: según nuevas recomendaciones LDL<70mg/dL.
• Columnas 5 a 31: fármacos o combinación de fármacos que permitirán la reducción de LDL necesaria para alcanzar los objetivos terapéuticos. En verde para prevención primaria. En naranja para prevención secundaria. En rojo nuevas recomendaciones LDL<70mg/dL.
Modo de empleo:
1. Localizar el valor LDL de partida.
2. Comprobar el descenso requerido para conseguir objetivo de LDL<130mg/dL, 100mg/dL o <70mg/dL en columnas adyacentes.
3. Seguir la fila.
4. Las celdas en gris claro señalan los tratamientos que permitirán alcanzar objetivos en prevención primaria.
5. Las celdas en gris medio señalan los tratamientos que permitirán alcanzar objetivos en prevención secundaria, diabetes, síndrome metabólico y riesgo cardiovascular global alto, etc.
6. Las celdas en gris oscuro señalan las nuevas recomendaciones LDL=70mg/dL.
Con permiso de los autores. Masana y Plana14.
Los datos demográficos, los factores de riesgo cardiovascular así como el tratamiento hipolipidemiante previo al ingreso fueron recogidos al ingreso. Los factores de riesgo cardiovascular se definieron según: 1) Tabaquismo activo: pacientes fumadores o exfumadores de menos de un año; 2) Hipertensión arterial, diabetes mellitus o dislipidemia: si el antecedente era referido por el paciente o constaba en la historia clínica o bien recibían tratamiento farmacológico para ello.
Se realizó una analítica basal en las primeras 24h de ingreso con colesterol total, fracciones de colesterol y triglicéridos. La determinación de cLDL se realizó mediante la fórmula de Friedewald o mediante método enzimático si la concentración de triglicéridos era>400mg/dL.
Para el estudio se consideró que se habían seguido las tablas de planificación terapéutica si el tratamiento hipolipidemiante elegido era igual o superior al recomendado por las tablas según niveles basales de cLDL. Dado que las tablas de Masana contemplan la utilización del tratamiento combinado con ezetimiba se definió tratamiento hipolipidemiante de alta intensidad (incluye estatinas en monoterapia o bien combinación de estatinas con ezetimiba) aquel capaz de conseguir reducciones de cLDL del 50-60% y de muy alta intensidad aquel capaz de conseguir reducciones superiores al 60%20.
SeguimientoEl seguimiento clínico de los pacientes al alta hospitalaria se realizó en los centros de atención primaria de nuestra red sanitaria. Se monitorizó el perfil lipídico a través de la Historia Clínica Compartida de Cataluña, en la cual además se recogieron datos correspondientes al seguimiento clínico.
Para evaluar el control del cLDL se recopiló el primer perfil lipídico realizado después del SCA siempre que hubiese transcurrido un mínimo de un mes y un máximo de 12 meses tras el SCA. Se consideró control adecuado aquellos pacientes que tuviesen un cLDL<70mg/dL tal y como se contempla en las guías europeas de práctica clínica21,22.
Análisis estadísticoSe realizó un análisis descriptivo de los datos donde los resultados de las variables cuantitativas normales se expresan como media±desviación estándar, las variables cuantitativas no normales como mediana [rango intercuartílico] y las variables cualitativas se expresan como frecuencia y porcentaje. Para la comparación de las variables cuantitativas normales en 2 grupos independientes se utilizó la prueba T Student, para variables cuantitativas no normales se realizó el test de Kruskall-Wallis y para variables cualitativas la prueba Chi-cuadrado. Para evaluar los factores asociados con la consecución del objetivo terapéutico de colesterol LDL<70mg/dL (variable dependiente), se aplicó un modelo de regresión logística múltiple que incluía como variables independientes las que mostraron un valor de p<0,05 en el análisis univariante. Los análisis se realizaron con el software estadístico R, versión 3.4.1. (R: A language and environment for statistical computing, Viena, Austria.)
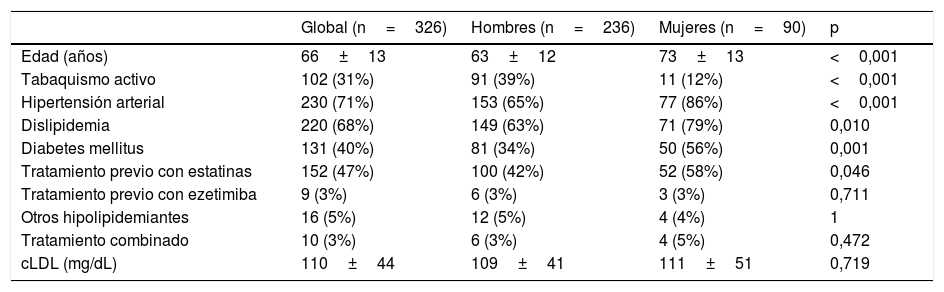
ResultadosPoblación a estudioUn total de 396 pacientes ingresaron consecutivamente en nuestro centro entre enero de 2015 y mayo de 2016 por un SCA. Se excluyeron 18 pacientes por fallecer los primeros 3 meses y 52 por no disponer de analítica con cLDL en el primer año, quedando como población a estudio 326 pacientes. Las características clínicas basales, analíticas y el tratamiento previo al ingreso se exponen en la tabla 1. A destacar que las mujeres tenían mayor edad (p<0,001) y mayor prevalencia de hipertensión arterial (p<0,001), diabetes mellitus (p=0,001), dislipidemia (p=0,01) y toma previa de estatinas (p=0,046).
Características basales de la población a estudio distribuidas según género
| Global (n=326) | Hombres (n=236) | Mujeres (n=90) | p | |
|---|---|---|---|---|
| Edad (años) | 66±13 | 63±12 | 73±13 | <0,001 |
| Tabaquismo activo | 102 (31%) | 91 (39%) | 11 (12%) | <0,001 |
| Hipertensión arterial | 230 (71%) | 153 (65%) | 77 (86%) | <0,001 |
| Dislipidemia | 220 (68%) | 149 (63%) | 71 (79%) | 0,010 |
| Diabetes mellitus | 131 (40%) | 81 (34%) | 50 (56%) | 0,001 |
| Tratamiento previo con estatinas | 152 (47%) | 100 (42%) | 52 (58%) | 0,046 |
| Tratamiento previo con ezetimiba | 9 (3%) | 6 (3%) | 3 (3%) | 0,711 |
| Otros hipolipidemiantes | 16 (5%) | 12 (5%) | 4 (4%) | 1 |
| Tratamiento combinado | 10 (3%) | 6 (3%) | 4 (5%) | 0,472 |
| cLDL (mg/dL) | 110±44 | 109±41 | 111±51 | 0,719 |
Los resultados se expresan como número (%) o media±desviación estándar.
Una p<0,05 se considera estadísticamente significativa.
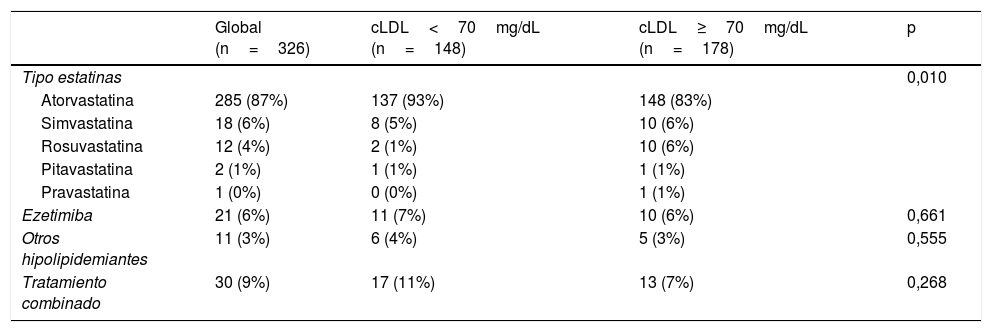
El 98% (318/326) de los pacientes recibió tratamiento con estatinas, la tabla 2 muestra el tratamiento hipolipidemiante indicado al alta tras el SCA. El tratamiento hipolipidemiante de alta potencia y muy alta potencia fue prescrito en un 80% (260/326) y un 6% (19/326) de los pacientes, respectivamente. La combinación de estatinas y ezetimiba se usó en el 9% (30/326).
Consecución del cLDL objetivo (LDL<70mg/dL) durante el seguimiento según el tratamiento hipolipidemiante al alta tras un síndrome coronario agudo
| Global (n=326) | cLDL<70mg/dL (n=148) | cLDL≥70mg/dL (n=178) | p | |
|---|---|---|---|---|
| Tipo estatinas | 0,010 | |||
| Atorvastatina | 285 (87%) | 137 (93%) | 148 (83%) | |
| Simvastatina | 18 (6%) | 8 (5%) | 10 (6%) | |
| Rosuvastatina | 12 (4%) | 2 (1%) | 10 (6%) | |
| Pitavastatina | 2 (1%) | 1 (1%) | 1 (1%) | |
| Pravastatina | 1 (0%) | 0 (0%) | 1 (1%) | |
| Ezetimiba | 21 (6%) | 11 (7%) | 10 (6%) | 0,661 |
| Otros hipolipidemiantes | 11 (3%) | 6 (4%) | 5 (3%) | 0,555 |
| Tratamiento combinado | 30 (9%) | 17 (11%) | 13 (7%) | 0,268 |
Los resultados se expresan como número (%).
Una p<0,05 se considera estadísticamente significativa.
Solo en 196 pacientes (60%) se siguieron de forma estricta las recomendaciones de Masana, en el 40% (130/326) restante, se prescribió una terapia hipolipidemiante inferior a la recomendada.
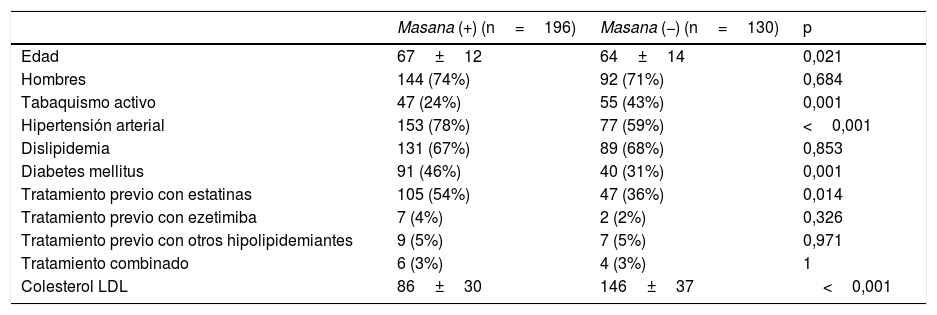
Los pacientes que se adecuaron a las recomendaciones de Masana eran mayores (p=0,021) y tenían más antecedentes de hipertensión arterial (p<0,001), diabetes mellitus (p=0,007) y seguían tratamiento previo con estatinas (p=0,014) por lo que las concentraciones de cLDL al ingreso eran menores (p<0,001; tabla 3).
Factores asociados a la adherencia a los criterios de Masana en la prescripción de hipolipidemiantes tras un síndrome coronario agudo
| Masana (+) (n=196) | Masana (−) (n=130) | p | |
|---|---|---|---|
| Edad | 67±12 | 64±14 | 0,021 |
| Hombres | 144 (74%) | 92 (71%) | 0,684 |
| Tabaquismo activo | 47 (24%) | 55 (43%) | 0,001 |
| Hipertensión arterial | 153 (78%) | 77 (59%) | <0,001 |
| Dislipidemia | 131 (67%) | 89 (68%) | 0,853 |
| Diabetes mellitus | 91 (46%) | 40 (31%) | 0,001 |
| Tratamiento previo con estatinas | 105 (54%) | 47 (36%) | 0,014 |
| Tratamiento previo con ezetimiba | 7 (4%) | 2 (2%) | 0,326 |
| Tratamiento previo con otros hipolipidemiantes | 9 (5%) | 7 (5%) | 0,971 |
| Tratamiento combinado | 6 (3%) | 4 (3%) | 1 |
| Colesterol LDL | 86±30 | 146±37 | <0,001 |
Los resultados se expresan como número (%) o media±desviación estándar.
Una p<0,05 se considera estadísticamente significativa.
Masana (+)=adherencia a las recomendaciones de Masana.
Masana (−)=no adherencia a las recomendaciones de Masana.
De los 326 pacientes incluidos, se alcanzó el objetivo de cLDL<70mg/dL en un 45% (148/326). Este porcentaje aumentó al 56% (109/196 pacientes) cuando se siguieron las tablas de Masana, y fue del 30% (39/130 pacientes) cuando el tratamiento hipolipidemiante no cumplía con dichas recomendaciones (p<0,001).
El tiempo medio hasta la realización de la primera analítica después del SCA fue de 122 [66-184] días sin que hubiese diferencias entre aquellos pacientes que consiguieron un control adecuado del cLDL y aquellos que no lo alcanzaron (p=0,893).
La atorvastatina como hipolipidemiante de elección más frecuente entre los pacientes que alcanzaron el cLDL objetivo (93 vs. 83%, p=0,010; tabla 2). Sin embargo, no se hallaron diferencias en la consecución del cLDL objetivo según el uso de hipolipidemiantes de alta o muy alta potencia (p=0,866). La elección de la potencia del tratamiento hipolipidemiante seleccionado no se vio influenciada por el género (p=0,285).
La población de pacientes en la que se consiguió alcanzar el objetivo terapéutico (cLDL<70mg/dL) estaba compuesta por una mayor proporción de varones (p<0,001), menor prevalencia de dislipidemia (p<0,001), concentraciones basales menores de cLDL (p<0,001) y menor uso previo de estatinas (p<0,005). Asimismo, tenía un mayor porcentaje de adherencia a las recomendaciones de Masana (74 vs. 49%, p<0,001; tabla 4).
Factores asociados a la consecución del objetivo de cLDL<70mg/dL durante el seguimiento
| cLDL<70mg/dL (n=148) | cLDL≥70mg/dL (n=178) | p | |
|---|---|---|---|
| Edad | 64±12 | 67±14 | 0,093 |
| Hombres | 129 (87%) | 107 (60%) | <0,001 |
| Tabaquismo activo | 50 (34%) | 52 (29%) | 0,419 |
| Hipertensión arterial | 107 (72%) | 123 (69%) | 0,611 |
| Dislipidemia | 83 (56%) | 137 (77%) | <0,001 |
| Diabetes mellitus | 63 (43%) | 68 (38%) | 0,492 |
| Tratamiento previo con estatinas | 54 (36%) | 98 (55%) | 0,005 |
| Tratamiento previo con ezetimiba | 2 (1%) | 7 (4%) | 0,192 |
| Otros hipolipidemiantes | 11 (7%) | 5 (3%) | 0,093 |
| cLDL basal | 99±38 | 119±47 | <0,001 |
| Masana (+) | 109 (74%) | 87 (49%) | <0,001 |
Los resultados se expresan como número (%) o media±desviación estándar.
Una p<0,05 se considera estadísticamente significativa.
Masana (+)=adherencia a las recomendaciones de Masana.
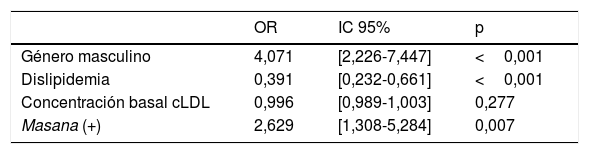
En el análisis multivariante, el género masculino (OR=4,071; p<0,001), la ausencia de dislipidemia previa al ingreso (OR=0,391; p<0,001) y el tratamiento al alta acorde con las tablas de Masana (OR=2,629; p=0,007) fueron predictores independientes para alcanzar el cLDL objetivo en el seguimiento (tabla 5).
Factores asociados a la consecución del objetivo de colesterol LDL<70mg/dL: Modelo de regresión logística (análisis multivariante)
| OR | IC 95% | p | |
|---|---|---|---|
| Género masculino | 4,071 | [2,226-7,447] | <0,001 |
| Dislipidemia | 0,391 | [0,232-0,661] | <0,001 |
| Concentración basal cLDL | 0,996 | [0,989-1,003] | 0,277 |
| Masana (+) | 2,629 | [1,308-5,284] | 0,007 |
IC 95%: intervalo de confianza del 95%; OR: odds ratio.
Masana (+)=adherencia a las recomendaciones de Masana.
El presente estudio muestra que la aplicación de las tablas de planificación terapéutica de Masana se asocia a la consecución del objetivo de niveles de cLDL<70mg/dL definidos en las actuales guías de práctica clínica (p<0,001). Sin embargo, estas recomendaciones solo se aplican a un 60% de los pacientes tras un SCA, lo cual tiene un impacto negativo en la consecución del objetivo de cLDL (p<0,001). Nuestros resultados sugieren la importancia de planificar el tratamiento hipolipidemiante de forma inmediata tras un SCA y en este contexto, la aplicación de las tablas de Masana ayuda de forma significativa a la consecución de este crucial objetivo terapéutico.
Control subóptimo del colesterol unido a lipoproteínas de baja densidad tras un síndrome coronario agudoA pesar de que la reducción de los niveles de cLDL disminuye de forma significativa la morbimortalidad cardiovascular en pacientes con cardiopatía isquémica2–5, en nuestro estudio, menos de la mitad de los pacientes (45%) alcanzaron concentraciones de cLDL<70mg/dL. Siendo bajas, estas tasas de control de la dislipidemia son incluso mejores que las referidas en estudios previos6–9 y están en concordancia con registros más actuales realizados en España como el estudio LIPICERES23.
Esta baja consecución del objetivo terapéutico se produce a pesar de una alta prescripción de estatinas de alta potencia tal y como recomiendan las guías de práctica clínica20,21,24. Así, el uso de estatinas de alta potencia no parece una estrategia suficiente para alcanzar el objetivo de cLDL.
Tras la publicación del estudio IMPROVE-IT25, se recomienda la adición de ezetimiba en aquellos pacientes con cLDL>70mg/dL a pesar del uso de una estatina de alta potencia a la dosis máxima tolerada. Solo el 9% de los pacientes en este trabajo llevaban terapia combinada con ezetimibe. Otros autores14,15 como Masana preconizan el uso precoz de terapia combinada para así incrementar la consecución del objetivo terapéutico, disminuir el número de efectos secundarios de altas dosis de estatinas y favorecer la adherencia terapéutica26. La planificación de la terapia hipolipidemiante mediante el uso de las tablas de Masana evita la infradosificación inicial de estatinas y valora, ya desde el inicio, la necesidad de tratamiento coadyuvante con ezetimibe lo que favorece la consecución rápida del objetivo terapéutico.
Factores predictores de la consecución del objetivo terapéutico de colesterol unido a lipoproteínas de baja densidad<70mg/dL. Utilidad de las tablas de MasanaEn nuestro modelo de regresión múltiple, el género masculino (OR=4,071; p<0,001), la ausencia de dislipidemia previa (OR=0,391; p<0,001) y la planificación del tratamiento hipolipidemiante acorde con las tablas de planificación terapéutica de Masana (OR=2,629; p=0,007) resultaron factores predictores de la consecución del objetivo terapéutico del cLDL<70mg/dL a los 122 [66-184] días tras un SCA.
La predominancia del género masculino en la consecución de niveles objetivo de cLDL ha sido replicada en numerosos estudios27–32. El menor uso de estatinas y de estatinas de alta potencia en las mujeres, una posible menor respuesta a las estatinas y una mayor intolerancia a las mismas aparecen como plausibles justificaciones de estas diferencias entre géneros. En nuestro estudio hallamos una mayor prescripción de atorvastatina en los hombres (p=0,016), si bien no se observaron diferencias con relación a la potencia del tratamiento hipolipidemiante (p=0,285).
La ausencia de dislipidemia previa al ingreso por SCA debe ser también analizada. Es importante subrayar que los pacientes con diagnóstico previo de dislipidemia partían de concentraciones basales mayores de cLDL y, en la mayoría de los casos, ya recibían tratamiento con estatinas, por lo que conforman un subgrupo de pacientes en los que conseguir el objetivo de control de cLDL es particularmente difícil.
Finalmente, la prescripción hipolipidemiante guiada por las tablas de planificación terapéutica descrita por Masana y Plana se asoció a una mayor tasa de consecución del objetivo terapéutico. Los resultados de nuestro trabajo ponen de relieve la eficacia del uso de esta herramienta clínica para adecuar la terapia hipolipidemiante más eficaz en los pacientes con un SCA para alcanzar el objetivo terapéutico de cLDL.
Limitaciones del estudioLa principal limitación del estudio deriva del diseño observacional no aleatorizado del mismo, con el consecuente posible sesgo de selección en los pacientes en los que se aplicaron las tablas de Masana. A pesar de ello, nuestro trabajo muestra resultados de la práctica clínica real y sugiere una influencia positiva de la implementación de las recomendaciones de Masana.
Durante la realización del estudio se publicaron las tablas de Masana actualizadas en 2015, que principalmente introducen modificaciones en la población de pacientes en prevención primaria, en los pacientes que previamente recibían tratamiento hipolipidemiante y añaden 2 nuevas moléculas de estatinas17.
En nuestro estudio el tiempo de seguimiento, durante el cual se establecen los valores de c LDL de referencia tras el SCA, es relativamente corto (122 [66-184] días) y, por tanto, se confiere un escaso margen a una adecuada titulación del tratamiento hipolipidemiante. No obstante, estudios previos muestran unas decepcionantes tasas de titulación de la terapia hipolipidemiante a largo plazo27. De hecho, de los resultados de nuestro estudio se deriva la conveniencia de dicha titulación guiada por las tablas de Masana y Plana.
ConclusionesEl control de la dislipidemia ha mejorado progresivamente a lo largo de las últimas décadas. A pesar de ello, en menos de la mitad de los pacientes se consiguen niveles adecuados de cLDL (<70mg/dL) tras un SCA. La utilización de herramientas clínicas como las tablas de Masana y Plana para planificar el tratamiento hipolipidemiante al alta hospitalaria tras un SCA mejora las tasas de consecución de este crucial objetivo terapéutico.
AutoríaNúria Ribas, Lluís Recasens, Silvia Pérez y Roberto Elosua han participado en la concepción y diseño del manuscrito. Núria Ribas, Lluís Recasens, Paula Poveda y Sonia Ruiz han participado en la recogida de datos. Silvia Pérez, Víctor Bazán, Juan Pedro-Botet, Roberto Elosua y Cosme García-García han participado en el análisis e interpretación de los datos. Núria Ribas, Lluís Recasens, Víctor Bazán y Juan Pedro-Botet han participado en la redacción del manuscrito. Todos los autores han participado en la revisión y aprobación del manuscrito remitido.
Conflicto de interesesLos autores del manuscrito declaran no tener conflicto de intereses.
Este trabajo se ha realizado en el marco del Doctorado en Medicina de la Universidad Autónoma de Barcelona.