Los niveles plasmáticos de colesterol y triglicéridos son 2 veces más altos en los osos pardos (Ursus arctos) durante el periodo de hibernación que en los humanos sanos. Sin embargo, los osos no muestran signos de desarrollo de aterosclerosis. Para explorar esta aparente paradoja, analizamos lipoproteínas del plasmas de 10 osos recolectados durante el invierno (hibernación: febrero) y verano (activo: junio) en el mismo año. El plasma de 14 humanos sanos se analizó como comparador. Se utilizaron métodos estándar para el aislamiento de lipoproteínas, la composición y la investigación funcional. Los resultados muestran que en los osos pardos la ausencia de aterosclerosis a pesar del colesterol elevado probablemente se asocie con 2 propiedades ateroprotectoras principales de las lipoproteínas circulantes. En primer lugar, una afinidad significativamente, 10 veces menor, de las partículas de lipoproteínas de baja densidad (LDL) por los proteoglicanos arteriales y, en segundo lugar, una capacidad elevada de eflujo de colesterol en plasma comparado con humanos. ¿Qué nos dicen los datos del oso pardo? Ese colesterol total elevado y las lipoproteínas que contienen ApoB no siempre se asocian con la enfermedad de aterosclerosis. Necesitamos observar también las características bioquímicas y la funcionalidad de las lipoproteínas, ya que son relevantes para la fisiopatología arterial. ¿Cuál es la traducibilidad al humano de estos resultados? Los humanos necesitamos controlar nuestros niveles de colesterol total y LDL. ¡No somos osos pardos!
Plasma cholesterol and triglyceride levels are twice as high in hibernating brown bears (Ursus arctos) than in healthy humans. Yet, bears display no sign of atherosclerosis development. To explore this apparent paradox, we analyzed lipoproteins from same ten individual bears plasma collected during winter (hibernation; February) and summer (active; June) in the same year. Plasma from fourteen healthy humans were analyzed as comparator. We used standard methods for lipoprotein isolation, composition and functional investigation. The results shows that in brown bears the absence of atherosclerosis despite elevated cholesterol is likely associated with two main athero-protective properties of circulating lipoproteins. First, a significant ten times lower affinity of low-density-lipoprotein (LDL) particles for arterial proteoglycans and secondly, an elevated plasma cholesterol efflux capacity. What does the brown bear data tell us? That elevated total cholesterol and ApoB-containing lipoproteins not always associates with atherosclerosis disease. We need to look also at the lipoprotein biochemical features and functionality as they are relevant for arterial pathophysiology. What is the translatability into human of these results? We humans need to control our total and LDL-cholesterol levels. We are not brown bears!
En estudios previos de osos pardos nórdicos observamos que estos animales, a pesar de los altos niveles de triglicéridos y colesterol en plasma (tabla 1), no desarrollaban aterosclerosis1. Curiosamente, el examen histopatológico de la arteria coronaria descendente y los arcos aórticos de 12 osos adultos criados en libertad no revelaron signos de infiltración de células espumosas, estrías grasas o lesiones ateromatosas avanzadas. Las muestras arteriales de los osos tenían una morfología similar a las arterias musculares que se encuentran en humanos sanos no ateroscleróticos2.
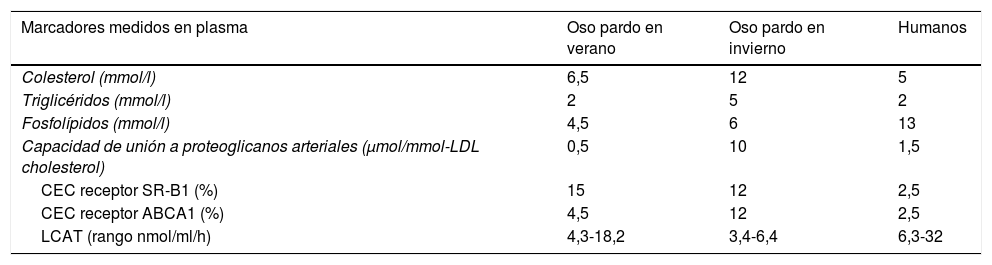
Valores promedios de concentraciones de lípidos totales y funcionalidad de lipoproteínas en plasma de osos pardos nórdicos en invierno y verano comparado con humanos
| Marcadores medidos en plasma | Oso pardo en verano | Oso pardo en invierno | Humanos |
|---|---|---|---|
| Colesterol (mmol/l) | 6,5 | 12 | 5 |
| Triglicéridos (mmol/l) | 2 | 5 | 2 |
| Fosfolípidos (mmol/l) | 4,5 | 6 | 13 |
| Capacidad de unión a proteoglicanos arteriales (μmol/mmol-LDL cholesterol) | 0,5 | 10 | 1,5 |
| CEC receptor SR-B1 (%) | 15 | 12 | 2,5 |
| CEC receptor ABCA1 (%) | 4,5 | 12 | 2,5 |
| LCAT (rango nmol/ml/h) | 4,3-18,2 | 3,4-6,4 | 6,3-32 |
CEC: capacidad del plasma para eliminar el colesterol de las células extrahepáticas; LCAT: actividad de la enzima de transferencia de ésteres de colesterol.
Fuente: Pedrelli et al.4.
En los seres humanos el colesterol plasmático elevado es un factor de riesgo principal de enfermedad cardiovascular aterosclerótica3. Pensamos que los osos nos brindaban una excelente y única oportunidad para investigar esta aparente paradoja. El oso es un animal que soporta el impacto de las condiciones ambientales extremas de las estaciones. Así, la hibernación en invierno supone ayuno y sueño versus vida activa, alimentación y actividad física en verano. Nos planteamos analizar las características de concentración, composición y funcionalidad de lípidos totales y lipoproteínas en el oso. Esta era la hipótesis del trabajo publicado en el Journal of Lipid Research4.
Los resultados del estudio que realizamos en colaboración con el laboratorio del Proyecto de Investigación del Oso Pardo Escandinavo (https://bearproject.info) (figs. 1 y 2) describen la composición de lipoproteínas y 3 propiedades funcionales que parecen modular la aterogénesis temprana en humanos y modelos preclínicos de mamíferos: la asociación de las LDL con los proteoglicanos arteriales, la capacidad del plasma para eliminar el colesterol de las células extrahepáticas (CEC)5 y la actividad de la enzima de transferencia de esteres de colesterol entre las lipoproteínas6.
¿Cuál es el mensaje que este estudio trasmite a la comunidad científica?El mensaje para llevar a casa es que la aparente paradoja descrita anteriormente se debe a las diferencias en las características estructurales de las lipoproteínas de los osos pardos en comparación con las lipoproteínas de los humanos. Por lo tanto, la aterosclerosis no solo es causada por altos niveles de lípidos totales, colesterol y triglicéridos, sino también por estructuras y características bioquímicas específicas de las lipoproteínas que transportan esos lípidos. Los osos pardos, a pesar de tener niveles de lípidos plasmáticos en invierno 2 veces más altos que los humanos, poseen lipoproteínas de mayor tamaño, con una capacidad de unión a los proteoglicanos extracelulares arteriales significativamente menor, una propiedad mecánicamente relacionada con la aterogénesis en humanos y otros mamíferos7. Las lipoproteínas que contienen ApoB-100 humana de sujetos sanos muestran una afinidad por los proteoglicanos de la matriz extracelular arterial diez veces mayor que la de los osos pardos. Creemos que nuestros resultados proporcionan por primera vez una explicación mecánica que puede contribuir a la resistencia observada a la aterogénesis temprana de los osos pardos en libertad, a pesar de sus altos niveles circulantes de colesterol y triglicéridos, especialmente durante la hibernación. Los análisis patológicos de las arterias de los osos que murieron por causas naturales (envejecimiento) no muestran aterosclerosis en sus arterias2. En humanos, los estudios patológicos han demostrado una alta prevalencia de aterosclerosis en las arterias coronarias ya en edades tempranas6. La aterosclerosis es la principal causa de enfermedad cardiovascular, la causa número uno de muerte y hospitalización a nivel mundial según las estadísticas recientes (2020) de la Organización Mundial de la Salud9.
¿Cuál fue el «momento eureka» mientras trabajábamos en este proyecto?Este momento tuvo lugar cuando observamos que, independientemente de los niveles de lipoproteínas y los cambios en la composición de lípidos durante el invierno (elevado) y el verano (disminuido), las lipoproteínas que contienen ApoB-100 en los osos pardos mostraron una afinidad significativamente menor hacia los proteoglicanos de la matriz extracelular arterial en comparación con los humanos sanos. Y que estos resultados proporcionan por primera vez una explicación mecánica que puede contribuir a la resistencia observada a la aterogénesis temprana de los osos pardos en libertad, a pesar de sus altos niveles circulantes de colesterol y triglicéridos, especialmente durante la hibernación.
¿Podemos hacer una analogía general para relacionar este estudio en osos con humanos?El principal factor que controla el depósito de colesterol en las arterias, el paso inicial en la aterogénesis, parece ser la presencia de una secuencia de aminoácidos específica de la ApoB-100 que se une a los proteoglicanos. Esta secuencia contiene residuos de lisina y arginina de carga positiva que permiten la unión a los proteoglicanos de carga negativa en la pared arterial7. En los osos, la apolipoproteína B-100 contiene menos aminoácidos cargados positivamente. Esto contribuye, en consecuencia, a su menor afinidad por los proteoglicanos de la matriz extracelular arterial10.
El cambio de peso es otro fenómeno metabólico que se asoció a efectos inesperados. A pesar de la pérdida significativa de peso durante el periodo de hibernación, en el que no ingieren alimento, es cuando los osos pardos tienen más alto los niveles de colesterol y triglicéridos. Ello significa que en los osos pardos el ayuno y la pérdida de peso no conlleva una reducción de los lípidos, que era lo contrario de lo que nos esperábamos.
¿Cuál es el mensaje de esta investigación para el público en general?Nuestra investigación se ha centrado en la hipótesis de que la unión de lipoproteínas que contienen ApoB-100 rica en colesterol es la causa inicial de la aterosclerosis. Los resultados de este estudio con osos pardos respaldan la hipótesis de que la unión de lipoproteínas que contienen apolipoproteína B (es decir, principalmente las lipoproteínas de baja densidad) a la pared arterial parece ser más relevante para la enfermedad que las altas concentraciones de colesterol en plasma5,8.
¿Cuál fue el mayor obstáculo al que nos enfrentamos en este proyecto?Un obstáculo fue que no sabíamos si podíamos aplicar las técnicas convencionales de análisis de las lipoproteínas humanas a las lipoproteínas del oso. Por lo tanto, decidimos utilizar técnicas básicas, y comparar si eran aplicables a las lipoproteínas de osos pardos comparando el tamaño, la carga y la composición lipídica de las lipoproteínas. Otras limitaciones que tuvimos fueron la falta de reactivos para hacer análisis de proteínas y expresión de genes en tejidos. Las lipoproteínas plasmáticas se aislaron usando 2 métodos diferentes normalmente usados para el fraccionamiento de lipoproteínas humanas. Primero, cromatografía de exclusión por tamaño, y segundo, ultracentrifugación de densidad secuencial en soluciones de óxido de deuterio-sacarosa (agua pesada). Ambos métodos son adecuados para pequeños volúmenes de plasma y permiten un análisis rápido de la composición y las funciones de las lipoproteínas, es decir, la movilidad electroforética, el contenido de lípidos y otras características funcionales in vitro.
¿Cuál es su consejo para las personas para cuidar la salud de su corazón?Mantengan su colesterol y triglicéridos bajos, además de la actividad física, ¡no somos osos pardos!
¿Cuáles son las direcciones futuras de este estudio?Para verificar la validez de nuestros resultados, necesitamos comparar la estructura y la composición del tejido de la pared arterial entre osos y humanos. También, sus proteoglicanos de la matriz extracelular, e investigar las diferencias y/o similitudes.
Conflicto de interesesE. Hurt-Camejo es empleada de AstraZeneca. M. Pedrelli es cofundador y propietario de Lipoprotein Research Stockholm AB.
Al Profesor Rafael Carmena por revisar el texto y brindar sugerencias relevantes.